3.3.1《乙醇》PPT课件(新人教版-必修2)
文档属性
| 名称 | 3.3.1《乙醇》PPT课件(新人教版-必修2) |  | |
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-08 21:25:18 | ||
图片预览






文档简介
(共34张PPT)
新课标人教版课件系列
《高中化学》
必修2
3.3.1《乙醇》
第三章 有机化合物 第三节《生活中两种常见的有机物 》 第1课时
教学目标
知识与技能:
1、通过对乙醇的分子结构、物理性质和化学性质的探究,学会由事物的表象解析事物的本质与变化,进一步培养学生的综合探究能力、空间想象能力和创造性思维能力;2、通过从动手实验,规范学生操作,全面培养,提高学生的实验能力、观察能力和对实验现象的解析能力。
过程与方法:
通过揭示问题、讨论释疑、动手实验,学习对比、推断等多种科学探究方法。
情感态度与价值观:
让学生体验科学探究的艰辛和乐趣,认识化学与人类生活密切关系,激发学生学习化学积极性。
教学重点:
乙醇的结构与性质
乙醇俗称酒精
跟我们日常生活密切联系
一、乙醇的物理性质
[观察] 无水乙醇。观察乙醇的颜色、状态,并闻其气味。
1.无色、透明、有特殊香味的液体;乙醇俗称酒精;
2.沸点78℃;
3.易挥发;
4.密度比水小;
5.能跟水以任意比互溶;
6.能溶解多种无机物和有机物。
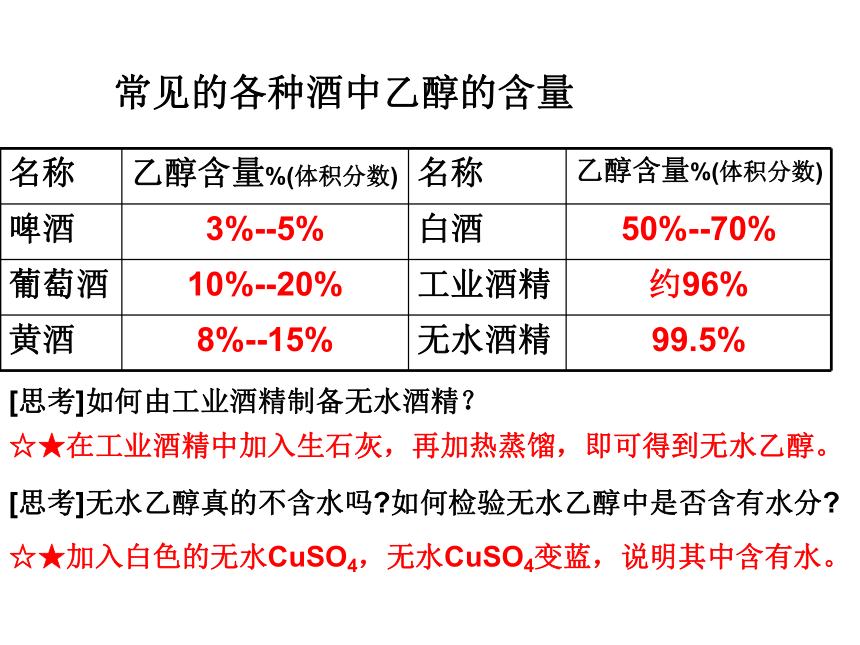
名称 乙醇含量%(体积分数) 名称 乙醇含量%(体积分数)
啤酒 3%--5% 白酒 50%--70%
葡萄酒 10%--20% 工业酒精 约96%
黄酒 8%--15% 无水酒精 99.5%
常见的各种酒中乙醇的含量
[思考]无水乙醇真的不含水吗 如何检验无水乙醇中是否含有水分
[思考]如何由工业酒精制备无水酒精?
☆★在工业酒精中加入生石灰,再加热蒸馏,即可得到无水乙醇。
☆★加入白色的无水CuSO4,无水CuSO4变蓝,说明其中含有水。
C—C—O—H
H
H
H
H
H
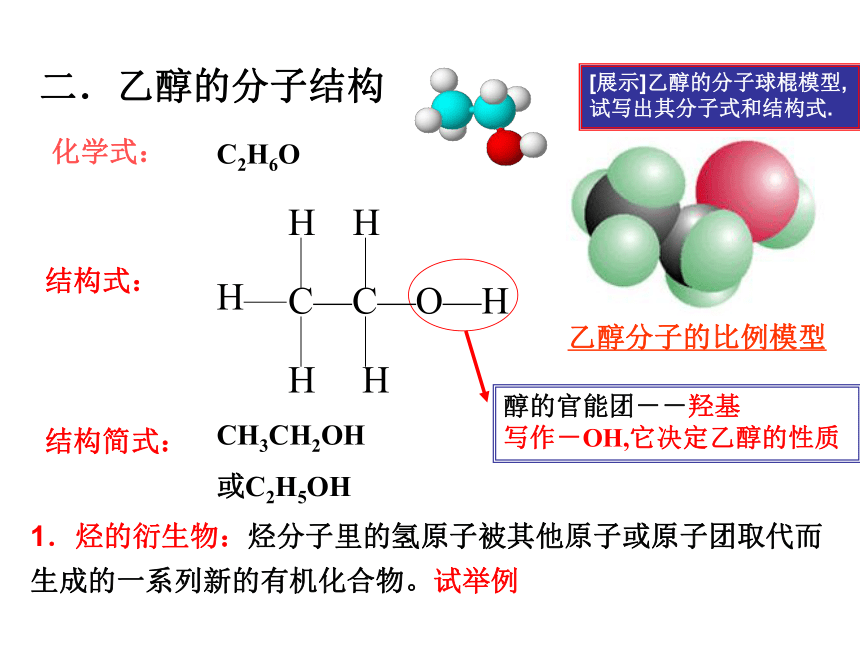
结构式:
CH3CH2OH
或C2H5OH
醇的官能团--羟基
写作-OH,它决定乙醇的性质
乙醇分子的比例模型
化学式:
C2H6O
结构简式:
二.乙醇的分子结构
[展示]乙醇的分子球棍模型,试写出其分子式和结构式.
1.烃的衍生物:烃分子里的氢原子被其他原子或原子团取代而生成的一系列新的有机化合物。试举例
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH
或C2H5OH
醇的官能团--羟基
写作-OH,它决定乙醇的性质
乙醇分子的比例模型
化学式:
C2H6O
结构简式:
二.乙醇的分子结构
2.官能团:决定有机化合物的化学特性的原子或原子团叫做官能团。如: —X(卤原子),-NO2,-OH,-C=C-
结构与性质分析
C—C—O—H
H
H
H
H
H
官能团--羟基(-OH)
乙醇分子是由乙基(—C2H5)和羟基(—OH)组成的,羟基比较活泼,它决定着乙醇的主要性质。
乙醇也可看成是水的衍生物,即水中的氢原子被-C2H5取代的产物,所以乙醇也具有水的部分性质,但-OH受-C2H5的影响,所以乙醇比水难电离。
①
②
④
③
[思考] -OH 与OH- 有何区别?
在后面的化学性质中要注意是在哪里断键的。
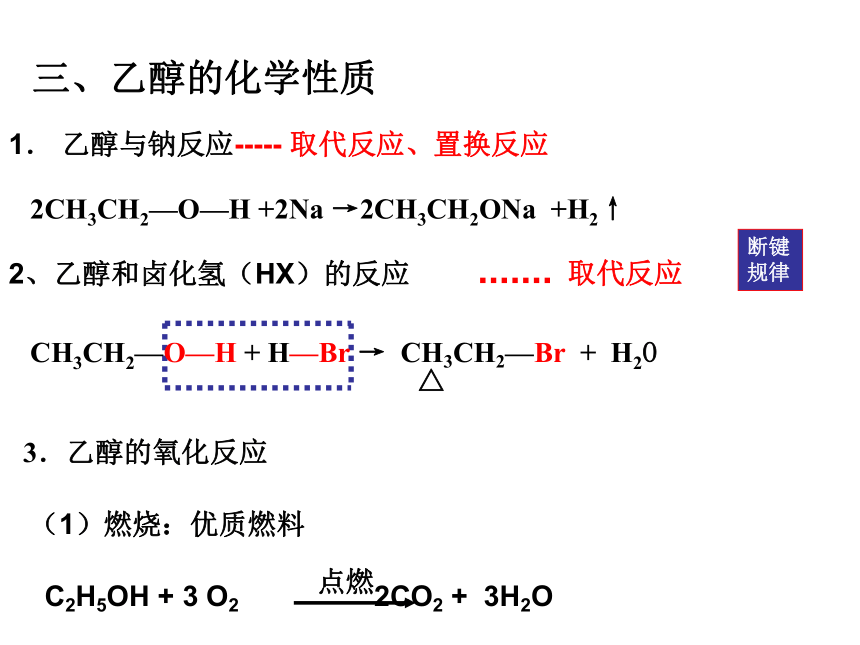
三、乙醇的化学性质
[思考]既然乙醇具有水的部分性质,那么,乙醇能否和金属钠反应呢?[演示实验]
1. 乙醇与钠反应
2CH3CH2—O—H +2Na →2CH3CH2ONa +H2↑
反应缓和
☆★凡含有-OH的物质(液态)一般都能和钠反应放出H2 。 2 mol —OH→→1mol H2。
[练习1] 写出K与乙醇反应的化学方程式。
反应类型: 置换反应、取代反应
[思考]乙醇和钠的反应属于什么反应类型?
2CH3CH2OH +2K →2CH3CH2OK +H2↑
断键规律
三、乙醇的化学性质
1. 乙醇与钠反应----- 取代反应、置换反应
2CH3CH2—O—H +2Na →2CH3CH2ONa +H2↑
2、乙醇和卤化氢(HX)的反应
取代反应
3.乙醇的氧化反应
(1)燃烧:优质燃料
C2H5OH + 3 O2 2CO2 + 3H2O
点燃
断键规律
CH3CH2—O—H + H—Br → CH3CH2—Br + H2O
△
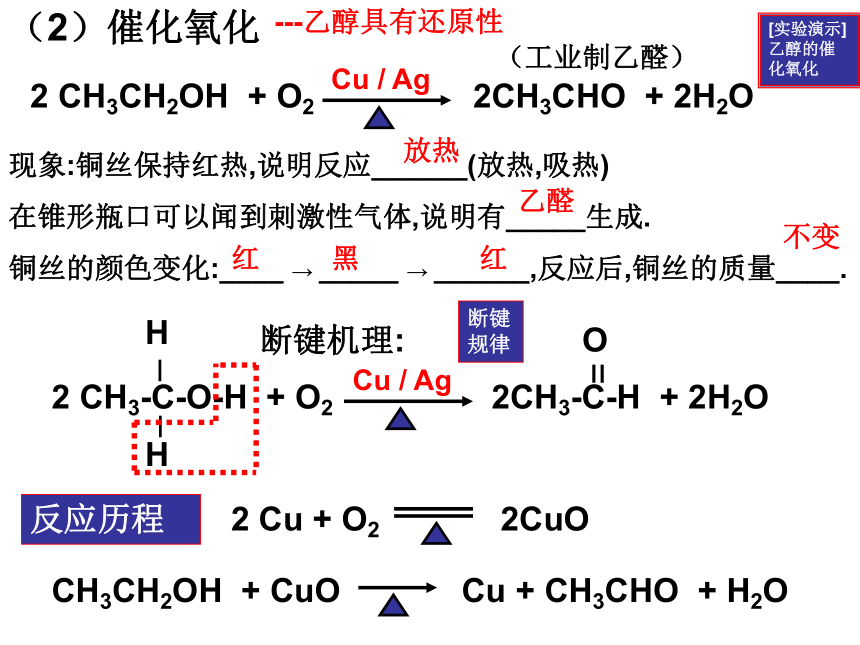
(2)催化氧化
[实验演示] 乙醇的催化氧化
(工业制乙醛)
2 CH3CH2OH + O2 2CH3CHO + 2H2O
Cu / Ag
现象:铜丝保持红热,说明反应______(放热,吸热)
在锥形瓶口可以闻到刺激性气体,说明有_____生成.
铜丝的颜色变化:____ → _____ → ______,反应后,铜丝的质量____.
断键机理:
2 CH3-C-O-H + O2 2CH3-C-H + 2H2O
H
H
Cu / Ag
O
=
放热
乙醛
红 黑 红
不变
---乙醇具有还原性
CH3CH2OH + CuO Cu + CH3CHO + H2O
2 Cu + O2 2CuO
反应历程
断键规律
[练习1] 将一定量的铜丝在酒精灯上加热一段时间后,迅速插入下列液体中,反应后,能使铜丝的质量增加的是 ( )
A.HCl B.石灰水
C.HNO3 D.CH3CH2OH
[交流与思考]乙醇能否使酸性KMnO4或K2Cr2O7溶液褪色
可以。乙醇具有还原性,被氧化成乙酸
B
[实验演示]
[延伸拓展] 下列醇在Cu或Ag的作用下将如何催化氧化
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-C-CH3 + 2H2O
丙酮
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
与-OH相连的C原子上有2个H原子的,氧化成醛.
与-OH相连的C原子上有1个H原子的,氧化成酮.
与-OH相连的C原子上没有H原子的,不能催化氧化.
醇催化氧化规律
a.-OH连接碳原子上有两个H原子,则该醇被氧化生成醛
b.-OH连接碳原子上有一个H原子, 则该醇氧化生成酮
c.-OH连接碳原子上无H原子,则该醇不能被氧化
4.乙醇的脱水反应 :
(1)分子内脱水
----消去反应
CH2-CH2
OH
H
浓H2SO4
1700C
CH2=CH2 ↑ + H2O
消去反应:有机化合物分子失去小分子生成不饱和化合物的反应。
(2)分子间脱水
C2H5-OH + H-O-C2H5 C2H5-O-C2H5 + H2O
浓H2SO4
1400C
乙醚
----取代反应
注意: 须有邻碳且邻碳有氢,方可发生消去反应.
断键规律
断键规律
[延伸拓展] 试写出下列醇在一定条件下发生消去反应的方程式.
CH3-CH2-CH-CH2-CH2-CH3
OH
浓H2SO4
CH3-CH=CH-CH2-CH2-CH3 + H2O
CH3-CH2-CH=CH-CH2-CH3 + H2O
或
四、乙醇的制法:
(2)乙烯水化法:
(1)发酵法:
五、乙醇的用途:
广泛(生活常识),饮酒的危害
[思考与交流] 交警是如何判断司机是否是酒后驾车的
C6H12O6 2CH3CH2OH + 2CO2 ↑
酶
CH2=CH2 + H2O CH3CH2OH
催化剂
加热 加压
观察与思考
马路上车流如潮 川流不息
观察与思考
马路上车流如潮 川流不息
观察与思考
马路上车流如潮 川流不息
观察与思考
哎哟!这辆红色轿车怎么打起转来呀?
观察与思考
警察叔叔眼晴真好使!敢忙上前拦住,瞧!多有礼貌。
观察与思考
观察与思考
观察与思考
生活与化学
这个仪器叫酒精测量器,里面装有用硫酸酸化了的重铬酸钾溶液(橙色)浸过的硅胶,遇到酒精蒸气便发生反应而生成绿色的硫酸铬溶液。
[练习4]下列反应可以用来检验司机是否酒后驾车.
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4
2Cr2(SO4)3 + 3CH3-C-OH + 2K2SO4 + 11H2O
橙红色
蓝绿色
O=
(1)上述反应中,氧化剂是_____________;氧化产物是________;反应中铬元素的化合价由___价变为___价
(2)若反应中生成1.0 mol Cr3+,则反应中转移的电子总数是_________________.
K2Cr2O7
CH3COOH
+6 +3
1.806×1024
[练习2] 乙醇分子中各种化学键如下图所示,试填写下列空格
A.乙醇和浓硫酸,共热到140℃时断键 _______
B.乙醇和金属钠的反应断键 ________
C.乙醇和浓硫酸,共热到170℃时断键 _______
D.乙醇在Ag催化下与O2反应时断键 __________
H
H
H
C
C
H
H
H
O
①
②
③
④
⑤
① 和②
①
②和⑤
① 和③
[练习3] 酒精完全燃烧后,生成的产物可用一种物质完全吸收,这种物质是 ( )
A、浓硫酸 B、浓NaOH溶液
C、碱石灰 D、无水氯化钙
C
[练习3] 乙烯和乙醇的混合气体V L,完全燃烧生成CO2和H2O ,消耗相同状态下的O2 3V L,则混合气体中乙烯和乙醇的体积比是( )
A、 1 :1 B、2 :1
C、1 :2 D、任意比
D
[练习5] 某有机物6 g 与足量钠反应,生成0.05 mol H2 ,该有机物可能是( )
A、CH3CH2OH B、CH3-CH-CH3
C、CH3OH D、CH3-O-CH2CH3
OH
B
[思考]能否通过钠与有机物的反应来测定有机物的羟基数目?
[延伸拓展] A、B、C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中羟基数之比是( )
A. 3∶2∶1 B. 2∶6∶3
C. 3∶1∶2 D. 2∶1∶3
由2 –OH → H2 可以推知该有机物中含有-OH的数目.
【解析】若都生成3 mol H2,需三种醇各提供6 mol-OH,即需一元醇6 mol,二元醇3 mol,三元醇2 mol,对照所给条件即可得答案。
D
乙 醇 小 结
1、分子结构( CH3CH2OH )及官能团 ( -OH )
2、重要化学性质:
A、与活泼金属发生取代反应产生H2 ;
B、和HX发生取代反应
C、燃烧(优质燃料);催化氧化(制醛);
D、脱水反应:
a、消去反应(分子内脱水);
b、取代反应(分子间脱水)。
新课标人教版课件系列
《高中化学》
必修2
3.3.1《乙醇》
第三章 有机化合物 第三节《生活中两种常见的有机物 》 第1课时
教学目标
知识与技能:
1、通过对乙醇的分子结构、物理性质和化学性质的探究,学会由事物的表象解析事物的本质与变化,进一步培养学生的综合探究能力、空间想象能力和创造性思维能力;2、通过从动手实验,规范学生操作,全面培养,提高学生的实验能力、观察能力和对实验现象的解析能力。
过程与方法:
通过揭示问题、讨论释疑、动手实验,学习对比、推断等多种科学探究方法。
情感态度与价值观:
让学生体验科学探究的艰辛和乐趣,认识化学与人类生活密切关系,激发学生学习化学积极性。
教学重点:
乙醇的结构与性质
乙醇俗称酒精
跟我们日常生活密切联系
一、乙醇的物理性质
[观察] 无水乙醇。观察乙醇的颜色、状态,并闻其气味。
1.无色、透明、有特殊香味的液体;乙醇俗称酒精;
2.沸点78℃;
3.易挥发;
4.密度比水小;
5.能跟水以任意比互溶;
6.能溶解多种无机物和有机物。
名称 乙醇含量%(体积分数) 名称 乙醇含量%(体积分数)
啤酒 3%--5% 白酒 50%--70%
葡萄酒 10%--20% 工业酒精 约96%
黄酒 8%--15% 无水酒精 99.5%
常见的各种酒中乙醇的含量
[思考]无水乙醇真的不含水吗 如何检验无水乙醇中是否含有水分
[思考]如何由工业酒精制备无水酒精?
☆★在工业酒精中加入生石灰,再加热蒸馏,即可得到无水乙醇。
☆★加入白色的无水CuSO4,无水CuSO4变蓝,说明其中含有水。
C—C—O—H
H
H
H
H
H
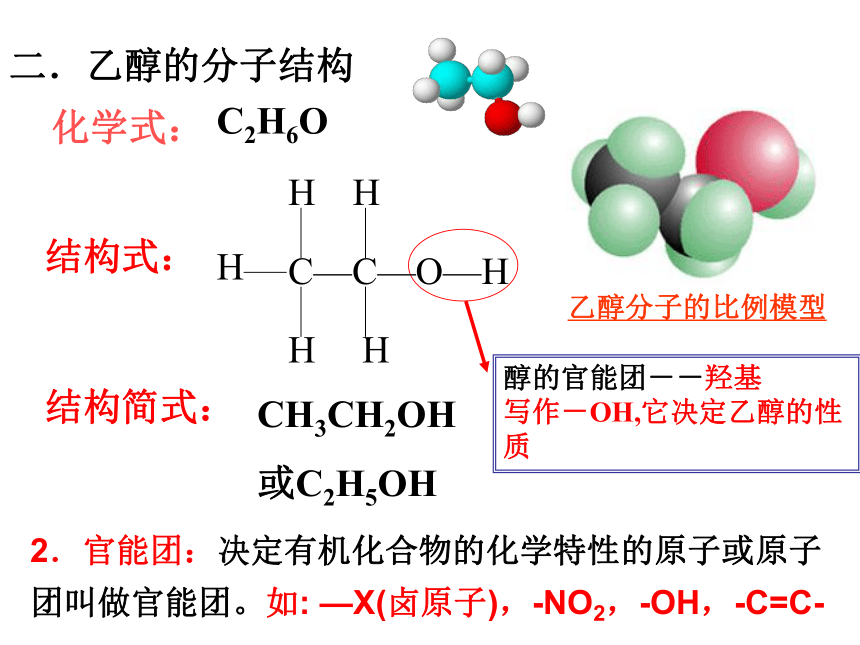
结构式:
CH3CH2OH
或C2H5OH
醇的官能团--羟基
写作-OH,它决定乙醇的性质
乙醇分子的比例模型
化学式:
C2H6O
结构简式:
二.乙醇的分子结构
[展示]乙醇的分子球棍模型,试写出其分子式和结构式.
1.烃的衍生物:烃分子里的氢原子被其他原子或原子团取代而生成的一系列新的有机化合物。试举例
C—C—O—H
H
H
H
H
H
结构式:
CH3CH2OH
或C2H5OH
醇的官能团--羟基
写作-OH,它决定乙醇的性质
乙醇分子的比例模型
化学式:
C2H6O
结构简式:
二.乙醇的分子结构
2.官能团:决定有机化合物的化学特性的原子或原子团叫做官能团。如: —X(卤原子),-NO2,-OH,-C=C-
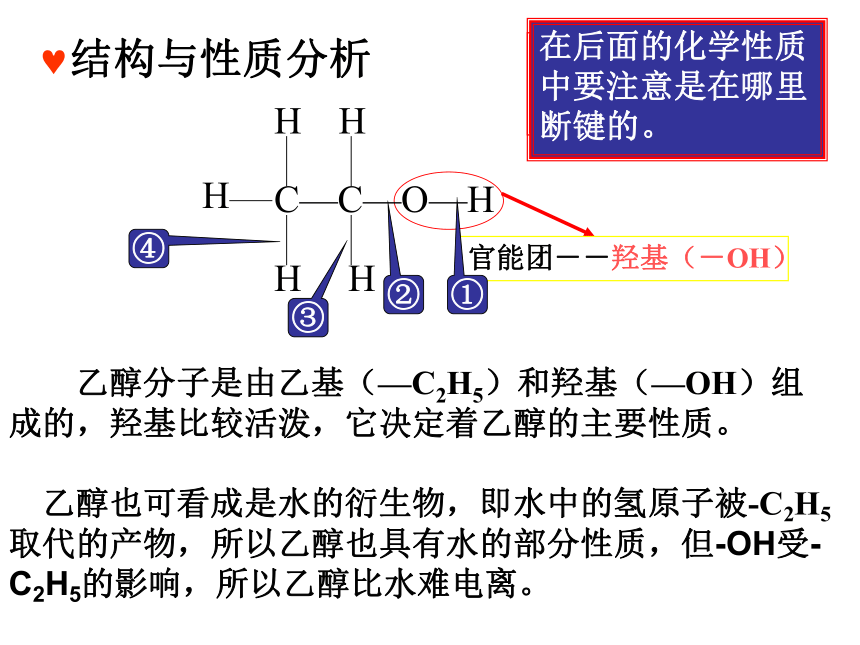
结构与性质分析
C—C—O—H
H
H
H
H
H
官能团--羟基(-OH)
乙醇分子是由乙基(—C2H5)和羟基(—OH)组成的,羟基比较活泼,它决定着乙醇的主要性质。
乙醇也可看成是水的衍生物,即水中的氢原子被-C2H5取代的产物,所以乙醇也具有水的部分性质,但-OH受-C2H5的影响,所以乙醇比水难电离。
①
②
④
③
[思考] -OH 与OH- 有何区别?
在后面的化学性质中要注意是在哪里断键的。
三、乙醇的化学性质
[思考]既然乙醇具有水的部分性质,那么,乙醇能否和金属钠反应呢?[演示实验]
1. 乙醇与钠反应
2CH3CH2—O—H +2Na →2CH3CH2ONa +H2↑
反应缓和
☆★凡含有-OH的物质(液态)一般都能和钠反应放出H2 。 2 mol —OH→→1mol H2。
[练习1] 写出K与乙醇反应的化学方程式。
反应类型: 置换反应、取代反应
[思考]乙醇和钠的反应属于什么反应类型?
2CH3CH2OH +2K →2CH3CH2OK +H2↑
断键规律
三、乙醇的化学性质
1. 乙醇与钠反应----- 取代反应、置换反应
2CH3CH2—O—H +2Na →2CH3CH2ONa +H2↑
2、乙醇和卤化氢(HX)的反应
取代反应
3.乙醇的氧化反应
(1)燃烧:优质燃料
C2H5OH + 3 O2 2CO2 + 3H2O
点燃
断键规律
CH3CH2—O—H + H—Br → CH3CH2—Br + H2O
△
(2)催化氧化
[实验演示] 乙醇的催化氧化
(工业制乙醛)
2 CH3CH2OH + O2 2CH3CHO + 2H2O
Cu / Ag
现象:铜丝保持红热,说明反应______(放热,吸热)
在锥形瓶口可以闻到刺激性气体,说明有_____生成.
铜丝的颜色变化:____ → _____ → ______,反应后,铜丝的质量____.
断键机理:
2 CH3-C-O-H + O2 2CH3-C-H + 2H2O
H
H
Cu / Ag
O
=
放热
乙醛
红 黑 红
不变
---乙醇具有还原性
CH3CH2OH + CuO Cu + CH3CHO + H2O
2 Cu + O2 2CuO
反应历程
断键规律
[练习1] 将一定量的铜丝在酒精灯上加热一段时间后,迅速插入下列液体中,反应后,能使铜丝的质量增加的是 ( )
A.HCl B.石灰水
C.HNO3 D.CH3CH2OH
[交流与思考]乙醇能否使酸性KMnO4或K2Cr2O7溶液褪色
可以。乙醇具有还原性,被氧化成乙酸
B
[实验演示]
[延伸拓展] 下列醇在Cu或Ag的作用下将如何催化氧化
2 CH3-C-O-H + O2
CH3
H
Cu / Ag
O
=
2CH3-C-CH3 + 2H2O
丙酮
2 CH3-C-O-H + O2
CH3
CH3
Cu / Ag
不能发生催化氧化
H
H
2 CH3-CH2-C-O-H + O2
Cu / Ag
O
=
2CH3-CH2-C-H + 2H2O
丙醛
与-OH相连的C原子上有2个H原子的,氧化成醛.
与-OH相连的C原子上有1个H原子的,氧化成酮.
与-OH相连的C原子上没有H原子的,不能催化氧化.
醇催化氧化规律
a.-OH连接碳原子上有两个H原子,则该醇被氧化生成醛
b.-OH连接碳原子上有一个H原子, 则该醇氧化生成酮
c.-OH连接碳原子上无H原子,则该醇不能被氧化
4.乙醇的脱水反应 :
(1)分子内脱水
----消去反应
CH2-CH2
OH
H
浓H2SO4
1700C
CH2=CH2 ↑ + H2O
消去反应:有机化合物分子失去小分子生成不饱和化合物的反应。
(2)分子间脱水
C2H5-OH + H-O-C2H5 C2H5-O-C2H5 + H2O
浓H2SO4
1400C
乙醚
----取代反应
注意: 须有邻碳且邻碳有氢,方可发生消去反应.
断键规律
断键规律
[延伸拓展] 试写出下列醇在一定条件下发生消去反应的方程式.
CH3-CH2-CH-CH2-CH2-CH3
OH
浓H2SO4
CH3-CH=CH-CH2-CH2-CH3 + H2O
CH3-CH2-CH=CH-CH2-CH3 + H2O
或
四、乙醇的制法:
(2)乙烯水化法:
(1)发酵法:
五、乙醇的用途:
广泛(生活常识),饮酒的危害
[思考与交流] 交警是如何判断司机是否是酒后驾车的
C6H12O6 2CH3CH2OH + 2CO2 ↑
酶
CH2=CH2 + H2O CH3CH2OH
催化剂
加热 加压
观察与思考
马路上车流如潮 川流不息
观察与思考
马路上车流如潮 川流不息
观察与思考
马路上车流如潮 川流不息
观察与思考
哎哟!这辆红色轿车怎么打起转来呀?
观察与思考
警察叔叔眼晴真好使!敢忙上前拦住,瞧!多有礼貌。
观察与思考
观察与思考
观察与思考
生活与化学
这个仪器叫酒精测量器,里面装有用硫酸酸化了的重铬酸钾溶液(橙色)浸过的硅胶,遇到酒精蒸气便发生反应而生成绿色的硫酸铬溶液。
[练习4]下列反应可以用来检验司机是否酒后驾车.
2K2Cr2O7 + 3CH3CH2OH + 8H2SO4
2Cr2(SO4)3 + 3CH3-C-OH + 2K2SO4 + 11H2O
橙红色
蓝绿色
O=
(1)上述反应中,氧化剂是_____________;氧化产物是________;反应中铬元素的化合价由___价变为___价
(2)若反应中生成1.0 mol Cr3+,则反应中转移的电子总数是_________________.
K2Cr2O7
CH3COOH
+6 +3
1.806×1024
[练习2] 乙醇分子中各种化学键如下图所示,试填写下列空格
A.乙醇和浓硫酸,共热到140℃时断键 _______
B.乙醇和金属钠的反应断键 ________
C.乙醇和浓硫酸,共热到170℃时断键 _______
D.乙醇在Ag催化下与O2反应时断键 __________
H
H
H
C
C
H
H
H
O
①
②
③
④
⑤
① 和②
①
②和⑤
① 和③
[练习3] 酒精完全燃烧后,生成的产物可用一种物质完全吸收,这种物质是 ( )
A、浓硫酸 B、浓NaOH溶液
C、碱石灰 D、无水氯化钙
C
[练习3] 乙烯和乙醇的混合气体V L,完全燃烧生成CO2和H2O ,消耗相同状态下的O2 3V L,则混合气体中乙烯和乙醇的体积比是( )
A、 1 :1 B、2 :1
C、1 :2 D、任意比
D
[练习5] 某有机物6 g 与足量钠反应,生成0.05 mol H2 ,该有机物可能是( )
A、CH3CH2OH B、CH3-CH-CH3
C、CH3OH D、CH3-O-CH2CH3
OH
B
[思考]能否通过钠与有机物的反应来测定有机物的羟基数目?
[延伸拓展] A、B、C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的氢气,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中羟基数之比是( )
A. 3∶2∶1 B. 2∶6∶3
C. 3∶1∶2 D. 2∶1∶3
由2 –OH → H2 可以推知该有机物中含有-OH的数目.
【解析】若都生成3 mol H2,需三种醇各提供6 mol-OH,即需一元醇6 mol,二元醇3 mol,三元醇2 mol,对照所给条件即可得答案。
D
乙 醇 小 结
1、分子结构( CH3CH2OH )及官能团 ( -OH )
2、重要化学性质:
A、与活泼金属发生取代反应产生H2 ;
B、和HX发生取代反应
C、燃烧(优质燃料);催化氧化(制醛);
D、脱水反应:
a、消去反应(分子内脱水);
b、取代反应(分子间脱水)。
