3.2.1《乙烯》PPT课件(新人教版-必修2)
文档属性
| 名称 | 3.2.1《乙烯》PPT课件(新人教版-必修2) |

|
|
| 格式 | zip | ||
| 文件大小 | 638.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-08 00:00:00 | ||
图片预览







文档简介
(共47张PPT)
新课标人教版课件系列
《高中化学》
必修2
3.2.1《乙烯》
第三章 有机化合物 第二节《来自石油和煤的两种基本化工原料 》 第1课时
教学目标
知识与技能:
1.探究乙烯分子的组成、结构式;掌握乙烯的典型化学性质,掌握加成反应。
2.了解乙烯的制备和收集方法。
过程与方法:从实验现象到乙烯结构的推理,使学生体会科学研究的方法;结合乙烯实验室制法条件的选择控制,使学生领悟到科学的实验方法。
情感态度与价值观:
1.通过对乙烯分子结构的推理过程,使学生从中体会到严谨求实的科学态度;
2.结合乙烯实验室制法条件的选择控制,使学生领悟到化学现象与化学本质的辩证认识;
教学重点、难点: 乙烯的化学性质和加成反应
教学方法:实验探究、设疑启发、对比归纳等。
乙烯的用途
阅读课本P58
重要化工原料:乙烯的产量衡量一个国家的石油化工水平
植物生长调节剂:催熟剂
如果把青桔子和熟苹果放在同一个塑料袋里,系紧袋口,这样一段时间后青桔子就可以变黄、成熟。
[问题的提出]
乙烷分子中再去掉两个氢原子后分子式是什么?根据碳原子形成四个价键、氢原子形成一个价键的原则,其可能的结构式应该怎样?为什么?
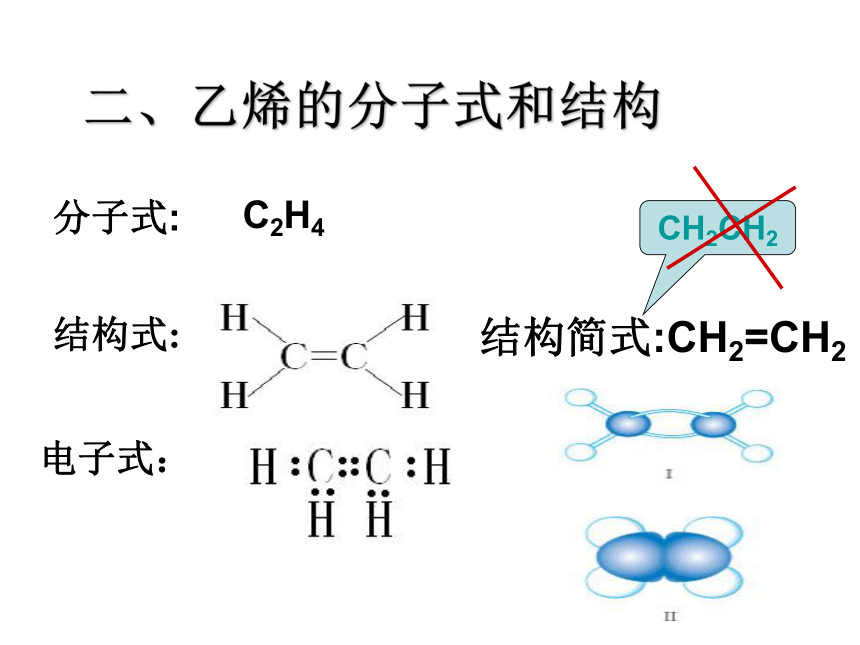
二、乙烯的分子式和结构
结构式:
分子式:
结构简式:CH2=CH2
CH2CH2
C2H4
电子式:
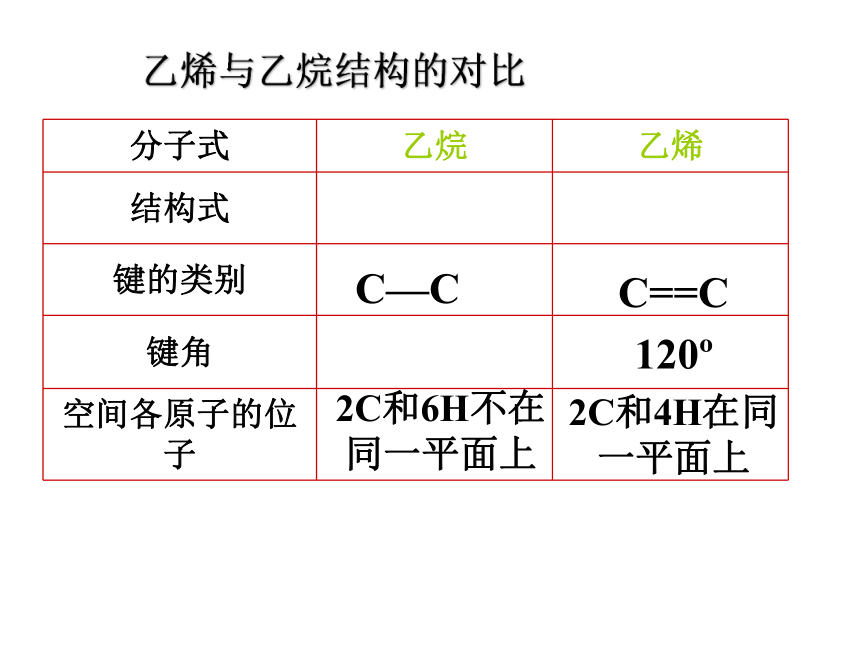
乙烯与乙烷结构的对比
分子式 乙烷 乙烯
结构式
键的类别
键角
空间各原子的位子
C—C
2C和6H不在同一平面上
C==C
120
2C和4H在同一平面上
一、石蜡油的分解实验
石蜡油:17个C以上的烷烃混合物
①
②碎瓷片:催化剂
③加热位置:碎瓷片
④将生成气体通人酸
性高锰酸钾溶液中。
⑤生成的气体通入溴的四氯化碳溶液
⑥点燃气体
酸性:增强氧
化性。
火焰明亮,并伴有黑烟。
石油裂化(工业制取乙烯的主要手段)
工业上采用裂化的方法:即在一定条件
下,把碳链长、分子量大、沸点高的烃,
断裂为碳链短、分子量小、沸点低的烃的
过程。叫石油的裂化,一般用重油、石蜡
等为原料进行裂化。
注意:裂解气的成分:主要是乙烯还含有丙烯、异丁烯、甲烷、乙烷、异丁烷、硫化氢和碳的氧化物等。
C8H16
C4H10 + C4H8
催化剂
△
C4H10
CH4 + C3H6
催化剂
△
C4H10
C2H4 + C2H6
催化剂
△
丁烷 丁烯
乙烯 乙烷
甲烷 丙烯
二、乙烯的性质
乙烯是 色 气味的气体;在水中 (“易”或“难”)溶于水;密度较空气 。
无
稍有
难
略小
乙烯的物理性质
乙烯的化学性质
⑴燃烧:CH2=CH2+3O2 2CO2+2H2O
点燃
⑵使酸性高锰酸钾溶液褪色(被氧化)
与溴单质
明亮火焰,少量黑烟
可鉴别乙烯与甲烷
等饱和气态烷烃
1、氧化反应:
问题讨论
试验探究
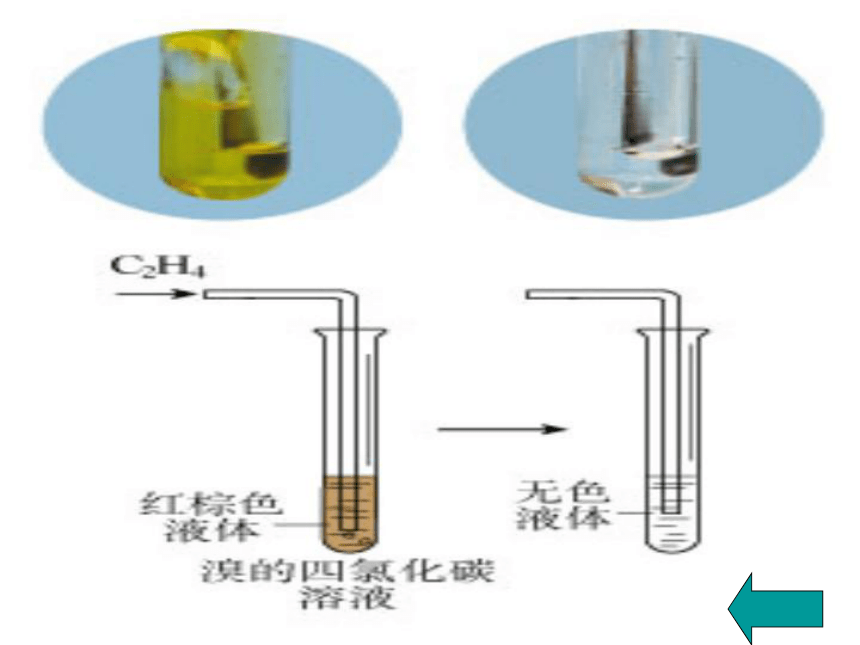
①溴与乙烯可能发生什么样的反应?
②如何验证溴与乙烯之间的反应?
溴的四氯化碳溶液颜色褪色
2、加成反应(与Br2、H2、HX、H2O等)
CH2=CH2+H―H CH3-CH3
催化剂
CH2=CH2+Br―Br CH2Br-CH2Br
CH2=CH2+H―OH CH3-CH2OH
CH2=CH2+H―X CH3-CH2X
催化剂
催化剂
现象
用途
加成反应有机物分子中的双键或叁键两端的碳原子与其他原子或原子团直接结合成新化合物的反应叫加成反应
乙烯分子内碳碳双键的键能(615KJ/mol)小于碳碳单键键能(348KJ/mol)的二倍,说明其中有一条碳碳键键能小,容易断裂。
我是
溴分子
有机物分子里不饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应叫做加成反应。
2、加成反应
加成反应的反应实质
乙烯
溴分子
1,2-二溴乙烷
反应方程式:
CH2=CH2+Br2 CH2CH2
Br
Br
1,2-二溴乙烷
除此以外乙烯还可以与其他物质发生加成反应
CH2=CH2+H2 CH3CH3
催化剂
△
CH2=CH2+Cl2 CH2ClCH2Cl
CH2=CH2+HCl CH3CH2Cl
CH2=CH2+H2O CH3CH2OH
催化剂
加压加热
1,2-二氯乙烷
氯乙烷
3. 聚合反应
定义:由相对分子质量小的化合物分子互相结合成相对分子质量大的高分子的反应叫做聚合反应
在聚合反应中,由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物的分子,这样的聚合反应同时也是加成反应,所以这种聚合反应又叫做加成聚合反应,简称加聚反应.
nCH2=CH2 [ CH2- CH2 ]n
催化剂
1、关于乙烯分子结构的说法中,错误的是( )
A.乙烯分子里含有C=C双键;
B.乙烯分子里所有的原子共平面;
C.乙烯分子中C=C双键的键长和乙烷分子中C-C单键的键长相等。
D.乙烯分子里各共价键之间的夹角为120 。
C
2、除去乙烷中混有的少量乙烯的方法,正确的是( )
A.通入氯气后进行光照
B.通入溴水
C.通入澄清的石灰水
D.点燃
B
练习:
1、能用于鉴别甲烷和乙烯的试剂是 ( )
A.溴水 B.酸性高锰酸钾溶液
C.苛性钠溶 D.四氯化碳溶液
2、制取一氯甲烷最好采用的方法是 ( )
A.乙烷和氯气反应 B.乙烯和氯气反应
C.乙烯和氯化氢反应 D.乙烷和氯化氢反应
AB
C
3. 既可以使溴水褪色,又可以使酸性高锰酸钾溶液褪色的气体有 ( )
A. CO B. CO2
C. C2H4 D. C2H6
C
4. 乙烯发生的下列反应中,不属于加成反应的是 ( )
A. 与氢气反应生成乙烷
B. 与水反应生成乙醇
C. 与溴水反应使之褪色
D. 与氧气反应生成二氧化碳和水
D
[例1]某气态烃在密闭容器中与氧气混合,用电火花点燃,完全燃烧前后容器内压强保持不变(温度为120℃),则该烃为( )
A、CH4 B、C2H6
C、C2H4 D、C3H6
例题选讲:
AC
[例2]标准状况下1.68L无色可燃性气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15克;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气态烃,通过计算推断它的分子式。
2.7g
C2H4
[例3]将乙烯和甲烷的混合气体完全燃烧时,所消耗的氧气的体积是混合气体体积的2.4倍,则甲烷和乙烯的体积比是:
A、1:2 B、2:1
C、2:3 D、3:2
C
[例4]将0.2mol两种气态烃组成的混合气体完全燃烧,得到6.72LCO2(标准状况)和7.2g水,下列说法中正确的是:
A、一定有甲烷 B、一定有乙烯
C、一定没有甲烷 D、一定没有乙烯
A
[例5] 一种能使溴水褪色的气态烃,标准状况下5.6升的质量10.5为克,这些质量的烃完全燃烧时生成16.8升二氧化碳和13.5克水。求该烃的分子式,并推论它的化学性质。
(C3H6)
[例6] 、用含水5%的酒精100克跟浓硫酸共热制乙烯,可制得乙烯多少升(标准状况)?如果把这些乙烯通过溴水,全部被溴水吸收,理论上溴水至少应含纯溴多少摩?
(答:可制乙烯46.2升,含溴2.06摩)
浓硫酸和酒精的用量配比:
体积比约为 3:1
为什么浓硫酸用量要多?
反应中有生成水,会使浓硫酸稀释,而稀硫酸没有脱水性会导致实验失败。
浓硫酸和酒精
浓硫酸在反应中起什么作用?
脱水剂和催化剂
1、药品:
2、原理:
乙烯的实验室制法
发生分子内脱水生成乙烯
A
B
C
1、固+液 气
2、固 气
3、固+液 气
可用( )装置常用做制( )
A
可用( )装置常用做制( )
可用( )装置常用做制( )
B
C
H2 CO2
O2 NH3
Cl2
3、制备装置
液+液 气
△
4、操作原理:
1、安装顺序如何?
(由下到上,由左到右)
3、混合液体时是将什么倒入什么中?为什么?
(浓硫酸缓缓倒入乙醇中)
4、能否在量筒中混合液体?为什么?
(否,混合时放热)
2、如何检查装置的气密性?
把导气管伸入水中,用手捂住烧瓶。
思考:
1、碎瓷片的作用?
防止爆沸
2、迅速升温至1700C目的?
3、温度计水银球所在的位置?
温度计的水银球必须伸入液面以下,因为温度计指示的是反应温度。
4、能否用排空法收集乙烯?
不能,因为乙烯的密度与空气的密度接近。
5、实验结束是先撤酒精灯还是先撤导管?
先撤导管,防止倒吸。
1400C乙醇会发生分子间脱水生成副产品乙醚。
6、加热过程中混合液颜色如何变化?
溶液由无色变成棕色最后变成黑色。
原因是浓硫酸使酒精脱水碳化
2H2SO4+C2H5OH 2SO2↑+2C+5H2O
△
7、加热时间过长,还会产生有刺激性气味的气体,为什么?
浓硫酸具有强氧化性,可以与生成的碳反应。
C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
△
练习:
实验室制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫。
I
II
IIII
IV
①如图上所示,I、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:(将下列有关试剂的序号填入空格内)。
I ,Ⅱ ,Ⅲ ,Ⅳ 。
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性KMnO4溶液
②能说明二氧化硫气体存在的现象是 。
③使用装置Ⅱ的目的是 。
④使用装置Ⅲ的目的是 。
⑤确证含有乙烯的现象是 。
A
D
A
B
I中品红褪色
除去SO2
验证SO2是否除净
IV中紫色KMnO4褪色
新课标人教版课件系列
《高中化学》
必修2
3.2.1《乙烯》
第三章 有机化合物 第二节《来自石油和煤的两种基本化工原料 》 第1课时
教学目标
知识与技能:
1.探究乙烯分子的组成、结构式;掌握乙烯的典型化学性质,掌握加成反应。
2.了解乙烯的制备和收集方法。
过程与方法:从实验现象到乙烯结构的推理,使学生体会科学研究的方法;结合乙烯实验室制法条件的选择控制,使学生领悟到科学的实验方法。
情感态度与价值观:
1.通过对乙烯分子结构的推理过程,使学生从中体会到严谨求实的科学态度;
2.结合乙烯实验室制法条件的选择控制,使学生领悟到化学现象与化学本质的辩证认识;
教学重点、难点: 乙烯的化学性质和加成反应
教学方法:实验探究、设疑启发、对比归纳等。
乙烯的用途
阅读课本P58
重要化工原料:乙烯的产量衡量一个国家的石油化工水平
植物生长调节剂:催熟剂
如果把青桔子和熟苹果放在同一个塑料袋里,系紧袋口,这样一段时间后青桔子就可以变黄、成熟。
[问题的提出]
乙烷分子中再去掉两个氢原子后分子式是什么?根据碳原子形成四个价键、氢原子形成一个价键的原则,其可能的结构式应该怎样?为什么?
二、乙烯的分子式和结构
结构式:
分子式:
结构简式:CH2=CH2
CH2CH2
C2H4
电子式:
乙烯与乙烷结构的对比
分子式 乙烷 乙烯
结构式
键的类别
键角
空间各原子的位子
C—C
2C和6H不在同一平面上
C==C
120
2C和4H在同一平面上
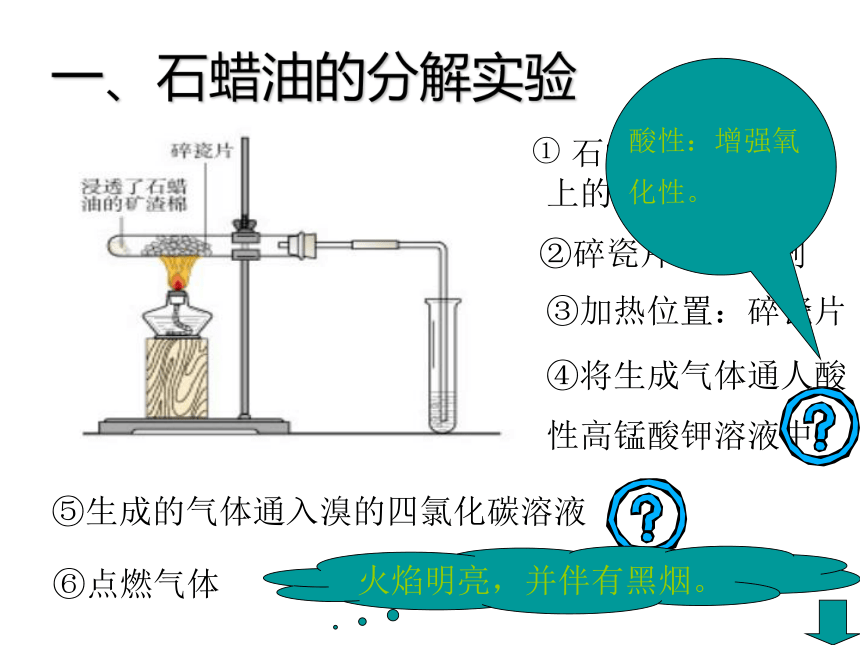
一、石蜡油的分解实验
石蜡油:17个C以上的烷烃混合物
①
②碎瓷片:催化剂
③加热位置:碎瓷片
④将生成气体通人酸
性高锰酸钾溶液中。
⑤生成的气体通入溴的四氯化碳溶液
⑥点燃气体
酸性:增强氧
化性。
火焰明亮,并伴有黑烟。
石油裂化(工业制取乙烯的主要手段)
工业上采用裂化的方法:即在一定条件
下,把碳链长、分子量大、沸点高的烃,
断裂为碳链短、分子量小、沸点低的烃的
过程。叫石油的裂化,一般用重油、石蜡
等为原料进行裂化。
注意:裂解气的成分:主要是乙烯还含有丙烯、异丁烯、甲烷、乙烷、异丁烷、硫化氢和碳的氧化物等。
C8H16
C4H10 + C4H8
催化剂
△
C4H10
CH4 + C3H6
催化剂
△
C4H10
C2H4 + C2H6
催化剂
△
丁烷 丁烯
乙烯 乙烷
甲烷 丙烯
二、乙烯的性质
乙烯是 色 气味的气体;在水中 (“易”或“难”)溶于水;密度较空气 。
无
稍有
难
略小
乙烯的物理性质
乙烯的化学性质
⑴燃烧:CH2=CH2+3O2 2CO2+2H2O
点燃
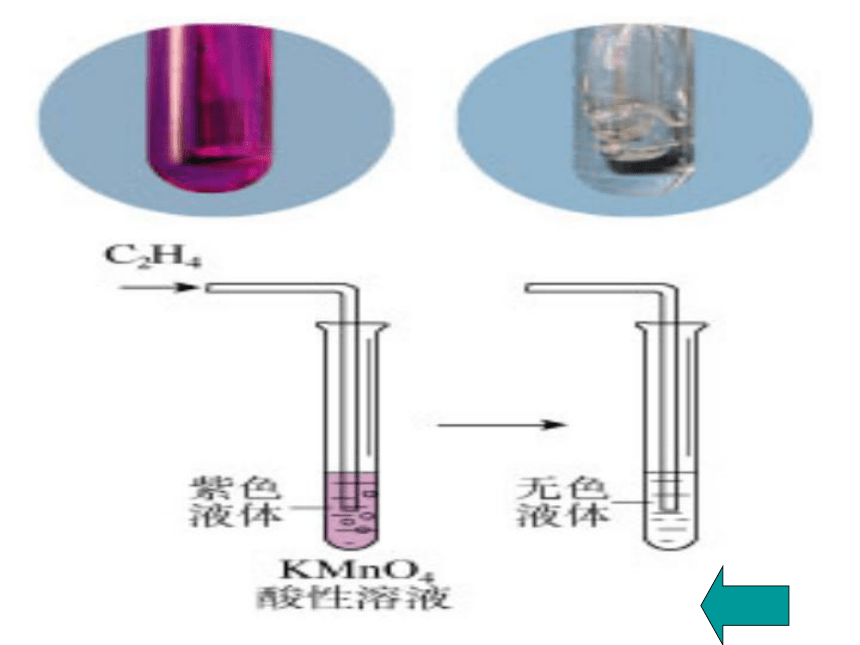
⑵使酸性高锰酸钾溶液褪色(被氧化)
与溴单质
明亮火焰,少量黑烟
可鉴别乙烯与甲烷
等饱和气态烷烃
1、氧化反应:
问题讨论
试验探究
①溴与乙烯可能发生什么样的反应?
②如何验证溴与乙烯之间的反应?
溴的四氯化碳溶液颜色褪色
2、加成反应(与Br2、H2、HX、H2O等)
CH2=CH2+H―H CH3-CH3
催化剂
CH2=CH2+Br―Br CH2Br-CH2Br
CH2=CH2+H―OH CH3-CH2OH
CH2=CH2+H―X CH3-CH2X
催化剂
催化剂
现象
用途
加成反应有机物分子中的双键或叁键两端的碳原子与其他原子或原子团直接结合成新化合物的反应叫加成反应
乙烯分子内碳碳双键的键能(615KJ/mol)小于碳碳单键键能(348KJ/mol)的二倍,说明其中有一条碳碳键键能小,容易断裂。
我是
溴分子
有机物分子里不饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应叫做加成反应。
2、加成反应
加成反应的反应实质
乙烯
溴分子
1,2-二溴乙烷
反应方程式:
CH2=CH2+Br2 CH2CH2
Br
Br
1,2-二溴乙烷
除此以外乙烯还可以与其他物质发生加成反应
CH2=CH2+H2 CH3CH3
催化剂
△
CH2=CH2+Cl2 CH2ClCH2Cl
CH2=CH2+HCl CH3CH2Cl
CH2=CH2+H2O CH3CH2OH
催化剂
加压加热
1,2-二氯乙烷
氯乙烷
3. 聚合反应
定义:由相对分子质量小的化合物分子互相结合成相对分子质量大的高分子的反应叫做聚合反应
在聚合反应中,由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物的分子,这样的聚合反应同时也是加成反应,所以这种聚合反应又叫做加成聚合反应,简称加聚反应.
nCH2=CH2 [ CH2- CH2 ]n
催化剂
1、关于乙烯分子结构的说法中,错误的是( )
A.乙烯分子里含有C=C双键;
B.乙烯分子里所有的原子共平面;
C.乙烯分子中C=C双键的键长和乙烷分子中C-C单键的键长相等。
D.乙烯分子里各共价键之间的夹角为120 。
C
2、除去乙烷中混有的少量乙烯的方法,正确的是( )
A.通入氯气后进行光照
B.通入溴水
C.通入澄清的石灰水
D.点燃
B
练习:
1、能用于鉴别甲烷和乙烯的试剂是 ( )
A.溴水 B.酸性高锰酸钾溶液
C.苛性钠溶 D.四氯化碳溶液
2、制取一氯甲烷最好采用的方法是 ( )
A.乙烷和氯气反应 B.乙烯和氯气反应
C.乙烯和氯化氢反应 D.乙烷和氯化氢反应
AB
C
3. 既可以使溴水褪色,又可以使酸性高锰酸钾溶液褪色的气体有 ( )
A. CO B. CO2
C. C2H4 D. C2H6
C
4. 乙烯发生的下列反应中,不属于加成反应的是 ( )
A. 与氢气反应生成乙烷
B. 与水反应生成乙醇
C. 与溴水反应使之褪色
D. 与氧气反应生成二氧化碳和水
D
[例1]某气态烃在密闭容器中与氧气混合,用电火花点燃,完全燃烧前后容器内压强保持不变(温度为120℃),则该烃为( )
A、CH4 B、C2H6
C、C2H4 D、C3H6
例题选讲:
AC
[例2]标准状况下1.68L无色可燃性气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水,得到的白色沉淀质量为15克;若用足量碱石灰吸收燃烧产物,增重9.3g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气态烃,通过计算推断它的分子式。
2.7g
C2H4
[例3]将乙烯和甲烷的混合气体完全燃烧时,所消耗的氧气的体积是混合气体体积的2.4倍,则甲烷和乙烯的体积比是:
A、1:2 B、2:1
C、2:3 D、3:2
C
[例4]将0.2mol两种气态烃组成的混合气体完全燃烧,得到6.72LCO2(标准状况)和7.2g水,下列说法中正确的是:
A、一定有甲烷 B、一定有乙烯
C、一定没有甲烷 D、一定没有乙烯
A
[例5] 一种能使溴水褪色的气态烃,标准状况下5.6升的质量10.5为克,这些质量的烃完全燃烧时生成16.8升二氧化碳和13.5克水。求该烃的分子式,并推论它的化学性质。
(C3H6)
[例6] 、用含水5%的酒精100克跟浓硫酸共热制乙烯,可制得乙烯多少升(标准状况)?如果把这些乙烯通过溴水,全部被溴水吸收,理论上溴水至少应含纯溴多少摩?
(答:可制乙烯46.2升,含溴2.06摩)
浓硫酸和酒精的用量配比:
体积比约为 3:1
为什么浓硫酸用量要多?
反应中有生成水,会使浓硫酸稀释,而稀硫酸没有脱水性会导致实验失败。
浓硫酸和酒精
浓硫酸在反应中起什么作用?
脱水剂和催化剂
1、药品:
2、原理:
乙烯的实验室制法
发生分子内脱水生成乙烯
A
B
C
1、固+液 气
2、固 气
3、固+液 气
可用( )装置常用做制( )
A
可用( )装置常用做制( )
可用( )装置常用做制( )
B
C
H2 CO2
O2 NH3
Cl2
3、制备装置
液+液 气
△
4、操作原理:
1、安装顺序如何?
(由下到上,由左到右)
3、混合液体时是将什么倒入什么中?为什么?
(浓硫酸缓缓倒入乙醇中)
4、能否在量筒中混合液体?为什么?
(否,混合时放热)
2、如何检查装置的气密性?
把导气管伸入水中,用手捂住烧瓶。
思考:
1、碎瓷片的作用?
防止爆沸
2、迅速升温至1700C目的?
3、温度计水银球所在的位置?
温度计的水银球必须伸入液面以下,因为温度计指示的是反应温度。
4、能否用排空法收集乙烯?
不能,因为乙烯的密度与空气的密度接近。
5、实验结束是先撤酒精灯还是先撤导管?
先撤导管,防止倒吸。
1400C乙醇会发生分子间脱水生成副产品乙醚。
6、加热过程中混合液颜色如何变化?
溶液由无色变成棕色最后变成黑色。
原因是浓硫酸使酒精脱水碳化
2H2SO4+C2H5OH 2SO2↑+2C+5H2O
△
7、加热时间过长,还会产生有刺激性气味的气体,为什么?
浓硫酸具有强氧化性,可以与生成的碳反应。
C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
△
练习:
实验室制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的二氧化硫。有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫。
I
II
IIII
IV
①如图上所示,I、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:(将下列有关试剂的序号填入空格内)。
I ,Ⅱ ,Ⅲ ,Ⅳ 。
A.品红溶液 B.NaOH溶液
C.浓H2SO4 D.酸性KMnO4溶液
②能说明二氧化硫气体存在的现象是 。
③使用装置Ⅱ的目的是 。
④使用装置Ⅲ的目的是 。
⑤确证含有乙烯的现象是 。
A
D
A
B
I中品红褪色
除去SO2
验证SO2是否除净
IV中紫色KMnO4褪色
