2021-2022学年高一化学苏教版(2019)必修第一册专题3从海水中获得的化学物质 单元测试
文档属性
| 名称 | 2021-2022学年高一化学苏教版(2019)必修第一册专题3从海水中获得的化学物质 单元测试 |  | |
| 格式 | docx | ||
| 文件大小 | 180.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-25 14:14:33 | ||
图片预览




文档简介
专题3从海水中获得的化学物质专题练习2021-2022学年高中化学苏教版(2019)必修一
一、单选题(共15题)
1.海带产量高、价格低,常用作提取碘单质的原料。实验室从海带中提取碘的部分流程如图所示,下列实验装置或操作能达到实验目的的是
下列说法正确的是(??
)
A.完成步骤①需要装置III
B.完成步骤③需要装置I
C.完成步骤⑤需要装置II
D.完成步骤②和④需要装置IV
2.正确表示下列变化的离子方程式是(???
)
A.?水垢滴加
溶液产生气体:
B.?打磨的
片和
溶液反应:
C.?向硫酸铜溶液中加入过量的氨水:
D.?向
溶液加入少量的
溶液:
3.下列物质属于弱电解质的是(
??)
A.?CO2???????????????????????????????????B.?H2O???????????????????????????????????C.?HNO3???????????????????????????????????D.?NaOH
4.Na2SO3溶液是工业上常用的还原剂、防腐剂、去氯剂等。下列离子方程式正确的是(
??)
A.?Na2SO3溶液在空气中易被氧化:SO
+O2=SO
B.?Na2SO3溶液用作去氯剂:Cl2+SO
+H2O=2H++2Cl-+SO
C.?0.1mol·L-1Na2SO3溶液pH>7:SO
+2H2O
H2SO3+2OH-
D.?过量SO2与NaOH溶液反应生成Na2SO3溶液:SO2+2OH-=SO
+H2O
5.下列指定反应的离子方程式书写正确的是(
??)
A.?过量铁粉溶于稀硝酸:Fe+2H+=Fe2++H2↑
B.?向0.1mol·L?1Ba(OH)2溶液中滴加NaHSO4至Ba2+完全沉淀:Ba2++OH?+H++SO
=BaSO4↓+H2O
C.?将Al2(SO4)2溶液与Na2CO3溶液混合:2Al3++3CO
=Al2(CO3)3↓
D.?用食醋来除水壶中的水垢(主要成分CaCO3):CaCO3+2H+=Ca2++CO2↑+H2O
6.对于反应:2Na2O2+2H2O=4NaOH+O2↑,下列说法中正确的是
(?
)
A.?Na2O2是氧化剂,H2O是还原剂?????????????????????????B.?Na2O2既是氧化剂,又是还原剂
C.?该反应中电子转移的数目为4e-?????????????????????????D.?氧气是还原产物
7.下列离子方程式能用来解释相应实验现象的是(?
?)
?
实验现象
离子方程式
A
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
B
向沸水中滴加饱和氯化铁溶液得到红褐色液体
C
二氧化硫使酸性高锰酸钾溶液褪色
D
氧化亚铁溶于稀硝酸
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
8.下列指定反应的离子方程式正确的是(
??)
A.将Cl2通入水中制备氯水:Cl2+H2O
2H++Cl-+ClO-
B.酸化NaIO3和NaI的混合溶液:5I-+IO
+6H+=3I2+3H2O
C.0.1mol/LAgNO3溶液中加入过量稀氨水:Ag++NH3·H2O=AgOH↓+NH
D.电解饱和食盐水:2Cl-+2H+
Cl2↑+H2↑
9.能正确表示下列反应的离子方程式为
(?
)
A.?过量CO2通入澄清的石灰水:Ca2+
+
2OH-
+
CO2=CaCO3↓+H2O
B.?向CuSO4溶液中通入H2S:H2S+Cu2+=CuS↓+2H+
C.?向碘化钾溶液中加入少量酸性双氧水:3H2O2+I-=I+3H2O
D.?向饱和碳酸钠溶液中通入足量CO2:CO3-+2CO2+H2O=2HCO3-
10.下列物质属于强电解质的是(??
)
A.?KOH?????????????????????????????????B.?H3PO4?????????????????????????????????C.?SO3?????????????????????????????????D.?CH3CHO
11.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是(??
)
A.?????????????????????????????????????B.?
C.???????????????????????????????????????D.?
12.以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3SO4)2(OH)6]和纳米镍粉的部分工艺流程如图:
已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3
,
Fe2+在pH约为9时可完全转化为Fe(OH)2
下列说法错误的是(
??)
A.?“滤渣”的主要成分是SiO2
B.?为提高镍、铁元素的利用率,可将“过滤I”的滤液和滤渣洗涤液合并
C.?“氧化”过程发生的离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O
D.?“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,应将pH控制在3.7~9
13.化学与生产、生活密切相关,下列物质用途错误的是(??
)
A.次氯酸钠:漂白剂
B.碳酸氢钠:候氏制碱法的初始原料
C.硅酸钠:木材防火剂
D.过氧化钠:呼吸面具的供氧剂
14.下列实验的反应原理用离子方程式表示正确的是(??
)
A.少量
通入
溶液中:
B.用惰性电极电解氯化镁溶液:
C.向
溶液中加入足量Ba(OH)2溶液:
D.用双氧水和稀硫酸处理铜印刷电路板:
15.下列实验现象对应的离子方程式正确的是(
??)
A.少量SO2通入水玻璃中得到白色沉淀:2SO2+SiO
+2H2O=H2SiO3↓+2HSO
B.向醋酸溶液中加入小苏打粉末得到无色气体:2CH3COOH+CO
=2CH3COO-+H2O+CO2↑
C.向AgCl悬浊液中滴加足量Na2S溶液,出现黑色沉淀:AgCl(s)+S2-=Ag2S(s)+Cl-
D.向草酸溶液中滴加几滴酸性高锰酸钾溶液,紫色褪色,同时有气泡产生:2MnO
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
二、综合题(共5题)
16.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。某校探究学习小组同学用含有少量杂质(主要为少量泥沙、
、
、
等)的粗盐制取较纯净的NaCl,实验前他们设计了如图所示的实验方案。
请回答:
(1)请写出操作第④、⑤步所加试剂名称:④________;⑤________。
(2)写出第⑤步操作中可能发生反应的离子方程式:________;________。
(3)第⑥步需要用到的主要仪器有:带铁圈的铁架台、酒精灯、________和________。
(4)你认为该设计里哪些步骤调换后不影响实验结果:________;
(5)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:________。
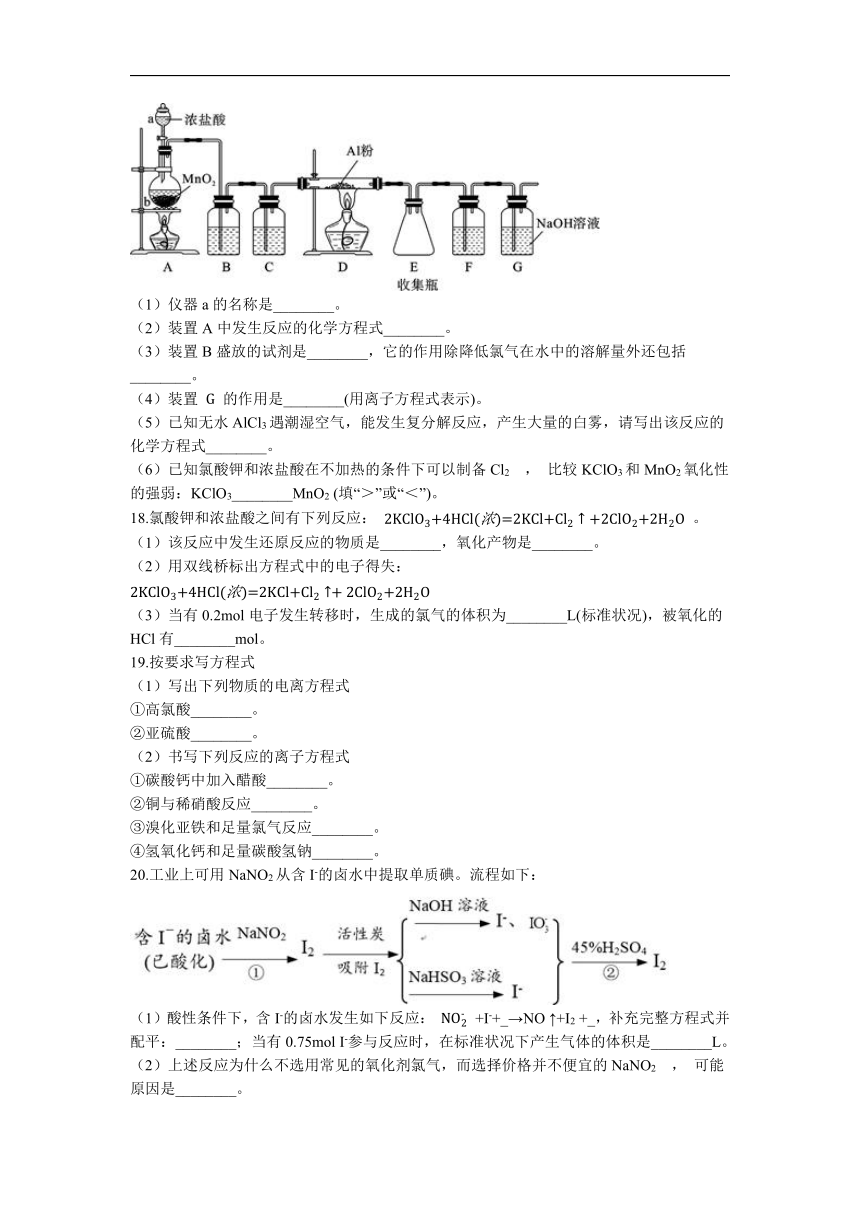
17.已知无水AlCl3遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备无水AlCl3。请回答:
(1)仪器a的名称是________。
(2)装置A中发生反应的化学方程式________。
(3)装置B盛放的试剂是________,它的作用除降低氯气在水中的溶解量外还包括________。
(4)装置
的作用是________(用离子方程式表示)。
(5)已知无水AlCl3遇潮湿空气,能发生复分解反应,产生大量的白雾,请写出该反应的化学方程式________。
(6)已知氯酸钾和浓盐酸在不加热的条件下可以制备Cl2
,
比较KClO3和MnO2氧化性的强弱:KClO3________MnO2
(填“>”或“<”)。
18.氯酸钾和浓盐酸之间有下列反应:
。
(1)该反应中发生还原反应的物质是________,氧化产物是________。
(2)用双线桥标出方程式中的电子得失:
(3)当有0.2mol电子发生转移时,生成的氯气的体积为________L(标准状况),被氧化的HCl有________mol。
19.按要求写方程式
(1)写出下列物质的电离方程式
①高氯酸________。
②亚硫酸________。
(2)书写下列反应的离子方程式
①碳酸钙中加入醋酸________。
②铜与稀硝酸反应________。
③溴化亚铁和足量氯气反应________。
④氢氧化钙和足量碳酸氢钠________。
20.工业上可用NaNO2从含I-的卤水中提取单质碘。流程如下:
(1)酸性条件下,含I-的卤水发生如下反应:
+I-+_→NO
↑+I2
+_,补充完整方程式并配平:________;当有0.75mol
I-参与反应时,在标准状况下产生气体的体积是________L。
(2)上述反应为什么不选用常见的氧化剂氯气,而选择价格并不便宜的NaNO2
,
可能原因是________。
(3)从第②步反应后的溶液中提纯I2涉及到的方法可以是________(选填编号)。
a.萃取????????????
b.升华??????????
c.纸层析??????????
d.过滤
(4)在富集碘元素过程中,还使用了NaHSO3溶液。该物质既能水解又能电离,设计实验验证其水解程度和电离程度的相对大小________。
答案解析部分
一、单选题
1.【答案】
D
【解析】【解答】A.步骤①灼烧海带需要用坩埚,不需要蒸发皿,故A不符合题意;
B.步骤③为分离海带灰悬浊液得到含碘离子的水溶液,操作为过滤,需要装置Ⅱ,故B不符合题意;
C.步骤⑤是萃取分液,不是过滤,需要装置Ⅰ,故C不符合题意;
D.完成步骤②浸泡海带灰,④是酸性条件下H2O2氧化碘离子,则都需要装置Ⅳ,故D符合题意;
故答案为:D。
【分析】①灼烧一般用的是坩埚,②浸泡一般是在烧杯中进行,③是过滤一般需要用到过滤装置,④反应一般是在烧杯中进行,⑤萃取一般用分液漏斗
2.【答案】
D
【解析】【解答】A.
水垢滴加??溶液产生气体
正确的离子方程式:
,故A不符合题意
B.
打磨的??片和??溶液反应,正确的离子方程式是:2Al+2H2O+2OH-=2AlO2-+3H2,故B不符合题意
C.
向硫酸铜溶液中加入过量的氨水的筷子方程式为:Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O,故C不符合题意
D.向碳酸氢钙溶液中加入少量的氢氧化钠产生碳酸钙和碳酸氢钠和水,正确的离子方程式是:
,故D符合题意
故答案为:D
【分析】A.醋酸是弱酸,不能拆开
B.反应原理不对,且不符合电荷守恒
C.过量的氨水形成的是铜氨溶液
D.氢氧化钠少量,以氢氧化钠计算1mol氢氧根离子只能消耗1mol碳酸氢根离子变为1mol碳酸根离子
3.【答案】
B
【解析】【解答】A.二氧化碳是非电解质,故A不符合题意
B.水是部分电离,是弱电解质,故B符合题意
C.硝酸是强酸属于强电解质,故C不符合题意
D.氢氧化钠是强碱,是强电解质,故D不符合题意
故答案为:B
【分析】弱电解质是在部分电离的电解质,主要是弱酸、弱碱、以及水。强酸、强碱、以及可溶性盐均是强电解质
4.【答案】
B
【解析】【解答】A.正确的是2SO
+O2=2SO
,故A不符合题意;
B.离子方程式为Cl2+SO
+H2O=2H++2Cl-+SO
;故B符合题意;
C.分步水解,正确的水解方程式为:SO
+H2O
HSO
+OH-、HSO
+H2O
H2SO3+OH-
,
溶液中c(OH-)>c(H+),溶液显碱性,故C不符合题意;
D.正确的是SO2+OH-=HSO
,故D不符合题意;
故答案为B。
【分析】A.亚硫酸钠容易被氧气氧化成硫酸钠,题中所给离子方程式氧原子不守恒
B.氯气具有强氧化性,能将亚硫酸钠氧化成硫酸钠,本身被还原成氯离子
C.亚硫酸钠为强碱弱酸盐,SO
为二元弱酸根,分步水解
D.过量的SO2能与SO
反应生成HSO
?
5.【答案】
B
【解析】【解答】A.
过量铁粉溶于稀硝酸生成硝酸亚铁、一氧化氮和水:3Fe+8H++2NO
═3Fe2++2NO↑+4H2O↑,故A不符合题意;
B.
向0.1mol·L?1Ba(OH)2溶液中滴加NaHSO4至Ba2+完全沉淀,钡离子与硫酸根离子比是1:1,:Ba2++OH?+H++SO
=BaSO4↓+H2O,故B符合题意;
C.
将Al2(SO4)2溶液与Na2CO3溶液混合:2Al3++3CO
+3H2O
=2Al(OH)3↓+3CO2
↑,故C不符合题意
D.用食醋来除水壶中的水垢(主要成分CaCO3):CaCO3+2CH3COOH=Ca2++CO2↑+H2O+2CH3COO-
,
故D不符合题意;
故答案为:B。
【分析】A.稀硝酸具有氧化性,铁具有还原性得到产物不是氢气
B.将钡离子沉淀完全需要是氢氧化钡与硫酸氢钠的物质的量之比为1:1
C.应该考虑铝离子和碳酸根离子的双水解
D.
醋酸是弱酸,不应该拆开
6.【答案】
B
【解析】【解答】A.
Na2O2是氧化剂同时也是还原剂,水只是做溶剂的作用,故A不符合题意
B.Na2O2是氧化剂同时也是还原剂,故B符合题意
C.?根据方程式2Na2O2+2H2O=4NaOH+O2↑?~2e,反应的转移的电子数为2,故C不符合题意
D.Na2O2~O2
,
氧元素的化合价升高,故为氧化反应,为氧化产物,故D不符合题意
故答案为:B
【分析】根据
2Na2O2+2H2O=4NaOH+O2↑,?标出元素的化合价,过氧化钠即是氧化剂又是还原剂,氢氧化钠是还原产物,而氧气是氧化产物,该反应中得失电子总数为2个电子
7.【答案】
A
【解析】【解答】A.
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
的离子方程式为
,故A符合题意
B.
向沸水中滴加饱和氯化铁溶液得到红褐色液体得到的方程式为?Fe3++3H2OFe(OH)3(胶体)+3H2O,故B不符合题意
C.?二氧化硫使酸性高锰酸钾溶液褪色的方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,故C不符合题意
D.
氧化亚铁溶于稀硝酸
反应的方程式为?
3FeO+10H++NO3-=3Fe3++NO+5H2O,故D不符合题意
故答案为:A
【分析】A.利用铵根离子的水解呈酸性与氢氧化镁作用
B.制备的氢氧化铁胶体不是沉淀
C.方程式书写错误且配平错误
D.硝酸具有很强的氧化性,而氧化亚铁具有还原性
8.【答案】
B
【解析】【解答】A.将Cl2通入水中制备氯水的离子方程式为:Cl2+H2O
H++Cl-+HClO,A不符合题意;
B.酸化NaIO3和NaI的混合溶液的离子方程式为:5I-+IO
+6H+=3I2+3H2O,B符合题意;
C.0.1mol/LAgNO3溶液中加入过量稀氨水的离子方程式为:Ag++3NH3·H2O=
+OH-+2H2O+
,C不符合题意;
D.电解饱和食盐水的离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-
,
D不符合题意;
故答案为:B。
【分析】A.次氯酸是弱酸不拆
B.利用碘酸根和碘离子发生氧化还原反应得到碘单质
C.过量的氨水形成银氨溶液
D.电解饱和食盐水得到的是氢氧化钠和氢气和氯气
9.【答案】
B
【解析】【解答】A.CO2能与Ca(OH)2反应生成CaCO3沉淀,过量的CO2能继续跟CaCO3反应生成可溶性Ca(HCO3)2
,
因此反应的离子方程式为:CO2+OH-=HCO3-
,
A不符合题意;
B.H2S能与CuSO4溶液反应生成CuS沉淀,该反应的离子方程式为Cu2++H2S=CuS↓+2H+
,
B符合题意;
C.H2O2能将I2氧化成I2
,
自身还原为H2O,该反应的离子方程式为:H2O2+2H++2I-=I2+2H2O,C不符合题意;
D.饱和Na2CO3溶液中通入CO2
,
可反应生成NaHCO3
,
由于NaHCO3的溶解度较小,因此产生的NaHCO3无法完全溶解,会有固体析出,故反应的离子方程式为:2Na++CO32-+CO2+H2O=2NaHCO3↓,D不符合题意;
故答案为:B
【分析】A.过量的CO2能继续与CaCO3反应;
B.H2S能与Cu2+形成CuS沉淀;
C.H2O2具有氧化性,能将I-氧化成I2;
D.饱和Na2CO3溶液中通入CO2
,
可形成NaHCO3沉淀;
10.【答案】
A
【解析】【解答】A.KOH在水溶液中或熔融状态下能够完全电离出K+和OH-
,
KOH为强电解质,A符合题意;
B.H3PO4在水溶液中或熔融状态下能不够完全电离,H3PO4为弱电解质,B不符合题意;
C.SO3在水溶液中或熔融状态下不能电离,SO3属于非电解质,C不符合题意;
D.CH3CHO在水溶液中或熔融状态下不能电离,CH3CHO属于非电解质,D不符合题意;
故答案为:A。
【分析】在水溶液中或熔融状态下能够完全电离的化合物为强电解质。氢氧化钾在水溶液中完全电离
11.【答案】
D
【解析】【解答】A.
是紫红色的溶液,故A不符;
B.
结合生成NH3?H2O
,故B不符;
C.
????之间发生氧化还原反应,不能大量共存,故C不符;
D.
在碱性溶液中能大量共存,且溶液为无色透明,故D符合;
故答案为:D。
【分析】
离子不能共存,说明可以发生化学反应,主要是发生复分解反应、氧化还原反应、络合反应等等
常见发生复分解反应不能共存的是:氢离子与氢氧根离子、以及可以形成弱电解质的阴离子,氢氧根与氢离子、碳酸氢根、亚硫酸氢根、铜离子、铁离子、镁离子等不同共存,银离子和氯离子,钡离子和碳酸根、硫酸根、钙离子和碳酸根
发生氧化还原反应不能共存的是:氢离子、硝酸根以及次氯酸根以及高锰酸根和亚铁离子、硫离子等还原性离子
发生络合不能共存的是:铁离子和硫氰酸根、铜离子和氨水等等
12.【答案】
D
【解析】【解答】A.根据分析,二氧化硅不溶于硫酸,形成滤渣,故A不符合题意;
B.滤渣表面吸附有滤液中的镍、铁元素,为提高镍、铁元素的利用率,可将“过滤I”的滤液和滤渣洗涤液合并,故B不符合题意;
C.“氧化”过程中NaClO氧化Fe2+生成Fe3+
,
反应的离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O,故C不符合题意;
D.Fe3+在pH约为3.7时可完全转化为Fe(OH)3
,
Fe2+在pH约为9时可完全转化为Fe(OH)2
,
“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度形成黄钠铁矾[NaFe3SO4)2(OH)6],应将pH控制在pH<3.7,故D符合题意;
故答案为:D。
【分析】红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)中加入硫酸酸浸,酸浸后的酸性溶液中含有Ni2+、Fe2+、Fe3+等,二氧化硅不溶,形成滤渣,滤液中加入NaClO氧化亚铁离子为铁离子,再加入碳酸钠溶液调节溶液的pH,使铁离子全部沉淀,过滤后得到沉淀黄钠铁矾,滤液经处理可得到Ni,据此分析解答。
13.【答案】
B
【解析】【解答】A.次氯酸钠具有氧化性,是家庭常用的漂白剂,故A不符合题意;
B.侯氏制碱法的初始原料是
、
、
和
,反应先生成碳酸氢钠,受热分解后得到纯碱碳酸钠,故B符合题意;
C.硅酸钠不易燃,常用作木材防火剂,故C不符合题意;
D.过氧化钠与水、二氧化碳均能反应生成氧气,可以作为呼吸面具的供氧剂,故D不符合题意;
故答案为:B。
【分析】侯式制碱法的原料是饱和食盐水、二氧化碳和氨气,而碳酸氢钠是制取纯碱的原料。
14.【答案】
D
【解析】【解答】A.离子方程式应为SO2+2CO
+H2O=SO
+2HCO
,A不符合题意;
B.离子方程式为Mg2++2Cl-+2H2O
Cl2↑+H2↑+Mg(OH)2↓,B不符合题意;
C.符合题意离子方程式为Al3++2SO
+2Ba2++4OH-=2BaSO4↓+AlO
+2H2O,C不符合题意;
D.双氧水在酸性环境中会将Cu氧化为Cu2+
,
选项所给离子方程式无误,D符合题意;
故答案为:D。
【分析】A.SO2少量无法生成CO2
B.电解氯化镁溶液时阴极产生的氢氧根会和镁离子生成沉淀
C.Ba(OH)2足量,最终会得到偏铝酸根
D.过氧化氢具有氧化性可将铜单质氧化为铜离子
15.【答案】
D
【解析】【解答】A.少量SO2通入水玻璃中得到白色沉淀硅酸和亚硫酸钠,SO2+SiO
+H2O=H2SiO3↓+SO
,A不符合题意;
B.向醋酸溶液中加入小苏打粉末得到无色气体,小苏打为碳酸氢钠,CH3COOH+HCO
=CH3COO-+H2O+CO2↑,B不符合题意;
C.向AgCl悬浊液中滴加足量Na2S溶液,出现黑色沉淀Ag2S,2AgCl(s)+S2-=Ag2S(s)+2Cl-
,
C不符合题意;
D.向草酸溶液中滴加几滴酸性高锰酸钾溶液,紫色褪色,同时生成气体二氧化碳和硫酸锰,2MnO
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,D符合题意;
答案为D。
【分析】A.过量的二氧化硫得到的是亚硫酸氢根
B.苏打是碳酸钠,而小苏打是碳酸氢钠
C.电荷不守恒
D.符合氧化还原反应的原理
二、综合题
16.【答案】
(1)碳酸钠溶液;稀盐酸
(2);
(3)蒸发皿;玻璃棒
(4)②③或③④
(5)用
代替
和NaOH,使②③合并为一步
【解析】【解答】(1)操作第④步除钙离子加Na2CO3溶液转化为沉淀,生成CaCO3
,
同时碳酸钠会除去反应剩余的氯化钡,生成BaCO3
,
离子都形成沉淀,再进行过滤;操作第⑤步加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠;
?
(2)根据(1)的分析,第⑤步操作中可能发生反应的离子方程式有
;
;
(3)第⑥步为蒸发结晶,需要用到的仪器有:带铁圈的铁架台、酒精灯、蒸发皿、玻璃棒;
(4)先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化碳酸钙为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,故答案为②③或③④;
(5)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用BaCl2沉淀,所以,用Ba(OH)2代替BaCl2和NaOH,使②③步合并为一步。
【分析】粗盐经过溶解得到浓液体,加入氯化钡生成硫酸钡沉淀A,沉淀B为氢氧化镁,加入碳酸钠除去钙离子和过量钡离子,混合沉淀C为碳酸钙、碳酸钡,第⑤步加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠,据此解题。
?
17.【答案】
(1)分液漏斗
(2)MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(3)饱和食盐水;除去氯气中的HCl
(4)Cl2+2OH-=Cl-+ClO-+H2O
(5)AlCl3+3H2O=Al(OH)3↓+3HCl
(6)>
【解析】【解答】(1)根据装置图可知仪器a的名称是分液漏斗;
(2)在装置A中浓盐酸与MnO2混合加热反应产生Cl2
,
反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(3)装置B中试剂是饱和NaCl溶液;作用是降低Cl2的溶解度,同时也能除去Cl2中的杂质HCl;
(4)装置G的作用是吸收多余Cl2
,
防止大气污染,该反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)无水AlCl3遇潮湿的空气,发生复分解反应产生Al(OH)3和HCl,反应的化学方程式为:AlCl3+3H2O=Al(OH)3↓+3HCl;
(6)KClO3与浓盐酸在常温下发生氧化还原反应产生Cl2
,
而MnO2与浓盐酸在加热条件下才可以发生氧化还原反应产生Cl2
,
说明物质的氧化性:KClO3>MnO2。
【分析】在A中浓盐酸与MnO2混合加热制取Cl2
,
由于浓盐酸具有挥发性,挥发的HCl及水蒸气混在Cl2中,先通过饱和NaCl溶液除去杂质HCl,再通过浓硫酸干燥,得到纯净Cl2在D中与Al在加热条件下反应产生AlCl3
,
装置E用于储存AlCl3
,
由于无水AlCl3遇潮湿空气即产生大量白雾,因此装置F中盛有浓硫酸,装置G中NaOH溶液作用是尾气处理,用于吸收多余Cl2
,
防止大气污染。
18.【答案】
(1);
(2)
(3)2.24;0.2
【解析】【解答】(1)在该氧化还原反应中,KClO3中氯元素由+5价变为+4价,化合价降低,发生得电子的还原反应,因此发生还原反应的物质为KClO3;HCl中氯元素由-1价变为0,发生氧化反应,因此氧化产物为Cl2。
(2)在该氧化还原反应中,KClO3中氯元素得到电子,发生还原反应,生成ClO2
,
HCl中氯元素失去电子,发生氧化反应,生成Cl2
,
反应过程中转移2个电子,因此用双线桥表示如下:
。
(3)由双线桥可知,该反应中每转移2个电子,生成一分子Cl2
,
因此当有0.2mol电子发生转移时,生成Cl2的物质的量为0.1mol,其在标准状态下的体积V=n×Vm=0.1mol×22.4L/mol=2.24L;
由双线桥可知,该反应中每转移2个电子,即又2分子HCl被氧化,因此当有0.2mol电子发生转移时,被氧化的HCl的物质的量为0.2mol。
【分析】(1)根据反应过程重元素化合价的变化进行分析即可。
(2)根据反应过程中元素化合价的变化,结合双线桥的表示方法进行分析。
(3)根据转移电子数和生成Cl2的关系确定生成Cl2的物质的量,结合V=n×Vm计算其体积;根据转移电子数计算被氧化的HCl的物质的量。
19.【答案】
(1);
(2);;;
【解析】【解答】(1)①HClO4为强酸,在水中完全电离,形成H+和ClO4-
,
因此其电离方程式为:HClO4=H++ClO4-;
②H2SO3是一种二元弱酸,在水中部分电离,且分步进行,因此其电离方程式为:H2SO3?H++HSO3-、HSO3-?H++SO32-。
(2)①难溶于水的CaCO3能与CH3COOH(弱酸)反应生成可溶于水的(CH3COO)2Ca、H2O和CO2
,
因此反应的离子方程式为:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑;
②铜与稀硝酸(强酸)反应生成可溶性的Cu(NO3)2、NO和H2O,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
③Cl2足量,则FeBr2完全反应,参与反应的Fe2+和Br-的个数比为1:2,因此反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
④NaHCO3足量,则Ca(OH)2完全反应,参与反应的Ca2+和OH-的个数比为1:2,因此该反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O。
【分析】(1)①HClO4为强酸,在水中完全电离;
②H2SO3为弱酸,在水中部分电离。
(2)①CaCO3与CH3COOH反应生成可溶性(CH3COO)2Ca、H2O和CO2
,
且CaCO3难溶于水,CH3COOH为弱酸,据此写出反应的离子方程式;
②铜与硝酸反应生成可溶性Cu(NO3)2、NO和H2O,据此写出反应的离子方程式;
③Cl2足量,则FeBr2完全反应,参与反应的Fe2+和Br-的个数比需满足1:2,据此写出反应的离子方程式;
④NaHCO3足量,则Ca(OH)2完全反应,参与反应的Ca2+和OH-需满足1:2,据此写出反应的离子方程式。
20.【答案】
(1)2
+2I-+4H+=2NO↑+I2+2H2O;16.8
(2)氯气氧化性太强,还能继续氧化I2
(3)ab
(4)常温下测NaHSO3稀溶液的pH,若pH大于7,则其水解程度大于电离程度,若pH小于7,其水解程度小于电离程度
【解析】【解答】(1)该反应中N元素的化合价由+3降低为+2,I元素的化合价由-1升高为0,根据电子得失守恒,可得主反应2
+2I-→2NO
↑+I2
,
酸性条件下,结合电荷守恒方程式左边补充4H+
,
结合原子个数守恒方程式右边补充2H2O,最后完整方程式为:2
+2I-+4H+=2NO↑+I2+2H2O。当有0.75mol
I-参与反应时,则生成
n(NO)=
=0.75mol,在标准状况下产生气体的体积是0.75mol
22.4L/mol=16.8L。故答案为:2
+2I-+4H+=2NO↑+I2+2H2O;16.8;
?
(2)上述反应中不选用常见的氧化剂氯气,原因是氯气氧化性太强,还能继续氧化I2
,
从而提取碘单质产率降低,故工业上氧化卤水中I-选择价格并不便宜的NaNO2。故答案为:氯气氧化性太强,还能继续氧化I2;
(3)从第②步反应后的溶液中提纯I2
,
碘在水中的溶解度不大,但易溶于有机溶剂,可加入四氯化碳萃取碘,即把碘从水溶液中提取出来;同时碘容易升华,也可用升华提取碘。
故答案为:ab;
(4)NaHSO3溶液中
既能水解又能电离,水解使其显碱性,电离使其显酸性,在常温下,可测NaHSO3稀溶液的pH,若pH大于7,则其水解程度大于电离程度,若pH小于7,其水解程度小于电离程度。故答案为:常温下测NaHSO3稀溶液的pH,若pH大于7,则其水解程度大于电离程度,若pH小于7,其水解程度小于电离程度。
【分析】含I-的卤水经过酸化,亚硝酸钠具有氧化性,碘离子具有还原性,二者发生氧化还原反应生成一氧化氮、碘单质、碘化钠和水,反应化学方程式:2
+4HI=2NO↑+I2+2H2O+2NaI,活性炭所吸附I2通过NaOH溶液或NaHSO3溶液得到I-、
,再经过45%H2SO4处理提取单质碘,据此分析解答。
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
(
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
)
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
?
一、单选题(共15题)
1.海带产量高、价格低,常用作提取碘单质的原料。实验室从海带中提取碘的部分流程如图所示,下列实验装置或操作能达到实验目的的是
下列说法正确的是(??
)
A.完成步骤①需要装置III
B.完成步骤③需要装置I
C.完成步骤⑤需要装置II
D.完成步骤②和④需要装置IV
2.正确表示下列变化的离子方程式是(???
)
A.?水垢滴加
溶液产生气体:
B.?打磨的
片和
溶液反应:
C.?向硫酸铜溶液中加入过量的氨水:
D.?向
溶液加入少量的
溶液:
3.下列物质属于弱电解质的是(
??)
A.?CO2???????????????????????????????????B.?H2O???????????????????????????????????C.?HNO3???????????????????????????????????D.?NaOH
4.Na2SO3溶液是工业上常用的还原剂、防腐剂、去氯剂等。下列离子方程式正确的是(
??)
A.?Na2SO3溶液在空气中易被氧化:SO
+O2=SO
B.?Na2SO3溶液用作去氯剂:Cl2+SO
+H2O=2H++2Cl-+SO
C.?0.1mol·L-1Na2SO3溶液pH>7:SO
+2H2O
H2SO3+2OH-
D.?过量SO2与NaOH溶液反应生成Na2SO3溶液:SO2+2OH-=SO
+H2O
5.下列指定反应的离子方程式书写正确的是(
??)
A.?过量铁粉溶于稀硝酸:Fe+2H+=Fe2++H2↑
B.?向0.1mol·L?1Ba(OH)2溶液中滴加NaHSO4至Ba2+完全沉淀:Ba2++OH?+H++SO
=BaSO4↓+H2O
C.?将Al2(SO4)2溶液与Na2CO3溶液混合:2Al3++3CO
=Al2(CO3)3↓
D.?用食醋来除水壶中的水垢(主要成分CaCO3):CaCO3+2H+=Ca2++CO2↑+H2O
6.对于反应:2Na2O2+2H2O=4NaOH+O2↑,下列说法中正确的是
(?
)
A.?Na2O2是氧化剂,H2O是还原剂?????????????????????????B.?Na2O2既是氧化剂,又是还原剂
C.?该反应中电子转移的数目为4e-?????????????????????????D.?氧气是还原产物
7.下列离子方程式能用来解释相应实验现象的是(?
?)
?
实验现象
离子方程式
A
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
B
向沸水中滴加饱和氯化铁溶液得到红褐色液体
C
二氧化硫使酸性高锰酸钾溶液褪色
D
氧化亚铁溶于稀硝酸
A.?A???????????????????????????????????????????B.?B???????????????????????????????????????????C.?C???????????????????????????????????????????D.?D
8.下列指定反应的离子方程式正确的是(
??)
A.将Cl2通入水中制备氯水:Cl2+H2O
2H++Cl-+ClO-
B.酸化NaIO3和NaI的混合溶液:5I-+IO
+6H+=3I2+3H2O
C.0.1mol/LAgNO3溶液中加入过量稀氨水:Ag++NH3·H2O=AgOH↓+NH
D.电解饱和食盐水:2Cl-+2H+
Cl2↑+H2↑
9.能正确表示下列反应的离子方程式为
(?
)
A.?过量CO2通入澄清的石灰水:Ca2+
+
2OH-
+
CO2=CaCO3↓+H2O
B.?向CuSO4溶液中通入H2S:H2S+Cu2+=CuS↓+2H+
C.?向碘化钾溶液中加入少量酸性双氧水:3H2O2+I-=I+3H2O
D.?向饱和碳酸钠溶液中通入足量CO2:CO3-+2CO2+H2O=2HCO3-
10.下列物质属于强电解质的是(??
)
A.?KOH?????????????????????????????????B.?H3PO4?????????????????????????????????C.?SO3?????????????????????????????????D.?CH3CHO
11.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是(??
)
A.?????????????????????????????????????B.?
C.???????????????????????????????????????D.?
12.以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3SO4)2(OH)6]和纳米镍粉的部分工艺流程如图:
已知:Fe3+在pH约为3.7时可完全转化为Fe(OH)3
,
Fe2+在pH约为9时可完全转化为Fe(OH)2
下列说法错误的是(
??)
A.?“滤渣”的主要成分是SiO2
B.?为提高镍、铁元素的利用率,可将“过滤I”的滤液和滤渣洗涤液合并
C.?“氧化”过程发生的离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O
D.?“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度,应将pH控制在3.7~9
13.化学与生产、生活密切相关,下列物质用途错误的是(??
)
A.次氯酸钠:漂白剂
B.碳酸氢钠:候氏制碱法的初始原料
C.硅酸钠:木材防火剂
D.过氧化钠:呼吸面具的供氧剂
14.下列实验的反应原理用离子方程式表示正确的是(??
)
A.少量
通入
溶液中:
B.用惰性电极电解氯化镁溶液:
C.向
溶液中加入足量Ba(OH)2溶液:
D.用双氧水和稀硫酸处理铜印刷电路板:
15.下列实验现象对应的离子方程式正确的是(
??)
A.少量SO2通入水玻璃中得到白色沉淀:2SO2+SiO
+2H2O=H2SiO3↓+2HSO
B.向醋酸溶液中加入小苏打粉末得到无色气体:2CH3COOH+CO
=2CH3COO-+H2O+CO2↑
C.向AgCl悬浊液中滴加足量Na2S溶液,出现黑色沉淀:AgCl(s)+S2-=Ag2S(s)+Cl-
D.向草酸溶液中滴加几滴酸性高锰酸钾溶液,紫色褪色,同时有气泡产生:2MnO
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
二、综合题(共5题)
16.我国的青海省有许多盐湖盛产食盐,人类与食盐关系密切,食盐在老百姓生活和现代社会的工农业生产中均有重要作用。某校探究学习小组同学用含有少量杂质(主要为少量泥沙、
、
、
等)的粗盐制取较纯净的NaCl,实验前他们设计了如图所示的实验方案。
请回答:
(1)请写出操作第④、⑤步所加试剂名称:④________;⑤________。
(2)写出第⑤步操作中可能发生反应的离子方程式:________;________。
(3)第⑥步需要用到的主要仪器有:带铁圈的铁架台、酒精灯、________和________。
(4)你认为该设计里哪些步骤调换后不影响实验结果:________;
(5)有同学认为上述实验设计步骤可以简化,请你提出简化的一种设想:________。
17.已知无水AlCl3遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备无水AlCl3。请回答:
(1)仪器a的名称是________。
(2)装置A中发生反应的化学方程式________。
(3)装置B盛放的试剂是________,它的作用除降低氯气在水中的溶解量外还包括________。
(4)装置
的作用是________(用离子方程式表示)。
(5)已知无水AlCl3遇潮湿空气,能发生复分解反应,产生大量的白雾,请写出该反应的化学方程式________。
(6)已知氯酸钾和浓盐酸在不加热的条件下可以制备Cl2
,
比较KClO3和MnO2氧化性的强弱:KClO3________MnO2
(填“>”或“<”)。
18.氯酸钾和浓盐酸之间有下列反应:
。
(1)该反应中发生还原反应的物质是________,氧化产物是________。
(2)用双线桥标出方程式中的电子得失:
(3)当有0.2mol电子发生转移时,生成的氯气的体积为________L(标准状况),被氧化的HCl有________mol。
19.按要求写方程式
(1)写出下列物质的电离方程式
①高氯酸________。
②亚硫酸________。
(2)书写下列反应的离子方程式
①碳酸钙中加入醋酸________。
②铜与稀硝酸反应________。
③溴化亚铁和足量氯气反应________。
④氢氧化钙和足量碳酸氢钠________。
20.工业上可用NaNO2从含I-的卤水中提取单质碘。流程如下:
(1)酸性条件下,含I-的卤水发生如下反应:
+I-+_→NO
↑+I2
+_,补充完整方程式并配平:________;当有0.75mol
I-参与反应时,在标准状况下产生气体的体积是________L。
(2)上述反应为什么不选用常见的氧化剂氯气,而选择价格并不便宜的NaNO2
,
可能原因是________。
(3)从第②步反应后的溶液中提纯I2涉及到的方法可以是________(选填编号)。
a.萃取????????????
b.升华??????????
c.纸层析??????????
d.过滤
(4)在富集碘元素过程中,还使用了NaHSO3溶液。该物质既能水解又能电离,设计实验验证其水解程度和电离程度的相对大小________。
答案解析部分
一、单选题
1.【答案】
D
【解析】【解答】A.步骤①灼烧海带需要用坩埚,不需要蒸发皿,故A不符合题意;
B.步骤③为分离海带灰悬浊液得到含碘离子的水溶液,操作为过滤,需要装置Ⅱ,故B不符合题意;
C.步骤⑤是萃取分液,不是过滤,需要装置Ⅰ,故C不符合题意;
D.完成步骤②浸泡海带灰,④是酸性条件下H2O2氧化碘离子,则都需要装置Ⅳ,故D符合题意;
故答案为:D。
【分析】①灼烧一般用的是坩埚,②浸泡一般是在烧杯中进行,③是过滤一般需要用到过滤装置,④反应一般是在烧杯中进行,⑤萃取一般用分液漏斗
2.【答案】
D
【解析】【解答】A.
水垢滴加??溶液产生气体
正确的离子方程式:
,故A不符合题意
B.
打磨的??片和??溶液反应,正确的离子方程式是:2Al+2H2O+2OH-=2AlO2-+3H2,故B不符合题意
C.
向硫酸铜溶液中加入过量的氨水的筷子方程式为:Cu2++4NH3.H2O=[Cu(NH3)4]2++4H2O,故C不符合题意
D.向碳酸氢钙溶液中加入少量的氢氧化钠产生碳酸钙和碳酸氢钠和水,正确的离子方程式是:
,故D符合题意
故答案为:D
【分析】A.醋酸是弱酸,不能拆开
B.反应原理不对,且不符合电荷守恒
C.过量的氨水形成的是铜氨溶液
D.氢氧化钠少量,以氢氧化钠计算1mol氢氧根离子只能消耗1mol碳酸氢根离子变为1mol碳酸根离子
3.【答案】
B
【解析】【解答】A.二氧化碳是非电解质,故A不符合题意
B.水是部分电离,是弱电解质,故B符合题意
C.硝酸是强酸属于强电解质,故C不符合题意
D.氢氧化钠是强碱,是强电解质,故D不符合题意
故答案为:B
【分析】弱电解质是在部分电离的电解质,主要是弱酸、弱碱、以及水。强酸、强碱、以及可溶性盐均是强电解质
4.【答案】
B
【解析】【解答】A.正确的是2SO
+O2=2SO
,故A不符合题意;
B.离子方程式为Cl2+SO
+H2O=2H++2Cl-+SO
;故B符合题意;
C.分步水解,正确的水解方程式为:SO
+H2O
HSO
+OH-、HSO
+H2O
H2SO3+OH-
,
溶液中c(OH-)>c(H+),溶液显碱性,故C不符合题意;
D.正确的是SO2+OH-=HSO
,故D不符合题意;
故答案为B。
【分析】A.亚硫酸钠容易被氧气氧化成硫酸钠,题中所给离子方程式氧原子不守恒
B.氯气具有强氧化性,能将亚硫酸钠氧化成硫酸钠,本身被还原成氯离子
C.亚硫酸钠为强碱弱酸盐,SO
为二元弱酸根,分步水解
D.过量的SO2能与SO
反应生成HSO
?
5.【答案】
B
【解析】【解答】A.
过量铁粉溶于稀硝酸生成硝酸亚铁、一氧化氮和水:3Fe+8H++2NO
═3Fe2++2NO↑+4H2O↑,故A不符合题意;
B.
向0.1mol·L?1Ba(OH)2溶液中滴加NaHSO4至Ba2+完全沉淀,钡离子与硫酸根离子比是1:1,:Ba2++OH?+H++SO
=BaSO4↓+H2O,故B符合题意;
C.
将Al2(SO4)2溶液与Na2CO3溶液混合:2Al3++3CO
+3H2O
=2Al(OH)3↓+3CO2
↑,故C不符合题意
D.用食醋来除水壶中的水垢(主要成分CaCO3):CaCO3+2CH3COOH=Ca2++CO2↑+H2O+2CH3COO-
,
故D不符合题意;
故答案为:B。
【分析】A.稀硝酸具有氧化性,铁具有还原性得到产物不是氢气
B.将钡离子沉淀完全需要是氢氧化钡与硫酸氢钠的物质的量之比为1:1
C.应该考虑铝离子和碳酸根离子的双水解
D.
醋酸是弱酸,不应该拆开
6.【答案】
B
【解析】【解答】A.
Na2O2是氧化剂同时也是还原剂,水只是做溶剂的作用,故A不符合题意
B.Na2O2是氧化剂同时也是还原剂,故B符合题意
C.?根据方程式2Na2O2+2H2O=4NaOH+O2↑?~2e,反应的转移的电子数为2,故C不符合题意
D.Na2O2~O2
,
氧元素的化合价升高,故为氧化反应,为氧化产物,故D不符合题意
故答案为:B
【分析】根据
2Na2O2+2H2O=4NaOH+O2↑,?标出元素的化合价,过氧化钠即是氧化剂又是还原剂,氢氧化钠是还原产物,而氧气是氧化产物,该反应中得失电子总数为2个电子
7.【答案】
A
【解析】【解答】A.
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
的离子方程式为
,故A符合题意
B.
向沸水中滴加饱和氯化铁溶液得到红褐色液体得到的方程式为?Fe3++3H2OFe(OH)3(胶体)+3H2O,故B不符合题意
C.?二氧化硫使酸性高锰酸钾溶液褪色的方程式为5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+,故C不符合题意
D.
氧化亚铁溶于稀硝酸
反应的方程式为?
3FeO+10H++NO3-=3Fe3++NO+5H2O,故D不符合题意
故答案为:A
【分析】A.利用铵根离子的水解呈酸性与氢氧化镁作用
B.制备的氢氧化铁胶体不是沉淀
C.方程式书写错误且配平错误
D.硝酸具有很强的氧化性,而氧化亚铁具有还原性
8.【答案】
B
【解析】【解答】A.将Cl2通入水中制备氯水的离子方程式为:Cl2+H2O
H++Cl-+HClO,A不符合题意;
B.酸化NaIO3和NaI的混合溶液的离子方程式为:5I-+IO
+6H+=3I2+3H2O,B符合题意;
C.0.1mol/LAgNO3溶液中加入过量稀氨水的离子方程式为:Ag++3NH3·H2O=
+OH-+2H2O+
,C不符合题意;
D.电解饱和食盐水的离子方程式为:2Cl-+2H2O
Cl2↑+H2↑+2OH-
,
D不符合题意;
故答案为:B。
【分析】A.次氯酸是弱酸不拆
B.利用碘酸根和碘离子发生氧化还原反应得到碘单质
C.过量的氨水形成银氨溶液
D.电解饱和食盐水得到的是氢氧化钠和氢气和氯气
9.【答案】
B
【解析】【解答】A.CO2能与Ca(OH)2反应生成CaCO3沉淀,过量的CO2能继续跟CaCO3反应生成可溶性Ca(HCO3)2
,
因此反应的离子方程式为:CO2+OH-=HCO3-
,
A不符合题意;
B.H2S能与CuSO4溶液反应生成CuS沉淀,该反应的离子方程式为Cu2++H2S=CuS↓+2H+
,
B符合题意;
C.H2O2能将I2氧化成I2
,
自身还原为H2O,该反应的离子方程式为:H2O2+2H++2I-=I2+2H2O,C不符合题意;
D.饱和Na2CO3溶液中通入CO2
,
可反应生成NaHCO3
,
由于NaHCO3的溶解度较小,因此产生的NaHCO3无法完全溶解,会有固体析出,故反应的离子方程式为:2Na++CO32-+CO2+H2O=2NaHCO3↓,D不符合题意;
故答案为:B
【分析】A.过量的CO2能继续与CaCO3反应;
B.H2S能与Cu2+形成CuS沉淀;
C.H2O2具有氧化性,能将I-氧化成I2;
D.饱和Na2CO3溶液中通入CO2
,
可形成NaHCO3沉淀;
10.【答案】
A
【解析】【解答】A.KOH在水溶液中或熔融状态下能够完全电离出K+和OH-
,
KOH为强电解质,A符合题意;
B.H3PO4在水溶液中或熔融状态下能不够完全电离,H3PO4为弱电解质,B不符合题意;
C.SO3在水溶液中或熔融状态下不能电离,SO3属于非电解质,C不符合题意;
D.CH3CHO在水溶液中或熔融状态下不能电离,CH3CHO属于非电解质,D不符合题意;
故答案为:A。
【分析】在水溶液中或熔融状态下能够完全电离的化合物为强电解质。氢氧化钾在水溶液中完全电离
11.【答案】
D
【解析】【解答】A.
是紫红色的溶液,故A不符;
B.
结合生成NH3?H2O
,故B不符;
C.
????之间发生氧化还原反应,不能大量共存,故C不符;
D.
在碱性溶液中能大量共存,且溶液为无色透明,故D符合;
故答案为:D。
【分析】
离子不能共存,说明可以发生化学反应,主要是发生复分解反应、氧化还原反应、络合反应等等
常见发生复分解反应不能共存的是:氢离子与氢氧根离子、以及可以形成弱电解质的阴离子,氢氧根与氢离子、碳酸氢根、亚硫酸氢根、铜离子、铁离子、镁离子等不同共存,银离子和氯离子,钡离子和碳酸根、硫酸根、钙离子和碳酸根
发生氧化还原反应不能共存的是:氢离子、硝酸根以及次氯酸根以及高锰酸根和亚铁离子、硫离子等还原性离子
发生络合不能共存的是:铁离子和硫氰酸根、铜离子和氨水等等
12.【答案】
D
【解析】【解答】A.根据分析,二氧化硅不溶于硫酸,形成滤渣,故A不符合题意;
B.滤渣表面吸附有滤液中的镍、铁元素,为提高镍、铁元素的利用率,可将“过滤I”的滤液和滤渣洗涤液合并,故B不符合题意;
C.“氧化”过程中NaClO氧化Fe2+生成Fe3+
,
反应的离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O,故C不符合题意;
D.Fe3+在pH约为3.7时可完全转化为Fe(OH)3
,
Fe2+在pH约为9时可完全转化为Fe(OH)2
,
“沉铁”过程中加入碳酸钠的作用是调节溶液的酸碱度形成黄钠铁矾[NaFe3SO4)2(OH)6],应将pH控制在pH<3.7,故D符合题意;
故答案为:D。
【分析】红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)中加入硫酸酸浸,酸浸后的酸性溶液中含有Ni2+、Fe2+、Fe3+等,二氧化硅不溶,形成滤渣,滤液中加入NaClO氧化亚铁离子为铁离子,再加入碳酸钠溶液调节溶液的pH,使铁离子全部沉淀,过滤后得到沉淀黄钠铁矾,滤液经处理可得到Ni,据此分析解答。
13.【答案】
B
【解析】【解答】A.次氯酸钠具有氧化性,是家庭常用的漂白剂,故A不符合题意;
B.侯氏制碱法的初始原料是
、
、
和
,反应先生成碳酸氢钠,受热分解后得到纯碱碳酸钠,故B符合题意;
C.硅酸钠不易燃,常用作木材防火剂,故C不符合题意;
D.过氧化钠与水、二氧化碳均能反应生成氧气,可以作为呼吸面具的供氧剂,故D不符合题意;
故答案为:B。
【分析】侯式制碱法的原料是饱和食盐水、二氧化碳和氨气,而碳酸氢钠是制取纯碱的原料。
14.【答案】
D
【解析】【解答】A.离子方程式应为SO2+2CO
+H2O=SO
+2HCO
,A不符合题意;
B.离子方程式为Mg2++2Cl-+2H2O
Cl2↑+H2↑+Mg(OH)2↓,B不符合题意;
C.符合题意离子方程式为Al3++2SO
+2Ba2++4OH-=2BaSO4↓+AlO
+2H2O,C不符合题意;
D.双氧水在酸性环境中会将Cu氧化为Cu2+
,
选项所给离子方程式无误,D符合题意;
故答案为:D。
【分析】A.SO2少量无法生成CO2
B.电解氯化镁溶液时阴极产生的氢氧根会和镁离子生成沉淀
C.Ba(OH)2足量,最终会得到偏铝酸根
D.过氧化氢具有氧化性可将铜单质氧化为铜离子
15.【答案】
D
【解析】【解答】A.少量SO2通入水玻璃中得到白色沉淀硅酸和亚硫酸钠,SO2+SiO
+H2O=H2SiO3↓+SO
,A不符合题意;
B.向醋酸溶液中加入小苏打粉末得到无色气体,小苏打为碳酸氢钠,CH3COOH+HCO
=CH3COO-+H2O+CO2↑,B不符合题意;
C.向AgCl悬浊液中滴加足量Na2S溶液,出现黑色沉淀Ag2S,2AgCl(s)+S2-=Ag2S(s)+2Cl-
,
C不符合题意;
D.向草酸溶液中滴加几滴酸性高锰酸钾溶液,紫色褪色,同时生成气体二氧化碳和硫酸锰,2MnO
+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,D符合题意;
答案为D。
【分析】A.过量的二氧化硫得到的是亚硫酸氢根
B.苏打是碳酸钠,而小苏打是碳酸氢钠
C.电荷不守恒
D.符合氧化还原反应的原理
二、综合题
16.【答案】
(1)碳酸钠溶液;稀盐酸
(2);
(3)蒸发皿;玻璃棒
(4)②③或③④
(5)用
代替
和NaOH,使②③合并为一步
【解析】【解答】(1)操作第④步除钙离子加Na2CO3溶液转化为沉淀,生成CaCO3
,
同时碳酸钠会除去反应剩余的氯化钡,生成BaCO3
,
离子都形成沉淀,再进行过滤;操作第⑤步加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠;
?
(2)根据(1)的分析,第⑤步操作中可能发生反应的离子方程式有
;
;
(3)第⑥步为蒸发结晶,需要用到的仪器有:带铁圈的铁架台、酒精灯、蒸发皿、玻璃棒;
(4)先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化碳酸钙为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,故答案为②③或③④;
(5)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用BaCl2沉淀,所以,用Ba(OH)2代替BaCl2和NaOH,使②③步合并为一步。
【分析】粗盐经过溶解得到浓液体,加入氯化钡生成硫酸钡沉淀A,沉淀B为氢氧化镁,加入碳酸钠除去钙离子和过量钡离子,混合沉淀C为碳酸钙、碳酸钡,第⑤步加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,最后经蒸发操作得到较纯净的氯化钠,据此解题。
?
17.【答案】
(1)分液漏斗
(2)MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(3)饱和食盐水;除去氯气中的HCl
(4)Cl2+2OH-=Cl-+ClO-+H2O
(5)AlCl3+3H2O=Al(OH)3↓+3HCl
(6)>
【解析】【解答】(1)根据装置图可知仪器a的名称是分液漏斗;
(2)在装置A中浓盐酸与MnO2混合加热反应产生Cl2
,
反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(3)装置B中试剂是饱和NaCl溶液;作用是降低Cl2的溶解度,同时也能除去Cl2中的杂质HCl;
(4)装置G的作用是吸收多余Cl2
,
防止大气污染,该反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)无水AlCl3遇潮湿的空气,发生复分解反应产生Al(OH)3和HCl,反应的化学方程式为:AlCl3+3H2O=Al(OH)3↓+3HCl;
(6)KClO3与浓盐酸在常温下发生氧化还原反应产生Cl2
,
而MnO2与浓盐酸在加热条件下才可以发生氧化还原反应产生Cl2
,
说明物质的氧化性:KClO3>MnO2。
【分析】在A中浓盐酸与MnO2混合加热制取Cl2
,
由于浓盐酸具有挥发性,挥发的HCl及水蒸气混在Cl2中,先通过饱和NaCl溶液除去杂质HCl,再通过浓硫酸干燥,得到纯净Cl2在D中与Al在加热条件下反应产生AlCl3
,
装置E用于储存AlCl3
,
由于无水AlCl3遇潮湿空气即产生大量白雾,因此装置F中盛有浓硫酸,装置G中NaOH溶液作用是尾气处理,用于吸收多余Cl2
,
防止大气污染。
18.【答案】
(1);
(2)
(3)2.24;0.2
【解析】【解答】(1)在该氧化还原反应中,KClO3中氯元素由+5价变为+4价,化合价降低,发生得电子的还原反应,因此发生还原反应的物质为KClO3;HCl中氯元素由-1价变为0,发生氧化反应,因此氧化产物为Cl2。
(2)在该氧化还原反应中,KClO3中氯元素得到电子,发生还原反应,生成ClO2
,
HCl中氯元素失去电子,发生氧化反应,生成Cl2
,
反应过程中转移2个电子,因此用双线桥表示如下:
。
(3)由双线桥可知,该反应中每转移2个电子,生成一分子Cl2
,
因此当有0.2mol电子发生转移时,生成Cl2的物质的量为0.1mol,其在标准状态下的体积V=n×Vm=0.1mol×22.4L/mol=2.24L;
由双线桥可知,该反应中每转移2个电子,即又2分子HCl被氧化,因此当有0.2mol电子发生转移时,被氧化的HCl的物质的量为0.2mol。
【分析】(1)根据反应过程重元素化合价的变化进行分析即可。
(2)根据反应过程中元素化合价的变化,结合双线桥的表示方法进行分析。
(3)根据转移电子数和生成Cl2的关系确定生成Cl2的物质的量,结合V=n×Vm计算其体积;根据转移电子数计算被氧化的HCl的物质的量。
19.【答案】
(1);
(2);;;
【解析】【解答】(1)①HClO4为强酸,在水中完全电离,形成H+和ClO4-
,
因此其电离方程式为:HClO4=H++ClO4-;
②H2SO3是一种二元弱酸,在水中部分电离,且分步进行,因此其电离方程式为:H2SO3?H++HSO3-、HSO3-?H++SO32-。
(2)①难溶于水的CaCO3能与CH3COOH(弱酸)反应生成可溶于水的(CH3COO)2Ca、H2O和CO2
,
因此反应的离子方程式为:CaCO3+2CH3COOH=2CH3COO-+Ca2++H2O+CO2↑;
②铜与稀硝酸(强酸)反应生成可溶性的Cu(NO3)2、NO和H2O,该反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
③Cl2足量,则FeBr2完全反应,参与反应的Fe2+和Br-的个数比为1:2,因此反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;
④NaHCO3足量,则Ca(OH)2完全反应,参与反应的Ca2+和OH-的个数比为1:2,因此该反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O。
【分析】(1)①HClO4为强酸,在水中完全电离;
②H2SO3为弱酸,在水中部分电离。
(2)①CaCO3与CH3COOH反应生成可溶性(CH3COO)2Ca、H2O和CO2
,
且CaCO3难溶于水,CH3COOH为弱酸,据此写出反应的离子方程式;
②铜与硝酸反应生成可溶性Cu(NO3)2、NO和H2O,据此写出反应的离子方程式;
③Cl2足量,则FeBr2完全反应,参与反应的Fe2+和Br-的个数比需满足1:2,据此写出反应的离子方程式;
④NaHCO3足量,则Ca(OH)2完全反应,参与反应的Ca2+和OH-需满足1:2,据此写出反应的离子方程式。
20.【答案】
(1)2
+2I-+4H+=2NO↑+I2+2H2O;16.8
(2)氯气氧化性太强,还能继续氧化I2
(3)ab
(4)常温下测NaHSO3稀溶液的pH,若pH大于7,则其水解程度大于电离程度,若pH小于7,其水解程度小于电离程度
【解析】【解答】(1)该反应中N元素的化合价由+3降低为+2,I元素的化合价由-1升高为0,根据电子得失守恒,可得主反应2
+2I-→2NO
↑+I2
,
酸性条件下,结合电荷守恒方程式左边补充4H+
,
结合原子个数守恒方程式右边补充2H2O,最后完整方程式为:2
+2I-+4H+=2NO↑+I2+2H2O。当有0.75mol
I-参与反应时,则生成
n(NO)=
=0.75mol,在标准状况下产生气体的体积是0.75mol
22.4L/mol=16.8L。故答案为:2
+2I-+4H+=2NO↑+I2+2H2O;16.8;
?
(2)上述反应中不选用常见的氧化剂氯气,原因是氯气氧化性太强,还能继续氧化I2
,
从而提取碘单质产率降低,故工业上氧化卤水中I-选择价格并不便宜的NaNO2。故答案为:氯气氧化性太强,还能继续氧化I2;
(3)从第②步反应后的溶液中提纯I2
,
碘在水中的溶解度不大,但易溶于有机溶剂,可加入四氯化碳萃取碘,即把碘从水溶液中提取出来;同时碘容易升华,也可用升华提取碘。
故答案为:ab;
(4)NaHSO3溶液中
既能水解又能电离,水解使其显碱性,电离使其显酸性,在常温下,可测NaHSO3稀溶液的pH,若pH大于7,则其水解程度大于电离程度,若pH小于7,其水解程度小于电离程度。故答案为:常温下测NaHSO3稀溶液的pH,若pH大于7,则其水解程度大于电离程度,若pH小于7,其水解程度小于电离程度。
【分析】含I-的卤水经过酸化,亚硝酸钠具有氧化性,碘离子具有还原性,二者发生氧化还原反应生成一氧化氮、碘单质、碘化钠和水,反应化学方程式:2
+4HI=2NO↑+I2+2H2O+2NaI,活性炭所吸附I2通过NaOH溶液或NaHSO3溶液得到I-、
,再经过45%H2SO4处理提取单质碘,据此分析解答。
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
(
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
)
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
?
