黑龙江省双鸭山市重点中学2021-2022学年高二上学期8月开学考试化学试题 Word版含答案
文档属性
| 名称 | 黑龙江省双鸭山市重点中学2021-2022学年高二上学期8月开学考试化学试题 Word版含答案 |

|
|
| 格式 | docx | ||
| 文件大小 | 548.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-25 00:00:00 | ||
图片预览

文档简介
双鸭山市重点中学2021-2022学年高二上学期8月开学考试
化学试题
可能用到的相对原子质量:H:1
C:12
N:14
O:16
Na:23
Mg:24
Al:27
Cl:35.5
Mn:55
Fe:56
Cu:64
第I卷
选择题部分
一.选择题(每题只有一个正确答案,1—20题每题2分,21—25题每题3分,共55分)
1.古丝绸之路贸易中的下列商品,主要成分属于无机物的是( )
A.瓷器
B.丝绸
C.茶叶
D.中草药
2.
下列表示的是有机化合物结构式中的一部分,其中不是官能团的是( )
A.—OH
B.—C≡C—
C.
D.
3.下列有关化学用语表示正确的是( )
A.甲基的电子式:
B.乙烯的结构简式:CHCH
C.葡萄糖的分子式:CH2OH(CHOH)4CHO
D.甲烷分子的空间填充模型:
4.如图所示的某有机反应,其反应类型为( )
A.取代反应
B.加成反应
C.水解反应
D.氧化反应
5.下列每步转化不能通过一步反应实现的是( )
A.NH3→NO→NO2→HNO3
B.Si→SiO2→H2SiO3
C.S→SO2→SO3→H2SO4
D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
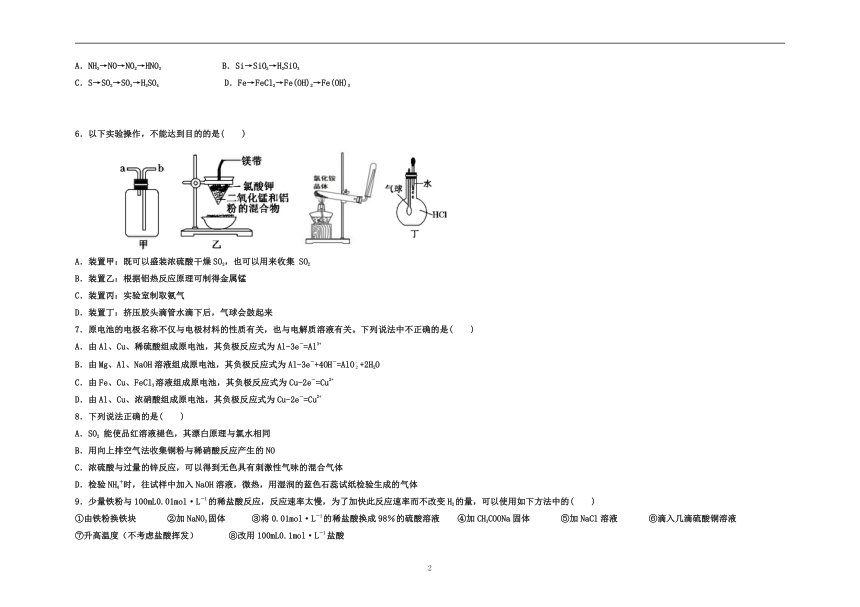
6.以下实验操作,不能达到目的的是( )
A.装置甲:既可以盛装浓硫酸干燥SO2,也可以用来收集
SO2
B.装置乙:根据铝热反应原理可制得金属锰
C.装置丙:实验室制取氨气
D.装置丁:挤压胶头滴管水滴下后,气球会鼓起来
7.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀硫酸组成原电池,其负极反应式为Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e-+4OH-=AlO+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e-=Cu2+
8.下列说法正确的是( )
A.SO2
能使品红溶液褪色,其漂白原理与氯水相同
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
C.浓硫酸与过量的锌反应,可以得到无色具有刺激性气味的混合气体
D.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验生成的气体
9.少量铁粉与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的量,可以使用如下方法中的( )
①由铁粉换铁块
②加NaNO3固体
③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液
④加CH3COONa固体
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
⑧改用100mL0.1mol·L-1盐酸
A.③⑤
B.①③
C.⑥⑦
D.⑦⑧
10.下列说法正确的是( )
A.1mol甲烷参加反应生成CCl4,最多消耗2mol氯气
B.乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色的原理相同
C.聚乙烯可使溴水因发生化学反应而褪色
D.等质量的乙烯和聚乙烯完全燃烧生成的CO2的物质的量相等
11.“绿色化学”的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是(
)
A.工业生产环氧乙烷:
B.水煤气合成甲醇:CO
+
2H2CH3OH
C.制取硫酸铜:Cu
+
2H2SO4(浓)CuSO4
+
SO2↑+
2H2O
D.合成甲基丙烯酸甲酯:CH3C≡CH
+
CO
+
CH3OHCH2=C(CH3)COOCH3
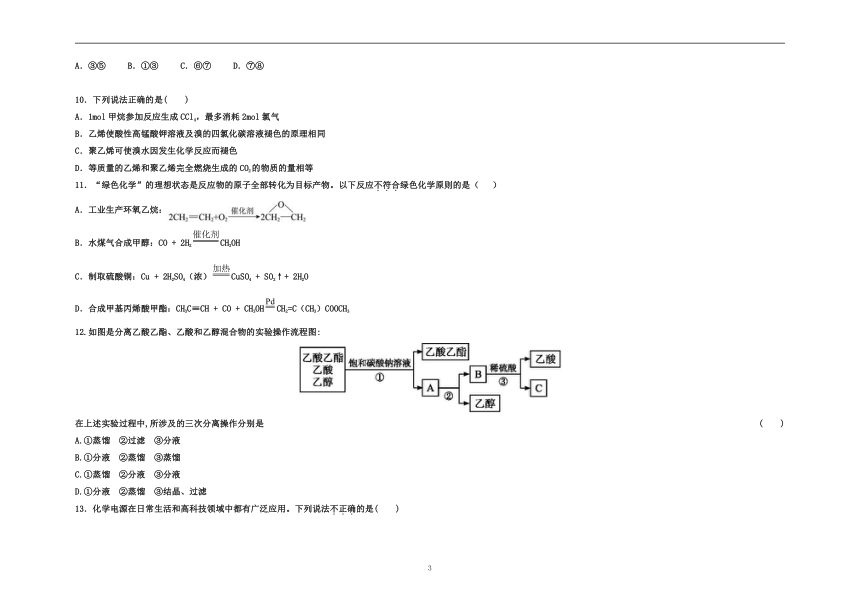
12.如图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图:
在上述实验过程中,所涉及的三次分离操作分别是
( )
A.①蒸馏 ②过滤 ③分液
B.①分液 ②蒸馏 ③蒸馏
C.①蒸馏 ②分液 ③分液
D.①分液 ②蒸馏 ③结晶、过滤
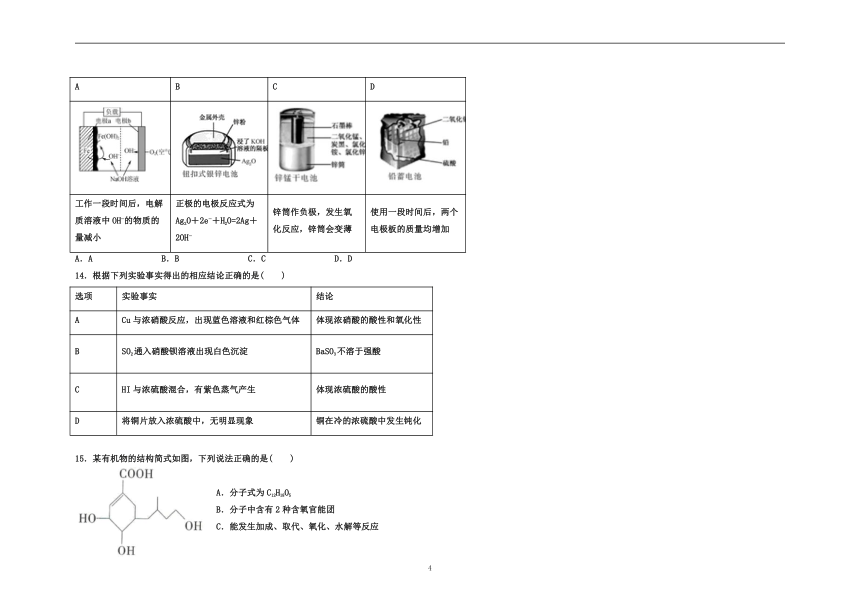
13.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )
A
B
C
D
工作一段时间后,电解质溶液中OH?的物质的量减小
正极的电极反应式为
Ag2O+2e?+H2O=2Ag+2OH?
锌筒作负极,发生氧化反应,锌筒会变薄
使用一段时间后,两个电极板的质量均增加
A.A
B.B
C.C
D.D
14.根据下列实验事实得出的相应结论正确的是( )
选项
实验事实
结论
A
Cu与浓硝酸反应,出现蓝色溶液和红棕色气体
体现浓硝酸的酸性和氧化性
B
SO2通入硝酸钡溶液出现白色沉淀
BaSO3不溶于强酸
C
HI与浓硫酸混合,有紫色蒸气产生
体现浓硫酸的酸性
D
将铜片放入浓硫酸中,无明显现象
铜在冷的浓硫酸中发生钝化
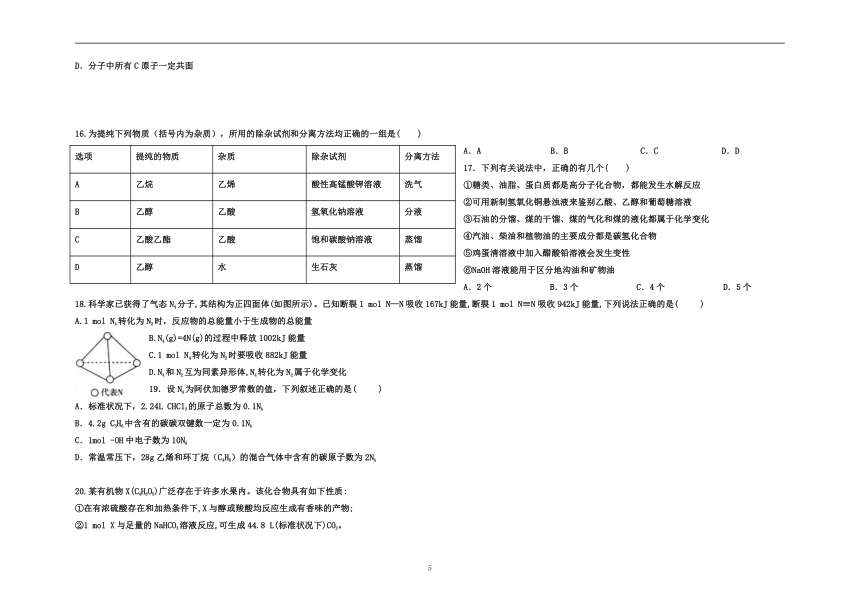
15.某有机物的结构简式如图,下列说法正确的是( )
A.分子式为C12H18O5
B.分子中含有2种含氧官能团
C.能发生加成、取代、氧化、水解等反应
D.分子中所有C原子一定共面
16.为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法均正确的一组是( )
选项
提纯的物质
杂质
除杂试剂
分离方法
A
乙烷
乙烯
酸性高锰酸钾溶液
洗气
B
乙醇
乙酸
氢氧化钠溶液
分液
C
乙酸乙酯
乙酸
饱和碳酸钠溶液
蒸馏
D
乙醇
水
生石灰
蒸馏
A.A
B.B
C.C
D.D
17.下列有关说法中,正确的有几个( )
①糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应
②可用新制氢氧化铜悬浊液来鉴别乙酸、乙醇和葡萄糖溶液
③石油的分馏、煤的干馏、煤的气化和煤的液化都属于化学变化
④汽油、柴油和植物油的主要成分都是碳氢化合物
⑤鸡蛋清溶液中加入醋酸铅溶液会发生变性
⑥NaOH溶液能用于区分地沟油和矿物油
A.2个
B.3个
C.4个
D.5个
18.科学家已获得了气态N4分子,其结构为正四面体(如图所示)。已知断裂1
mol
N—N吸收167kJ能量,断裂1
mol
N≡N吸收942kJ能量,下列说法正确的是(??
)
A.1
mol
N4转化为N2时,反应物的总能量小于生成物的总能量
B.N4(g)=4N(g)的过程中释放1002kJ能量
C.1
mol
N4转化为N2时要吸收882kJ能量
D.N4和N2互为同素异形体,N4转化为N2属于化学变化
19.设NA为阿伏加德罗常数的值,下列叙述正确的是(??
)
A.标准状况下,2.24L
CHCl3的原子总数为0.1NA
B.4.2g
C3H6中含有的碳碳双键数一定为0.1NA
C.1mol
-OH中电子数为10NA
D.常温常压下,28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
20.某有机物X(C4H6O5)广泛存在于许多水果内。该化合物具有如下性质:
①在有浓硫酸存在和加热条件下,X与醇或羧酸均反应生成有香味的产物;
②1
mol
X与足量的NaHCO3溶液反应,可生成44.8
L(标准状况下)CO2。
根据上述信息,对X的结构判断正确的是( )
A.含有碳碳双键
B.含有两个羧基和一个羟基
C.含有一个羧基和两个羟基
D.含有三个羟基和一个—COOR
21.某烯烃与氢气加成后得到饱和烃,则该烯烃可能的结构是几种( )
A.1种
B.2种
C.3种
D.4种
22.已知分子中含有羟基的物质都能与钠反应产生氢气。乙醇、乙二醇()、丙三醇()分别与足量金属钠作用,产生氢气在相同条件下体积之比为6∶2∶3。则这三种醇的物质的量之比为( )
A.6∶3∶2
B.1∶3∶2
C.3∶2∶1
D.6∶1∶1
23.一定质量的某有机物与足量金属钠反应,可得VA
L气体。相同质量的该有机物与足量的NaHCO3溶液反应,可得VB
L气体(VB≠0)。已知在同温、同压下VA和VB不相同,则该有机物可能是( )
A.CH3CH(OH)COOH
B.HOOCCOOH
C.HOCH2CH2OH
D.
24.1
mol某烷烃在氧气中充分燃烧,需要消耗氧气246.4
L(标准状况),它在光照的条件下与氯气反应,生成4种不同的一氯取代物。该烷烃的结构简式是( )
A.
B.CH3CH2CH2CH2CH3
C.
D.
25.某混合气体由两种气态烃组成。该混合气体完全燃烧后,得到二氧化碳(气体体积均已换算成标准状况下的体积)和水。则这两种气体可能是( )
A.和
B.和
C.和
D.和
第II卷
非选择题部分
二.填空题(共45分)
26.(15分)根据下列变化关系,请回答下列问题:
Ⅰ(1)写出A物质的名称_______。加B溶液的作用为_____________________。
(2)写出下列反应的化学方程式:
③_____________________。
④_____________________。
Ⅱ实验室利用反应⑥制取E,甲、乙、丙三位同学分别设计了下列三套实验装置。
从甲、乙两位同学设计的装置中选择一种作为实验室制取E的装置,应选择装置
(填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是
。
(2)
装好实验装置,加入样品前还应检查_____________________。
(3)
试管①中主要反应的化学方程式为_____________________,反应类型是_______;该反应中浓硫酸的作用是催化剂和_______。
(4)
试管②中所加试剂为
,该试剂的作用是_____________________。
27.(9分)海洋资源和新型燃料电池的利用具有广阔前景。部分流程如下图。
请回答下列问题:
(1)操作I用SO2水溶液吸收Br2有关反应的化学方程式为_____________________。
(2)为使母液中的MgCl2转化为Mg(OH)2,从原料来源及经济效益角度考虑,试剂①最好选用___________。
a.氨水
b.氢氧化钙
c.氢氧化钠
(3)操作III的化学方程式为_____________________。
(4)从海带中提取碘的实验中,所选择的装置或仪器(夹持装置已略去)正确的是( )
A.灼烧
B.过滤
C.分液
(5)甲烷燃料电池应用十分广泛。如下图,甲烷通入的一极的电极反应式为_____________________;当电路中累计有电子通过时,消耗的氧气体积为______(在标准状况下)。
28.(7分)
Ⅰ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
(1)下图中表示NO2的变化的曲线是___________(填字母);
(2)800℃,反应达到平衡时,NO的转化率是___________;
(3)用O2表示从0~2s内该反应的平均速率v=___________。
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___________(填选项);
A.v正(NH3)=2v逆(CO2)
B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变
D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
F.
气体平均相对分子质量不变
(2)能使该反应的反应速率增大的是___________(填选项);
A.及时分离出CO2气体
B.适当升高温度
C.加入少量NH2COONH4(s)
D.保持容器体积不变,充入N2
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___________形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。
29.(14分)下表是A、B、C、D四种有机物的有关信息;
A
B
C
D
①能使溴的四氯化碳溶液褪色;
②比例模型为:
③能与水在一定条件下反应生成C
①由C、H两种元素组成;
②球棍模型为:
①由C、H、O三种元素组成;
②能与Na反应,但不能与NaOH溶液反应;
③能与E反应生成相对分子质量为100的酯。
①由C、H、O三种元素组成;
②球棍模型为:
根据表中信息回答下列问题:
(1)有机物A的电子式为___________,比烃A多一个碳原子的A的同系物发生加聚反应的化学方程式_____________________。
(2)下列有关有机物A、B的说法正确的是___________
a.A和分子式为C3H6的烃一定互为同系物
b.A、B分子中所有的原子均在同一平面内
c.等质量的A、B完全燃烧,消耗氧气的量相同
d.B分子含有官能团碳碳双键,能发生加成反应
(3)C的结构简式为___________;C的同系物E,
分子式为C3H8O,能与Na反应生成H2的结构有______种,其中能够发生催化氧化生成醛的结构简式为___________。
(4)在100
℃、常压下,将C汽化为蒸气,然后与A以任意比例混合,混合气体的体积为V
L。使该混合气体完全燃烧,需消耗相同条件下的氧气的体积是___________L
(5)D与H2O加成后的产物之一为乳酸:
①请写出乳酸分子中官能团的名称___________、___________。
②乳酸发生下列变化:
所用的试剂是a___________,b___________(写化学式)
③在浓硫酸作用下,两分子乳酸相互反应生成六元环状结构的物质。试写出该六元环状物质的结构
简式_____________________。
双鸭山市重点中学2021-2022学年高二上学期8月开学考试
化学考试答案
1
2
3
4
5
6
7
8
9
10
A
D
D
A
B
C
C
C
D
D
11
12
13
14
15
16
17
18
19
20
C
B
A
A
B
D
B
D
D
B
21
22
23
24
25
D
D
B
A
B
26(15分)、
Ⅰ(1)
葡萄糖,
中和稀硫酸
C6H12O62C2H5OH+2CO2↑2CH3CH2OH+O22CH3CHO+2H2O
Ⅱ(1)乙,防止倒吸(2)装置气密性(3)CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O,
酯化反应(取代反应),吸水剂(4)饱和Na2CO3溶液;吸收乙醇,除去乙酸,降低乙酸乙酯溶解度
27(9分)、
(1)SO2+Br2+2H2O=2HBr+H2SO4
(2)b
(3)MgCl2(熔融)Mg+Cl2↑
(4)C
(5)
解析:操作I用SO2水溶液吸收Br2,SO2把溴还原为HBr,SO2被氧化为H2SO4,反应的化学方程式为:SO2+Br2+2H2O=2HBr+H2SO4。
操作II是通氯气将HBr氧化为Br2,离子方程式为:Cl2+2Br-=Br2+2Cl-。
氨水易挥发,NaOH较Ca(OH)2价格高,从原料来源及经济效益角度考虑,试剂①最好选用氢氧化钙,故选b。
(6)操作III是电解熔融的MgCl2得到金属镁,化学方程式为:MgCl2(熔融)Mg+Cl2↑。
28(7分)、
Ⅰ(1)b
(2)65%
(3)1.5×10-3mol·L-1·s-1
Ⅱ(1)CF
(2)B
(3)大于
29(14分)、
(1)略(2)b(3)C2H5CH
2
CH3CH2CH2OH
(4)3V
(5)①羟基
羧基
②NaHCO3或NaOH或Na2CO3(任一种即可)
Na
③略
解析:乳酸中含有羟基、羧基,根据反应过程,乳酸中的羧基与a反应,而羟基不反应,则a为NaOH或碳酸钠或碳酸氢钠溶液;中的羟基与b反应,则b为Na。
化学试题
可能用到的相对原子质量:H:1
C:12
N:14
O:16
Na:23
Mg:24
Al:27
Cl:35.5
Mn:55
Fe:56
Cu:64
第I卷
选择题部分
一.选择题(每题只有一个正确答案,1—20题每题2分,21—25题每题3分,共55分)
1.古丝绸之路贸易中的下列商品,主要成分属于无机物的是( )
A.瓷器
B.丝绸
C.茶叶
D.中草药
2.
下列表示的是有机化合物结构式中的一部分,其中不是官能团的是( )
A.—OH
B.—C≡C—
C.
D.
3.下列有关化学用语表示正确的是( )
A.甲基的电子式:
B.乙烯的结构简式:CHCH
C.葡萄糖的分子式:CH2OH(CHOH)4CHO
D.甲烷分子的空间填充模型:
4.如图所示的某有机反应,其反应类型为( )
A.取代反应
B.加成反应
C.水解反应
D.氧化反应
5.下列每步转化不能通过一步反应实现的是( )
A.NH3→NO→NO2→HNO3
B.Si→SiO2→H2SiO3
C.S→SO2→SO3→H2SO4
D.Fe→FeCl2→Fe(OH)2→Fe(OH)3
6.以下实验操作,不能达到目的的是( )
A.装置甲:既可以盛装浓硫酸干燥SO2,也可以用来收集
SO2
B.装置乙:根据铝热反应原理可制得金属锰
C.装置丙:实验室制取氨气
D.装置丁:挤压胶头滴管水滴下后,气球会鼓起来
7.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是( )
A.由Al、Cu、稀硫酸组成原电池,其负极反应式为Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e-+4OH-=AlO+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e-=Cu2+
8.下列说法正确的是( )
A.SO2
能使品红溶液褪色,其漂白原理与氯水相同
B.用向上排空气法收集铜粉与稀硝酸反应产生的NO
C.浓硫酸与过量的锌反应,可以得到无色具有刺激性气味的混合气体
D.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验生成的气体
9.少量铁粉与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的量,可以使用如下方法中的( )
①由铁粉换铁块
②加NaNO3固体
③将0.01mol·L-1的稀盐酸换成98%的硫酸溶液
④加CH3COONa固体
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
⑧改用100mL0.1mol·L-1盐酸
A.③⑤
B.①③
C.⑥⑦
D.⑦⑧
10.下列说法正确的是( )
A.1mol甲烷参加反应生成CCl4,最多消耗2mol氯气
B.乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色的原理相同
C.聚乙烯可使溴水因发生化学反应而褪色
D.等质量的乙烯和聚乙烯完全燃烧生成的CO2的物质的量相等
11.“绿色化学”的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是(
)
A.工业生产环氧乙烷:
B.水煤气合成甲醇:CO
+
2H2CH3OH
C.制取硫酸铜:Cu
+
2H2SO4(浓)CuSO4
+
SO2↑+
2H2O
D.合成甲基丙烯酸甲酯:CH3C≡CH
+
CO
+
CH3OHCH2=C(CH3)COOCH3
12.如图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图:
在上述实验过程中,所涉及的三次分离操作分别是
( )
A.①蒸馏 ②过滤 ③分液
B.①分液 ②蒸馏 ③蒸馏
C.①蒸馏 ②分液 ③分液
D.①分液 ②蒸馏 ③结晶、过滤
13.化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是( )
A
B
C
D
工作一段时间后,电解质溶液中OH?的物质的量减小
正极的电极反应式为
Ag2O+2e?+H2O=2Ag+2OH?
锌筒作负极,发生氧化反应,锌筒会变薄
使用一段时间后,两个电极板的质量均增加
A.A
B.B
C.C
D.D
14.根据下列实验事实得出的相应结论正确的是( )
选项
实验事实
结论
A
Cu与浓硝酸反应,出现蓝色溶液和红棕色气体
体现浓硝酸的酸性和氧化性
B
SO2通入硝酸钡溶液出现白色沉淀
BaSO3不溶于强酸
C
HI与浓硫酸混合,有紫色蒸气产生
体现浓硫酸的酸性
D
将铜片放入浓硫酸中,无明显现象
铜在冷的浓硫酸中发生钝化
15.某有机物的结构简式如图,下列说法正确的是( )
A.分子式为C12H18O5
B.分子中含有2种含氧官能团
C.能发生加成、取代、氧化、水解等反应
D.分子中所有C原子一定共面
16.为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法均正确的一组是( )
选项
提纯的物质
杂质
除杂试剂
分离方法
A
乙烷
乙烯
酸性高锰酸钾溶液
洗气
B
乙醇
乙酸
氢氧化钠溶液
分液
C
乙酸乙酯
乙酸
饱和碳酸钠溶液
蒸馏
D
乙醇
水
生石灰
蒸馏
A.A
B.B
C.C
D.D
17.下列有关说法中,正确的有几个( )
①糖类、油脂、蛋白质都是高分子化合物,都能发生水解反应
②可用新制氢氧化铜悬浊液来鉴别乙酸、乙醇和葡萄糖溶液
③石油的分馏、煤的干馏、煤的气化和煤的液化都属于化学变化
④汽油、柴油和植物油的主要成分都是碳氢化合物
⑤鸡蛋清溶液中加入醋酸铅溶液会发生变性
⑥NaOH溶液能用于区分地沟油和矿物油
A.2个
B.3个
C.4个
D.5个
18.科学家已获得了气态N4分子,其结构为正四面体(如图所示)。已知断裂1
mol
N—N吸收167kJ能量,断裂1
mol
N≡N吸收942kJ能量,下列说法正确的是(??
)
A.1
mol
N4转化为N2时,反应物的总能量小于生成物的总能量
B.N4(g)=4N(g)的过程中释放1002kJ能量
C.1
mol
N4转化为N2时要吸收882kJ能量
D.N4和N2互为同素异形体,N4转化为N2属于化学变化
19.设NA为阿伏加德罗常数的值,下列叙述正确的是(??
)
A.标准状况下,2.24L
CHCl3的原子总数为0.1NA
B.4.2g
C3H6中含有的碳碳双键数一定为0.1NA
C.1mol
-OH中电子数为10NA
D.常温常压下,28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
20.某有机物X(C4H6O5)广泛存在于许多水果内。该化合物具有如下性质:
①在有浓硫酸存在和加热条件下,X与醇或羧酸均反应生成有香味的产物;
②1
mol
X与足量的NaHCO3溶液反应,可生成44.8
L(标准状况下)CO2。
根据上述信息,对X的结构判断正确的是( )
A.含有碳碳双键
B.含有两个羧基和一个羟基
C.含有一个羧基和两个羟基
D.含有三个羟基和一个—COOR
21.某烯烃与氢气加成后得到饱和烃,则该烯烃可能的结构是几种( )
A.1种
B.2种
C.3种
D.4种
22.已知分子中含有羟基的物质都能与钠反应产生氢气。乙醇、乙二醇()、丙三醇()分别与足量金属钠作用,产生氢气在相同条件下体积之比为6∶2∶3。则这三种醇的物质的量之比为( )
A.6∶3∶2
B.1∶3∶2
C.3∶2∶1
D.6∶1∶1
23.一定质量的某有机物与足量金属钠反应,可得VA
L气体。相同质量的该有机物与足量的NaHCO3溶液反应,可得VB
L气体(VB≠0)。已知在同温、同压下VA和VB不相同,则该有机物可能是( )
A.CH3CH(OH)COOH
B.HOOCCOOH
C.HOCH2CH2OH
D.
24.1
mol某烷烃在氧气中充分燃烧,需要消耗氧气246.4
L(标准状况),它在光照的条件下与氯气反应,生成4种不同的一氯取代物。该烷烃的结构简式是( )
A.
B.CH3CH2CH2CH2CH3
C.
D.
25.某混合气体由两种气态烃组成。该混合气体完全燃烧后,得到二氧化碳(气体体积均已换算成标准状况下的体积)和水。则这两种气体可能是( )
A.和
B.和
C.和
D.和
第II卷
非选择题部分
二.填空题(共45分)
26.(15分)根据下列变化关系,请回答下列问题:
Ⅰ(1)写出A物质的名称_______。加B溶液的作用为_____________________。
(2)写出下列反应的化学方程式:
③_____________________。
④_____________________。
Ⅱ实验室利用反应⑥制取E,甲、乙、丙三位同学分别设计了下列三套实验装置。
从甲、乙两位同学设计的装置中选择一种作为实验室制取E的装置,应选择装置
(填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是
。
(2)
装好实验装置,加入样品前还应检查_____________________。
(3)
试管①中主要反应的化学方程式为_____________________,反应类型是_______;该反应中浓硫酸的作用是催化剂和_______。
(4)
试管②中所加试剂为
,该试剂的作用是_____________________。
27.(9分)海洋资源和新型燃料电池的利用具有广阔前景。部分流程如下图。
请回答下列问题:
(1)操作I用SO2水溶液吸收Br2有关反应的化学方程式为_____________________。
(2)为使母液中的MgCl2转化为Mg(OH)2,从原料来源及经济效益角度考虑,试剂①最好选用___________。
a.氨水
b.氢氧化钙
c.氢氧化钠
(3)操作III的化学方程式为_____________________。
(4)从海带中提取碘的实验中,所选择的装置或仪器(夹持装置已略去)正确的是( )
A.灼烧
B.过滤
C.分液
(5)甲烷燃料电池应用十分广泛。如下图,甲烷通入的一极的电极反应式为_____________________;当电路中累计有电子通过时,消耗的氧气体积为______(在标准状况下)。
28.(7分)
Ⅰ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s)
0
1
2
3
4
5
n(NO)(mol)
0.020
0.010
0.008
0.007
0.007
0.007
(1)下图中表示NO2的变化的曲线是___________(填字母);
(2)800℃,反应达到平衡时,NO的转化率是___________;
(3)用O2表示从0~2s内该反应的平均速率v=___________。
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___________(填选项);
A.v正(NH3)=2v逆(CO2)
B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变
D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
F.
气体平均相对分子质量不变
(2)能使该反应的反应速率增大的是___________(填选项);
A.及时分离出CO2气体
B.适当升高温度
C.加入少量NH2COONH4(s)
D.保持容器体积不变,充入N2
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___________形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。
29.(14分)下表是A、B、C、D四种有机物的有关信息;
A
B
C
D
①能使溴的四氯化碳溶液褪色;
②比例模型为:
③能与水在一定条件下反应生成C
①由C、H两种元素组成;
②球棍模型为:
①由C、H、O三种元素组成;
②能与Na反应,但不能与NaOH溶液反应;
③能与E反应生成相对分子质量为100的酯。
①由C、H、O三种元素组成;
②球棍模型为:
根据表中信息回答下列问题:
(1)有机物A的电子式为___________,比烃A多一个碳原子的A的同系物发生加聚反应的化学方程式_____________________。
(2)下列有关有机物A、B的说法正确的是___________
a.A和分子式为C3H6的烃一定互为同系物
b.A、B分子中所有的原子均在同一平面内
c.等质量的A、B完全燃烧,消耗氧气的量相同
d.B分子含有官能团碳碳双键,能发生加成反应
(3)C的结构简式为___________;C的同系物E,
分子式为C3H8O,能与Na反应生成H2的结构有______种,其中能够发生催化氧化生成醛的结构简式为___________。
(4)在100
℃、常压下,将C汽化为蒸气,然后与A以任意比例混合,混合气体的体积为V
L。使该混合气体完全燃烧,需消耗相同条件下的氧气的体积是___________L
(5)D与H2O加成后的产物之一为乳酸:
①请写出乳酸分子中官能团的名称___________、___________。
②乳酸发生下列变化:
所用的试剂是a___________,b___________(写化学式)
③在浓硫酸作用下,两分子乳酸相互反应生成六元环状结构的物质。试写出该六元环状物质的结构
简式_____________________。
双鸭山市重点中学2021-2022学年高二上学期8月开学考试
化学考试答案
1
2
3
4
5
6
7
8
9
10
A
D
D
A
B
C
C
C
D
D
11
12
13
14
15
16
17
18
19
20
C
B
A
A
B
D
B
D
D
B
21
22
23
24
25
D
D
B
A
B
26(15分)、
Ⅰ(1)
葡萄糖,
中和稀硫酸
C6H12O62C2H5OH+2CO2↑2CH3CH2OH+O22CH3CHO+2H2O
Ⅱ(1)乙,防止倒吸(2)装置气密性(3)CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O,
酯化反应(取代反应),吸水剂(4)饱和Na2CO3溶液;吸收乙醇,除去乙酸,降低乙酸乙酯溶解度
27(9分)、
(1)SO2+Br2+2H2O=2HBr+H2SO4
(2)b
(3)MgCl2(熔融)Mg+Cl2↑
(4)C
(5)
解析:操作I用SO2水溶液吸收Br2,SO2把溴还原为HBr,SO2被氧化为H2SO4,反应的化学方程式为:SO2+Br2+2H2O=2HBr+H2SO4。
操作II是通氯气将HBr氧化为Br2,离子方程式为:Cl2+2Br-=Br2+2Cl-。
氨水易挥发,NaOH较Ca(OH)2价格高,从原料来源及经济效益角度考虑,试剂①最好选用氢氧化钙,故选b。
(6)操作III是电解熔融的MgCl2得到金属镁,化学方程式为:MgCl2(熔融)Mg+Cl2↑。
28(7分)、
Ⅰ(1)b
(2)65%
(3)1.5×10-3mol·L-1·s-1
Ⅱ(1)CF
(2)B
(3)大于
29(14分)、
(1)略(2)b(3)C2H5CH
2
CH3CH2CH2OH
(4)3V
(5)①羟基
羧基
②NaHCO3或NaOH或Na2CO3(任一种即可)
Na
③略
解析:乳酸中含有羟基、羧基,根据反应过程,乳酸中的羧基与a反应,而羟基不反应,则a为NaOH或碳酸钠或碳酸氢钠溶液;中的羟基与b反应,则b为Na。
同课章节目录
