2.2《芳香烃》PPT课件(新人教版-选修5)
文档属性
| 名称 | 2.2《芳香烃》PPT课件(新人教版-选修5) |  | |
| 格式 | zip | ||
| 文件大小 | 251.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-11 16:18:45 | ||
图片预览









文档简介
(共40张PPT)
新课标人教版课件系列
《高中化学》
选修5
2.2《芳香烃》
教学目标
(1)知识目标:了解苯的物理性质,理解苯分子的独特结构,掌握苯的主要化学性质。
(2)能力目标:培养学生逻辑思维能力和实验能力。
(3)情感目标:使学生认识结构决定性质,性质又反映结构的辩证关系。培养学生以实验事实为依据,严谨求实勇于创新的科学精神。引导学生以假说的方法研究苯的结构,并从中了解研究事物所应遵循的科学方法。
教学重点、难点:
(1)重点:苯的分子结构与其化学性质
(2)难点:理解苯环上碳碳间的化学键是一种介于单键和双键之间的独特的化学键。
(3)关键:正确处理苯的分子结构与其化学性质的关系。
教学方法
(1)主要教学方法
归纳、演绎法:通过学生的逻辑推导和归纳,最终确定苯的分子结构。
(2)辅助教学方法
情境激学法:创设问题的意境,激发学习兴趣,调动学生内在的学习动力,促使学生在意境中主动探究科学的奥妙。
实验促学法:通过学生的动手操作,教师的演示,观察分析实验现象,掌握苯的分子结构和化学性质。
辅助教学手段:多媒体辅助教学
运用先进的教学手段,将微观现象宏观化,将瞬间变化定格化,有助于学生掌握苯的结构特点和苯的主要化学性质(易取代、难加成、难氧化)的本质。
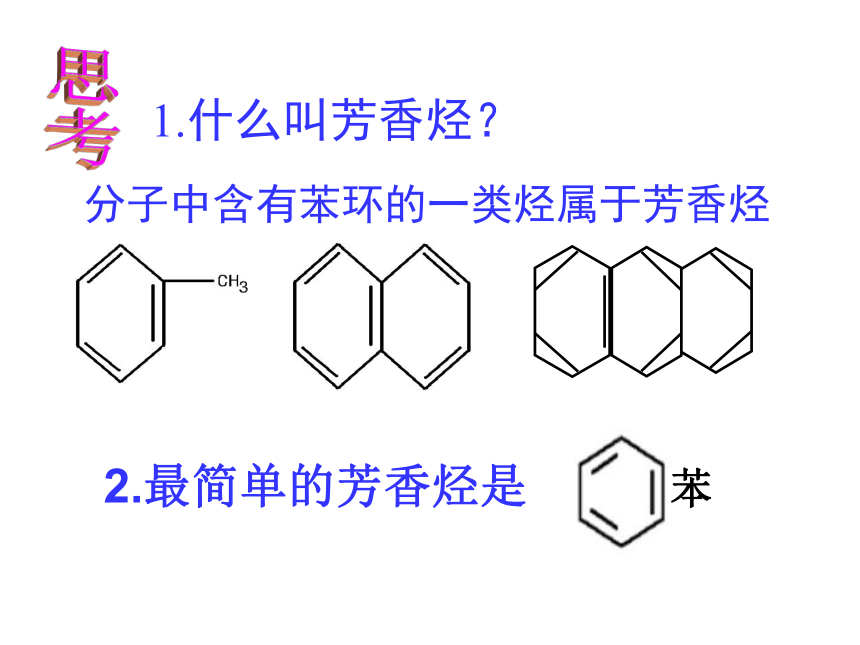
1.什么叫芳香烃?
分子中含有苯环的一类烃属于芳香烃
2.最简单的芳香烃是
苯
一、苯的物理性质
(色、味、态、熔点、沸点、密度、溶解性、特性)
颜色
无色
气味
特殊气味
状态
液态
熔点
5.5℃
沸点
80.1℃
密度
比水小
毒性
有毒
溶解性
不溶于水,易溶于有机
溶剂。
易挥发
二、苯的分子结构与化学性质:
1)结构式 2)结构简式
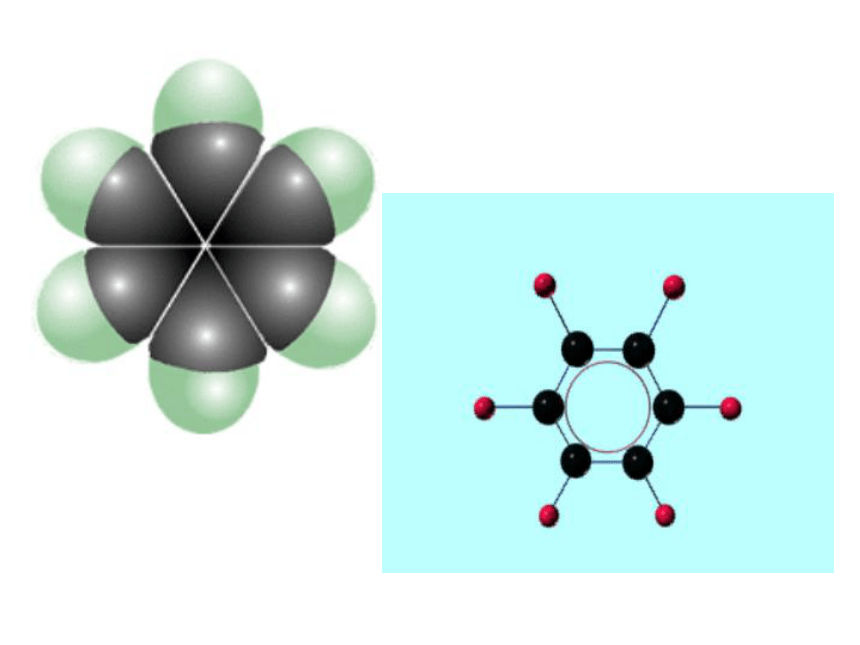
3)结构特点:
(1)苯分子是平面六边形的稳定结构;
(2)苯分子中碳碳键是介于碳碳单键与碳碳双键之间的一种独特的键;
(3)苯分子中六个碳原子等效,六个氢原子等效
1、组成与结构:
分子式:
C6H6
键角 120°
2、苯的化学性质
在通常情况下比较稳定,在一定条件下能发生氧化、取代、加成等反应。
苯的化学性质和烷烃、烯烃、炔烃有何异同点 为什么
(1) 氧化反应:
现象:火焰明亮,带有浓烟
思考:苯燃烧时为什么伴有浓烟?
不能使酸性高锰酸钾溶液褪色
2C6H6+15O2 12CO2+ 6H2O
点燃
a 燃烧
b 与高锰酸钾反应
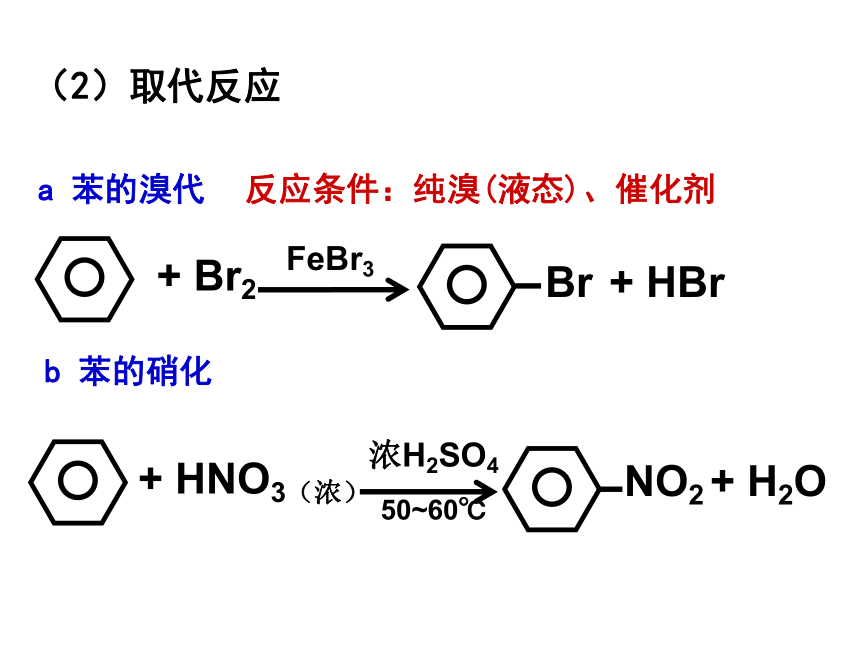
(2)取代反应
a 苯的溴代
反应条件:纯溴(液态)、催化剂
b 苯的硝化
+ HNO3(浓)
NO2
+ H2O
浓H2SO4
50~60℃
+ Br2
Br
+ HBr
FeBr3
根据苯与溴、浓硝酸发生反应的条件,请你设计制备溴苯和硝基苯的实验方案(注意仪器的选择和试剂的加入顺序)
实验思考题:
1.苯、溴、Fe屑等试剂加入烧瓶的顺序是怎样的?
2.Fe屑的作用是什么?
3.将Fe屑加入烧瓶后,烧瓶内有什么现象?这说明什么?
4.长导管的作用是什么?
5.为什么导管末端不插入液面下?
6.哪些现象说明发生了取代反应而不是加成反应?
7.纯净的溴苯应是无色的,为什么所得溴苯为褐色?怎样使之恢复本来的面目?
苯 液溴 Fe屑
用作催化剂
剧烈反应,轻微翻腾,有气体逸出。反应放热。
用于导气和冷凝回流(或冷凝器)
溴化氢易溶于水,防止倒吸。
苯与溴反应生成溴苯的同时有溴化氢生成,说明它们发生了取代反应而非加成反应。因加成反应不会生成溴化氢。
因为未发生反应的溴和反应中的催化剂FeBr3溶解在生成的溴苯中。用水和碱溶液反复洗涤可以使褐色褪去,还溴苯以本来的面目。
溴苯实验后思考题:
1.烧瓶中的试剂顺序能够颠倒吗?为什么?能用浓溴水代替液溴吗?为什么?
2.该反应的催化剂是FeBr3,而反应时加的是Fe屑, Fe屑是怎样转化为FeBr3的?
3.该反应是放热反应,而苯、液溴均易挥发,为了减少放热对苯及液溴挥发的影响,装置上有哪些独特的设计和考虑?
4.生成的HBr中常混有溴蒸气,此时用AgNO3溶液对HBr的检验结果是否可靠?为什么?如何除去混在HBr中的溴蒸气?
5.如何分离出烧瓶中反应生成的溴苯?
+ Br2
— Br
+ HBr
FeBr3
+ 2Br2
— Br
+ 2HBr
FeBr3
Br—
+ 2Br2
— Br
+ 2HBr
FeBr3
— Br
苯在三卤化铁催化下可与Cl2、Br2发生取代反应,生成一卤代苯、二卤代苯(主要是邻、对位取代产物)等。
玻璃管
实验步骤:①先将1.5mL浓硝酸注入大试管中,再慢慢注入2mL浓硫酸,并及时摇匀和冷却.
②向冷却后的酸中逐滴加入1mL苯,充分振荡,混和均匀.
③将混合物控制在50-60℃的条件下约10min,实验装置如左图.
④将反应后的液体到入盛冷水的烧杯中,可以看到烧杯底部有黄色油状物生成,经过分离得到粗硝基苯.
⑤粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯.
注意:
①浓硝酸和浓硫酸的混合酸要冷却到50-60℃以下,再慢慢滴入苯,边加边振荡,因为反应放热,温度过高,苯易挥发,且硝酸也会分解,同时苯和浓硫酸在75-80℃时会发生反应。
②什么时候采用水浴加热:需要加热,而且一定要控制在100℃以下,均可采用水浴加热。如果超过100 ℃,还可采用油浴(0~300 ℃)、沙浴温度更高。
⑤为提纯硝基苯,一般将粗产品依次用蒸馏水和NaOH溶液洗涤。
③温度计必须悬挂在水浴中。
④不纯的硝基苯显黄色
(因为溶有NO2)而纯净硝基苯是无色,有苦杏仁味,比水重,油状液体。
1.配制浓硫酸与浓硝酸混和酸时,是否可以将浓硝酸加入到浓硫酸中 为什么
2.步骤③中,为了使反应在50-60℃下进行,常用的方法是什么
3.步骤④中洗涤、分离粗硝基苯使用的主要仪器是什么
4.步骤④中粗产品用5%NaOH溶液洗涤的目的
5.敞口玻璃管的作用是什么 浓硫酸的作用
c 磺化(苯分子中的H原子被磺酸基取代的反应)
+ H2O
(苯磺酸)
+ HO-SO3H
75℃~80℃
-SO3H
(3)苯的加成反应 (与H2、Cl2)
+ H2
Ni
环己烷
加热
+ 3Cl2
催化剂
Cl
Cl
Cl
Cl
Cl
Cl
H
H
H
H
H
H
六六六
对比与归纳
烷 烯 苯
与Br2作用 Br2试剂
反应条件
反应类型
与KMnO4作用
点燃 现象
结论
纯溴
溴水
纯溴
溴水
光照
取代
加成
Fe粉
取代
萃取
无反应
现象
结论
不褪色
褪色
不褪色
不被KMnO4氧化
易被KMnO4氧化
苯环难被KMnO4氧化
焰色浅,无烟
焰色亮,有烟
焰色亮,浓烟
C%低
C%较高
C%高
小结:苯易取代、难加成、难氧化
三、苯的同系物
1.含义:苯的苯环上氢原子被烷基代替而得到的芳烃。
CH3
|
CH2CH3
|
CH3
|
|
CH3
|
CH3
CH3
|
CH3
CH3
H3C
H3C
甲苯(C7H8) 乙苯( C8H10) 对二甲苯(C8H10) 六甲基苯(C12H18)
只含有一个苯环,且侧链为C-C单键的芳香烃。
CnH2n-6 (n≥6)
2.通式:
2CnH2n-6 + 3 (n-1)O2
点燃
2nCO2+ 2(n-3)H2O
(1)氧化反应
a 燃烧反应
现象:火焰明亮并带有浓烟
3.化学性质
2mL苯
3滴高锰酸钾酸性溶液
用力振荡
2mL甲苯
3滴高锰酸钾酸性溶液
用力振荡
b 苯环影响侧链,使侧链能被强氧化剂氧化
实验结论:
苯不能被KMnO4酸性溶液氧化,甲苯能被KMnO4酸性溶液氧化
未褪色
褪色
甲苯被氧化的是侧链,即甲基被氧化,该反应可简单表示为:
CH3
KMnO4、H+
COOH
(苯甲酸)
这样的氧化反应,都是苯环上的烷烃基被氧化,说明了苯环上的烷烃基比烷烃性质活泼。这活泼性是苯环对烷烃基影响的结果。
苯的同系物的氧化反应
反应机理:
|
—C—H
|
O
||
C—OH
|
酸性高锰酸钾溶液
烷基上与苯环直接相连的碳原子直接连氢原子
H
|
—C—H
|
H
H
| |
—C—C—
| |
H
C
|
—C—C
|
C
×
CH3
|
—C—CH3
|
CH3
CH3
|
|
CH2—R
CH3
|
CH3—CH—
CH3
|
—C—CH3
|
CH3
HOOC
|
|
COOH
HOOC—
KMnO4/H+
思考:产物是什么?
可用KMnO4酸性溶液作试剂鉴别苯的同系物和苯、苯的同系物和烷烃。
(2)取代反应 甲苯能发生硝化反应
邻硝基甲苯
对硝基甲苯
2
2
2
CH3
+ HNO3
浓硫酸
300C
CH3
NO2
CH3
NO2
+ + H2O
2,4,6-三硝基甲苯
简称三硝基甲苯,又叫TNT
是一种淡黄色针状晶体,不溶于水,不稳定,是一种烈性炸药
CH3
|
|
NO2
CH3
|
NO2
O2N
+ 3HNO3
+ 3H2O
浓硫酸
100℃
—CH3对苯环的影响使取代反应更易进行
(3)加成反应
催化剂
△
+ 3H2
(2)苯的同系物含有侧链,性质与苯又有不同
①侧链影响苯环,使苯环上的氢原子比苯更易被取代
②苯环影响侧链,使侧链能被强氧化剂氧化
(1)苯的同系物和苯都含有苯环,性质相似
①氧化反应
②取代反应
③加成反应
小结:化学性质
四、多环芳烃
多苯代脂烃:苯环通过脂肪烃连在一起
联苯或多联苯:苯环之间通过碳碳单键直接相连
稠环芳烃:苯环之间通过共用苯环的若干环边而形成
—CH2—
—
二苯甲烷(C13H12)
联苯(C12H10)
萘(C10H8)
蒽(C14H10)
芳香烃的来源及其应用
1、来源:a、煤的干馏 b、石油的催化重整
2、应用:简单的芳香烃是基本的有机 化工原料。
芳香烃对健康的危害
苯
稠环
芳烃
是黏合剂、油性涂料、油墨等的常用有机溶剂
操作车间空气中苯的浓度≤40mg·m-3
居室内空气中苯含量平均每小时≤0.09mg·m-3
制鞋、皮革、箱包、家具、喷漆、油漆等工作
引起急性中毒或慢性中毒,诱发白血病
致癌物质
萘——过去卫生球的主要成分
秸秆、树叶等不完全燃烧形成的烟雾中
香烟的烟雾中
有机物 烷烃 烯烃 炔烃 芳香烃
代表物 CH4 C2H4 C2H2 C6H6
结构特点 全部单键
饱和烃 含碳碳双键不饱和 含碳碳叁键不饱和 特殊的键不饱和
空间结构
物理性质
燃烧
与溴水
KMnO4
主要反应类型
烷烃、烯烃、炔烃、芳香烃的比较
正四面体型
平面型
直线型
平面正六边形
无色气体,难溶于水
无色液体
易燃,完全燃烧时生成CO2和H2O
不反应
不反应
取代
加成反应
氧化反应
加成、聚合
加成反应
氧化反应
加成、聚合
不反应
不反应
取代、加成
下列属于苯的同系物的是( )
证明苯分子中不存在单双键交替的理由是 ( )
(A)苯的邻位二元取代物只有一种
(B)苯的间位二元取代物只有一种
(C)苯的对位二元取代物只有一种
(D)苯的邻位二元取代物有二种
A
练一练
下列物质中所有原子都有可能在同一平面上的是 ( )
(A)
( B)
(C)
(D)
B
C
CH=CH2
CH3
Cl
练一练
新课标人教版课件系列
《高中化学》
选修5
2.2《芳香烃》
教学目标
(1)知识目标:了解苯的物理性质,理解苯分子的独特结构,掌握苯的主要化学性质。
(2)能力目标:培养学生逻辑思维能力和实验能力。
(3)情感目标:使学生认识结构决定性质,性质又反映结构的辩证关系。培养学生以实验事实为依据,严谨求实勇于创新的科学精神。引导学生以假说的方法研究苯的结构,并从中了解研究事物所应遵循的科学方法。
教学重点、难点:
(1)重点:苯的分子结构与其化学性质
(2)难点:理解苯环上碳碳间的化学键是一种介于单键和双键之间的独特的化学键。
(3)关键:正确处理苯的分子结构与其化学性质的关系。
教学方法
(1)主要教学方法
归纳、演绎法:通过学生的逻辑推导和归纳,最终确定苯的分子结构。
(2)辅助教学方法
情境激学法:创设问题的意境,激发学习兴趣,调动学生内在的学习动力,促使学生在意境中主动探究科学的奥妙。
实验促学法:通过学生的动手操作,教师的演示,观察分析实验现象,掌握苯的分子结构和化学性质。
辅助教学手段:多媒体辅助教学
运用先进的教学手段,将微观现象宏观化,将瞬间变化定格化,有助于学生掌握苯的结构特点和苯的主要化学性质(易取代、难加成、难氧化)的本质。
1.什么叫芳香烃?
分子中含有苯环的一类烃属于芳香烃
2.最简单的芳香烃是
苯
一、苯的物理性质
(色、味、态、熔点、沸点、密度、溶解性、特性)
颜色
无色
气味
特殊气味
状态
液态
熔点
5.5℃
沸点
80.1℃
密度
比水小
毒性
有毒
溶解性
不溶于水,易溶于有机
溶剂。
易挥发
二、苯的分子结构与化学性质:
1)结构式 2)结构简式
3)结构特点:
(1)苯分子是平面六边形的稳定结构;
(2)苯分子中碳碳键是介于碳碳单键与碳碳双键之间的一种独特的键;
(3)苯分子中六个碳原子等效,六个氢原子等效
1、组成与结构:
分子式:
C6H6
键角 120°
2、苯的化学性质
在通常情况下比较稳定,在一定条件下能发生氧化、取代、加成等反应。
苯的化学性质和烷烃、烯烃、炔烃有何异同点 为什么
(1) 氧化反应:
现象:火焰明亮,带有浓烟
思考:苯燃烧时为什么伴有浓烟?
不能使酸性高锰酸钾溶液褪色
2C6H6+15O2 12CO2+ 6H2O
点燃
a 燃烧
b 与高锰酸钾反应
(2)取代反应
a 苯的溴代
反应条件:纯溴(液态)、催化剂
b 苯的硝化
+ HNO3(浓)
NO2
+ H2O
浓H2SO4
50~60℃
+ Br2
Br
+ HBr
FeBr3
根据苯与溴、浓硝酸发生反应的条件,请你设计制备溴苯和硝基苯的实验方案(注意仪器的选择和试剂的加入顺序)
实验思考题:
1.苯、溴、Fe屑等试剂加入烧瓶的顺序是怎样的?
2.Fe屑的作用是什么?
3.将Fe屑加入烧瓶后,烧瓶内有什么现象?这说明什么?
4.长导管的作用是什么?
5.为什么导管末端不插入液面下?
6.哪些现象说明发生了取代反应而不是加成反应?
7.纯净的溴苯应是无色的,为什么所得溴苯为褐色?怎样使之恢复本来的面目?
苯 液溴 Fe屑
用作催化剂
剧烈反应,轻微翻腾,有气体逸出。反应放热。
用于导气和冷凝回流(或冷凝器)
溴化氢易溶于水,防止倒吸。
苯与溴反应生成溴苯的同时有溴化氢生成,说明它们发生了取代反应而非加成反应。因加成反应不会生成溴化氢。
因为未发生反应的溴和反应中的催化剂FeBr3溶解在生成的溴苯中。用水和碱溶液反复洗涤可以使褐色褪去,还溴苯以本来的面目。
溴苯实验后思考题:
1.烧瓶中的试剂顺序能够颠倒吗?为什么?能用浓溴水代替液溴吗?为什么?
2.该反应的催化剂是FeBr3,而反应时加的是Fe屑, Fe屑是怎样转化为FeBr3的?
3.该反应是放热反应,而苯、液溴均易挥发,为了减少放热对苯及液溴挥发的影响,装置上有哪些独特的设计和考虑?
4.生成的HBr中常混有溴蒸气,此时用AgNO3溶液对HBr的检验结果是否可靠?为什么?如何除去混在HBr中的溴蒸气?
5.如何分离出烧瓶中反应生成的溴苯?
+ Br2
— Br
+ HBr
FeBr3
+ 2Br2
— Br
+ 2HBr
FeBr3
Br—
+ 2Br2
— Br
+ 2HBr
FeBr3
— Br
苯在三卤化铁催化下可与Cl2、Br2发生取代反应,生成一卤代苯、二卤代苯(主要是邻、对位取代产物)等。
玻璃管
实验步骤:①先将1.5mL浓硝酸注入大试管中,再慢慢注入2mL浓硫酸,并及时摇匀和冷却.
②向冷却后的酸中逐滴加入1mL苯,充分振荡,混和均匀.
③将混合物控制在50-60℃的条件下约10min,实验装置如左图.
④将反应后的液体到入盛冷水的烧杯中,可以看到烧杯底部有黄色油状物生成,经过分离得到粗硝基苯.
⑤粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤.将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯.
注意:
①浓硝酸和浓硫酸的混合酸要冷却到50-60℃以下,再慢慢滴入苯,边加边振荡,因为反应放热,温度过高,苯易挥发,且硝酸也会分解,同时苯和浓硫酸在75-80℃时会发生反应。
②什么时候采用水浴加热:需要加热,而且一定要控制在100℃以下,均可采用水浴加热。如果超过100 ℃,还可采用油浴(0~300 ℃)、沙浴温度更高。
⑤为提纯硝基苯,一般将粗产品依次用蒸馏水和NaOH溶液洗涤。
③温度计必须悬挂在水浴中。
④不纯的硝基苯显黄色
(因为溶有NO2)而纯净硝基苯是无色,有苦杏仁味,比水重,油状液体。
1.配制浓硫酸与浓硝酸混和酸时,是否可以将浓硝酸加入到浓硫酸中 为什么
2.步骤③中,为了使反应在50-60℃下进行,常用的方法是什么
3.步骤④中洗涤、分离粗硝基苯使用的主要仪器是什么
4.步骤④中粗产品用5%NaOH溶液洗涤的目的
5.敞口玻璃管的作用是什么 浓硫酸的作用
c 磺化(苯分子中的H原子被磺酸基取代的反应)
+ H2O
(苯磺酸)
+ HO-SO3H
75℃~80℃
-SO3H
(3)苯的加成反应 (与H2、Cl2)
+ H2
Ni
环己烷
加热
+ 3Cl2
催化剂
Cl
Cl
Cl
Cl
Cl
Cl
H
H
H
H
H
H
六六六
对比与归纳
烷 烯 苯
与Br2作用 Br2试剂
反应条件
反应类型
与KMnO4作用
点燃 现象
结论
纯溴
溴水
纯溴
溴水
光照
取代
加成
Fe粉
取代
萃取
无反应
现象
结论
不褪色
褪色
不褪色
不被KMnO4氧化
易被KMnO4氧化
苯环难被KMnO4氧化
焰色浅,无烟
焰色亮,有烟
焰色亮,浓烟
C%低
C%较高
C%高
小结:苯易取代、难加成、难氧化
三、苯的同系物
1.含义:苯的苯环上氢原子被烷基代替而得到的芳烃。
CH3
|
CH2CH3
|
CH3
|
|
CH3
|
CH3
CH3
|
CH3
CH3
H3C
H3C
甲苯(C7H8) 乙苯( C8H10) 对二甲苯(C8H10) 六甲基苯(C12H18)
只含有一个苯环,且侧链为C-C单键的芳香烃。
CnH2n-6 (n≥6)
2.通式:
2CnH2n-6 + 3 (n-1)O2
点燃
2nCO2+ 2(n-3)H2O
(1)氧化反应
a 燃烧反应
现象:火焰明亮并带有浓烟
3.化学性质
2mL苯
3滴高锰酸钾酸性溶液
用力振荡
2mL甲苯
3滴高锰酸钾酸性溶液
用力振荡
b 苯环影响侧链,使侧链能被强氧化剂氧化
实验结论:
苯不能被KMnO4酸性溶液氧化,甲苯能被KMnO4酸性溶液氧化
未褪色
褪色
甲苯被氧化的是侧链,即甲基被氧化,该反应可简单表示为:
CH3
KMnO4、H+
COOH
(苯甲酸)
这样的氧化反应,都是苯环上的烷烃基被氧化,说明了苯环上的烷烃基比烷烃性质活泼。这活泼性是苯环对烷烃基影响的结果。
苯的同系物的氧化反应
反应机理:
|
—C—H
|
O
||
C—OH
|
酸性高锰酸钾溶液
烷基上与苯环直接相连的碳原子直接连氢原子
H
|
—C—H
|
H
H
| |
—C—C—
| |
H
C
|
—C—C
|
C
×
CH3
|
—C—CH3
|
CH3
CH3
|
|
CH2—R
CH3
|
CH3—CH—
CH3
|
—C—CH3
|
CH3
HOOC
|
|
COOH
HOOC—
KMnO4/H+
思考:产物是什么?
可用KMnO4酸性溶液作试剂鉴别苯的同系物和苯、苯的同系物和烷烃。
(2)取代反应 甲苯能发生硝化反应
邻硝基甲苯
对硝基甲苯
2
2
2
CH3
+ HNO3
浓硫酸
300C
CH3
NO2
CH3
NO2
+ + H2O
2,4,6-三硝基甲苯
简称三硝基甲苯,又叫TNT
是一种淡黄色针状晶体,不溶于水,不稳定,是一种烈性炸药
CH3
|
|
NO2
CH3
|
NO2
O2N
+ 3HNO3
+ 3H2O
浓硫酸
100℃
—CH3对苯环的影响使取代反应更易进行
(3)加成反应
催化剂
△
+ 3H2
(2)苯的同系物含有侧链,性质与苯又有不同
①侧链影响苯环,使苯环上的氢原子比苯更易被取代
②苯环影响侧链,使侧链能被强氧化剂氧化
(1)苯的同系物和苯都含有苯环,性质相似
①氧化反应
②取代反应
③加成反应
小结:化学性质
四、多环芳烃
多苯代脂烃:苯环通过脂肪烃连在一起
联苯或多联苯:苯环之间通过碳碳单键直接相连
稠环芳烃:苯环之间通过共用苯环的若干环边而形成
—CH2—
—
二苯甲烷(C13H12)
联苯(C12H10)
萘(C10H8)
蒽(C14H10)
芳香烃的来源及其应用
1、来源:a、煤的干馏 b、石油的催化重整
2、应用:简单的芳香烃是基本的有机 化工原料。
芳香烃对健康的危害
苯
稠环
芳烃
是黏合剂、油性涂料、油墨等的常用有机溶剂
操作车间空气中苯的浓度≤40mg·m-3
居室内空气中苯含量平均每小时≤0.09mg·m-3
制鞋、皮革、箱包、家具、喷漆、油漆等工作
引起急性中毒或慢性中毒,诱发白血病
致癌物质
萘——过去卫生球的主要成分
秸秆、树叶等不完全燃烧形成的烟雾中
香烟的烟雾中
有机物 烷烃 烯烃 炔烃 芳香烃
代表物 CH4 C2H4 C2H2 C6H6
结构特点 全部单键
饱和烃 含碳碳双键不饱和 含碳碳叁键不饱和 特殊的键不饱和
空间结构
物理性质
燃烧
与溴水
KMnO4
主要反应类型
烷烃、烯烃、炔烃、芳香烃的比较
正四面体型
平面型
直线型
平面正六边形
无色气体,难溶于水
无色液体
易燃,完全燃烧时生成CO2和H2O
不反应
不反应
取代
加成反应
氧化反应
加成、聚合
加成反应
氧化反应
加成、聚合
不反应
不反应
取代、加成
下列属于苯的同系物的是( )
证明苯分子中不存在单双键交替的理由是 ( )
(A)苯的邻位二元取代物只有一种
(B)苯的间位二元取代物只有一种
(C)苯的对位二元取代物只有一种
(D)苯的邻位二元取代物有二种
A
练一练
下列物质中所有原子都有可能在同一平面上的是 ( )
(A)
( B)
(C)
(D)
B
C
CH=CH2
CH3
Cl
练一练
