3.1 溶液的形成课件(16张PPT)-2021-2022学年化学九年级上册-鲁教版
文档属性
| 名称 | 3.1 溶液的形成课件(16张PPT)-2021-2022学年化学九年级上册-鲁教版 |

|
|
| 格式 | ppt | ||
| 文件大小 | 33.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-26 15:14:48 | ||
图片预览






文档简介
(共18张PPT)
第一节
溶液的形成
第一课时
第三单元
溶液
食盐放入水中
硫酸铜晶体放入水中
现象
形成什么
探究实验一:几种固体物质溶于水
氯化钠逐渐溶解,最后消失,成为无色透明的液体
氯化钠溶液
硫酸铜溶液
硫酸铜晶体逐渐溶解,最后消失,成为蓝色透明的液体
Na+和Cl-
扩散到水分子的间隔之中。
食盐溶解视频
食盐溶于水时,在水分子的作用下,钠离子和氯离子向水中扩散,均匀地分散到水中,所以食盐溶液实际上是离子和分子组成的均匀混合物。离子的直径很小(一般小于10-9m),质量也很小,它们在水溶液中跟水分子一起不断运动,所以溶液是均一、稳定的。
为什么这些固体会“消失”在水中?以氯化钠溶液为例
1、溶液各处性质是否各处相同?
——溶液具有均一性
2、形成溶液后,有固体与液体分离吗?
——溶液具有稳定性
3、此时的溶液是纯净物还是混合物?
——溶液是混合物
通过上面的思考题,大家概括一下什么叫做溶液?
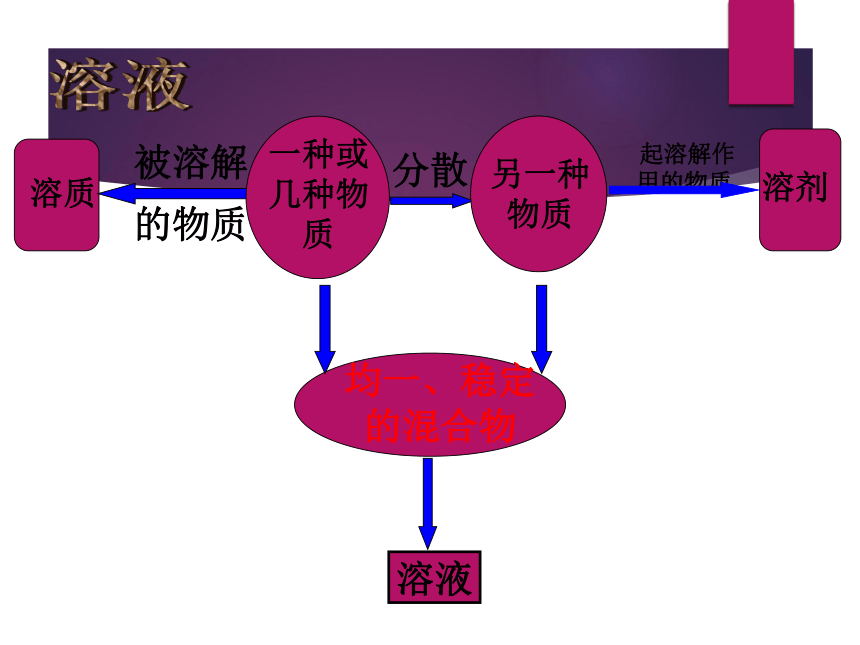
1、定义:一种或几种物质分散到另一种物质
里,形成
均一的、稳定的混合物。
溶液中任意一部分的组成、性质完全一样
均一性:
外界条件(温度、压强等)不变时,无论放置多久,溶质都不会从溶剂中分离出来,不发生改变
稳定性:
2、溶液的基本特征:
均一性
稳定性
混合物
溶质
被溶解
的物质
起溶解作
用的物质
溶剂
一种或
几种物
质
分散
另一种
物质
均一、稳定
的混合物
溶液
溶剂有多种(水、汽油、酒精等),水是一种最常用的溶剂,不指明溶剂的溶液,一般指的是水溶液。汽油也可能做溶剂,它可以溶解油脂——用汽油洗油污。酒精也可做溶剂,如溶解碘形成碘酒。
空气、合金也是溶液吗?
固体
(如食盐水,硫酸铜溶液等)
液体(如白酒等)
气体(如稀盐酸等)
溶质
它们具有均一性、稳定性、是混合物。因此是溶液!
1、判断下列说法是否正确
(1)凡是无色、透明的液体都是溶液
(2)溶液都是均一、稳定、无色透明的液体
(3)食盐水和蔗糖水混合后仍为溶液
(4)溶液都是由一种溶质和一种溶剂组成的
(5)98%的硫酸溶液中水做溶质,硫酸做溶剂
(6)食盐溶于水,得到食盐溶液的过程属于化合反应
【跟进训练】
×
×
√
(7)把食盐溶液倒掉一半后,变稀了。
体系
溶质
溶剂
气+液
固+液
液+液
无水
有水
气体
液体
固体
液体
量少
量多
非水物
水
探讨:
怎样确定溶液中谁是溶质?谁是溶剂?
练习:
指出下列溶液中溶质、溶剂各是什么?
溶质
溶剂
(1)硫酸铜溶液
(2)稀硫酸
(3)75%的医用酒精
(4)油脂溶解在汽油里
(5)白磷的二硫化碳溶液
(6)碘酒
硫酸铜
水
H2SO4
水
酒精
水
油脂
汽油
白磷
二硫化碳
碘
酒精
实验操作
实验数据
结论
1.取两只小烧杯,分别加入约50mL蒸馏水,用温度计测量水温(
T1
)
T1=
℃
2.向一只小烧杯中加入两大药匙氢氧化钠固体,搅拌,测量溶液的温度(
T2
)
T2=
℃
3.向另一只小烧杯中加入两大药匙硝酸铵固体,搅拌,测量溶液的温度(
T3
)
T3=
℃
注意:温度计、玻璃棒每次用完要擦干净,再继续使用。
氢氧化钠溶解放出大量的热
硝酸铵溶解吸收大量的热
溶解过程
扩散过程
(吸热)
水合过程
(放热)
吸热>放热
(溶液温度降低)
例如:NH4NO3固体溶于水
吸热
=
放热
(溶液温度不变)
例如:NaCl固体溶于水
吸热<放热
(溶液温度升高)
例如:NaOH
固体溶于水
1、下列关于溶液的叙述,正确的是
(
)
A.凡是均一的、稳定的、澄清的、透明的液体一定是溶液
B.当外界条件不变时,溶液不论放置多长时间,溶质也不会从溶剂中分离出来
C.一种溶液上面部分和下面部分所含的溶质是不同的
D.溶质和溶剂混合时开始是混合物,等到溶质,全部溶解后就变成纯净的、透明的纯净物了
B
巩固练习
2、烧杯中有100毫升NaCl溶液,请比较A处和B
处密度的大小(
)
A:?A
>
?B
B:
?A
<
?B
C:
?A=
?B
D:
不能确定
A
B
C
3、当水分不蒸发,温度不改变时,KNO3溶液放置一年时间后,KNO3将(
)
A:会沉降下来
B:不会分离出来
C:会浮上水面
D:不能确定
B
4、溶液一定是(
)
A
化合物
B
单质
C
混合物
D
纯净物
C
5、下列各组物质中,前者是化合物,后
者是溶液的是(
)
A
澄清石灰水、水
B
氧气、稀硫酸
C
空气、汽水
D
氯化氢气体、盐酸
D
6.市场上有一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动饮料罐使它们混合,罐内饮料温度就会降低,这种固体物质可能是(
)
A.硝酸铵
B.氢氧化钠
C.食盐
D.熟石灰
A
归纳总结
一、溶液的定义
二、溶液的性质
三、溶液中溶质与溶剂的判断
四、一些物质溶解时温度的变化情况
第一节
溶液的形成
第一课时
第三单元
溶液
食盐放入水中
硫酸铜晶体放入水中
现象
形成什么
探究实验一:几种固体物质溶于水
氯化钠逐渐溶解,最后消失,成为无色透明的液体
氯化钠溶液
硫酸铜溶液
硫酸铜晶体逐渐溶解,最后消失,成为蓝色透明的液体
Na+和Cl-
扩散到水分子的间隔之中。
食盐溶解视频
食盐溶于水时,在水分子的作用下,钠离子和氯离子向水中扩散,均匀地分散到水中,所以食盐溶液实际上是离子和分子组成的均匀混合物。离子的直径很小(一般小于10-9m),质量也很小,它们在水溶液中跟水分子一起不断运动,所以溶液是均一、稳定的。
为什么这些固体会“消失”在水中?以氯化钠溶液为例
1、溶液各处性质是否各处相同?
——溶液具有均一性
2、形成溶液后,有固体与液体分离吗?
——溶液具有稳定性
3、此时的溶液是纯净物还是混合物?
——溶液是混合物
通过上面的思考题,大家概括一下什么叫做溶液?
1、定义:一种或几种物质分散到另一种物质
里,形成
均一的、稳定的混合物。
溶液中任意一部分的组成、性质完全一样
均一性:
外界条件(温度、压强等)不变时,无论放置多久,溶质都不会从溶剂中分离出来,不发生改变
稳定性:
2、溶液的基本特征:
均一性
稳定性
混合物
溶质
被溶解
的物质
起溶解作
用的物质
溶剂
一种或
几种物
质
分散
另一种
物质
均一、稳定
的混合物
溶液
溶剂有多种(水、汽油、酒精等),水是一种最常用的溶剂,不指明溶剂的溶液,一般指的是水溶液。汽油也可能做溶剂,它可以溶解油脂——用汽油洗油污。酒精也可做溶剂,如溶解碘形成碘酒。
空气、合金也是溶液吗?
固体
(如食盐水,硫酸铜溶液等)
液体(如白酒等)
气体(如稀盐酸等)
溶质
它们具有均一性、稳定性、是混合物。因此是溶液!
1、判断下列说法是否正确
(1)凡是无色、透明的液体都是溶液
(2)溶液都是均一、稳定、无色透明的液体
(3)食盐水和蔗糖水混合后仍为溶液
(4)溶液都是由一种溶质和一种溶剂组成的
(5)98%的硫酸溶液中水做溶质,硫酸做溶剂
(6)食盐溶于水,得到食盐溶液的过程属于化合反应
【跟进训练】
×
×
√
(7)把食盐溶液倒掉一半后,变稀了。
体系
溶质
溶剂
气+液
固+液
液+液
无水
有水
气体
液体
固体
液体
量少
量多
非水物
水
探讨:
怎样确定溶液中谁是溶质?谁是溶剂?
练习:
指出下列溶液中溶质、溶剂各是什么?
溶质
溶剂
(1)硫酸铜溶液
(2)稀硫酸
(3)75%的医用酒精
(4)油脂溶解在汽油里
(5)白磷的二硫化碳溶液
(6)碘酒
硫酸铜
水
H2SO4
水
酒精
水
油脂
汽油
白磷
二硫化碳
碘
酒精
实验操作
实验数据
结论
1.取两只小烧杯,分别加入约50mL蒸馏水,用温度计测量水温(
T1
)
T1=
℃
2.向一只小烧杯中加入两大药匙氢氧化钠固体,搅拌,测量溶液的温度(
T2
)
T2=
℃
3.向另一只小烧杯中加入两大药匙硝酸铵固体,搅拌,测量溶液的温度(
T3
)
T3=
℃
注意:温度计、玻璃棒每次用完要擦干净,再继续使用。
氢氧化钠溶解放出大量的热
硝酸铵溶解吸收大量的热
溶解过程
扩散过程
(吸热)
水合过程
(放热)
吸热>放热
(溶液温度降低)
例如:NH4NO3固体溶于水
吸热
=
放热
(溶液温度不变)
例如:NaCl固体溶于水
吸热<放热
(溶液温度升高)
例如:NaOH
固体溶于水
1、下列关于溶液的叙述,正确的是
(
)
A.凡是均一的、稳定的、澄清的、透明的液体一定是溶液
B.当外界条件不变时,溶液不论放置多长时间,溶质也不会从溶剂中分离出来
C.一种溶液上面部分和下面部分所含的溶质是不同的
D.溶质和溶剂混合时开始是混合物,等到溶质,全部溶解后就变成纯净的、透明的纯净物了
B
巩固练习
2、烧杯中有100毫升NaCl溶液,请比较A处和B
处密度的大小(
)
A:?A
>
?B
B:
?A
<
?B
C:
?A=
?B
D:
不能确定
A
B
C
3、当水分不蒸发,温度不改变时,KNO3溶液放置一年时间后,KNO3将(
)
A:会沉降下来
B:不会分离出来
C:会浮上水面
D:不能确定
B
4、溶液一定是(
)
A
化合物
B
单质
C
混合物
D
纯净物
C
5、下列各组物质中,前者是化合物,后
者是溶液的是(
)
A
澄清石灰水、水
B
氧气、稀硫酸
C
空气、汽水
D
氯化氢气体、盐酸
D
6.市场上有一种罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动饮料罐使它们混合,罐内饮料温度就会降低,这种固体物质可能是(
)
A.硝酸铵
B.氢氧化钠
C.食盐
D.熟石灰
A
归纳总结
一、溶液的定义
二、溶液的性质
三、溶液中溶质与溶剂的判断
四、一些物质溶解时温度的变化情况
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
