第1章认识化学科学 专题练习 2021-2022学年高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第1章认识化学科学 专题练习 2021-2022学年高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 125.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-28 17:30:21 | ||
图片预览




文档简介
第1章认识化学科学专题练习2021-2022学年高中化学鲁科版(2019)必修一
一、单选题(共15题)
1.某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl
3种固体原料的物质的量之比为1:4:8。若配制该营养液,取428gNH4Cl,则需要KCl和K2SO4的质量分别为(???
)
A.?53.5g和214g?????????????????????B.?74.5g和348g??????????????C.?74.5g和696g??
???????????????????D.?149g和696g
2.标准状况下1
mol
H2的体积约为(??
)
A.?11.2
L?????????????????????????????????B.?22.4
L?????????????????????????????????C.?33.6
L?????????????????????????????????D.?44.8
L
3.血液化验单中“葡萄糖”一项的结果为4.94×10﹣3
mol?L﹣1
.
这里的“4.94×10﹣3
mol?L﹣1”表示葡萄糖的(?
)
A.?物质的量?????????????????????????B.?摩尔质量?????????????????????????C.?质量分数?????????????????????????D.?物质的量浓度
4.下列说法正确的是(??
)
A.?Na2O2与水反应生成标准状况下1.12LO2转移电子数为0.2NA
B.?标准状况下,0.56L丙烷含共价键数为0.2NA
C.?标准状况下,2.24LSO2与足量氧气充分反应生成SO3分子数为0.1NA
D.?14g乙烯和丙烯混合气体中氢原子数为2NA
5.下列对于“摩尔”的理解正确的是(??
)
A.?摩尔是国际科学界建议采用的一种物理量
B.?摩尔可以把物质的宏观数量与微观粒子的数量联系起来
C.?摩尔是物质的量的单位,简称摩,符号为mol
D.?国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
6.下列说法不正确的是(??
)
A.?可用灼烧的方法鉴别纯羊毛和合成纤维
B.?过氧化钠可作为潜水艇里的氧气来源
C.?碳酸钡悬浊液可用作胃部X
射线透视的“钡餐”
D.?硅的导电性介于导体和绝缘体之间,晶体硅可用作半导体材料
7.设NA表示阿伏加德罗常数的值。下列说法均错误的是()
①将1mol氯气通入一定量水中发生反应转移电子数为NA
②12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
③在标准状况下,22.4L辛烷中的分子数为NA
④1mol羟基中含有的电子数为10NA
⑤1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
A.?②③⑤????????????????????????????????B.?①②④????????????????????????????????C.?③④⑤????????????????????????????????D.?①③④
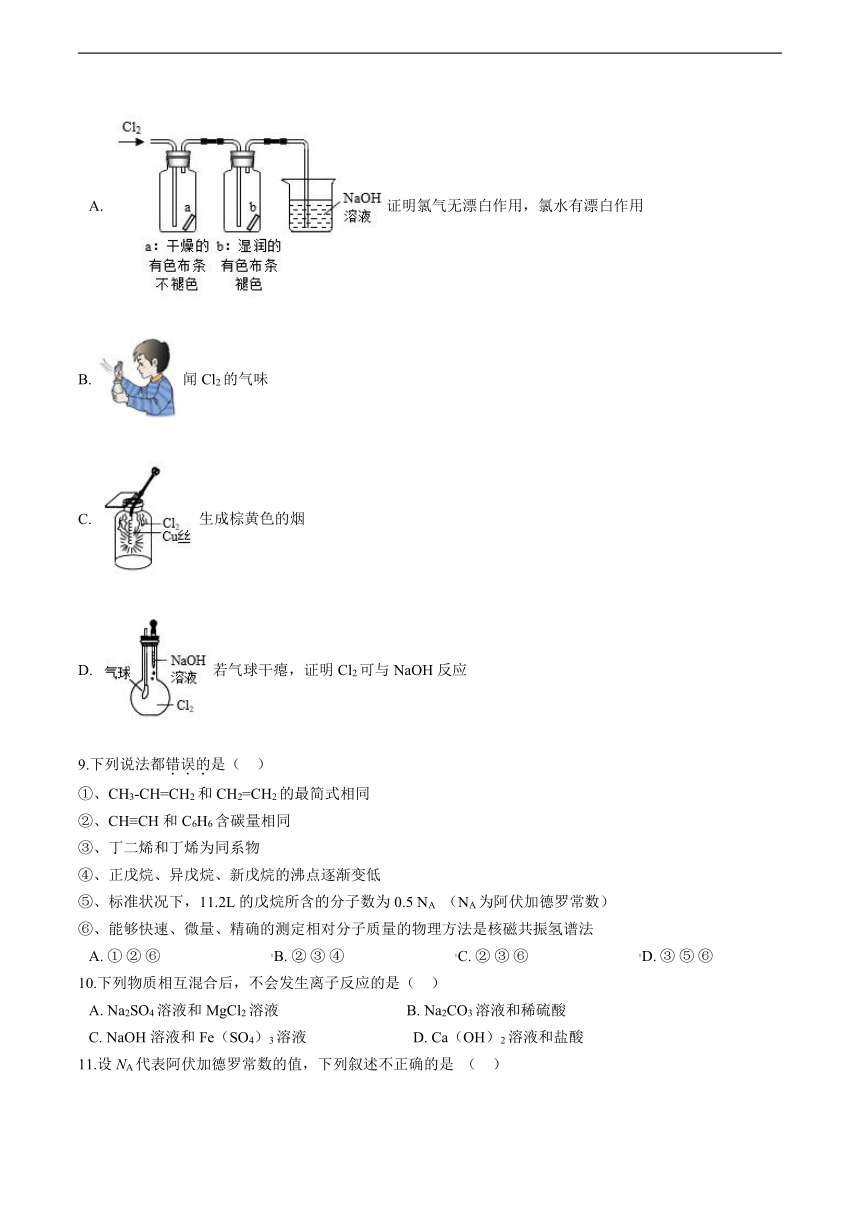
8.某同学用下列装置进行有关Cl2的实验。下列说法错误的是(
??)
A.?证明氯气无漂白作用,氯水有漂白作用
B.?闻Cl2的气味
C.?生成棕黄色的烟
D.?若气球干瘪,证明Cl2可与NaOH反应
9.下列说法都错误的是(??
)
①、CH3-CH=CH2和CH2=CH2的最简式相同
②、CH≡CH和C6H6含碳量相同
③、丁二烯和丁烯为同系物
④、正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤、标准状况下,11.2L的戊烷所含的分子数为0.5
NA
(NA为阿伏加德罗常数)
⑥、能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法
A.?①
②
⑥?????????????????????????????B.?②
③
④?????????????????????????????C.?②
③
⑥?????????????????????????????D.?③
⑤
⑥
10.下列物质相互混合后,不会发生离子反应的是(??
)
A.?Na2SO4溶液和MgCl2溶液?????????????????????????????????B.?Na2CO3溶液和稀硫酸
C.?NaOH溶液和Fe(SO4)3溶液????????????????????????????D.?Ca(OH)2溶液和盐酸
11.设NA代表阿伏加德罗常数的值,下列叙述不正确的是
(??
)
A.?常温常压下,0.l
NA个Al与足量氢氧化钠溶液反应生成的H2体积大于3.36
L
B.?标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA
C.?常温常压下,Na2O2与足量H2O反应,共生成1molO2
,
转移电子的数目为2
NA
D.?4.4g
CO2所含有的成键电子数约为0.8NA
12.用NA表示阿伏加德罗常数,下列叙述中正确的是(??)
A.?0.1mol·L-1稀硫酸中含有硫酸根离子个数为0.1NA
B.?1molCH3+(碳正离子)中含有电子数为10NA
C.?标准状况下,0.5NA个NO和0.5NA个O2混合气体的体积约为22.4
L
D.?12.4g白磷中含有磷原子数为0.4NA
13.Na2O2、HCl和Al2O3在水中反应,若最后所得溶液中只含AlO2-、Na+、Cl-
,
则Na2O2、HCl和Al2O3的物质的量之可能为(???)
A.?4∶6∶1??????????????????????????????B.?8∶6∶1??????????????????????????????C.?3∶3∶1??????????????????????????????D.?4∶6∶3
14.某温度下,向浓氯水(由0.12mol氯气溶于水配制而成)中,以恒定速率滴入NaOH溶液,溶液中
和
的物质的量与时间t的关系曲线如图:
下列说法正确的是(
??)
A.?
时,溶液中的含氯微粒为:
、
B.?
时,发生的离子反应是:
C.?
时,溶液中存在如下关系:
D.?
时,溶液中含NaCl
0.20mol
15.有一真空瓶质量为m1
,
该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3
,
则A的相对分子质量是(
??)
A.?
???????????????????????????B.?
???????????????????????????C.?
???????????????????????????D.?
二、综合题(共5题)
16.已知漂白粉与浓盐酸反应可产生氯气,某同学试图测定氯气的体积并验证干
燥纯净的氯气无漂白性,现有如下装置,请回答:
(1)请用字母填写装置的连接顺序:
a
接________,________接________,________接________,________接________,
________接________.
(2)洗气瓶中所装液体是________.
(3)在制氯气前,必须进行的一项操作步骤是________.
(4)某同学实验时,发现量筒中未收集到液体,则失败的原因可能是________.
(5)写出漂白粉与浓盐酸反应制氯气的化学方程式________.
17.化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。实验室需要配制0.1
mol·L-1NaOH溶液230mL,请回答下列问题:
(1)所需的玻璃仪器除烧杯、量筒、玻璃棒和胶头滴管之外,还需要________、用天平称取________gNaOH。
(2)溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移定容会使溶液的浓度________(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度________。
(3)使用容量瓶前必须进行的一步操作是________,若加蒸馏水时不慎超过刻度线,处理方法是________
18.有X、Y、Z、三种元素,X元素原子核内无中子,Y元素原子核内有8个质子,Z元素原子得到1个电子后与氩原子核外电子排布相同。
(1)写出X元素符号________,画出Y元素的原子结构示意图________。
(2)写出Z单质与X2Y反应化学方程式________。
19.氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含
NH4+废水和工业废气(主要含
NO、CO、CO2、SO2、N2)的流程如图:
已知:NO+NO2+2NaOH=2NaNO2+H2O??
2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)固体
1
的主要成分有
Ca(OH)2、________、________(填化学式)。
(2)若实验室需要配制100mL
3.00mol·L-1NaOH溶液进行模拟测试,需用托盘天平称取
NaOH固体质量为________g。
(3)用
NaNO2
溶液处理含NH4+废水反应的离子方程式为________。
(4)捕获剂从气体
3
中捕获的气体主要是________
(填化学式)。
(5)流程中生成的
NaNO2
因外观和食盐相似,又有咸味,容易使人误食中毒。已知
NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2
可以使淀粉变蓝。根据上述反应,
选择生活中常见的物质和有关试剂进行实验,以鉴别
NaNO2
和
NaCl。需选用的物质是_____________________(填序号)。
①水???
②淀粉碘化钾试纸???
③淀粉???
④白酒???
⑤白醋
A.①③⑤
B.①②④
C.①②⑤
D.①②③⑤
20.金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO.
(1)Ca与最活跃的非金属元素A形成化合物D,D的电子式为________,D的沸点比A与
形成的化合物E的沸点________.(填“高”或“低”)
(2)配平用钙线氧脱鳞的化学方程式:__P+
__FeO+__CaO
__Ca3(PO4)2+__Fe
(3)将钙线试样溶于稀盐酸后,加入过量
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
.则金属M为________(填元素符号);检测溶液中含有
的方法是________.
(4)取1.6g钙线试样,与水充分反映,生成224mL
(标准状况),在此溶液中通入适量的
,最多能得到
________g.
答案解析部分
一、单选题
1.【答案】
C
【解析】【解答】428gNH4Cl的物质的量为8mol;KCl、K2SO4、NH4Cl三种固体原料的物质的量之比为1∶4∶8;所以需要KCl
1mol,质量为74.5g、需要K2SO4
4mol,质量为696g,C符合题意。
故答案为:C
【分析】先求得NH4Cl的物质的量,再根据KCl、K2SO4、NH4Cl三种固体原料的物质的量之比,求得KCl、K2SO4物质的量,根据公式n=m/M,求得KCl、K2SO4的质量。
2.【答案】
B
【解析】【解答】标况下,气体摩尔体积为22.4L/mol,1molH2的体积为22.4L;B符合题意,
故答案为:B。
【分析】根据标准状况下,气体摩尔体积为22.4L/mol解答;
3.【答案】
D
【解析】【解答】解:4.94×10﹣3
mol/L表示1L溶液中含有溶质葡萄糖的物质的量为4.94×10﹣3
mol,为单位体积的溶液中含有溶质的物质的量,该浓度是物质的量浓度.
故选:D.
【分析】4.94×10﹣3
mol/L表示1L溶液中含有溶质葡萄糖的物质的量为4.94×10﹣3
mol,该浓度是物质的量浓度.
4.【答案】
D
【解析】【解答】A、过氧化钠与水反应时,氧元素的价态一半由-1价变为0价,一半降为-2价,故当生成标准状况下1.12LO2转移电子数为0.1NA
,
故A不符合题意;
B、
标准状况下,0.56L丙烷的物质的量是0.025mol,含共价键数为0.25NA
,
故B不符合题意;
C、SO2与氧气反应生成SO3的反应可逆,标准状况下,2.24LSO2与足量氧气充分反应生成SO3分子数小于0.1NA
,
故C不符合题意;
D、乙烯和丙烯的最简式都是
,14g乙烯和丙烯混合气体中氢原子数为
?,故D符合题意。
故答案为:D
【分析】阿伏伽德罗常数,为热学常量,符号NA。
它的精确数值为:6.02214076×10??,一般计算时取6.02×10??或6.022×10??。
5.【答案】
C
【解析】【解答】A.物质的量是一种物理量,摩尔是物质的量的单位,选项A不符合题意;
B.物质的量是连接宏观物质与微观粒子的桥梁,摩尔是物质的量的单位,选项B不符合题意;
C.物质的量是含有一定数目粒子的集体,单位是摩尔,简称摩,符号为mol,选项C符合题意;
D.碳原子指含有6个质子6个中子的原子,本选项未明确,选项D不符合题意;
故答案为:C。
【分析】根据摩尔的概念进行判断,注意物质的量与摩尔的关系和区别。
6.【答案】C
【解析】【解答】解:A.羊毛的主要成分为蛋白质,灼烧时有烧焦的羽毛气味,为蛋白质的特征性质,可用于鉴别,故A不选;
B.过氧化钠与水或二氧化碳反应生成氧气,可作为氧气的来源,故B不选;
C.碳酸钡可溶于盐酸,而钡离子有毒,应用硫酸钡,故C选;
D.硅是重要的半导体原料,导电性介于导体和绝缘体之间,可用用作半导体材料,故D不选.
故选C.
【分析】A.羊毛的主要成分为蛋白质,灼烧时有烧焦的羽毛气味;
B.过氧化钠与水或二氧化碳反应生成氧气;
C.碳酸钡可溶于盐酸;
D.晶体硅常用作半导体材料.
7.【答案】
D
【解析】【解答】①氯气与水反应是可逆反应,则将1mol氯气通入一定量水中发生反应转移电子数小于NA
,
不符合题意;②硫酸氢钠熔融时电离出钠离子和硫酸氢根离子,则12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
,
符合题意;③在标准状况下辛烷不是气态,不能适用于气体摩尔体积,则22.4L辛烷中的分子数不是NA
,
不符合题意;④1mol羟基中含有的电子数为9NA
,
不符合题意;⑤氧化钠与过氧化钠中阴、阳离子的个数之比均是1:2,则1molNa2O和Na2O2混合物中含有的阴、阳离子总数均是3NA
,
符合题意;
故答案为:D。
【分析】阿伏伽德罗常数,为热学常量,符号NA,它的数值为:6.022
141
29
±0.000
000
27×10??,一般计算时取6.02×10??或6.022×10??。它的正式的定义是0.012kg碳12中包含的碳12的原子的数量。
8.【答案】
D
【解析】【解答】A.干燥氯气不能使有色布条褪色,湿润的有色布条褪色,说明氯气本身无漂白作用,氯气与水反应产生的物质有漂白作用,A不符合题意;
B.Cl2是有毒气体,为达到闻气味的目的,同时避免中毒现象,应该在集气瓶口用手轻轻煽动,仅使少量气体分子飘入鼻孔,达到闻气体气味的目的,B不符合题意;
C.Cl2具有强氧化性,在点燃情况下可以与不活泼金属Cu发生燃烧反应,生成棕黄色的烟,该物质是CuCl2
,
C不符合题意;
D.向盛有Cl2的烧瓶中滴入NaOH溶液,若二者发生反应,导致烧瓶内气体减少,气压降低,气球内部与外界大气相同,空气会进入气球中,使气球鼓起胀大,D符合题意;
故答案为:D。
【分析】氢氧化钠溶液和氯气反应,消耗氯气,导致烧瓶内部气压变小,外部大气压进入气球,导致气球变大
9.【答案】
D
【解析】【解答】①CH3-CH=CH2和CH2=CH2的最简式的是CH2
,
二者的最简式相同,故①符合题意;
②CH≡CH和C6H6的最简式的是CH,所以二者的含碳量相同,故②符合题意;
③丁二烯和丁烯中碳碳双键的数目不同,二者不是同系物,故③不符合题意;
④正戊烷、异戊烷、新戊烷分子中含有的碳原子数目,含有的支链逐渐增多,则它们的沸点逐渐变低,故④符合题意;
⑤标准状况下,戊烷的状态不是气体,题中条件无法计算11.2L的戊烷的物质的量,故⑤不符合题意;
⑥能够快速、微量、精确的测定相对分子质量的物理方法是质谱法,而核磁共振谱法可确定有机物中H的种类,故⑥不符合题意;
根据以上分析,错误的有:③⑤⑥,
故答案为:D。
【分析】①
都是属于单烯烃,最简式相同?
②最简式相同,其含氢量和含碳量是相同?
?③结构不同不是同系物
④碳原子相同,支链越多沸点越低?
?
?⑤
使用摩尔体积时,需要注意物质的状态和条件?
⑥相对分子质量的测定时采用质谱法,核磁共振氢谱可以测定氢的种类
10.【答案】A
【解析】【解答】解:A.Na2SO4溶液和MgCl2溶液,不反应,故A选;
B.Na2CO3溶液和稀硫酸,反应生成气体,可发生离子反应,故B不选;
C.NaOH溶液和Fe(SO4)3溶液,可发生离子反应生成沉淀,故C不选;
D.Ca(OH)2溶液和盐酸可发生离子反应生成盐和水,故D不选;
故选A.
【分析】A.二者混合不生成沉淀、气体、水等;
B.反应生成二氧化碳;
C.反应生成氢氧化铁沉淀;
D.反应生成氯化钙和水.
11.【答案】
B
【解析】【分析】2NO+O2=2NO2
,
11.2L一氧化氮和11.2L氧气混合后生成二氧化氮11.2L同时氧气过量5.6L,但二氧化氮与四氧化二氮存在平衡:2NO2N2O4
,
所以混合气体体积应介于11.2L~16.8L之间,B错误;2Na2O2+2H2O=4NaOH+O2↑反应中过氧化钠既是氧化剂又是还原剂,每生成1mol氧气转移电子数2mol,C正确;2Al+2NaOH+2H2O=2NaAlO2+3H2↑反应中1mol铝参加反应转移电子数3mol,常温常压下1mol气体体积大于3.36L,A正确。二氧化碳分子中碳原子最外层4个电子与氧原子最外层4个电子形成两个碳碳双键,成键电子数为8,D正确。
【点评】常温常压下,22.4L气体物质的量小于1mol。
12.【答案】
D
【解析】【解答】注意物质的量相关计算公式的熟练应用。
A中考查物质的量浓度概念,由N=n×NA和n
=
C×V可得,光由已知浓度不能确定溶液中微粒个数,应该还要给出溶液的体积才可以计算,所以A错误;B,要先求出一个CH3+中电子数为6+3-1=8个,所以1molCH3+(碳正离子)中含有电子数为8NA;C中标准状况下,
NO和O2混合会发生反应2NO+
O2==2NO2
,
所以气体的体积不是22.4
L,应为0.75×22.4
L,C错误;D中白磷分子为P4
,
12.4g白磷的物质的量为0.1mol,所以含有磷原子数为0.4NA
,
D正确。
【分析】学生要熟悉以物质的量为中心的计算公式,并进行细心计算
13.【答案】
A
【解析】【分析】设Na2O2、HCl和Al2O3的物质的量分别是a、b、c。则有关的反应方程式是2Na2O2+2H2O=4NaOH+O2↑、NaOH+HCl=NaCl+H2O、2NaOH+Al2O3=2NaAlO2+H2O。由于最后所得溶液中只含AlO、Na+、Cl-
,
所以2a=b+2c。根据选项中的数据可知,A是正确的,其余都是不可能的,答案选A。
【点评】该题的关键是根据反应的方程式,得出三种物质的物质的量之间的某种关系,然后借助于数学上的排除法,进行筛选即可。
14.【答案】
D
【解析】【解答】A.氯气溶于水生成次氯酸,次氯酸为弱酸,生成的次氯酸根离子会水解,因此
时,溶液中的含氯微粒除了
和
,还有次氯酸,A项不符合题意;
B.
在t2时刻才开始生成,因此
时,发生的离子反应是:
,
时,发生的离子反应是:
,B项不符合题意;
C.由B选项中的方程式
,结合电荷守恒,有
,但是题中没给出t3时的pH,无法确定氢离子和氢氧根离子的浓度大小,因此无法确定
和
的大小,C项不符合题意;
D.
时,溶液中的含氯微粒只有氯离子和
,则
时的总反应可表示为:
,由起始时氯气的物质的量为0.12mol可知
时,溶液中含NaCl
0.20mol,D项符合题意;
故答案为:D。
【分析】A.氯水中存在Cl2+H2O
Cl-+H++HClO,HClOH++ClO-,因此即可找出含氯微粒
B.根据图示,即可判断是分段反应,1-t1,t1-t2发生的两个反应
C.t3时,根据电荷守恒以及物料守恒即可判断
D.根据最终的反应物写出反应方程式即可写出方程式,根据数据计算
15.【答案】
C
【解析】【解答】相同状况(同温同压)下,同一真空瓶所充空气、气体A的体积相等。据阿伏加德罗定律,它们的物质的量相等,故
,得M(A)=
,则Mr(A)=
,C符合题意;
故答案为:C
【分析】同一真空瓶内,气体体积相同,则其物质的量相同,据此进行计算。
二、综合题
16.【答案】
(1)d;e;b;c;g;h;e;d;f
(2)饱和食盐水
(3)检查装置的气密性
(4)盐酸浓度小,反应没发生;装置漏气;e
与
f
连接
(5)Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O
【解析】【解答】解:(1)实验装置的连接顺序,遵循“发生装置﹣除杂装置﹣性质检验装置﹣气体收集装置﹣尾气处理装置”,故其连接顺序为:a接(d)、(e)接(b或c)、(c或b)接(g)、(h)接(e)、(d)接(f),
故答案为:d;e;b;c;g;h;e;d;f;(2)U型管中的无水CaCl
2
的作用主要是吸收水蒸气,因此可用盛饱和食盐水的洗气瓶除去氯化氢,所以洗气瓶中所装液体是饱和食盐水,故答案为:饱和食盐水;(3)对于有气体生成的装置,实验进行前都应对装置的气密性进行检查,故答案为:检查装置的气密性;(4)对于气体的收集,若反应后无法收集到气体,可从装置的气密性、反应的发生进行考虑,如酸的浓度小,装置漏气,或装置连接错误,
故答案为:盐酸浓度小,反应没发生;装置漏气;e
与
f
连接;(5)漂白粉与浓盐酸反应制氯气的化学方程式为:Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O,故答案为:Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O.
【分析】(1)实验装置的连接顺序,遵循“发生装置﹣除杂装置﹣性质检验装置﹣气体收集装置﹣尾气处理装置”由此分析解答;(2)U型管中的无水CaCl
2
的作用主要是吸收水蒸气,因此可用盛饱和食盐水的洗气瓶除去氯化氢;(3)对于有气体生成的装置,实验进行前都应对装置的气密性进行检查或装置连接错误;(4)对于气体的收集,若反应后无法收集到气体,可从装置的气密性、反应的发生进行考虑;(5)漂白粉与浓盐酸反应制氯气的化学方程式为:Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O.
17.【答案】
(1)250mL容量瓶;1.0g
(2)偏大;偏小
(3)检漏;重新配制
【解析】【解答】(1)因为实验室没有230mL容量瓶,则需要选择250mL容量瓶、用天平称取NaOH固体的质量为0.1mol/L×0.25L×40g/mol=1.0g。答案为:250mL容量瓶;1.0g;(2)若趁热转移,定容并冷却后,溶液的体积偏小,溶液的浓度偏大;在洗涤烧杯和玻璃棒的过程中,若液体有损失,则容量瓶内溶质的质量偏小,溶液的浓度偏小。答案为:偏大;偏小;(3)使用容量瓶前,必须检查其是否漏液,所以进行的一步操作是检漏,若加蒸馏水时不慎超过刻度线,因为我们无法把多加入的纯水取出,所以处理方法是重新配制。答案为:检漏;重新配制。
【分析】配制一定物质的量浓度的溶液时,首先应选择容量瓶,根据所配溶液的体积,选择相同规格或稍大规格的容量瓶;称量氢氧化钠固体时,应放在小烧杯内;溶解并冷却到室温后的溶液,应全部转移入容量瓶,不能将溶质有点滴损失。
18.【答案】
(1)H;
(2)Cl2+H2O?HCl+HClO
【解析】【解答】(1)由分析可知,X为H,Y为O,O原子的原子结构示意图为:;
(2)Z的单质为Cl2
,
X2Y为H2O,二者反应生成HCl和HClO,反应的化学方程式为:Cl2+H2O?HCl+HClO;
【分析】“X元素原子核内无中子”则X为H;“Y元素原子核内有8个质子”则Y为O;“Z元素原子得到1个电子后与氩原子核外电子排布相同”则Z为Cl;据此作答。
19.【答案】
(1)CaCO3;CaSO3
(2)12
(3)NO2-+
NH4+=
N2↑+2H2O
(4)CO
(5)C
【解析】【解答】(1)根据分析,固体
1
的主要成分有
Ca(OH)2、CaCO3、CaSO3;
(2)
需要配制100mL
3.00mol·L-1NaOH溶液,所需质量m=C·V·M=3.00mol·L-1×0.1L×40
g·mol-1=12g;
(3)用
NaNO2
溶液处理含NH4+废水,二者发生归中反应,氮元素最终都以氮气形式存在,反应的离子方程式为:NO2-+
NH4+=
N2↑+2H2O;
(4)根据分析,捕获剂从气体
3
中捕获的气体主要是CO;
(5)由2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,可知NO2-在酸性条件下可以氧化I-
,
生成的I2
可以使淀粉变蓝。故检验NO2-使用淀粉碘化钾试纸、白酒、水,故故答案为:C。
【分析】工业废气通过过量的石灰乳,除去CO2和SO2
,
生成CaCO3和CaSO3
,
气体1是NO
、CO
、N2
,
通入适量的空气,把NO转化为NO2
,
通过氢氧化钠溶液只得到NaNO2溶液,说明气体2是NO、NO2、N2
,
气体3是CO和N2
,
捕获产物是CO,得到的NaNO2溶液和含NH4+废水发生氧化还原反应,得到无污染的气体是氮气。
20.【答案】
(1);高
(2)2|5|3|1|5
(3)Fe;向溶液中滴入硫氰化钾溶液,若溶液变成血红色,则证明含有
Fe3+
(4)1.1
【解析】【解答】(1)、元素周期表中最活泼的非金属元素是F元素,与Ca形成化合物离子化合物D,所以D是CaF
2
,
其电子式为
;F与Si形成D的化合物E是SiF4
,
SiF4是共价化合物,所以D的沸点比E高;(2)该方程式中元素的化合价变化为:P→Ca3(PO4)2
,
磷元素由0价→+5价,一个磷原子失5个电子;
FeO→Fe,铁元素由+2价→0价,一个
FeO得2个电子,根据氧化还原反应中得失电子数相等,所以其最小公倍数为10,故
P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为:2P+5FeO+3CaO
Ca3(PO4)2+5Fe;(3)根据题意知M(OH)n为请氧化铁,Mn+为Fe
3+
,
Fe
3+
的检验方法是:向溶液中加入KSCN溶液后,溶液变成血红色就说明原溶液有Fe
3+
,
发生反应的离子方程式为Fe+3SCN-=Fe(SCN)3。(4)224mLH2的物质的量为
=0.01mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为
=0.01mol,样品中CaO质量分数为3.5%,故氧化钙的质量为1.6g×3.5%=0.056g,故氧化钙的物质的量为
=0.001mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.01mol+0.001mol=0.011mol,碳酸钙的质量为0.011mol×100g/mol=1.1g。
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
(
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
)
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
【分析】(1)结合元素周期表判断出D,用小黑点表示电子写出电子式;根据化合物的类型判断其沸点;
(2)根据氧化还原反应得失电子守恒结合原子守恒进行配平;
(3)根据其反应现象进行分析;根据三价铁离子的检验方法进行解答;
(4)先计算出氢气的物质的量,再根据电子守恒计算出钙的物质的量,进而计算出氧化钙的物质的量。根据反应后溶液中的钙离子守恒得出碳酸钙的物质的量,进而即可得出碳酸钙的质量。
一、单选题(共15题)
1.某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl
3种固体原料的物质的量之比为1:4:8。若配制该营养液,取428gNH4Cl,则需要KCl和K2SO4的质量分别为(???
)
A.?53.5g和214g?????????????????????B.?74.5g和348g??????????????C.?74.5g和696g??
???????????????????D.?149g和696g
2.标准状况下1
mol
H2的体积约为(??
)
A.?11.2
L?????????????????????????????????B.?22.4
L?????????????????????????????????C.?33.6
L?????????????????????????????????D.?44.8
L
3.血液化验单中“葡萄糖”一项的结果为4.94×10﹣3
mol?L﹣1
.
这里的“4.94×10﹣3
mol?L﹣1”表示葡萄糖的(?
)
A.?物质的量?????????????????????????B.?摩尔质量?????????????????????????C.?质量分数?????????????????????????D.?物质的量浓度
4.下列说法正确的是(??
)
A.?Na2O2与水反应生成标准状况下1.12LO2转移电子数为0.2NA
B.?标准状况下,0.56L丙烷含共价键数为0.2NA
C.?标准状况下,2.24LSO2与足量氧气充分反应生成SO3分子数为0.1NA
D.?14g乙烯和丙烯混合气体中氢原子数为2NA
5.下列对于“摩尔”的理解正确的是(??
)
A.?摩尔是国际科学界建议采用的一种物理量
B.?摩尔可以把物质的宏观数量与微观粒子的数量联系起来
C.?摩尔是物质的量的单位,简称摩,符号为mol
D.?国际上规定,0.012kg碳原子所含有的碳原子数目为1摩
6.下列说法不正确的是(??
)
A.?可用灼烧的方法鉴别纯羊毛和合成纤维
B.?过氧化钠可作为潜水艇里的氧气来源
C.?碳酸钡悬浊液可用作胃部X
射线透视的“钡餐”
D.?硅的导电性介于导体和绝缘体之间,晶体硅可用作半导体材料
7.设NA表示阿伏加德罗常数的值。下列说法均错误的是()
①将1mol氯气通入一定量水中发生反应转移电子数为NA
②12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
③在标准状况下,22.4L辛烷中的分子数为NA
④1mol羟基中含有的电子数为10NA
⑤1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
A.?②③⑤????????????????????????????????B.?①②④????????????????????????????????C.?③④⑤????????????????????????????????D.?①③④
8.某同学用下列装置进行有关Cl2的实验。下列说法错误的是(
??)
A.?证明氯气无漂白作用,氯水有漂白作用
B.?闻Cl2的气味
C.?生成棕黄色的烟
D.?若气球干瘪,证明Cl2可与NaOH反应
9.下列说法都错误的是(??
)
①、CH3-CH=CH2和CH2=CH2的最简式相同
②、CH≡CH和C6H6含碳量相同
③、丁二烯和丁烯为同系物
④、正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤、标准状况下,11.2L的戊烷所含的分子数为0.5
NA
(NA为阿伏加德罗常数)
⑥、能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法
A.?①
②
⑥?????????????????????????????B.?②
③
④?????????????????????????????C.?②
③
⑥?????????????????????????????D.?③
⑤
⑥
10.下列物质相互混合后,不会发生离子反应的是(??
)
A.?Na2SO4溶液和MgCl2溶液?????????????????????????????????B.?Na2CO3溶液和稀硫酸
C.?NaOH溶液和Fe(SO4)3溶液????????????????????????????D.?Ca(OH)2溶液和盐酸
11.设NA代表阿伏加德罗常数的值,下列叙述不正确的是
(??
)
A.?常温常压下,0.l
NA个Al与足量氢氧化钠溶液反应生成的H2体积大于3.36
L
B.?标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA
C.?常温常压下,Na2O2与足量H2O反应,共生成1molO2
,
转移电子的数目为2
NA
D.?4.4g
CO2所含有的成键电子数约为0.8NA
12.用NA表示阿伏加德罗常数,下列叙述中正确的是(??)
A.?0.1mol·L-1稀硫酸中含有硫酸根离子个数为0.1NA
B.?1molCH3+(碳正离子)中含有电子数为10NA
C.?标准状况下,0.5NA个NO和0.5NA个O2混合气体的体积约为22.4
L
D.?12.4g白磷中含有磷原子数为0.4NA
13.Na2O2、HCl和Al2O3在水中反应,若最后所得溶液中只含AlO2-、Na+、Cl-
,
则Na2O2、HCl和Al2O3的物质的量之可能为(???)
A.?4∶6∶1??????????????????????????????B.?8∶6∶1??????????????????????????????C.?3∶3∶1??????????????????????????????D.?4∶6∶3
14.某温度下,向浓氯水(由0.12mol氯气溶于水配制而成)中,以恒定速率滴入NaOH溶液,溶液中
和
的物质的量与时间t的关系曲线如图:
下列说法正确的是(
??)
A.?
时,溶液中的含氯微粒为:
、
B.?
时,发生的离子反应是:
C.?
时,溶液中存在如下关系:
D.?
时,溶液中含NaCl
0.20mol
15.有一真空瓶质量为m1
,
该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3
,
则A的相对分子质量是(
??)
A.?
???????????????????????????B.?
???????????????????????????C.?
???????????????????????????D.?
二、综合题(共5题)
16.已知漂白粉与浓盐酸反应可产生氯气,某同学试图测定氯气的体积并验证干
燥纯净的氯气无漂白性,现有如下装置,请回答:
(1)请用字母填写装置的连接顺序:
a
接________,________接________,________接________,________接________,
________接________.
(2)洗气瓶中所装液体是________.
(3)在制氯气前,必须进行的一项操作步骤是________.
(4)某同学实验时,发现量筒中未收集到液体,则失败的原因可能是________.
(5)写出漂白粉与浓盐酸反应制氯气的化学方程式________.
17.化学实验是化学学习的重要内容。根据你掌握的知识,完成下面内容。实验室需要配制0.1
mol·L-1NaOH溶液230mL,请回答下列问题:
(1)所需的玻璃仪器除烧杯、量筒、玻璃棒和胶头滴管之外,还需要________、用天平称取________gNaOH。
(2)溶解NaOH后的溶液需冷却到室温后方能转移入容量瓶中。若趁热转移定容会使溶液的浓度________(填“偏大”或“偏小”,下同);在洗涤烧杯和玻璃棒的过程中,每次洗涤液均需注入容量瓶,不能损失点滴液体,否则会导致溶液的浓度________。
(3)使用容量瓶前必须进行的一步操作是________,若加蒸馏水时不慎超过刻度线,处理方法是________
18.有X、Y、Z、三种元素,X元素原子核内无中子,Y元素原子核内有8个质子,Z元素原子得到1个电子后与氩原子核外电子排布相同。
(1)写出X元素符号________,画出Y元素的原子结构示意图________。
(2)写出Z单质与X2Y反应化学方程式________。
19.氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含
NH4+废水和工业废气(主要含
NO、CO、CO2、SO2、N2)的流程如图:
已知:NO+NO2+2NaOH=2NaNO2+H2O??
2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)固体
1
的主要成分有
Ca(OH)2、________、________(填化学式)。
(2)若实验室需要配制100mL
3.00mol·L-1NaOH溶液进行模拟测试,需用托盘天平称取
NaOH固体质量为________g。
(3)用
NaNO2
溶液处理含NH4+废水反应的离子方程式为________。
(4)捕获剂从气体
3
中捕获的气体主要是________
(填化学式)。
(5)流程中生成的
NaNO2
因外观和食盐相似,又有咸味,容易使人误食中毒。已知
NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2
可以使淀粉变蓝。根据上述反应,
选择生活中常见的物质和有关试剂进行实验,以鉴别
NaNO2
和
NaCl。需选用的物质是_____________________(填序号)。
①水???
②淀粉碘化钾试纸???
③淀粉???
④白酒???
⑤白醋
A.①③⑤
B.①②④
C.①②⑤
D.①②③⑤
20.金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO.
(1)Ca与最活跃的非金属元素A形成化合物D,D的电子式为________,D的沸点比A与
形成的化合物E的沸点________.(填“高”或“低”)
(2)配平用钙线氧脱鳞的化学方程式:__P+
__FeO+__CaO
__Ca3(PO4)2+__Fe
(3)将钙线试样溶于稀盐酸后,加入过量
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
.则金属M为________(填元素符号);检测溶液中含有
的方法是________.
(4)取1.6g钙线试样,与水充分反映,生成224mL
(标准状况),在此溶液中通入适量的
,最多能得到
________g.
答案解析部分
一、单选题
1.【答案】
C
【解析】【解答】428gNH4Cl的物质的量为8mol;KCl、K2SO4、NH4Cl三种固体原料的物质的量之比为1∶4∶8;所以需要KCl
1mol,质量为74.5g、需要K2SO4
4mol,质量为696g,C符合题意。
故答案为:C
【分析】先求得NH4Cl的物质的量,再根据KCl、K2SO4、NH4Cl三种固体原料的物质的量之比,求得KCl、K2SO4物质的量,根据公式n=m/M,求得KCl、K2SO4的质量。
2.【答案】
B
【解析】【解答】标况下,气体摩尔体积为22.4L/mol,1molH2的体积为22.4L;B符合题意,
故答案为:B。
【分析】根据标准状况下,气体摩尔体积为22.4L/mol解答;
3.【答案】
D
【解析】【解答】解:4.94×10﹣3
mol/L表示1L溶液中含有溶质葡萄糖的物质的量为4.94×10﹣3
mol,为单位体积的溶液中含有溶质的物质的量,该浓度是物质的量浓度.
故选:D.
【分析】4.94×10﹣3
mol/L表示1L溶液中含有溶质葡萄糖的物质的量为4.94×10﹣3
mol,该浓度是物质的量浓度.
4.【答案】
D
【解析】【解答】A、过氧化钠与水反应时,氧元素的价态一半由-1价变为0价,一半降为-2价,故当生成标准状况下1.12LO2转移电子数为0.1NA
,
故A不符合题意;
B、
标准状况下,0.56L丙烷的物质的量是0.025mol,含共价键数为0.25NA
,
故B不符合题意;
C、SO2与氧气反应生成SO3的反应可逆,标准状况下,2.24LSO2与足量氧气充分反应生成SO3分子数小于0.1NA
,
故C不符合题意;
D、乙烯和丙烯的最简式都是
,14g乙烯和丙烯混合气体中氢原子数为
?,故D符合题意。
故答案为:D
【分析】阿伏伽德罗常数,为热学常量,符号NA。
它的精确数值为:6.02214076×10??,一般计算时取6.02×10??或6.022×10??。
5.【答案】
C
【解析】【解答】A.物质的量是一种物理量,摩尔是物质的量的单位,选项A不符合题意;
B.物质的量是连接宏观物质与微观粒子的桥梁,摩尔是物质的量的单位,选项B不符合题意;
C.物质的量是含有一定数目粒子的集体,单位是摩尔,简称摩,符号为mol,选项C符合题意;
D.碳原子指含有6个质子6个中子的原子,本选项未明确,选项D不符合题意;
故答案为:C。
【分析】根据摩尔的概念进行判断,注意物质的量与摩尔的关系和区别。
6.【答案】C
【解析】【解答】解:A.羊毛的主要成分为蛋白质,灼烧时有烧焦的羽毛气味,为蛋白质的特征性质,可用于鉴别,故A不选;
B.过氧化钠与水或二氧化碳反应生成氧气,可作为氧气的来源,故B不选;
C.碳酸钡可溶于盐酸,而钡离子有毒,应用硫酸钡,故C选;
D.硅是重要的半导体原料,导电性介于导体和绝缘体之间,可用用作半导体材料,故D不选.
故选C.
【分析】A.羊毛的主要成分为蛋白质,灼烧时有烧焦的羽毛气味;
B.过氧化钠与水或二氧化碳反应生成氧气;
C.碳酸钡可溶于盐酸;
D.晶体硅常用作半导体材料.
7.【答案】
D
【解析】【解答】①氯气与水反应是可逆反应,则将1mol氯气通入一定量水中发生反应转移电子数小于NA
,
不符合题意;②硫酸氢钠熔融时电离出钠离子和硫酸氢根离子,则12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
,
符合题意;③在标准状况下辛烷不是气态,不能适用于气体摩尔体积,则22.4L辛烷中的分子数不是NA
,
不符合题意;④1mol羟基中含有的电子数为9NA
,
不符合题意;⑤氧化钠与过氧化钠中阴、阳离子的个数之比均是1:2,则1molNa2O和Na2O2混合物中含有的阴、阳离子总数均是3NA
,
符合题意;
故答案为:D。
【分析】阿伏伽德罗常数,为热学常量,符号NA,它的数值为:6.022
141
29
±0.000
000
27×10??,一般计算时取6.02×10??或6.022×10??。它的正式的定义是0.012kg碳12中包含的碳12的原子的数量。
8.【答案】
D
【解析】【解答】A.干燥氯气不能使有色布条褪色,湿润的有色布条褪色,说明氯气本身无漂白作用,氯气与水反应产生的物质有漂白作用,A不符合题意;
B.Cl2是有毒气体,为达到闻气味的目的,同时避免中毒现象,应该在集气瓶口用手轻轻煽动,仅使少量气体分子飘入鼻孔,达到闻气体气味的目的,B不符合题意;
C.Cl2具有强氧化性,在点燃情况下可以与不活泼金属Cu发生燃烧反应,生成棕黄色的烟,该物质是CuCl2
,
C不符合题意;
D.向盛有Cl2的烧瓶中滴入NaOH溶液,若二者发生反应,导致烧瓶内气体减少,气压降低,气球内部与外界大气相同,空气会进入气球中,使气球鼓起胀大,D符合题意;
故答案为:D。
【分析】氢氧化钠溶液和氯气反应,消耗氯气,导致烧瓶内部气压变小,外部大气压进入气球,导致气球变大
9.【答案】
D
【解析】【解答】①CH3-CH=CH2和CH2=CH2的最简式的是CH2
,
二者的最简式相同,故①符合题意;
②CH≡CH和C6H6的最简式的是CH,所以二者的含碳量相同,故②符合题意;
③丁二烯和丁烯中碳碳双键的数目不同,二者不是同系物,故③不符合题意;
④正戊烷、异戊烷、新戊烷分子中含有的碳原子数目,含有的支链逐渐增多,则它们的沸点逐渐变低,故④符合题意;
⑤标准状况下,戊烷的状态不是气体,题中条件无法计算11.2L的戊烷的物质的量,故⑤不符合题意;
⑥能够快速、微量、精确的测定相对分子质量的物理方法是质谱法,而核磁共振谱法可确定有机物中H的种类,故⑥不符合题意;
根据以上分析,错误的有:③⑤⑥,
故答案为:D。
【分析】①
都是属于单烯烃,最简式相同?
②最简式相同,其含氢量和含碳量是相同?
?③结构不同不是同系物
④碳原子相同,支链越多沸点越低?
?
?⑤
使用摩尔体积时,需要注意物质的状态和条件?
⑥相对分子质量的测定时采用质谱法,核磁共振氢谱可以测定氢的种类
10.【答案】A
【解析】【解答】解:A.Na2SO4溶液和MgCl2溶液,不反应,故A选;
B.Na2CO3溶液和稀硫酸,反应生成气体,可发生离子反应,故B不选;
C.NaOH溶液和Fe(SO4)3溶液,可发生离子反应生成沉淀,故C不选;
D.Ca(OH)2溶液和盐酸可发生离子反应生成盐和水,故D不选;
故选A.
【分析】A.二者混合不生成沉淀、气体、水等;
B.反应生成二氧化碳;
C.反应生成氢氧化铁沉淀;
D.反应生成氯化钙和水.
11.【答案】
B
【解析】【分析】2NO+O2=2NO2
,
11.2L一氧化氮和11.2L氧气混合后生成二氧化氮11.2L同时氧气过量5.6L,但二氧化氮与四氧化二氮存在平衡:2NO2N2O4
,
所以混合气体体积应介于11.2L~16.8L之间,B错误;2Na2O2+2H2O=4NaOH+O2↑反应中过氧化钠既是氧化剂又是还原剂,每生成1mol氧气转移电子数2mol,C正确;2Al+2NaOH+2H2O=2NaAlO2+3H2↑反应中1mol铝参加反应转移电子数3mol,常温常压下1mol气体体积大于3.36L,A正确。二氧化碳分子中碳原子最外层4个电子与氧原子最外层4个电子形成两个碳碳双键,成键电子数为8,D正确。
【点评】常温常压下,22.4L气体物质的量小于1mol。
12.【答案】
D
【解析】【解答】注意物质的量相关计算公式的熟练应用。
A中考查物质的量浓度概念,由N=n×NA和n
=
C×V可得,光由已知浓度不能确定溶液中微粒个数,应该还要给出溶液的体积才可以计算,所以A错误;B,要先求出一个CH3+中电子数为6+3-1=8个,所以1molCH3+(碳正离子)中含有电子数为8NA;C中标准状况下,
NO和O2混合会发生反应2NO+
O2==2NO2
,
所以气体的体积不是22.4
L,应为0.75×22.4
L,C错误;D中白磷分子为P4
,
12.4g白磷的物质的量为0.1mol,所以含有磷原子数为0.4NA
,
D正确。
【分析】学生要熟悉以物质的量为中心的计算公式,并进行细心计算
13.【答案】
A
【解析】【分析】设Na2O2、HCl和Al2O3的物质的量分别是a、b、c。则有关的反应方程式是2Na2O2+2H2O=4NaOH+O2↑、NaOH+HCl=NaCl+H2O、2NaOH+Al2O3=2NaAlO2+H2O。由于最后所得溶液中只含AlO、Na+、Cl-
,
所以2a=b+2c。根据选项中的数据可知,A是正确的,其余都是不可能的,答案选A。
【点评】该题的关键是根据反应的方程式,得出三种物质的物质的量之间的某种关系,然后借助于数学上的排除法,进行筛选即可。
14.【答案】
D
【解析】【解答】A.氯气溶于水生成次氯酸,次氯酸为弱酸,生成的次氯酸根离子会水解,因此
时,溶液中的含氯微粒除了
和
,还有次氯酸,A项不符合题意;
B.
在t2时刻才开始生成,因此
时,发生的离子反应是:
,
时,发生的离子反应是:
,B项不符合题意;
C.由B选项中的方程式
,结合电荷守恒,有
,但是题中没给出t3时的pH,无法确定氢离子和氢氧根离子的浓度大小,因此无法确定
和
的大小,C项不符合题意;
D.
时,溶液中的含氯微粒只有氯离子和
,则
时的总反应可表示为:
,由起始时氯气的物质的量为0.12mol可知
时,溶液中含NaCl
0.20mol,D项符合题意;
故答案为:D。
【分析】A.氯水中存在Cl2+H2O
Cl-+H++HClO,HClOH++ClO-,因此即可找出含氯微粒
B.根据图示,即可判断是分段反应,1-t1,t1-t2发生的两个反应
C.t3时,根据电荷守恒以及物料守恒即可判断
D.根据最终的反应物写出反应方程式即可写出方程式,根据数据计算
15.【答案】
C
【解析】【解答】相同状况(同温同压)下,同一真空瓶所充空气、气体A的体积相等。据阿伏加德罗定律,它们的物质的量相等,故
,得M(A)=
,则Mr(A)=
,C符合题意;
故答案为:C
【分析】同一真空瓶内,气体体积相同,则其物质的量相同,据此进行计算。
二、综合题
16.【答案】
(1)d;e;b;c;g;h;e;d;f
(2)饱和食盐水
(3)检查装置的气密性
(4)盐酸浓度小,反应没发生;装置漏气;e
与
f
连接
(5)Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O
【解析】【解答】解:(1)实验装置的连接顺序,遵循“发生装置﹣除杂装置﹣性质检验装置﹣气体收集装置﹣尾气处理装置”,故其连接顺序为:a接(d)、(e)接(b或c)、(c或b)接(g)、(h)接(e)、(d)接(f),
故答案为:d;e;b;c;g;h;e;d;f;(2)U型管中的无水CaCl
2
的作用主要是吸收水蒸气,因此可用盛饱和食盐水的洗气瓶除去氯化氢,所以洗气瓶中所装液体是饱和食盐水,故答案为:饱和食盐水;(3)对于有气体生成的装置,实验进行前都应对装置的气密性进行检查,故答案为:检查装置的气密性;(4)对于气体的收集,若反应后无法收集到气体,可从装置的气密性、反应的发生进行考虑,如酸的浓度小,装置漏气,或装置连接错误,
故答案为:盐酸浓度小,反应没发生;装置漏气;e
与
f
连接;(5)漂白粉与浓盐酸反应制氯气的化学方程式为:Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O,故答案为:Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O.
【分析】(1)实验装置的连接顺序,遵循“发生装置﹣除杂装置﹣性质检验装置﹣气体收集装置﹣尾气处理装置”由此分析解答;(2)U型管中的无水CaCl
2
的作用主要是吸收水蒸气,因此可用盛饱和食盐水的洗气瓶除去氯化氢;(3)对于有气体生成的装置,实验进行前都应对装置的气密性进行检查或装置连接错误;(4)对于气体的收集,若反应后无法收集到气体,可从装置的气密性、反应的发生进行考虑;(5)漂白粉与浓盐酸反应制氯气的化学方程式为:Ca(ClO)2+4HCl═CaCl2+2Cl2↑+2H2O.
17.【答案】
(1)250mL容量瓶;1.0g
(2)偏大;偏小
(3)检漏;重新配制
【解析】【解答】(1)因为实验室没有230mL容量瓶,则需要选择250mL容量瓶、用天平称取NaOH固体的质量为0.1mol/L×0.25L×40g/mol=1.0g。答案为:250mL容量瓶;1.0g;(2)若趁热转移,定容并冷却后,溶液的体积偏小,溶液的浓度偏大;在洗涤烧杯和玻璃棒的过程中,若液体有损失,则容量瓶内溶质的质量偏小,溶液的浓度偏小。答案为:偏大;偏小;(3)使用容量瓶前,必须检查其是否漏液,所以进行的一步操作是检漏,若加蒸馏水时不慎超过刻度线,因为我们无法把多加入的纯水取出,所以处理方法是重新配制。答案为:检漏;重新配制。
【分析】配制一定物质的量浓度的溶液时,首先应选择容量瓶,根据所配溶液的体积,选择相同规格或稍大规格的容量瓶;称量氢氧化钠固体时,应放在小烧杯内;溶解并冷却到室温后的溶液,应全部转移入容量瓶,不能将溶质有点滴损失。
18.【答案】
(1)H;
(2)Cl2+H2O?HCl+HClO
【解析】【解答】(1)由分析可知,X为H,Y为O,O原子的原子结构示意图为:;
(2)Z的单质为Cl2
,
X2Y为H2O,二者反应生成HCl和HClO,反应的化学方程式为:Cl2+H2O?HCl+HClO;
【分析】“X元素原子核内无中子”则X为H;“Y元素原子核内有8个质子”则Y为O;“Z元素原子得到1个电子后与氩原子核外电子排布相同”则Z为Cl;据此作答。
19.【答案】
(1)CaCO3;CaSO3
(2)12
(3)NO2-+
NH4+=
N2↑+2H2O
(4)CO
(5)C
【解析】【解答】(1)根据分析,固体
1
的主要成分有
Ca(OH)2、CaCO3、CaSO3;
(2)
需要配制100mL
3.00mol·L-1NaOH溶液,所需质量m=C·V·M=3.00mol·L-1×0.1L×40
g·mol-1=12g;
(3)用
NaNO2
溶液处理含NH4+废水,二者发生归中反应,氮元素最终都以氮气形式存在,反应的离子方程式为:NO2-+
NH4+=
N2↑+2H2O;
(4)根据分析,捕获剂从气体
3
中捕获的气体主要是CO;
(5)由2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,可知NO2-在酸性条件下可以氧化I-
,
生成的I2
可以使淀粉变蓝。故检验NO2-使用淀粉碘化钾试纸、白酒、水,故故答案为:C。
【分析】工业废气通过过量的石灰乳,除去CO2和SO2
,
生成CaCO3和CaSO3
,
气体1是NO
、CO
、N2
,
通入适量的空气,把NO转化为NO2
,
通过氢氧化钠溶液只得到NaNO2溶液,说明气体2是NO、NO2、N2
,
气体3是CO和N2
,
捕获产物是CO,得到的NaNO2溶液和含NH4+废水发生氧化还原反应,得到无污染的气体是氮气。
20.【答案】
(1);高
(2)2|5|3|1|5
(3)Fe;向溶液中滴入硫氰化钾溶液,若溶液变成血红色,则证明含有
Fe3+
(4)1.1
【解析】【解答】(1)、元素周期表中最活泼的非金属元素是F元素,与Ca形成化合物离子化合物D,所以D是CaF
2
,
其电子式为
;F与Si形成D的化合物E是SiF4
,
SiF4是共价化合物,所以D的沸点比E高;(2)该方程式中元素的化合价变化为:P→Ca3(PO4)2
,
磷元素由0价→+5价,一个磷原子失5个电子;
FeO→Fe,铁元素由+2价→0价,一个
FeO得2个电子,根据氧化还原反应中得失电子数相等,所以其最小公倍数为10,故
P的计量数为2,FeO的计量数为5,其它元素根据原子守恒配平,所以该方程式为:2P+5FeO+3CaO
Ca3(PO4)2+5Fe;(3)根据题意知M(OH)n为请氧化铁,Mn+为Fe
3+
,
Fe
3+
的检验方法是:向溶液中加入KSCN溶液后,溶液变成血红色就说明原溶液有Fe
3+
,
发生反应的离子方程式为Fe+3SCN-=Fe(SCN)3。(4)224mLH2的物质的量为
=0.01mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为
=0.01mol,样品中CaO质量分数为3.5%,故氧化钙的质量为1.6g×3.5%=0.056g,故氧化钙的物质的量为
=0.001mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.01mol+0.001mol=0.011mol,碳酸钙的质量为0.011mol×100g/mol=1.1g。
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
)
(
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
)
(
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
【分析】(1)结合元素周期表判断出D,用小黑点表示电子写出电子式;根据化合物的类型判断其沸点;
(2)根据氧化还原反应得失电子守恒结合原子守恒进行配平;
(3)根据其反应现象进行分析;根据三价铁离子的检验方法进行解答;
(4)先计算出氢气的物质的量,再根据电子守恒计算出钙的物质的量,进而计算出氧化钙的物质的量。根据反应后溶液中的钙离子守恒得出碳酸钙的物质的量,进而即可得出碳酸钙的质量。
