2.2溶液组成的定量研究 同步练习 2021-2022学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.2溶液组成的定量研究 同步练习 2021-2022学年高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 147.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-28 20:51:36 | ||
图片预览



文档简介
专题二研究物质的基本方法第二单元溶液组成的定量研究课后练习2021-2022学年高中化学苏教版2019必修第一册
一、单选题(共17题)
1.将4g
NaOH溶解在10mL水中,再稀释成1L,从中取1mL,这1mL溶液的物质的量浓度为( )
A.?1mol?L﹣1?????????????????????B.?0.1mol?L﹣1?????????????????????C.?0.01mol?L﹣1?????????????????????D.?10mol?L﹣1
2.用固体样品配制—定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是(??
)
A.?称量??????B.?溶解???C.?转移溶液?????????D.?定容
3.高一入学体检时,小亮体检的血液化验单中,出现了如下图所示的体检指标。表示该体检指标的物理量是(
??)
A.?溶解度??????????????????????????B.?摩尔质量??????????????????????????C.?质量分数??????????????????????????D.?物质的量浓度
4.从1L1mol·L-1的KOH溶液中取出100mL,下面关于这100mL溶液的叙述错误的是(??
)
A.?物质的量浓度为0.1mol·L-1?????????????????????????????????B.?密度与原溶液相同
C.?含有KOH的物质的量为0.1mol????????????????????????????D.?溶质的质量分数与原溶液相同
5.小明体检的血液化验单中,葡萄糖为5.9mmol/L。表示该体检指标的物理量是(??
)
A.?溶解度(s)??????????????B.?物质的量浓度(c)???????????C.?质量分数(
)??????????????D.?摩尔质量(M)
6.下列关于容量瓶的使用方法中,正确的是(??
)
A.?使用前要检查是否漏水???????????????????????????????????????B.?溶液未经冷却即注入容量瓶中
C.?用漏斗向容量瓶中转移溶液????????????????????????????????D.?可以在容量瓶中直接溶解固体
7.硫酸铜水溶液呈酸性,属保护性无机杀菌剂,对人畜比较安全,其同石灰乳混合可得“波尔多”溶液。实验室里需用480
mL
0.10
mol/L的硫酸铜溶液,则应选用的容量瓶规格和称取溶质的质量分别为(
??)
A.?480
mL容量瓶,称取7.68
g硫酸铜
B.?480
mL容量瓶,称取12.0
g胆矾
C.?500
mL容量瓶,称取8.00
g硫酸铜
D.?500
mL容量瓶,称取12.5
g胆矾
8.下列操作会导致所配的溶液浓度偏高的是(??
)
A.?定容时仰视刻度线
B.?定容后摇匀、静置,发现液面低于刻度线,又加水至刻度线
C.?烧杯中的溶液未冷却至室温就将溶液移到容量瓶中
D.?容量瓶洗涤后仍有少量残留
9.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.?950mL,11.2g????????????B.?500mL,117g????????????C.?1000mL,117.0g????????????D.?任意规格,111.2g
10.某同学在配制500
mL
0.5
mol/L
NaOH溶液的实验过程中,除用到玻璃棒、烧杯、500mL容量瓶、量筒、胶头滴管、试剂瓶之外,还需要的主要仪器有(?????
)
A.?温度计?????????????????????????????????B.?天平?????????????????????????????????C.?蒸发皿?????????????????????????????????D.?酒精灯
11.某位同学在配制980mL
0.1mol/L
Na2CO3溶液的实验过程时,对该实验的有关叙述正确的是(??
)
A.?计算需要Na2CO3.10
H2O的质量为28.0
g
B.?用带游码的托盘天平称量时误用了“左码右物”方法,而导致所配溶液浓度偏低
C.?定容时,沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液的凹液面的最低处恰好与刻度线相切为止即可
D.?定容时,不慎加蒸馏水超过刻度线,在超量不多的情况下可以立即用胶头滴管将多余的水吸出
12.下列装置能达到实验目的的是
A.?图1:向容量瓶中转移溶液?????????????????????????????????B.?图2:验证木炭与浓硫酸的反应产物中含有
C.?图3:除去
中的少量
杂质?????????????????D.?图4:除去
中含有的少量
杂质
13.常温下,欲配制密度为1.1
g·cm-3、浓度为6
mol·L-1的稀盐酸,在体积为100
mL、密度为1.19
g·cm-3、浓度为12
mol·L-1的浓盐酸中需加蒸馏水(??
)
A.?200
mL??????????????????????????????B.?100
mL??????????????????????????????C.?101
mL??????????????????????????????D.?120
mL
14.如图表示配制一定物质的量浓度的NaCl溶液的部分操作示意图,其中有错误的是( )
A.?????????????????????????????B.?????????????????????????????C.?????????????????????????????D.?
15.下列说法错误的是(??
)
A.?1
mol
氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4
L
B.?1
mol臭氧和1.5
mol氧气含有相同的氧原子数
C.?等体积、浓度均为1
mol·L-1的磷酸和盐酸,H3PO4和HCl含有的氢元素质量之比为1∶1
D.?等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1∶6,氧原子数之比为1∶3
16.下列实验操作正确且能达到相应实验目的的是(???
)
A.?称量NaOH
固体
B.?配制100mL?
0.1mol/L
的H2SO4
溶液
C.?家里的食用胡麻油不小心混入了大量的水采取的分离方法
D.?提纯Fe(OH)3
胶体
17.NA代表阿伏加德罗常数的值,下列说法正确的是(??
)
A.?在常温常压下,11.2L氮气所含的原子数目为NA?????????????B.?1.7g氨气所含分子数目为0.1NA
C.?1L
1mol?L﹣1的Na2SO4溶液中含有Na+的个数为NA?????D.?2g氢气所含氢原子数目为NA
二、综合题(共3题)
18.我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸密度为119
g/cm3配制成250mL
0.1mol·L-1的盐酸溶液。
(1)在如图所示仪器中,配制上述溶液不需要的是________(填右图相应仪器的序号);
除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________,其作用按使用的先后顺序分别是________和________。
(2)根据计算,下列量程或规格中,本实验量筒应使用的是________;容量瓶应使用________。(在横线上填写相应的序号,否则无分,下同)
A、10mL????
B、100mL???
C、250mL????
D、500mL
(3)在容量瓶的使用方法中,下列操作正确的是_________________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1
~
2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(4)若定容后摇匀静置,发现凹液面低于刻度线,此时应该________________
A.直接转移到细口试剂瓶中??????????
B.再用胶头滴管加水,重新定容
C.将此溶液倒掉,重新配制??????????
D.直接贮存于容量瓶中
(5)假设配制时其他操作均正确,只出现以下某一情况,试判断所配制的溶液浓度相比于要求的值(即0.1
mol/L)如何。(a、偏高;b、偏低;c、无影响,在下列横线上填相应序号)
①容量瓶中有少量蒸馏水????????????????????????????????????
________
②稀释浓HCl时,没有冷却就立即转移到容量瓶中??????????????
________
③配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中????????????
________
④若定容时俯视,所配溶液的物质的量浓度????????????????????
________
19.84消毒液”能有效杀灭甲型H1N1等病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:含25%
NaClO、1000mL、密度1.19g?cm﹣3
,
稀释100倍(体积比)后使用.
请根据信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________?mol?L﹣1
.
(2)该同学取100mL该“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol?L﹣1(假设稀释后溶液密度为1.0g?cm﹣3).
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含25%
NaClO的消毒液.下列说法正确的是
??????
.
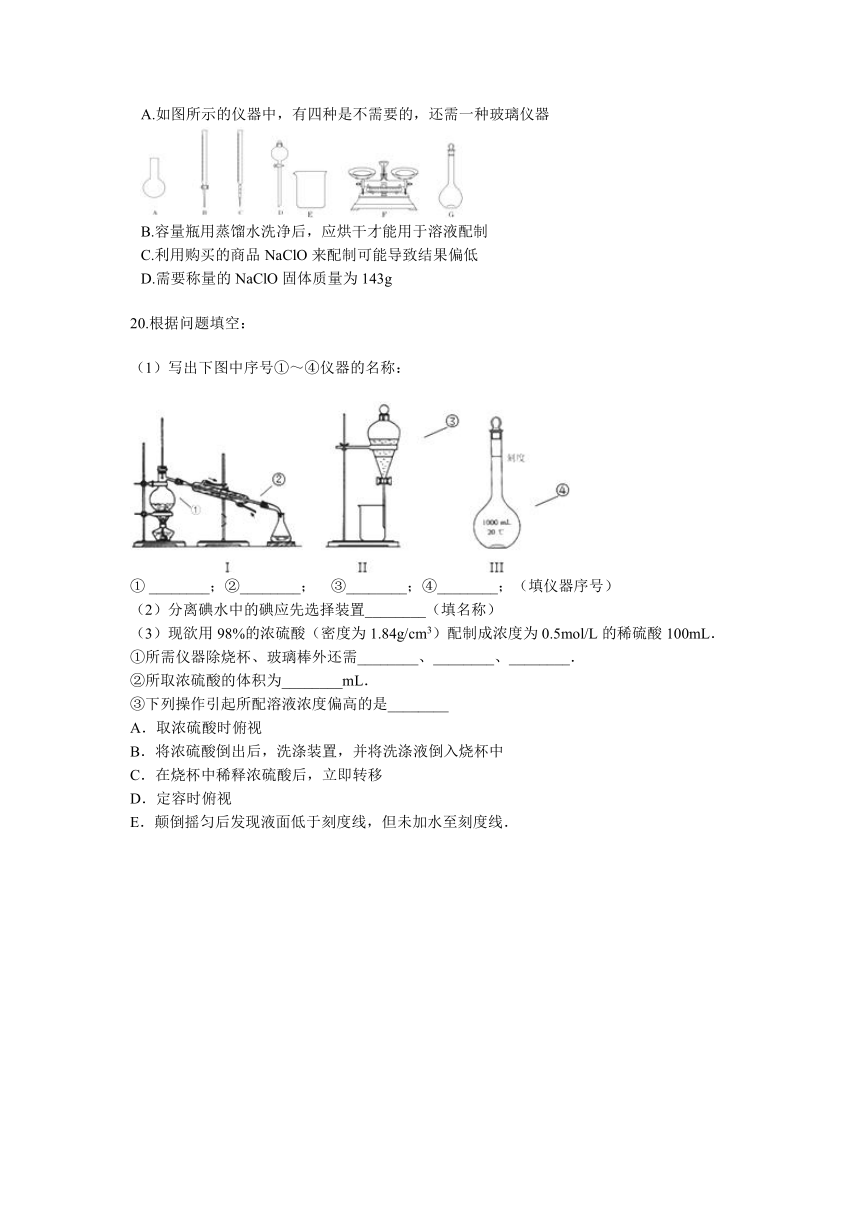
A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
20.根据问题填空:
(1)写出下图中序号①~④仪器的名称:
①
________;②________;??
③________;④________;(填仪器序号)
(2)分离碘水中的碘应先选择装置________(填名称)
(3)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸100mL.
①所需仪器除烧杯、玻璃棒外还需________、________、________.
②所取浓硫酸的体积为________mL.
③下列操作引起所配溶液浓度偏高的是________
A.取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D.定容时俯视
E.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线.
答案解析部分
一、单选题
1.【答案】
B
【解析】【解答】4gNaOH的物质的量=
=0.1mol,
稀释成1L的溶液后,氢氧化钠的物质的量浓度=
=0.1mol/L,
溶液是均匀的,从稀释后的1L溶液中取出10mL溶液,该10mL溶液与1L溶液的物质的量浓度相等为0.1mol/L,
故答案为:B.
【分析】根据计算NaOH溶液的物质的量浓度,再由溶液均一、稳定性判断其中一部分溶液的浓度即可.
2.【答案】
B
【解析】【解答】A.用天平称量药品,药品不能直接放在托盘内,天平称量应遵循“左物右码”,故A不符合题意;
B.固体溶解用玻璃棒搅拌,加速溶解,故B符合题意;
C.转移溶液时,应用玻璃棒引流,防止溶液洒落,故C不符合题意;
D.胶头滴管不能深入容量瓶内,应在容量瓶正上方,悬空滴加,故D不符合题意;
故答案为:B。
【分析】解决本题需要了解实验仪器的基本操作及注意事项
A中天平要左物右码
C中转移溶液要用玻璃棒引流
D中胶头滴管不能伸入容量瓶中
3.【答案】
D
【解析】【解答】A.溶解度的单位是g,不是mol/L,A不符合题意;
B.摩尔质量的单位为g/mol,B不符合题意;
C.质量分数是表示溶液组成的物理量,无单位,C不符合题意;
D.物质的量浓度是表示溶液组成的物理量,mmol/L是物质的量浓度的单位,D符合题意;
故答案为:D
【分析】mol/L为物质的量浓度的单位。
4.【答案】
A
【解析】【解答】A.取出后溶液浓度不变,仍然为1mo/L,故A不符合题意;
B.溶液具有均一性,取出溶液的密度与原溶液相同,故B符合题意;
C.取出的100mL溶液中含有KOH的物质的量为:1mol/L×0.1L=0.1mol,故C符合题意;
D.取出溶液的浓度不变,溶质质量分数与原溶液相同,故D符合题意;
故答案为:A。
【分析】从原溶液中取出的溶液与原溶液的性质完全相同,但溶质的物质的量减小,据此分析即可。
5.【答案】
B
【解析】【解答】5.9×10-3mmol?L-1表示1L溶液中含有溶质葡萄糖的物质的量为5.9×10-3mmol,为单位体积的溶液中含有溶质的物质的量,该浓度是物质的量浓度.
故答案为:B。
【分析】本题主要考查物质的量浓度的概念及表示方法。物质的量浓度是一种常用的溶液浓度的表示方法,据此进行分析。
6.【答案】
A
【解析】【解答】A.带有活塞的仪器使用前要检查是否漏水,A符合题意;
B.溶液未经冷却即注入容量瓶,冷却后溶液体积缩小,导致浓度偏大,B不符合题意;
C.用玻璃棒向容量瓶中转移溶液,C不符合题意;
D.应在烧杯中溶解固体,冷却至室温再转移到容量瓶,D不符合题意,
故答案为:A
【分析】A.容量瓶使用前需检漏;
B.移液前应使溶液恢复至室温;
C.移液时用玻璃棒引流即可;
D.容量瓶不能用于溶解、稀释;
7.【答案】
D
【解析】【解答】由于容量瓶的规格中没有480
mL,只能选择略大于所需溶液体积规格的容量瓶(即500
mL容量瓶),计算溶质的质量时按500
mL溶液计算,还要注意托盘天平的读数;保留一位小数。所以应选择500
mL容量瓶,称取8.0
g硫酸铜或12.5
g胆矾。D符合题意。
【分析】配制480ml溶液,根据容量瓶的规格需要选用500ml,根据m=nM=cvM计算质量,托盘天平保留小数点后一位。硫酸铜溶液配制需要注意称量的物质是CuSO4还是胆矾。
8.【答案】
C
【解析】【解答】解:A.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故A不选;
B.定容后摇匀、静置,发现液面低于刻度线,又加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故B不选;
C.烧杯中的溶液未冷却至室温就将溶液移到容量瓶中,冷却后,液面下降,溶液体积偏小,溶液浓度偏高,故C选;
D.容量瓶洗涤后仍有少量残留,对溶液体积和溶质的物质的量都不会产生影响,溶液浓度不变,故D不选;
故选:C.
【分析】分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=
进行误差分析,凡是使n偏大或者使V偏小的操作溶液浓度都将偏高,据此解答.
9.【答案】
C
【解析】【解答】实验室没有950mL的容量瓶,应用1000mL的容量瓶进行配制,
则n(NaCl)=1L×2mol/L=2mol,
m(NaCl)=2mol×58.5g/mol=117g,
故选C.
【分析】实验室没有950mL的容量瓶,应用1000mL的容量瓶进行配制,根据n=cV以及m=nM进行计算.
10.【答案】
B
【解析】【分析】正确答案:B
配制溶液过程中要称取10.0gNaOH,要用到托盘天平。
11.【答案】
B
【解析】【解答】解:A、根据无980ml容量瓶,故选用1000ml容量瓶,故配制出1000mL
0.1mol/L
Na2CO3溶液,则需要的Na2CO3的物质的量n=CV=1L×0.1mol/L=0.1mol,需要的Na2CO3.10
H2O物质的量也为0.1mol,故质量为m=nM=0.1mol×286g/mol=28.6g,故A错误;
B、当“左码右物”时,m物=m砝﹣m游
,
故所称量的固体的质量偏小,则浓度偏低,故B正确;
C、定容时开始可以直接向容量瓶中倒水,至凹液面离刻度线1~2cm时,要改用胶头滴管逐滴滴加,至凹液面与刻度线相切,故C错误;
D、加水超过刻度线时,用胶头滴管将多余的水吸出,吸出的不只是水,连溶质也会吸出,故必须重配,故D错误.
故选B.
【分析】A、根据无980ml容量瓶,故选用1000ml容量瓶,据此计算;
B、当“左码右物”时,m物=m砝﹣m游
,
据此分析;
C、定容时要使用胶头滴管;
D、加水超过刻度线时必须重配.
12.【答案】
C
【解析】【解答】
A.缺少玻璃棒引流,故A不符合题意;
B.
,二氧化碳、二氧化硫都会使澄清石灰水变浑浊,B不符合题意;
C.氯化氢和碳酸氢钠反应而除去,可以实现除杂的目的,故C符合题意;
D.主物质氯气也会被氢氧化钠吸收,不符合除杂的原则,故D不符合题意.
故答案为:C.
【分析】
A.配制一定的物质的量浓度的实验中称量-稀释-转移-洗涤-转移-定容-摇匀;
B.检验二氧化碳时要注意防止二氧化硫的干扰;
C.除杂三原则:杂质反应完全;主物质不反应;不引入新杂质;
D.氢氧化钠用于吸收酸性气体。
13.【答案】
C
【解析】【解答】设需要加入水的体积为VmL,依据溶液稀释前后溶质的物质的量、溶质的质量保持不变得:
×10-3L/
cm3×6
mol·L?1=100×10-3L×12
mol·L?1;解得:V=101mL;
故答案为:C。
【分析】本题考查了溶液的配制,解题关键是抓住稀释过程中溶质的物质的量保持不变,注意溶液体积的计算,溶液的体积不等于水的体积与浓盐酸的体积之和。
14.【答案】
C
【解析】【解答】A为溶解或稀释溶质,B为搅拌加速溶解,D为摇匀都正确.定容时眼睛与刻度线相平,不能俯视或仰视;定容时,眼睛仰视刻度线,溶液的液面超过刻度线,溶液的体积偏大,浓度偏小,
故选C.
【分析】图示分别为溶解、搅拌、读数和摇匀操作,根据规范操作找出错误.
15.【答案】
C
【解析】【解答】A、1mol氧气中含有氧原子数目为:1mol×2×6.02×1023=12.04×1023
,
根据标准状况下的气体摩尔体积,1mol气体的体积为22.4L,A不符合题意;
B、1
mol
O3含有3molO原子,1.5
mol
O2含有3molO原子,二者含有相同的氧原子数,B不符合题意;
C、根据H3PO4和HCl的组成,等体积、浓度均为1
mol·L-1的磷酸和盐酸,H3PO4和HCl含有的氢元素质量之比为3∶1,C符合题意;
D、干冰为固态CO2
,
根据CO2与C6H12O6的组成,等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1∶6,氧原子数之比为1∶3,D不符合题意。
故答案为:C。
【分析】阿伏伽德罗常数指的是1mol任何粒子所含有的粒子数目;气体摩尔体积指的是1mol任何气体所占的体积,气体摩尔体积的数值受温度和压强的影响。在标准状况下,气体摩尔体积为22.4L/mol。
16.【答案】
C
【解析】【解答】A.称量固体质量时,固体放左盘,砝码放右盘,由于NaOH固体易潮解,故不能放在滤纸上称量,应放在小烧杯中称量,选项错误,A不符合题意;
B.容量瓶只能用于配制溶液,不能用于溶解、稀释、储存溶液,选项错误,B不符合题意;
C.食用油和水不互溶,可用分液操作进行分离,选项正确,C符合题意;
D.胶体粒子和溶液中的粒子都能透过滤纸,不能用过滤分离,提纯胶体,应用半透膜,胶体粒子不能透过半透膜,而溶液中的粒子可以,选项错误,D不符合题意;
故答案为:C
【分析】A.根据称量操作进行分析;
B.容量瓶不能用于稀释;
C.油与水不互溶;
D.胶体的提纯应用渗析操作;
17.【答案】
B
【解析】【解答】解:A.常温常压下,Vm≠22.4L/mol,11.2L氮气物质的量不是0.5mol,无法计算含有的原子数,故A错误;
B.1.7g氨气的物质的量n=
=0.1mol,所含分子数为0.1mol×
=0.1NA
,
故B正确;
C.c(Na+)=2×1mol?L﹣1=2mol?L﹣1
,
N(Na+)=2mol?L﹣1×1L×
=2NA
,
故C错误;
D.2g氢气的物质的量是1mol,分子数是NA
,
原子数为2NA
,
故D错误;
故选B.
【分析】A.常温常压下,Vm≠22.4L/mol;
B.根据n=
计算;
C.c(Na+)=2×1mol?L﹣1=2mol?L﹣1
,
N(Na+)=c(Na+)×V×NA;
D.2g氢气的物质的量是1mol,分子数是NA
,
原子数为2NA
.
二、综合题
18.【答案】
(1)C;玻璃棒;搅拌;引流
(2)A;C
(3)A,E
(4)A
(5)c;a;b;a
【解析】【解答】
(1)配制成250mL?0.1mol?L-1的盐酸溶液操作步骤为:计算、量取、稀释、移液、洗涤、定容。用到的仪器:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管;在图所示仪器中用不到的是:分液漏斗;还缺少的是:玻璃棒;在浓盐酸稀释时用玻璃棒搅拌,转移液体时用玻璃棒引流。
故答案为:C;玻璃棒;搅拌;引流;
(2)质量分数为37%的浓盐酸(密度为1.19g/cm3)盐酸的物质的量浓度c=
=12.1mol/L,设需要浓盐酸体积V,依据溶液稀释过程溶质的物质的量不变得:V×12.1mol/L=0.1mol/L×250mL,解得V=2.1mL;所以需要选择10mL量筒量取;配制250mL溶液,应选择250mL容量瓶;
故答案为:A;C;
(3)A、容量瓶使用时,应先检查是否漏水,然后用蒸馏水洗涤干净即可,故A正确;
B、容量瓶洗净后不能用所配制溶液润洗,否则影响配制的溶液的浓度,故B错误;
C、容量瓶只能用来配制溶液,不能在容量瓶中溶解,应该在烧杯中溶解,故C错误;
D、容量瓶只能用来配制溶液,不能在容量瓶中稀释,应该在烧杯中稀释,故D错误;
E、摇匀时,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转,故E正确;
故答案为:AE;
(4)若定容后摇匀静置,发现凹液面低于刻度线,是因为部分溶液沾到瓶塞上,属于正常操作,溶液浓度准确,此时应该直接转移到细口试剂瓶中;
故答案为:A;
(5)①容量瓶中有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,故答案为:c;
②稀释浓HCl时,没有冷却就立即转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故答案为:a;
③配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中,将配制好的溶液稀释,溶液浓度偏低,故答案为:b;
④若定容时俯视,所配溶液的物质的量浓度,导致溶液体积偏小,溶液浓度偏高,故答案为:a;
故答案为:c;a;b;a。
【分析】(1)根据配制步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)先计算出所需的浓盐酸的体积,再根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,据此选择;
(3)A、容量瓶使用前要先检查是否漏液;
B、容量瓶不能润洗;
C、容量瓶不能用来溶解固体;
D、容量瓶不能用来稀释溶液;
E、定容完成后应摇匀,摇匀时盖好瓶盖,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次.
(4)定容摇匀后静置,发现凹液面低于线是正常的,不用采取任何措施;
(5)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
19.【答案】
(1)4.0
(2)0.04
(3)C
【解析】【解答】解:(1)则c(NaClO)=
=4.0
mol?L﹣1
,
故答案为:4.0;(2)根据稀释前后溶质的物质的量不变,则100
mL×4.0
mol?L﹣1=
×c(NaClO),
解得稀释后c(NaClO)≈0.04
mol?L﹣1
,
c(Na+)=c(NaClO)≈0.04
mol?L﹣1
,
故答案为:0.04;(3)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、C、D不需要,但还需玻璃棒和胶头滴管,故A错误;
B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D.应选取500
mL的容量瓶进行配制,然后取出480
mL即可,所以需要NaClO的质量:0.5
L×4.0
mol?L﹣1×74.5
g?mol﹣1=149
g,故D错误;
故答案为:C.
【分析】(1)根据含25%NaClO、1000mL、密度1.19g?cm﹣3
,
及根据c=
来计算;(2)根据稀释前后溶质的物质的量不变来计算;(3)根据溶液的配制及c=
、m=nM来计算、分析.
20.【答案】
(1)蒸馏烧瓶;冷凝管;分液漏斗;容量瓶
(2)分液漏斗
(3)量筒;100mL容量瓶;胶头滴管;2.7;BCD
【解析】【解答】解:(1)由图可知,①②③④分别为蒸馏烧瓶、冷凝管、分液漏斗,容量瓶;故答案为:蒸馏烧瓶;冷凝管;分液漏斗;容量瓶;(2)碘在有机溶剂中的溶解度较大,可用萃取分液的方法分离,选择装置分液漏斗,故答案为:分液漏斗;(3)①用浓溶液配制稀溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀和装瓶可知所需的仪器为量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故除烧杯、玻璃棒外还需量筒、100mL容量瓶和胶头滴管;
故答案为:量筒;100mL容量瓶;胶头滴管;②98%、密度为1.84g?cm﹣3的浓硫酸的物质的量浓度c=
?mol/L=18.4mol/L,设需要浓硫酸积为V,依据溶液稀释过程中溶质的物质的量不变则:
100mL×0.5mol/L=18.4mol/L×V,解得:V=2.7mL;
故答案为:2.7;③A.用量筒取浓硫酸时俯视,会导致量取的浓硫酸的体积偏小,则所配溶液的浓度偏小,故A错误;B.将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中,会导致所取的溶质的物质的量偏多,则溶液浓度偏高,故B正确;C.在烧杯中稀释浓硫酸后,立即转移,则待冷却后溶液体积偏小,浓度偏高,C正确;D.定容时俯视,则溶液体积偏小,浓度偏高,故D正确;E.颠倒摇匀后发现液面低于刻度线是正常的,未加水至刻度线是正确的,对浓度无影响,故E错误.故选BCD.
【分析】(1)由仪器结构图可知①为蒸馏烧瓶,②为冷凝管,③为分液漏斗,④为容量瓶,以此解答该题;(2)碘在有机溶剂中的溶解度较大,可用萃取分液的方法分离;(3)①根据用浓溶液配制稀溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀和装瓶来分析所需的仪器;②根据c=
计算浓硫酸的物质的量浓度,根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓硫酸的体积;③分析具体操作对n、V的影响,根据c=
分析不当操作对溶液浓度的影响.
一、单选题(共17题)
1.将4g
NaOH溶解在10mL水中,再稀释成1L,从中取1mL,这1mL溶液的物质的量浓度为( )
A.?1mol?L﹣1?????????????????????B.?0.1mol?L﹣1?????????????????????C.?0.01mol?L﹣1?????????????????????D.?10mol?L﹣1
2.用固体样品配制—定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是(??
)
A.?称量??????B.?溶解???C.?转移溶液?????????D.?定容
3.高一入学体检时,小亮体检的血液化验单中,出现了如下图所示的体检指标。表示该体检指标的物理量是(
??)
A.?溶解度??????????????????????????B.?摩尔质量??????????????????????????C.?质量分数??????????????????????????D.?物质的量浓度
4.从1L1mol·L-1的KOH溶液中取出100mL,下面关于这100mL溶液的叙述错误的是(??
)
A.?物质的量浓度为0.1mol·L-1?????????????????????????????????B.?密度与原溶液相同
C.?含有KOH的物质的量为0.1mol????????????????????????????D.?溶质的质量分数与原溶液相同
5.小明体检的血液化验单中,葡萄糖为5.9mmol/L。表示该体检指标的物理量是(??
)
A.?溶解度(s)??????????????B.?物质的量浓度(c)???????????C.?质量分数(
)??????????????D.?摩尔质量(M)
6.下列关于容量瓶的使用方法中,正确的是(??
)
A.?使用前要检查是否漏水???????????????????????????????????????B.?溶液未经冷却即注入容量瓶中
C.?用漏斗向容量瓶中转移溶液????????????????????????????????D.?可以在容量瓶中直接溶解固体
7.硫酸铜水溶液呈酸性,属保护性无机杀菌剂,对人畜比较安全,其同石灰乳混合可得“波尔多”溶液。实验室里需用480
mL
0.10
mol/L的硫酸铜溶液,则应选用的容量瓶规格和称取溶质的质量分别为(
??)
A.?480
mL容量瓶,称取7.68
g硫酸铜
B.?480
mL容量瓶,称取12.0
g胆矾
C.?500
mL容量瓶,称取8.00
g硫酸铜
D.?500
mL容量瓶,称取12.5
g胆矾
8.下列操作会导致所配的溶液浓度偏高的是(??
)
A.?定容时仰视刻度线
B.?定容后摇匀、静置,发现液面低于刻度线,又加水至刻度线
C.?烧杯中的溶液未冷却至室温就将溶液移到容量瓶中
D.?容量瓶洗涤后仍有少量残留
9.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.?950mL,11.2g????????????B.?500mL,117g????????????C.?1000mL,117.0g????????????D.?任意规格,111.2g
10.某同学在配制500
mL
0.5
mol/L
NaOH溶液的实验过程中,除用到玻璃棒、烧杯、500mL容量瓶、量筒、胶头滴管、试剂瓶之外,还需要的主要仪器有(?????
)
A.?温度计?????????????????????????????????B.?天平?????????????????????????????????C.?蒸发皿?????????????????????????????????D.?酒精灯
11.某位同学在配制980mL
0.1mol/L
Na2CO3溶液的实验过程时,对该实验的有关叙述正确的是(??
)
A.?计算需要Na2CO3.10
H2O的质量为28.0
g
B.?用带游码的托盘天平称量时误用了“左码右物”方法,而导致所配溶液浓度偏低
C.?定容时,沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液的凹液面的最低处恰好与刻度线相切为止即可
D.?定容时,不慎加蒸馏水超过刻度线,在超量不多的情况下可以立即用胶头滴管将多余的水吸出
12.下列装置能达到实验目的的是
A.?图1:向容量瓶中转移溶液?????????????????????????????????B.?图2:验证木炭与浓硫酸的反应产物中含有
C.?图3:除去
中的少量
杂质?????????????????D.?图4:除去
中含有的少量
杂质
13.常温下,欲配制密度为1.1
g·cm-3、浓度为6
mol·L-1的稀盐酸,在体积为100
mL、密度为1.19
g·cm-3、浓度为12
mol·L-1的浓盐酸中需加蒸馏水(??
)
A.?200
mL??????????????????????????????B.?100
mL??????????????????????????????C.?101
mL??????????????????????????????D.?120
mL
14.如图表示配制一定物质的量浓度的NaCl溶液的部分操作示意图,其中有错误的是( )
A.?????????????????????????????B.?????????????????????????????C.?????????????????????????????D.?
15.下列说法错误的是(??
)
A.?1
mol
氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4
L
B.?1
mol臭氧和1.5
mol氧气含有相同的氧原子数
C.?等体积、浓度均为1
mol·L-1的磷酸和盐酸,H3PO4和HCl含有的氢元素质量之比为1∶1
D.?等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1∶6,氧原子数之比为1∶3
16.下列实验操作正确且能达到相应实验目的的是(???
)
A.?称量NaOH
固体
B.?配制100mL?
0.1mol/L
的H2SO4
溶液
C.?家里的食用胡麻油不小心混入了大量的水采取的分离方法
D.?提纯Fe(OH)3
胶体
17.NA代表阿伏加德罗常数的值,下列说法正确的是(??
)
A.?在常温常压下,11.2L氮气所含的原子数目为NA?????????????B.?1.7g氨气所含分子数目为0.1NA
C.?1L
1mol?L﹣1的Na2SO4溶液中含有Na+的个数为NA?????D.?2g氢气所含氢原子数目为NA
二、综合题(共3题)
18.我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸密度为119
g/cm3配制成250mL
0.1mol·L-1的盐酸溶液。
(1)在如图所示仪器中,配制上述溶液不需要的是________(填右图相应仪器的序号);
除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________,其作用按使用的先后顺序分别是________和________。
(2)根据计算,下列量程或规格中,本实验量筒应使用的是________;容量瓶应使用________。(在横线上填写相应的序号,否则无分,下同)
A、10mL????
B、100mL???
C、250mL????
D、500mL
(3)在容量瓶的使用方法中,下列操作正确的是_________________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1
~
2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(4)若定容后摇匀静置,发现凹液面低于刻度线,此时应该________________
A.直接转移到细口试剂瓶中??????????
B.再用胶头滴管加水,重新定容
C.将此溶液倒掉,重新配制??????????
D.直接贮存于容量瓶中
(5)假设配制时其他操作均正确,只出现以下某一情况,试判断所配制的溶液浓度相比于要求的值(即0.1
mol/L)如何。(a、偏高;b、偏低;c、无影响,在下列横线上填相应序号)
①容量瓶中有少量蒸馏水????????????????????????????????????
________
②稀释浓HCl时,没有冷却就立即转移到容量瓶中??????????????
________
③配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中????????????
________
④若定容时俯视,所配溶液的物质的量浓度????????????????????
________
19.84消毒液”能有效杀灭甲型H1N1等病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:含25%
NaClO、1000mL、密度1.19g?cm﹣3
,
稀释100倍(体积比)后使用.
请根据信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________?mol?L﹣1
.
(2)该同学取100mL该“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol?L﹣1(假设稀释后溶液密度为1.0g?cm﹣3).
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含25%
NaClO的消毒液.下列说法正确的是
??????
.
A.如图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143g
20.根据问题填空:
(1)写出下图中序号①~④仪器的名称:
①
________;②________;??
③________;④________;(填仪器序号)
(2)分离碘水中的碘应先选择装置________(填名称)
(3)现欲用98%的浓硫酸(密度为1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸100mL.
①所需仪器除烧杯、玻璃棒外还需________、________、________.
②所取浓硫酸的体积为________mL.
③下列操作引起所配溶液浓度偏高的是________
A.取浓硫酸时俯视
B.将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中
C.在烧杯中稀释浓硫酸后,立即转移
D.定容时俯视
E.颠倒摇匀后发现液面低于刻度线,但未加水至刻度线.
答案解析部分
一、单选题
1.【答案】
B
【解析】【解答】4gNaOH的物质的量=
=0.1mol,
稀释成1L的溶液后,氢氧化钠的物质的量浓度=
=0.1mol/L,
溶液是均匀的,从稀释后的1L溶液中取出10mL溶液,该10mL溶液与1L溶液的物质的量浓度相等为0.1mol/L,
故答案为:B.
【分析】根据计算NaOH溶液的物质的量浓度,再由溶液均一、稳定性判断其中一部分溶液的浓度即可.
2.【答案】
B
【解析】【解答】A.用天平称量药品,药品不能直接放在托盘内,天平称量应遵循“左物右码”,故A不符合题意;
B.固体溶解用玻璃棒搅拌,加速溶解,故B符合题意;
C.转移溶液时,应用玻璃棒引流,防止溶液洒落,故C不符合题意;
D.胶头滴管不能深入容量瓶内,应在容量瓶正上方,悬空滴加,故D不符合题意;
故答案为:B。
【分析】解决本题需要了解实验仪器的基本操作及注意事项
A中天平要左物右码
C中转移溶液要用玻璃棒引流
D中胶头滴管不能伸入容量瓶中
3.【答案】
D
【解析】【解答】A.溶解度的单位是g,不是mol/L,A不符合题意;
B.摩尔质量的单位为g/mol,B不符合题意;
C.质量分数是表示溶液组成的物理量,无单位,C不符合题意;
D.物质的量浓度是表示溶液组成的物理量,mmol/L是物质的量浓度的单位,D符合题意;
故答案为:D
【分析】mol/L为物质的量浓度的单位。
4.【答案】
A
【解析】【解答】A.取出后溶液浓度不变,仍然为1mo/L,故A不符合题意;
B.溶液具有均一性,取出溶液的密度与原溶液相同,故B符合题意;
C.取出的100mL溶液中含有KOH的物质的量为:1mol/L×0.1L=0.1mol,故C符合题意;
D.取出溶液的浓度不变,溶质质量分数与原溶液相同,故D符合题意;
故答案为:A。
【分析】从原溶液中取出的溶液与原溶液的性质完全相同,但溶质的物质的量减小,据此分析即可。
5.【答案】
B
【解析】【解答】5.9×10-3mmol?L-1表示1L溶液中含有溶质葡萄糖的物质的量为5.9×10-3mmol,为单位体积的溶液中含有溶质的物质的量,该浓度是物质的量浓度.
故答案为:B。
【分析】本题主要考查物质的量浓度的概念及表示方法。物质的量浓度是一种常用的溶液浓度的表示方法,据此进行分析。
6.【答案】
A
【解析】【解答】A.带有活塞的仪器使用前要检查是否漏水,A符合题意;
B.溶液未经冷却即注入容量瓶,冷却后溶液体积缩小,导致浓度偏大,B不符合题意;
C.用玻璃棒向容量瓶中转移溶液,C不符合题意;
D.应在烧杯中溶解固体,冷却至室温再转移到容量瓶,D不符合题意,
故答案为:A
【分析】A.容量瓶使用前需检漏;
B.移液前应使溶液恢复至室温;
C.移液时用玻璃棒引流即可;
D.容量瓶不能用于溶解、稀释;
7.【答案】
D
【解析】【解答】由于容量瓶的规格中没有480
mL,只能选择略大于所需溶液体积规格的容量瓶(即500
mL容量瓶),计算溶质的质量时按500
mL溶液计算,还要注意托盘天平的读数;保留一位小数。所以应选择500
mL容量瓶,称取8.0
g硫酸铜或12.5
g胆矾。D符合题意。
【分析】配制480ml溶液,根据容量瓶的规格需要选用500ml,根据m=nM=cvM计算质量,托盘天平保留小数点后一位。硫酸铜溶液配制需要注意称量的物质是CuSO4还是胆矾。
8.【答案】
C
【解析】【解答】解:A.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故A不选;
B.定容后摇匀、静置,发现液面低于刻度线,又加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故B不选;
C.烧杯中的溶液未冷却至室温就将溶液移到容量瓶中,冷却后,液面下降,溶液体积偏小,溶液浓度偏高,故C选;
D.容量瓶洗涤后仍有少量残留,对溶液体积和溶质的物质的量都不会产生影响,溶液浓度不变,故D不选;
故选:C.
【分析】分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=
进行误差分析,凡是使n偏大或者使V偏小的操作溶液浓度都将偏高,据此解答.
9.【答案】
C
【解析】【解答】实验室没有950mL的容量瓶,应用1000mL的容量瓶进行配制,
则n(NaCl)=1L×2mol/L=2mol,
m(NaCl)=2mol×58.5g/mol=117g,
故选C.
【分析】实验室没有950mL的容量瓶,应用1000mL的容量瓶进行配制,根据n=cV以及m=nM进行计算.
10.【答案】
B
【解析】【分析】正确答案:B
配制溶液过程中要称取10.0gNaOH,要用到托盘天平。
11.【答案】
B
【解析】【解答】解:A、根据无980ml容量瓶,故选用1000ml容量瓶,故配制出1000mL
0.1mol/L
Na2CO3溶液,则需要的Na2CO3的物质的量n=CV=1L×0.1mol/L=0.1mol,需要的Na2CO3.10
H2O物质的量也为0.1mol,故质量为m=nM=0.1mol×286g/mol=28.6g,故A错误;
B、当“左码右物”时,m物=m砝﹣m游
,
故所称量的固体的质量偏小,则浓度偏低,故B正确;
C、定容时开始可以直接向容量瓶中倒水,至凹液面离刻度线1~2cm时,要改用胶头滴管逐滴滴加,至凹液面与刻度线相切,故C错误;
D、加水超过刻度线时,用胶头滴管将多余的水吸出,吸出的不只是水,连溶质也会吸出,故必须重配,故D错误.
故选B.
【分析】A、根据无980ml容量瓶,故选用1000ml容量瓶,据此计算;
B、当“左码右物”时,m物=m砝﹣m游
,
据此分析;
C、定容时要使用胶头滴管;
D、加水超过刻度线时必须重配.
12.【答案】
C
【解析】【解答】
A.缺少玻璃棒引流,故A不符合题意;
B.
,二氧化碳、二氧化硫都会使澄清石灰水变浑浊,B不符合题意;
C.氯化氢和碳酸氢钠反应而除去,可以实现除杂的目的,故C符合题意;
D.主物质氯气也会被氢氧化钠吸收,不符合除杂的原则,故D不符合题意.
故答案为:C.
【分析】
A.配制一定的物质的量浓度的实验中称量-稀释-转移-洗涤-转移-定容-摇匀;
B.检验二氧化碳时要注意防止二氧化硫的干扰;
C.除杂三原则:杂质反应完全;主物质不反应;不引入新杂质;
D.氢氧化钠用于吸收酸性气体。
13.【答案】
C
【解析】【解答】设需要加入水的体积为VmL,依据溶液稀释前后溶质的物质的量、溶质的质量保持不变得:
×10-3L/
cm3×6
mol·L?1=100×10-3L×12
mol·L?1;解得:V=101mL;
故答案为:C。
【分析】本题考查了溶液的配制,解题关键是抓住稀释过程中溶质的物质的量保持不变,注意溶液体积的计算,溶液的体积不等于水的体积与浓盐酸的体积之和。
14.【答案】
C
【解析】【解答】A为溶解或稀释溶质,B为搅拌加速溶解,D为摇匀都正确.定容时眼睛与刻度线相平,不能俯视或仰视;定容时,眼睛仰视刻度线,溶液的液面超过刻度线,溶液的体积偏大,浓度偏小,
故选C.
【分析】图示分别为溶解、搅拌、读数和摇匀操作,根据规范操作找出错误.
15.【答案】
C
【解析】【解答】A、1mol氧气中含有氧原子数目为:1mol×2×6.02×1023=12.04×1023
,
根据标准状况下的气体摩尔体积,1mol气体的体积为22.4L,A不符合题意;
B、1
mol
O3含有3molO原子,1.5
mol
O2含有3molO原子,二者含有相同的氧原子数,B不符合题意;
C、根据H3PO4和HCl的组成,等体积、浓度均为1
mol·L-1的磷酸和盐酸,H3PO4和HCl含有的氢元素质量之比为3∶1,C符合题意;
D、干冰为固态CO2
,
根据CO2与C6H12O6的组成,等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1∶6,氧原子数之比为1∶3,D不符合题意。
故答案为:C。
【分析】阿伏伽德罗常数指的是1mol任何粒子所含有的粒子数目;气体摩尔体积指的是1mol任何气体所占的体积,气体摩尔体积的数值受温度和压强的影响。在标准状况下,气体摩尔体积为22.4L/mol。
16.【答案】
C
【解析】【解答】A.称量固体质量时,固体放左盘,砝码放右盘,由于NaOH固体易潮解,故不能放在滤纸上称量,应放在小烧杯中称量,选项错误,A不符合题意;
B.容量瓶只能用于配制溶液,不能用于溶解、稀释、储存溶液,选项错误,B不符合题意;
C.食用油和水不互溶,可用分液操作进行分离,选项正确,C符合题意;
D.胶体粒子和溶液中的粒子都能透过滤纸,不能用过滤分离,提纯胶体,应用半透膜,胶体粒子不能透过半透膜,而溶液中的粒子可以,选项错误,D不符合题意;
故答案为:C
【分析】A.根据称量操作进行分析;
B.容量瓶不能用于稀释;
C.油与水不互溶;
D.胶体的提纯应用渗析操作;
17.【答案】
B
【解析】【解答】解:A.常温常压下,Vm≠22.4L/mol,11.2L氮气物质的量不是0.5mol,无法计算含有的原子数,故A错误;
B.1.7g氨气的物质的量n=
=0.1mol,所含分子数为0.1mol×
=0.1NA
,
故B正确;
C.c(Na+)=2×1mol?L﹣1=2mol?L﹣1
,
N(Na+)=2mol?L﹣1×1L×
=2NA
,
故C错误;
D.2g氢气的物质的量是1mol,分子数是NA
,
原子数为2NA
,
故D错误;
故选B.
【分析】A.常温常压下,Vm≠22.4L/mol;
B.根据n=
计算;
C.c(Na+)=2×1mol?L﹣1=2mol?L﹣1
,
N(Na+)=c(Na+)×V×NA;
D.2g氢气的物质的量是1mol,分子数是NA
,
原子数为2NA
.
二、综合题
18.【答案】
(1)C;玻璃棒;搅拌;引流
(2)A;C
(3)A,E
(4)A
(5)c;a;b;a
【解析】【解答】
(1)配制成250mL?0.1mol?L-1的盐酸溶液操作步骤为:计算、量取、稀释、移液、洗涤、定容。用到的仪器:量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管;在图所示仪器中用不到的是:分液漏斗;还缺少的是:玻璃棒;在浓盐酸稀释时用玻璃棒搅拌,转移液体时用玻璃棒引流。
故答案为:C;玻璃棒;搅拌;引流;
(2)质量分数为37%的浓盐酸(密度为1.19g/cm3)盐酸的物质的量浓度c=
=12.1mol/L,设需要浓盐酸体积V,依据溶液稀释过程溶质的物质的量不变得:V×12.1mol/L=0.1mol/L×250mL,解得V=2.1mL;所以需要选择10mL量筒量取;配制250mL溶液,应选择250mL容量瓶;
故答案为:A;C;
(3)A、容量瓶使用时,应先检查是否漏水,然后用蒸馏水洗涤干净即可,故A正确;
B、容量瓶洗净后不能用所配制溶液润洗,否则影响配制的溶液的浓度,故B错误;
C、容量瓶只能用来配制溶液,不能在容量瓶中溶解,应该在烧杯中溶解,故C错误;
D、容量瓶只能用来配制溶液,不能在容量瓶中稀释,应该在烧杯中稀释,故D错误;
E、摇匀时,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转,故E正确;
故答案为:AE;
(4)若定容后摇匀静置,发现凹液面低于刻度线,是因为部分溶液沾到瓶塞上,属于正常操作,溶液浓度准确,此时应该直接转移到细口试剂瓶中;
故答案为:A;
(5)①容量瓶中有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不受影响,故答案为:c;
②稀释浓HCl时,没有冷却就立即转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故答案为:a;
③配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中,将配制好的溶液稀释,溶液浓度偏低,故答案为:b;
④若定容时俯视,所配溶液的物质的量浓度,导致溶液体积偏小,溶液浓度偏高,故答案为:a;
故答案为:c;a;b;a。
【分析】(1)根据配制步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)先计算出所需的浓盐酸的体积,再根据“大而近”的原则,根据需要量取的浓硫酸的体积来选择合适的量筒;容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,据此选择;
(3)A、容量瓶使用前要先检查是否漏液;
B、容量瓶不能润洗;
C、容量瓶不能用来溶解固体;
D、容量瓶不能用来稀释溶液;
E、定容完成后应摇匀,摇匀时盖好瓶盖,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次.
(4)定容摇匀后静置,发现凹液面低于线是正常的,不用采取任何措施;
(5)根据c=
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
19.【答案】
(1)4.0
(2)0.04
(3)C
【解析】【解答】解:(1)则c(NaClO)=
=4.0
mol?L﹣1
,
故答案为:4.0;(2)根据稀释前后溶质的物质的量不变,则100
mL×4.0
mol?L﹣1=
×c(NaClO),
解得稀释后c(NaClO)≈0.04
mol?L﹣1
,
c(Na+)=c(NaClO)≈0.04
mol?L﹣1
,
故答案为:0.04;(3)A.需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、C、D不需要,但还需玻璃棒和胶头滴管,故A错误;
B.配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;
C.由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;
D.应选取500
mL的容量瓶进行配制,然后取出480
mL即可,所以需要NaClO的质量:0.5
L×4.0
mol?L﹣1×74.5
g?mol﹣1=149
g,故D错误;
故答案为:C.
【分析】(1)根据含25%NaClO、1000mL、密度1.19g?cm﹣3
,
及根据c=
来计算;(2)根据稀释前后溶质的物质的量不变来计算;(3)根据溶液的配制及c=
、m=nM来计算、分析.
20.【答案】
(1)蒸馏烧瓶;冷凝管;分液漏斗;容量瓶
(2)分液漏斗
(3)量筒;100mL容量瓶;胶头滴管;2.7;BCD
【解析】【解答】解:(1)由图可知,①②③④分别为蒸馏烧瓶、冷凝管、分液漏斗,容量瓶;故答案为:蒸馏烧瓶;冷凝管;分液漏斗;容量瓶;(2)碘在有机溶剂中的溶解度较大,可用萃取分液的方法分离,选择装置分液漏斗,故答案为:分液漏斗;(3)①用浓溶液配制稀溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀和装瓶可知所需的仪器为量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故除烧杯、玻璃棒外还需量筒、100mL容量瓶和胶头滴管;
故答案为:量筒;100mL容量瓶;胶头滴管;②98%、密度为1.84g?cm﹣3的浓硫酸的物质的量浓度c=
?mol/L=18.4mol/L,设需要浓硫酸积为V,依据溶液稀释过程中溶质的物质的量不变则:
100mL×0.5mol/L=18.4mol/L×V,解得:V=2.7mL;
故答案为:2.7;③A.用量筒取浓硫酸时俯视,会导致量取的浓硫酸的体积偏小,则所配溶液的浓度偏小,故A错误;B.将浓硫酸倒出后,洗涤装置,并将洗涤液倒入烧杯中,会导致所取的溶质的物质的量偏多,则溶液浓度偏高,故B正确;C.在烧杯中稀释浓硫酸后,立即转移,则待冷却后溶液体积偏小,浓度偏高,C正确;D.定容时俯视,则溶液体积偏小,浓度偏高,故D正确;E.颠倒摇匀后发现液面低于刻度线是正常的,未加水至刻度线是正确的,对浓度无影响,故E错误.故选BCD.
【分析】(1)由仪器结构图可知①为蒸馏烧瓶,②为冷凝管,③为分液漏斗,④为容量瓶,以此解答该题;(2)碘在有机溶剂中的溶解度较大,可用萃取分液的方法分离;(3)①根据用浓溶液配制稀溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀和装瓶来分析所需的仪器;②根据c=
计算浓硫酸的物质的量浓度,根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓硫酸的体积;③分析具体操作对n、V的影响,根据c=
分析不当操作对溶液浓度的影响.
