高中化学人教版(2019)必修第一册2.3物质的量(共59张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册2.3物质的量(共59张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-28 21:51:33 | ||
图片预览










文档简介
(共59张PPT)
第1课时
物质的量的单位——摩尔
小明是个奇怪的孩子,奇怪在他对物质的数目特别感兴趣,一天买了五公斤苹果,他想知道有几个?你有什么方法?有没有最快知道苹果数目的方法?
若他买的是五公斤大米,他还想知道大米的颗粒数?你又能帮他吗?
一瓶矿泉水里又有多少个水分子?
新课导入
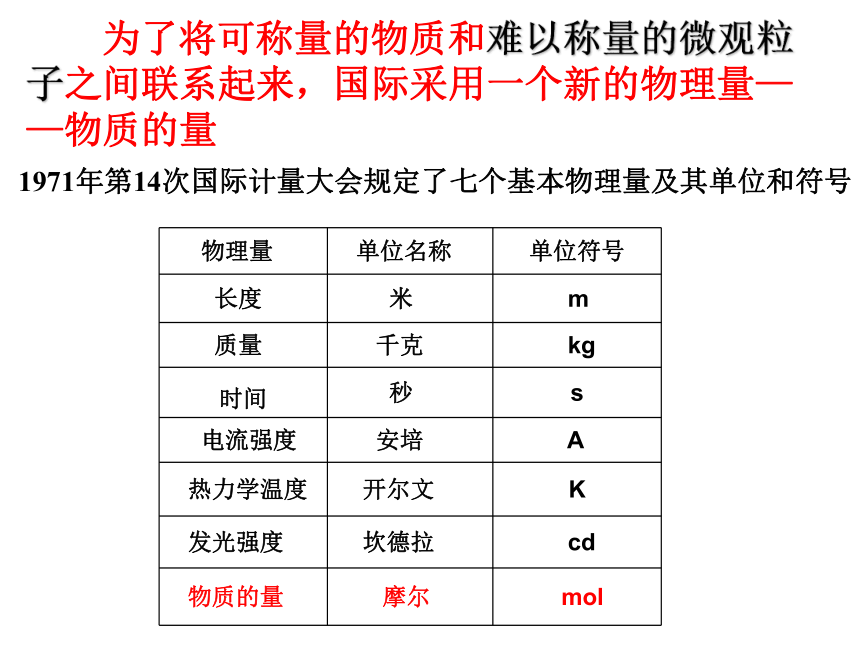
为了将可称量的物质和难以称量的微观粒子之间联系起来,国际采用一个新的物理量——物质的量
物理量
单位名称
单位符号
长度
米
m
质量
千克
kg
时间
秒
s
电流强度
安培
A
热力学温度
开尔文
K
发光强度
坎德拉
cd
物质的量
摩尔
mol
1971年第14次国际计量大会规定了七个基本物理量及其单位和符号
一、物质的量(n)
2、定义:表示含有一定数目粒子(分子、原子、离子、质子、中子、电子)的集合体,只适用于微观粒子。
1、是一个物理量,专用名词,不能增减
3、单位:
摩尔
(符号:mol)
活动一
1、阅读课本P49,总结物质的量的定义及单位
1.下列说法中正确的是(
)
A.1
mol氧
B.1
mol
H2SO4
C.1
mol米
D.1
mol面粉
2.在1
molH2O中(
)
A.含1molH
B.含1mol氢原子
C.含1mol水分子
D.含0.5mol个氧原子
B
C
课堂练习
还有更奇怪的,他还想知道……
18g水中有多少个水分子?
12g碳单质中含有多少个碳原子?
27g铝粉中含有多少个铝原子?
44g二氧化碳气体中含有多少个二氧化碳分子?
资料卡片
一个水分子的质量约为2.99×10-23g
一个碳原子的质量约为1.993×10-23g
一个铝原子的质量约为4.482×10-23g
一个二氧化碳分子的质量约为7.3078×10-23g
这几种物质中含有的微粒数目都约为6.02×1023个
意大利物理学家
阿梅代奥·阿伏加德罗
(A.Avogadro,1776-1856)
阿伏加德罗常数
:NA
二、阿伏加德罗常数(NA)
1、定义:1mol任何物质都含有NA个构成该物质的微粒数目。
3、阿伏加德罗常数的近似值是:
NA=
6.02×1023mol-1
2、单位:mol-1
活动一
2、阅读课本P49,总结阿伏加德罗常数(NA)的定义及单位
三、物质的量(n)、阿伏加德罗常数(NA)、
粒子数(N)之间的关系
物质的量
=
微粒个数
阿伏加德罗常数
N
NA
=
n(
mol)
活动二
总结物质的量(n)、阿伏加德罗常数(NA)、粒子数(N)之间的关系
课堂练习
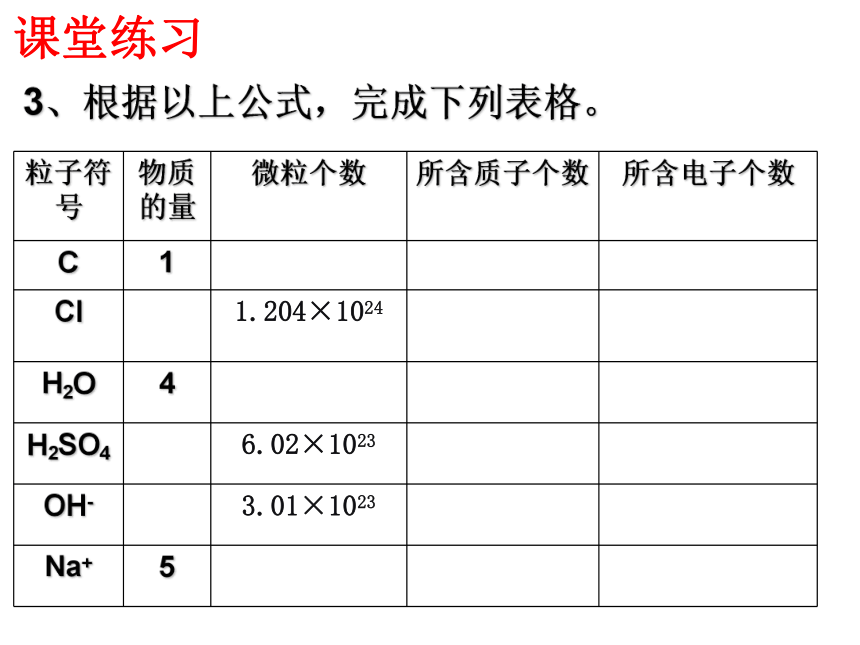
粒子符号
物质的量
微粒个数
所含质子个数
所含电子个数
C
1
Cl
1.204×1024
H2O
4
H2SO4
6.02×1023
OH-
3.01×1023
Na+
5
3、根据以上公式,完成下列表格。
4.(考查物质的量、阿伏加德罗常数和微粒数的关系)
(1)1molFe
含有_________个
Fe原子。
(2)2molO2含有_____个O2分子_______molO原子,______个O原子。
(3)3molH2O含_____个H2O,含有__molH原子,约含
_________
个H原子,含有____mol的O原子,约含________
个O原子。
(4)4molH2SO4含有_____molH+,约含_________
个H+;含有____molSO42-,约含有______
_
个SO42-。
NA
4
2NA
4NA
6
6×6.02×1023
3
3×6.02×1023
3NA
8
8×6.02×1023
4
4×6.02×1023
5.(考查物质的量、阿伏加德罗常数和微粒数的关系)
(1)6.02×1023个Cl2含有____molCl2分子,含有____molCl原子,约含
_______
Cl原子。
(2)
3.01×1023个
CO2中含有____molCO2,含有_____molC原子,含有________
个C原子,含有_____molO原子,含有__________
个O原子。
1
2
2×6.02×1023
0.5
1
6.02×1023
2
2×6.02×1023
第2课时
摩尔质量
【知识回顾】
1、什么叫物质的量?1摩尔粒子的数目是以什么标准来规定的?什么叫阿伏加德罗常数?
2、微观粒子数、物质的量和阿伏加德罗常数之间的关系是什么?
奇怪的小明现在对微粒数目不感兴趣了,他认为数字太大,他对数字头疼。他现在想知道
6.02×1023个水分子有多少g?
6.02×1023个二氧化碳分子有多少g?
6.02×1023个铝原子有多少g?
新课导入
已知一个氢原子的质量为1.674×10-24g,求1molH的质量。
氢原子的质量m=
1.674×10-24g
×6.02×1023
=1.0g
数值上与氢原子的原子量相等
1mol氢原子的质量,以克为单位,
数值上与氢原子的原子量相等
活动一
阅读课本P50,完成下列知识探究,总结物质的摩尔质量(M)的定义及单位
微粒
C
H
O
H2O
相对原子
(分子)质量
12
1
16
18
1mol的质量
12克
1克
16克
18克
1mol
物质的质量(g)在数值上
等于其相对原子(分子)质量
而1molC、H、O、H2O的质量分别为:
结论:
1mol任何微粒的质量都是以克为单位
数值上等于该物质化学式的式量
●
●
1molO2的质量为32克
1molNa+的质量为23克
1molNaCl的质量为58.5克
1molAl的质量为27克
四、物质的摩尔质量(M)
1、定义:单位物质的量的物质的质量叫物质的摩尔质量。
2、单位:g/mol或g.mol-1
,
kg/mol
1mol
M
=
m
n
物质的摩尔质量
=
物质的质量
物质的量
数值:
等于相对原子(分子)质量
总结:
物质的质量m、物质的量n、粒子数N之间的关系如下:
m
N
(÷M)
(×M)
(×NA)
(÷NA)
n
微观
宏观
1、2molCu的质量是_________。
2、5molSO2的质量是_________。
128g
320g
3、下列气体中所含分子数目最多的是(
)
A.1gH2
B.10gCO2
C.30gCl2
D.17g
NH3
D
课堂练习
4.
(考查物质的量、质量和摩尔质量的关系)
(1)N2的相对分子质量是_____,摩尔质量是________,
2mol
N2的质量是_____,其中含有_____
个N2,______molN原子,_____个N原子。
(2)SO2的相对分子质量是_____,摩尔质量是________,
128gSO2的物质的量是_______,其中含有____个SO2分子,S原子的物质的量是______,含_____个S原子,O原子的物质的量是_____,含_____个O原子。
56g
28g/mol
28
4
4NA
2NA
2mol
64
64g/mol
2NA
2mol
2NA
4NA
4mol
5(考查物质的量、质量和摩尔质量的关系)
(1)4gH2的物质的量是_______,含______个H原子,______mol质子,含_______个质子,____mol电子,含电子数_______个。
(2)
0.5NA个OH-的物质的量是______,质量是_______,含有_____mol质子,含有______mol电子。
(3)NH4+的相对分子质量是_______,摩尔质量是_________,
36gNH4+的物质的量是________,其中含有_____个NH4+
,_______mol质子,______个质子,______mol电子,______个电子。
18g/mol
2mol
4NA
4
4NA
4NA
4
0.5mol
8.5g
4.5
5
18
2mol
2NA
22NA
20NA
22
20
第3课时
气体摩尔体积
1、我们学习了“物质的量(n)”及摩尔质量(M),由n可以求出哪些物理量?
【活动一】
2、在实验室或
在生产中,对于气态物质常使用它的体积而不是质量。那么物质的量与气体体积之间有什么关系?1mol气态物质占据的体积有多大?
质量
(m)
物质的量
(n)
微粒数目
(N)
÷M
×NA
÷NA
×M
18.0
cm3
1.0
18
液
态
H2O
1.977
g/
L
44
CO2
1.43
g/
L
32
O2
0.0899
g/
L
2
气
态
H2
1.83
98
H2SO4
态
2.7
27
Al
7.88
56
固
态
Fe
1mol物质体积
密度
(g/cm3)
1mol物质质量(g)
状态
物质
由体积数据结合物质状态得出什么结论?
7.12cm3
10.0
cm3
53.6
cm3
22.4
L
22.4
L
22.3
L
3、认真分析课本P52“思考与讨论”的表格
0℃、101KPa
(2)符号:Vm
(3)常用单位:L/mol
和
m3/mol
(4)公式:
Vm=V/n
(5)在T=0
℃,P=101KPa(标准状况)下,1摩尔任何气体的体积都约是22.4升。
五、气体摩尔体积:
(1)定义:在一定温度和压强下单位物质的量(1mol)的气体所占的体积。
(6)标准状况下气体摩尔体积:Vm=22.4L/mol
4、阅读课本P52,总结气体摩尔体积(Vm)的定义及单位
1、阅读课本P52,结合生活实际分析为什么1mol固体、液体、气体的体积不同,不同物质体积大小主要取决于那些因素
?
【反思】
3、在标准状况下,混合气体的气体摩尔体积也是22.4
L·mol-1吗?为什么?
4、常温常压下,1molCO2的体积是否为22.4L?在标准状况下,1molH2O的体积是否为22.4L?总结使用22.4
L·mol-1时的注意事项。
2、在标准状况下,为什么1mol气体体积都是22.4
L?
1、决定物质体积大小的因素有:
①物质的粒子数目;
②粒子本身的大小;
③粒子之间的距离;
决定于
固体、液体的体积
决定于
气体的体积
2、气体的体积只受温度和压强的影响,跟分子的种类基本无关。
(1)温度越高,体积越大。
(2)压强越大,体积越小。
总结:
3.使用气体摩尔体积的注意事项
(1)气体摩尔体积的适用范围是气体、可以是单一气体,也可为混合气体。如标准状况下,0.2
mol
H2与0.8
mol
O2的混合气体的体积约为22.4
L。
(2)使用22.4
L·mol-1时的注意事项
①条件必须为标准状况。因此一定要看清气体所处的状况。
②物质状态必须为气体。如水、苯、汽油、乙醇、甲醇、CH2Cl2、CHCl3、SO3、HF、四氯化碳(CCl4)等物质在标准状况下不是气体。
③数值“22.4
L·mol-1”是近似值。
【课堂练习】
1、完成《导学案》P55例1和“迁移·应用”。
2、(1)现有34
g某气体,摩尔质量为17
g·mol-1,则:
①该气体的物质的量为 mol。?
②该气体所含分子数为 NA。?
③该气体在标准状况下的体积为 L。?
(2) g
H2O中的氧原子数目与标准状况下22.4
L
CO2中的氧原子数目相同。?
答案(1)①2 ②2 ③44.8 (2)36
解析(1)该气体的物质的量为
=2
mol,所含分子数为2NA,在标准状况下的体积为22.4
L·mol-1×2
mol=44.8
L。(2)标准状况下22.4
L
CO2的物质的量是1
mol,所含氧原子的物质的量是2
mol,故含2
mol氧原子的水的物质的量是2
mol,即36
g。
÷NA
m
n
N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
物质的量
同温同压下,相同体积的任何气体都含有相同数目的分子。
课堂总结
第4课时
物质的量浓度
1、什么叫溶液?溶液是由什么组成的?
一种或几种物质分散到另一种物质里形成均一的、稳定的混合物,叫做溶液。溶液由溶质和溶剂组成。
2、什么是溶液中溶质的质量分数?
溶质的质量分数=
×100%
溶质质量
溶液质量
【知识回顾】
一、物质的量浓度
1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液的组成的物理量,叫做溶质B的物质的量浓度。
单位:mol/L
3、含义:在1L溶液中含有1mol的溶质,这种溶液中溶质的物质的量浓度就是1mol/L。
2、符号:cB
表达式:cB=
nB
V
【活动一】阅读课本P53,总结物质的量浓度的定义、符号、表达式
(1)从500
mL
2
mol·L-1的NaCl溶液中,取出100
mL溶液,则这100
mL溶液的物质的量浓度为多少?取出400
mL溶液,则这400
mL溶液的物质的量浓度为多少?
【问题探究】
(2)1L
0.5
mol·L-1的Al2(SO4)3溶液中c(Al3+)、c(SO42-
)分别为多少?
(3)1L
0.5
mol·L-1的Al2(SO4)3溶液和500L
0.5
mol·L-1的Al2(SO4)3溶液中c(Al3+)分别为多少?
(6)98%
H2SO4溶液(ρ=1.84
g·cm-3)的物质的量浓度为多少?
(5)在标准状况下,448
L
NH3溶于水中,形成2
L溶液,则溶液的物质的量浓度为多少?写出计算步骤。
(4)将117g的NaCl固体溶于水,配制成1L溶液,则这该溶液的物质的量浓度为多少?
【课堂练习一】
3
4
÷NA
m
n
N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
课堂小结
第5课时
配制一定物质的量浓度的溶液
【活动一】1、完成课本P55“实验2-10”配制100ml
1mol·L-1的NaCl溶液,总结归纳配制一定物质的量浓度的溶液基本步骤及所需仪器。
【活动一】2、阅读课本P54“资料卡片”,归纳容量瓶的规格、使用原则、注意事项。
【活动一】3、请利用18.4mol·L-1的浓硫酸溶液配制500ml
1mol·L-1的稀硫酸溶液,总结浓溶液配制稀溶液时的基本步骤及所需仪器。
【课堂练习】
可能引起误差的操作
变化的量
实际浓度(cB)
将烧杯中溶液向容量瓶中转移时,有少量洒出
nB____
____
烧杯中溶液倾倒完毕,忘记洗涤烧杯和玻璃棒
nB____
____
未冷却至室温就注入容量瓶定容
V____
____
定容时,仰视容量瓶的刻度线
V____
____
减小
偏低
减小
偏低
减小
偏高
增大
偏低
【活动二】以配制100ml
1.0mol/L的NaCl溶液为例,分析实验步骤,判断下列操作对溶液浓度的影响。
可能引起误差的操作
变化的量
实际浓度(cB)
定容时,俯视容量瓶的刻度线
V____
____
定容时,水加多了,用滴管吸出
nB____
____
定容摇匀后,发现液面下降,再加水至刻度线
V____
____
溶解前烧杯内有水
—
无影响
减小
减小
偏高
偏低
增大
偏低
【分析总结】
【课堂练习】
解析
第1课时
物质的量的单位——摩尔
小明是个奇怪的孩子,奇怪在他对物质的数目特别感兴趣,一天买了五公斤苹果,他想知道有几个?你有什么方法?有没有最快知道苹果数目的方法?
若他买的是五公斤大米,他还想知道大米的颗粒数?你又能帮他吗?
一瓶矿泉水里又有多少个水分子?
新课导入
为了将可称量的物质和难以称量的微观粒子之间联系起来,国际采用一个新的物理量——物质的量
物理量
单位名称
单位符号
长度
米
m
质量
千克
kg
时间
秒
s
电流强度
安培
A
热力学温度
开尔文
K
发光强度
坎德拉
cd
物质的量
摩尔
mol
1971年第14次国际计量大会规定了七个基本物理量及其单位和符号
一、物质的量(n)
2、定义:表示含有一定数目粒子(分子、原子、离子、质子、中子、电子)的集合体,只适用于微观粒子。
1、是一个物理量,专用名词,不能增减
3、单位:
摩尔
(符号:mol)
活动一
1、阅读课本P49,总结物质的量的定义及单位
1.下列说法中正确的是(
)
A.1
mol氧
B.1
mol
H2SO4
C.1
mol米
D.1
mol面粉
2.在1
molH2O中(
)
A.含1molH
B.含1mol氢原子
C.含1mol水分子
D.含0.5mol个氧原子
B
C
课堂练习
还有更奇怪的,他还想知道……
18g水中有多少个水分子?
12g碳单质中含有多少个碳原子?
27g铝粉中含有多少个铝原子?
44g二氧化碳气体中含有多少个二氧化碳分子?
资料卡片
一个水分子的质量约为2.99×10-23g
一个碳原子的质量约为1.993×10-23g
一个铝原子的质量约为4.482×10-23g
一个二氧化碳分子的质量约为7.3078×10-23g
这几种物质中含有的微粒数目都约为6.02×1023个
意大利物理学家
阿梅代奥·阿伏加德罗
(A.Avogadro,1776-1856)
阿伏加德罗常数
:NA
二、阿伏加德罗常数(NA)
1、定义:1mol任何物质都含有NA个构成该物质的微粒数目。
3、阿伏加德罗常数的近似值是:
NA=
6.02×1023mol-1
2、单位:mol-1
活动一
2、阅读课本P49,总结阿伏加德罗常数(NA)的定义及单位
三、物质的量(n)、阿伏加德罗常数(NA)、
粒子数(N)之间的关系
物质的量
=
微粒个数
阿伏加德罗常数
N
NA
=
n(
mol)
活动二
总结物质的量(n)、阿伏加德罗常数(NA)、粒子数(N)之间的关系
课堂练习
粒子符号
物质的量
微粒个数
所含质子个数
所含电子个数
C
1
Cl
1.204×1024
H2O
4
H2SO4
6.02×1023
OH-
3.01×1023
Na+
5
3、根据以上公式,完成下列表格。
4.(考查物质的量、阿伏加德罗常数和微粒数的关系)
(1)1molFe
含有_________个
Fe原子。
(2)2molO2含有_____个O2分子_______molO原子,______个O原子。
(3)3molH2O含_____个H2O,含有__molH原子,约含
_________
个H原子,含有____mol的O原子,约含________
个O原子。
(4)4molH2SO4含有_____molH+,约含_________
个H+;含有____molSO42-,约含有______
_
个SO42-。
NA
4
2NA
4NA
6
6×6.02×1023
3
3×6.02×1023
3NA
8
8×6.02×1023
4
4×6.02×1023
5.(考查物质的量、阿伏加德罗常数和微粒数的关系)
(1)6.02×1023个Cl2含有____molCl2分子,含有____molCl原子,约含
_______
Cl原子。
(2)
3.01×1023个
CO2中含有____molCO2,含有_____molC原子,含有________
个C原子,含有_____molO原子,含有__________
个O原子。
1
2
2×6.02×1023
0.5
1
6.02×1023
2
2×6.02×1023
第2课时
摩尔质量
【知识回顾】
1、什么叫物质的量?1摩尔粒子的数目是以什么标准来规定的?什么叫阿伏加德罗常数?
2、微观粒子数、物质的量和阿伏加德罗常数之间的关系是什么?
奇怪的小明现在对微粒数目不感兴趣了,他认为数字太大,他对数字头疼。他现在想知道
6.02×1023个水分子有多少g?
6.02×1023个二氧化碳分子有多少g?
6.02×1023个铝原子有多少g?
新课导入
已知一个氢原子的质量为1.674×10-24g,求1molH的质量。
氢原子的质量m=
1.674×10-24g
×6.02×1023
=1.0g
数值上与氢原子的原子量相等
1mol氢原子的质量,以克为单位,
数值上与氢原子的原子量相等
活动一
阅读课本P50,完成下列知识探究,总结物质的摩尔质量(M)的定义及单位
微粒
C
H
O
H2O
相对原子
(分子)质量
12
1
16
18
1mol的质量
12克
1克
16克
18克
1mol
物质的质量(g)在数值上
等于其相对原子(分子)质量
而1molC、H、O、H2O的质量分别为:
结论:
1mol任何微粒的质量都是以克为单位
数值上等于该物质化学式的式量
●
●
1molO2的质量为32克
1molNa+的质量为23克
1molNaCl的质量为58.5克
1molAl的质量为27克
四、物质的摩尔质量(M)
1、定义:单位物质的量的物质的质量叫物质的摩尔质量。
2、单位:g/mol或g.mol-1
,
kg/mol
1mol
M
=
m
n
物质的摩尔质量
=
物质的质量
物质的量
数值:
等于相对原子(分子)质量
总结:
物质的质量m、物质的量n、粒子数N之间的关系如下:
m
N
(÷M)
(×M)
(×NA)
(÷NA)
n
微观
宏观
1、2molCu的质量是_________。
2、5molSO2的质量是_________。
128g
320g
3、下列气体中所含分子数目最多的是(
)
A.1gH2
B.10gCO2
C.30gCl2
D.17g
NH3
D
课堂练习
4.
(考查物质的量、质量和摩尔质量的关系)
(1)N2的相对分子质量是_____,摩尔质量是________,
2mol
N2的质量是_____,其中含有_____
个N2,______molN原子,_____个N原子。
(2)SO2的相对分子质量是_____,摩尔质量是________,
128gSO2的物质的量是_______,其中含有____个SO2分子,S原子的物质的量是______,含_____个S原子,O原子的物质的量是_____,含_____个O原子。
56g
28g/mol
28
4
4NA
2NA
2mol
64
64g/mol
2NA
2mol
2NA
4NA
4mol
5(考查物质的量、质量和摩尔质量的关系)
(1)4gH2的物质的量是_______,含______个H原子,______mol质子,含_______个质子,____mol电子,含电子数_______个。
(2)
0.5NA个OH-的物质的量是______,质量是_______,含有_____mol质子,含有______mol电子。
(3)NH4+的相对分子质量是_______,摩尔质量是_________,
36gNH4+的物质的量是________,其中含有_____个NH4+
,_______mol质子,______个质子,______mol电子,______个电子。
18g/mol
2mol
4NA
4
4NA
4NA
4
0.5mol
8.5g
4.5
5
18
2mol
2NA
22NA
20NA
22
20
第3课时
气体摩尔体积
1、我们学习了“物质的量(n)”及摩尔质量(M),由n可以求出哪些物理量?
【活动一】
2、在实验室或
在生产中,对于气态物质常使用它的体积而不是质量。那么物质的量与气体体积之间有什么关系?1mol气态物质占据的体积有多大?
质量
(m)
物质的量
(n)
微粒数目
(N)
÷M
×NA
÷NA
×M
18.0
cm3
1.0
18
液
态
H2O
1.977
g/
L
44
CO2
1.43
g/
L
32
O2
0.0899
g/
L
2
气
态
H2
1.83
98
H2SO4
态
2.7
27
Al
7.88
56
固
态
Fe
1mol物质体积
密度
(g/cm3)
1mol物质质量(g)
状态
物质
由体积数据结合物质状态得出什么结论?
7.12cm3
10.0
cm3
53.6
cm3
22.4
L
22.4
L
22.3
L
3、认真分析课本P52“思考与讨论”的表格
0℃、101KPa
(2)符号:Vm
(3)常用单位:L/mol
和
m3/mol
(4)公式:
Vm=V/n
(5)在T=0
℃,P=101KPa(标准状况)下,1摩尔任何气体的体积都约是22.4升。
五、气体摩尔体积:
(1)定义:在一定温度和压强下单位物质的量(1mol)的气体所占的体积。
(6)标准状况下气体摩尔体积:Vm=22.4L/mol
4、阅读课本P52,总结气体摩尔体积(Vm)的定义及单位
1、阅读课本P52,结合生活实际分析为什么1mol固体、液体、气体的体积不同,不同物质体积大小主要取决于那些因素
?
【反思】
3、在标准状况下,混合气体的气体摩尔体积也是22.4
L·mol-1吗?为什么?
4、常温常压下,1molCO2的体积是否为22.4L?在标准状况下,1molH2O的体积是否为22.4L?总结使用22.4
L·mol-1时的注意事项。
2、在标准状况下,为什么1mol气体体积都是22.4
L?
1、决定物质体积大小的因素有:
①物质的粒子数目;
②粒子本身的大小;
③粒子之间的距离;
决定于
固体、液体的体积
决定于
气体的体积
2、气体的体积只受温度和压强的影响,跟分子的种类基本无关。
(1)温度越高,体积越大。
(2)压强越大,体积越小。
总结:
3.使用气体摩尔体积的注意事项
(1)气体摩尔体积的适用范围是气体、可以是单一气体,也可为混合气体。如标准状况下,0.2
mol
H2与0.8
mol
O2的混合气体的体积约为22.4
L。
(2)使用22.4
L·mol-1时的注意事项
①条件必须为标准状况。因此一定要看清气体所处的状况。
②物质状态必须为气体。如水、苯、汽油、乙醇、甲醇、CH2Cl2、CHCl3、SO3、HF、四氯化碳(CCl4)等物质在标准状况下不是气体。
③数值“22.4
L·mol-1”是近似值。
【课堂练习】
1、完成《导学案》P55例1和“迁移·应用”。
2、(1)现有34
g某气体,摩尔质量为17
g·mol-1,则:
①该气体的物质的量为 mol。?
②该气体所含分子数为 NA。?
③该气体在标准状况下的体积为 L。?
(2) g
H2O中的氧原子数目与标准状况下22.4
L
CO2中的氧原子数目相同。?
答案(1)①2 ②2 ③44.8 (2)36
解析(1)该气体的物质的量为
=2
mol,所含分子数为2NA,在标准状况下的体积为22.4
L·mol-1×2
mol=44.8
L。(2)标准状况下22.4
L
CO2的物质的量是1
mol,所含氧原子的物质的量是2
mol,故含2
mol氧原子的水的物质的量是2
mol,即36
g。
÷NA
m
n
N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
物质的量
同温同压下,相同体积的任何气体都含有相同数目的分子。
课堂总结
第4课时
物质的量浓度
1、什么叫溶液?溶液是由什么组成的?
一种或几种物质分散到另一种物质里形成均一的、稳定的混合物,叫做溶液。溶液由溶质和溶剂组成。
2、什么是溶液中溶质的质量分数?
溶质的质量分数=
×100%
溶质质量
溶液质量
【知识回顾】
一、物质的量浓度
1、定义:以单位体积溶液里所含溶质B的物质的量来表示溶液的组成的物理量,叫做溶质B的物质的量浓度。
单位:mol/L
3、含义:在1L溶液中含有1mol的溶质,这种溶液中溶质的物质的量浓度就是1mol/L。
2、符号:cB
表达式:cB=
nB
V
【活动一】阅读课本P53,总结物质的量浓度的定义、符号、表达式
(1)从500
mL
2
mol·L-1的NaCl溶液中,取出100
mL溶液,则这100
mL溶液的物质的量浓度为多少?取出400
mL溶液,则这400
mL溶液的物质的量浓度为多少?
【问题探究】
(2)1L
0.5
mol·L-1的Al2(SO4)3溶液中c(Al3+)、c(SO42-
)分别为多少?
(3)1L
0.5
mol·L-1的Al2(SO4)3溶液和500L
0.5
mol·L-1的Al2(SO4)3溶液中c(Al3+)分别为多少?
(6)98%
H2SO4溶液(ρ=1.84
g·cm-3)的物质的量浓度为多少?
(5)在标准状况下,448
L
NH3溶于水中,形成2
L溶液,则溶液的物质的量浓度为多少?写出计算步骤。
(4)将117g的NaCl固体溶于水,配制成1L溶液,则这该溶液的物质的量浓度为多少?
【课堂练习一】
3
4
÷NA
m
n
N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
课堂小结
第5课时
配制一定物质的量浓度的溶液
【活动一】1、完成课本P55“实验2-10”配制100ml
1mol·L-1的NaCl溶液,总结归纳配制一定物质的量浓度的溶液基本步骤及所需仪器。
【活动一】2、阅读课本P54“资料卡片”,归纳容量瓶的规格、使用原则、注意事项。
【活动一】3、请利用18.4mol·L-1的浓硫酸溶液配制500ml
1mol·L-1的稀硫酸溶液,总结浓溶液配制稀溶液时的基本步骤及所需仪器。
【课堂练习】
可能引起误差的操作
变化的量
实际浓度(cB)
将烧杯中溶液向容量瓶中转移时,有少量洒出
nB____
____
烧杯中溶液倾倒完毕,忘记洗涤烧杯和玻璃棒
nB____
____
未冷却至室温就注入容量瓶定容
V____
____
定容时,仰视容量瓶的刻度线
V____
____
减小
偏低
减小
偏低
减小
偏高
增大
偏低
【活动二】以配制100ml
1.0mol/L的NaCl溶液为例,分析实验步骤,判断下列操作对溶液浓度的影响。
可能引起误差的操作
变化的量
实际浓度(cB)
定容时,俯视容量瓶的刻度线
V____
____
定容时,水加多了,用滴管吸出
nB____
____
定容摇匀后,发现液面下降,再加水至刻度线
V____
____
溶解前烧杯内有水
—
无影响
减小
减小
偏高
偏低
增大
偏低
【分析总结】
【课堂练习】
解析
