10.3《热力学第一定律 能量守恒定律》PPT课件(新人教版 选修3-3)
文档属性
| 名称 | 10.3《热力学第一定律 能量守恒定律》PPT课件(新人教版 选修3-3) |  | |
| 格式 | zip | ||
| 文件大小 | 198.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 物理 | ||
| 更新时间 | 2012-06-13 17:08:59 | ||
图片预览









文档简介
(共40张PPT)
新课标人教版课件系列
《高中物理》
选修3-3
10.3《热力学第一定律
能量守恒定律》
教学目标
(1)知道热力学第一定律 ,理解能量守恒定律
(2)对热力学第一定律的数学表达式有简单认识
(3)知道永动机是不可能的
本章内容
Contents
chapter 15
热力学第一定律
first law of thermodynamics
cycle Carnot cycle
循环过程 卡诺循环
热力学第一定律对理想气体的应用
application of first law of thermodynamics to ideal gas
第一节 引言
热力学是研究物质世界中有关热现象的宏观
理论,它不涉及物质的微观结构,而是将一物质
系统中大量粒子看作一个整体,研究系统所表现
的各种宏观性质和规律。
热力学第一定律是热力学的基本定律,是一个
包括热现象在内的能量守恒与转化的定律。
热力学第一定律首先涉及到
内能
功
热量
的基本概念
内能
广义上的内能,是指某物体系统由其内部状态所决定的能量。
某给定理想气体系统的内能,是组成该气体系统的全部
分子的动能之和,其值为 ,由状态参量
决定,内能 ,是状态参量 的单值函数。
真实气体的内能除了其全体分子的动能外还包括分子之间
的引力势能。实验证明人,真实气体的内能,是状态参量
和 (或 )的函数,即 或 。
总之,某给定气体系统的内能。只由该系统的状态所决定,
在热力学中内能是一个重要的状态量。
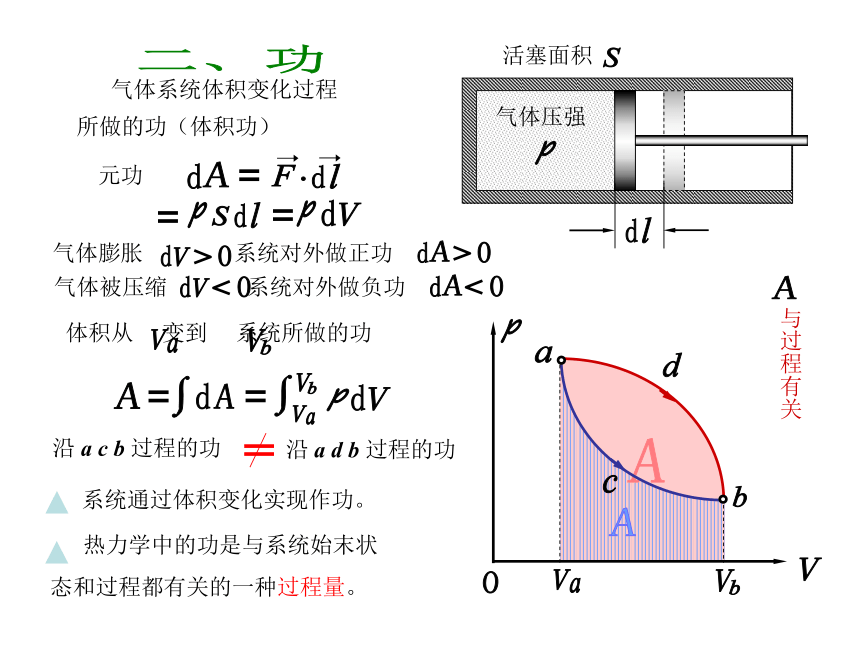
功
气体压强
活塞面积
气体系统体积变化过程
所做的功(体积功)
元功
气体膨胀 系统对外做正功
气体被压缩 系统对外做负功
与过程有关
体积从 变到 系统所做的功
沿 a c b 过程的功
沿 a d b 过程的功
系统通过体积变化实现作功。
热力学中的功是与系统始末状
态和过程都有关的一种过程量。
热量
热量是系统与外界仅由于
温度不同而传递的能量。
外
界
质量 M
比热 c
吸收热量 dQ
温度升高 dT
若改用摩尔热容
即1mol的物质温度升
高1K时所吸收的热量
则
的过程中所吸收的热量
系统由温度 T1 变到温度 T2
系统吸收的热量为正
若计算结果 则表示系统放热。
热量必须与过程相联系,只有发生
过程才有吸收或放出热量可言。
系统从某一状态变到另一状态,若其
过程不同,则吸或放的热量也会不同。
故 热量也是过程量
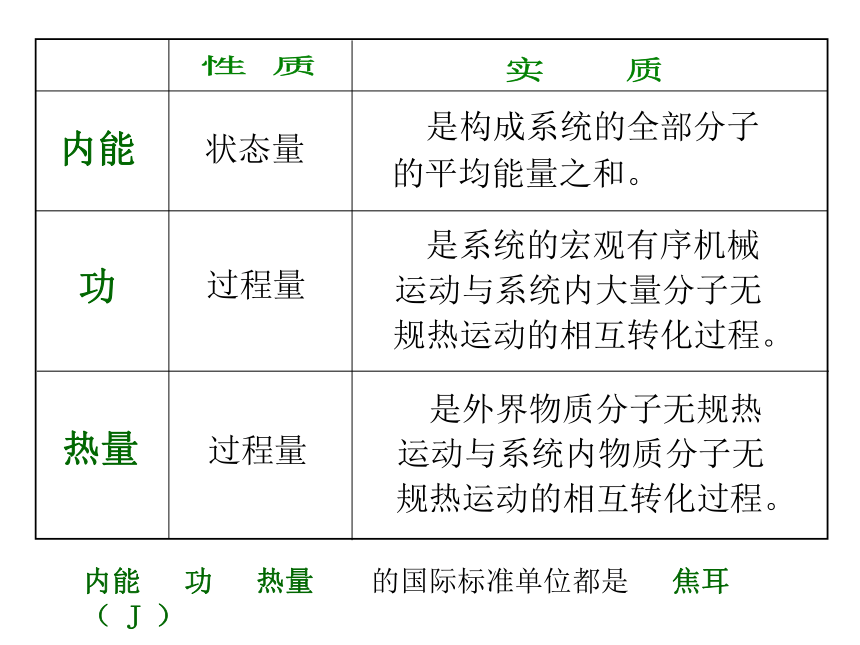
实质
内能
热量
功
状态量
过程量
过程量
是构成系统的全部分子
的平均能量之和。
是系统的宏观有序机械
运动与系统内大量分子无
规热运动的相互转化过程。
是外界物质分子无规热
运动与系统内物质分子无
规热运动的相互转化过程。
内能 功 热量 的国际标准单位都是 焦耳 ( J )
热力学第一定律
热力学第一定律是包括热现象在内的能量守恒与转化定律的一种表达形式。
该定律的另一种通俗表述是:第一类永动机是不可能造成的。
第一类永动机是指能不断对外作功而又不需消耗任何形式的能量、或消耗较少的能量却能得到更多的机械功的机器。
微过程表达式
热力学第一定律是包括热现象在内的能量守恒与转化定律的一种表达形式。
该定律的另一种通俗表述是:第一类永动机是不可能造成的。
第一类永动机是指能不断对外作功而又不需消耗任何形式的能量、或消耗较少的能量却能得到更多的机械功的机器。
对于一个无限小的过程,热力学第一定律可写成
式中各量均为代数量,有正有负
系统吸收热量,
或
为正,放出热量则为负
系统内能增加,
或
为正,内能减少则为负
系统对外作功,
或
为正,外界对系统作功则为负
式中各量的单位制必须统一。
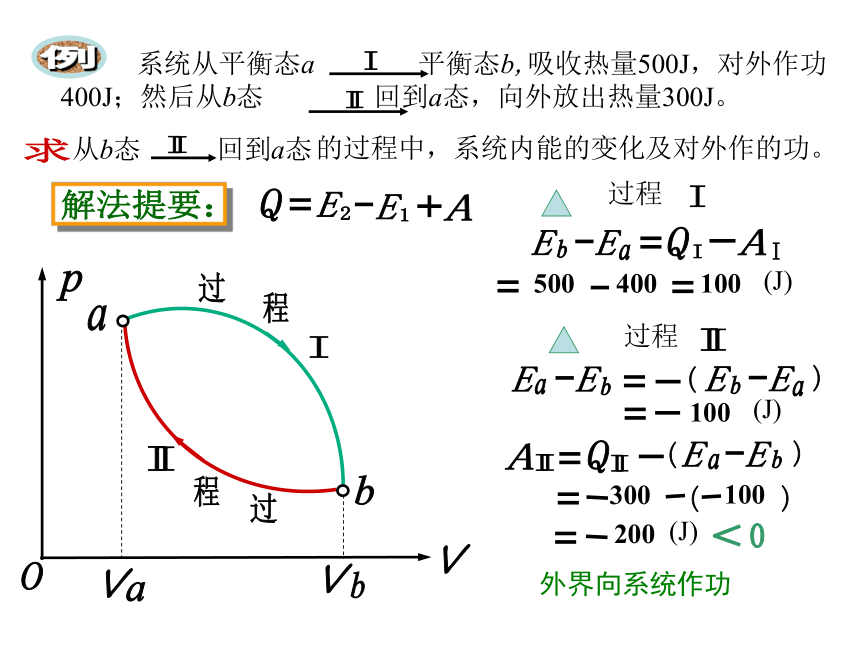
凡例
的过程中,系统内能的变化及对外作的功。
从b态 回到a态
系统从平衡态a 平衡态b,吸收热量500J,对外作功400J;然后从b态 回到a态,向外放出热量300J。
过程
500
400
100
(J)
300
200
过程
100
(J)
100
(J)
外界向系统作功
理想气体的物态方程
系统保持体积 不变
过程方程
常量
理想气体的内能
等
等V过程系统吸收的热量为
其中
称为定体摩尔热容
本式也是计算
的普遍式
等体升压过程所吸收的热量
全部用于增加系统的内能
等压过程
理想气体的物态方程
系统保持压强 不变
过程方程
常量
理想气体的内能
故
等压膨胀过程所吸收的热量
一部分用于增加系统的内能
一部分用于对外界做功
常写成
其中
称为定压摩尔热容
比热容比
定体摩尔热容
定压摩尔热容
(1mol气体在等体过程中温度升高1K所吸收的热量)
(1mol气体在等压过程中温度升高1K所吸收的热量)
理想气体常用式
理想气体常用式
热力学中还常用到比热容比的概念:
定压摩尔热容
比热容比
定体摩尔热容
理想气体常用式
(定压、定体两种比热之比或定压、定体两种摩尔热容之比)
等体等压例题
全过程系统吸收量热、对外作功及内能变化
1.75 10 (J)
1.09 10 (J )
2.84 10 (J)
放热
内能减少
等体
262.5 (K)
等压
210 (K)
1.75 10 (J)
外界对系统作功
等温过程
理想气体的内能
等温过程气体吸收的热量全部转化为对外作功。
理想气体的物态方程
系统保持温度 不变
常量
过程方程
绝热过程
系统不与外界交换热量
理想气体的内能
理想气体的物态方程
在绝热过程中
全靠消耗系统自身的内能对外作功
1mol 理想气体绝热功的大小为
值也可由气体的 值及初末态的 值求得
绝热过程方程
理想气体的物态方程
绝热过程方程
对于绝热过程
无一恒定
过程曲线形态
理想气体准静态绝热过程
及
两边积分得
即
常量
则
常量
由物态方程
消去
得常用的绝热过程方程
常量
其它形式
常量
常量
绝热线
绝热线的斜率
绝热过程方程
常量
其中
绝热线
等温线
绝热线较陡
Q
T
等温过程方程
等温线的斜率
常量
Q
T
对同一
除 共同因素外,还因消耗内能, ,
绝热线较陡的物理解释:
等温膨胀
绝热膨胀
不变,导致 的因素只是
使
等温绝热例题
绝热线
等温线
20.8 J mol K
1.4
绝热过程
11.94 (K)
3.76 10 (J)
等温过程
5.74 10 (J)
等值及绝热归纳
理想气体物态方程
过程
过程方程
常量
常量
常量
常量
或
或
或
等体
等压
等温
绝热
多方过程概念
理想气体物态方程
等体、等压、等温
状态参量
分别不变
绝热
都变
但过程量
即
或
现在讨论
(多方)
过程
都变
或
的普遍情况
为常量
(含零及非零)时
多方过程方程
理想气体的物态方程
联立消去
令
(常数)
两边积分得
常量
得多方过程方程
常量
称为多方指数
多方热功算式
多方过程方程
常量
称为多方指数
多方过程 系统 对外作功
内能变化
吸收热量
等温过程
常量
绝热过程
常量
等压过程
等体过程
可写成
可以是非整数,给定一个 对应着一个多方过程
等温、绝热、等压、等体过程,是多方过程的特例
介于等温与绝热之间的过程
随堂小议
结束选择
请在放映状态下点击你认为是对的答案
如图,a、b为 P-V 图中两平衡态的代表点,且 pa = pb,则
(1) Ea < Eb
(2) Aab < 0
(3) Qab < 0
(4) 以上结论都不对
小议链接1
结束选择
请在放映状态下点击你认为是对的答案
如图,a、b为 P-V 图中两平衡态的代表点,且 pa = pb,则
(1) Ea < Eb
(2) Aab < 0
(3) Qab < 0
(4) 以上结论都不对
小议链接2
结束选择
请在放映状态下点击你认为是对的答案
如图,a、b为 P-V 图中两平衡态的代表点,且 pa = pb,则
(1) Ea < Eb
(2) Aab < 0
(3) Qab < 0
(4) 以上结论都不对
小议链接3
结束选择
请在放映状态下点击你认为是对的答案
如图,a、b为 P-V 图中两平衡态的代表点,且 pa = pb,则
(1) Ea < Eb
(2) Aab < 0
(3) Qab < 0
(4) 以上结论都不对
小议链接4
结束选择
请在放映状态下点击你认为是对的答案
如图,a、b为 P-V 图中两平衡态的代表点,且 pa = pb,则
(1) Ea < Eb
(2) Aab < 0
(3) Qab < 0
(4) 以上结论都不对
循环过程
15-3
cycle Carnot cycle
将热能不断转变为功的装置称为热机。
热机中的工作物质(工质、系统)所进行的热力学过程都是循环过程。
系统从某一状态出发经历一系列变化后又回到了原态的整个变化过程。
循环过程内能变化
准静态循环过程
循环曲线包围面积代表系统作的净功
净
顺时针 正循环 热机
净
系统对外作正功
逆时针 逆循环 致冷机
净
外界对系统作功
净
循环热功转换
吸热膨胀
吸收热量
对外作功
放热压缩
放出热量
外界作功
绝对值
吸收的净热量
对外作的净功
循环过程
净
则
循环效率
热机的循环效率
工质对外作的净功
工质从高温热源吸收的热量
工质从低温热源吸收的热量
致冷机的致冷系数
外界对工质作的净功
卡诺循环
两个等温
两个绝热
过程构成的一种理想循环
高温热源
低温热源
卡诺循环分析
两个等温
两个绝热
过程构成的一种理想循环
高温热源
低温热源
绝热膨胀 过程方程
绝热压缩 过程方程
等温压缩 放热量
等温膨胀 吸热量
两式对比
得
卡诺循环效率
高温热源
低温热源
回顾循环效率和热机效率的普遍定义
高温热源温度 越高,低温热源温度 越低,卡诺循环效率就越大。
卡诺逆循环致冷
高温热源
低温热源
回顾逆循环效率和致冷机致冷系数的普遍定义
致冷系数随着被致冷物体的温度变化而变化。被致冷物体的温度 越低,则卡诺逆循环的致冷系数越小。
例题奥托循环
吸 气
绝 热
压 缩
点火等体吸热
绝热膨胀
等体放热
排 气
应用热机效率的一般概念,导出四冲程火花塞点燃式气油发动机的理想循环(奥托循环)效率
奥托
等体吸热
等体放热
均为绝热过程,有
奥托
奥托
两个绝热
两个等体
过程
主体
大 气 压
随堂练习
1mol
单原子理想气体循环如图
105pa
10-3m-3
循环一次的
证明
TaTc = TbTd
为吸热过程
800 (J)
面积
100 (J)
因
故
致冷例题
卡诺致冷机使1kg 0 C的水变成 0 C的冰,需作多少功?
10.1
1kg 0 C
的水变0 C的冰
需取出热量
3.35 10
3.35 10
(J)
外界需向致冷机作功
3.32 10 (J)
低温热源
0 +273 = 273(K)
高温热源
27+273 = 300 (K)
环境温度 27 C
冰的溶解热为 3.35 10 J kg
被致冷的 0 C
水变 0 C的冰
新课标人教版课件系列
《高中物理》
选修3-3
10.3《热力学第一定律
能量守恒定律》
教学目标
(1)知道热力学第一定律 ,理解能量守恒定律
(2)对热力学第一定律的数学表达式有简单认识
(3)知道永动机是不可能的
本章内容
Contents
chapter 15
热力学第一定律
first law of thermodynamics
cycle Carnot cycle
循环过程 卡诺循环
热力学第一定律对理想气体的应用
application of first law of thermodynamics to ideal gas
第一节 引言
热力学是研究物质世界中有关热现象的宏观
理论,它不涉及物质的微观结构,而是将一物质
系统中大量粒子看作一个整体,研究系统所表现
的各种宏观性质和规律。
热力学第一定律是热力学的基本定律,是一个
包括热现象在内的能量守恒与转化的定律。
热力学第一定律首先涉及到
内能
功
热量
的基本概念
内能
广义上的内能,是指某物体系统由其内部状态所决定的能量。
某给定理想气体系统的内能,是组成该气体系统的全部
分子的动能之和,其值为 ,由状态参量
决定,内能 ,是状态参量 的单值函数。
真实气体的内能除了其全体分子的动能外还包括分子之间
的引力势能。实验证明人,真实气体的内能,是状态参量
和 (或 )的函数,即 或 。
总之,某给定气体系统的内能。只由该系统的状态所决定,
在热力学中内能是一个重要的状态量。
功
气体压强
活塞面积
气体系统体积变化过程
所做的功(体积功)
元功
气体膨胀 系统对外做正功
气体被压缩 系统对外做负功
与过程有关
体积从 变到 系统所做的功
沿 a c b 过程的功
沿 a d b 过程的功
系统通过体积变化实现作功。
热力学中的功是与系统始末状
态和过程都有关的一种过程量。
热量
热量是系统与外界仅由于
温度不同而传递的能量。
外
界
质量 M
比热 c
吸收热量 dQ
温度升高 dT
若改用摩尔热容
即1mol的物质温度升
高1K时所吸收的热量
则
的过程中所吸收的热量
系统由温度 T1 变到温度 T2
系统吸收的热量为正
若计算结果 则表示系统放热。
热量必须与过程相联系,只有发生
过程才有吸收或放出热量可言。
系统从某一状态变到另一状态,若其
过程不同,则吸或放的热量也会不同。
故 热量也是过程量
实质
内能
热量
功
状态量
过程量
过程量
是构成系统的全部分子
的平均能量之和。
是系统的宏观有序机械
运动与系统内大量分子无
规热运动的相互转化过程。
是外界物质分子无规热
运动与系统内物质分子无
规热运动的相互转化过程。
内能 功 热量 的国际标准单位都是 焦耳 ( J )
热力学第一定律
热力学第一定律是包括热现象在内的能量守恒与转化定律的一种表达形式。
该定律的另一种通俗表述是:第一类永动机是不可能造成的。
第一类永动机是指能不断对外作功而又不需消耗任何形式的能量、或消耗较少的能量却能得到更多的机械功的机器。
微过程表达式
热力学第一定律是包括热现象在内的能量守恒与转化定律的一种表达形式。
该定律的另一种通俗表述是:第一类永动机是不可能造成的。
第一类永动机是指能不断对外作功而又不需消耗任何形式的能量、或消耗较少的能量却能得到更多的机械功的机器。
对于一个无限小的过程,热力学第一定律可写成
式中各量均为代数量,有正有负
系统吸收热量,
或
为正,放出热量则为负
系统内能增加,
或
为正,内能减少则为负
系统对外作功,
或
为正,外界对系统作功则为负
式中各量的单位制必须统一。
凡例
的过程中,系统内能的变化及对外作的功。
从b态 回到a态
系统从平衡态a 平衡态b,吸收热量500J,对外作功400J;然后从b态 回到a态,向外放出热量300J。
过程
500
400
100
(J)
300
200
过程
100
(J)
100
(J)
外界向系统作功
理想气体的物态方程
系统保持体积 不变
过程方程
常量
理想气体的内能
等
等V过程系统吸收的热量为
其中
称为定体摩尔热容
本式也是计算
的普遍式
等体升压过程所吸收的热量
全部用于增加系统的内能
等压过程
理想气体的物态方程
系统保持压强 不变
过程方程
常量
理想气体的内能
故
等压膨胀过程所吸收的热量
一部分用于增加系统的内能
一部分用于对外界做功
常写成
其中
称为定压摩尔热容
比热容比
定体摩尔热容
定压摩尔热容
(1mol气体在等体过程中温度升高1K所吸收的热量)
(1mol气体在等压过程中温度升高1K所吸收的热量)
理想气体常用式
理想气体常用式
热力学中还常用到比热容比的概念:
定压摩尔热容
比热容比
定体摩尔热容
理想气体常用式
(定压、定体两种比热之比或定压、定体两种摩尔热容之比)
等体等压例题
全过程系统吸收量热、对外作功及内能变化
1.75 10 (J)
1.09 10 (J )
2.84 10 (J)
放热
内能减少
等体
262.5 (K)
等压
210 (K)
1.75 10 (J)
外界对系统作功
等温过程
理想气体的内能
等温过程气体吸收的热量全部转化为对外作功。
理想气体的物态方程
系统保持温度 不变
常量
过程方程
绝热过程
系统不与外界交换热量
理想气体的内能
理想气体的物态方程
在绝热过程中
全靠消耗系统自身的内能对外作功
1mol 理想气体绝热功的大小为
值也可由气体的 值及初末态的 值求得
绝热过程方程
理想气体的物态方程
绝热过程方程
对于绝热过程
无一恒定
过程曲线形态
理想气体准静态绝热过程
及
两边积分得
即
常量
则
常量
由物态方程
消去
得常用的绝热过程方程
常量
其它形式
常量
常量
绝热线
绝热线的斜率
绝热过程方程
常量
其中
绝热线
等温线
绝热线较陡
Q
T
等温过程方程
等温线的斜率
常量
Q
T
对同一
除 共同因素外,还因消耗内能, ,
绝热线较陡的物理解释:
等温膨胀
绝热膨胀
不变,导致 的因素只是
使
等温绝热例题
绝热线
等温线
20.8 J mol K
1.4
绝热过程
11.94 (K)
3.76 10 (J)
等温过程
5.74 10 (J)
等值及绝热归纳
理想气体物态方程
过程
过程方程
常量
常量
常量
常量
或
或
或
等体
等压
等温
绝热
多方过程概念
理想气体物态方程
等体、等压、等温
状态参量
分别不变
绝热
都变
但过程量
即
或
现在讨论
(多方)
过程
都变
或
的普遍情况
为常量
(含零及非零)时
多方过程方程
理想气体的物态方程
联立消去
令
(常数)
两边积分得
常量
得多方过程方程
常量
称为多方指数
多方热功算式
多方过程方程
常量
称为多方指数
多方过程 系统 对外作功
内能变化
吸收热量
等温过程
常量
绝热过程
常量
等压过程
等体过程
可写成
可以是非整数,给定一个 对应着一个多方过程
等温、绝热、等压、等体过程,是多方过程的特例
介于等温与绝热之间的过程
随堂小议
结束选择
请在放映状态下点击你认为是对的答案
如图,a、b为 P-V 图中两平衡态的代表点,且 pa = pb,则
(1) Ea < Eb
(2) Aab < 0
(3) Qab < 0
(4) 以上结论都不对
小议链接1
结束选择
请在放映状态下点击你认为是对的答案
如图,a、b为 P-V 图中两平衡态的代表点,且 pa = pb,则
(1) Ea < Eb
(2) Aab < 0
(3) Qab < 0
(4) 以上结论都不对
小议链接2
结束选择
请在放映状态下点击你认为是对的答案
如图,a、b为 P-V 图中两平衡态的代表点,且 pa = pb,则
(1) Ea < Eb
(2) Aab < 0
(3) Qab < 0
(4) 以上结论都不对
小议链接3
结束选择
请在放映状态下点击你认为是对的答案
如图,a、b为 P-V 图中两平衡态的代表点,且 pa = pb,则
(1) Ea < Eb
(2) Aab < 0
(3) Qab < 0
(4) 以上结论都不对
小议链接4
结束选择
请在放映状态下点击你认为是对的答案
如图,a、b为 P-V 图中两平衡态的代表点,且 pa = pb,则
(1) Ea < Eb
(2) Aab < 0
(3) Qab < 0
(4) 以上结论都不对
循环过程
15-3
cycle Carnot cycle
将热能不断转变为功的装置称为热机。
热机中的工作物质(工质、系统)所进行的热力学过程都是循环过程。
系统从某一状态出发经历一系列变化后又回到了原态的整个变化过程。
循环过程内能变化
准静态循环过程
循环曲线包围面积代表系统作的净功
净
顺时针 正循环 热机
净
系统对外作正功
逆时针 逆循环 致冷机
净
外界对系统作功
净
循环热功转换
吸热膨胀
吸收热量
对外作功
放热压缩
放出热量
外界作功
绝对值
吸收的净热量
对外作的净功
循环过程
净
则
循环效率
热机的循环效率
工质对外作的净功
工质从高温热源吸收的热量
工质从低温热源吸收的热量
致冷机的致冷系数
外界对工质作的净功
卡诺循环
两个等温
两个绝热
过程构成的一种理想循环
高温热源
低温热源
卡诺循环分析
两个等温
两个绝热
过程构成的一种理想循环
高温热源
低温热源
绝热膨胀 过程方程
绝热压缩 过程方程
等温压缩 放热量
等温膨胀 吸热量
两式对比
得
卡诺循环效率
高温热源
低温热源
回顾循环效率和热机效率的普遍定义
高温热源温度 越高,低温热源温度 越低,卡诺循环效率就越大。
卡诺逆循环致冷
高温热源
低温热源
回顾逆循环效率和致冷机致冷系数的普遍定义
致冷系数随着被致冷物体的温度变化而变化。被致冷物体的温度 越低,则卡诺逆循环的致冷系数越小。
例题奥托循环
吸 气
绝 热
压 缩
点火等体吸热
绝热膨胀
等体放热
排 气
应用热机效率的一般概念,导出四冲程火花塞点燃式气油发动机的理想循环(奥托循环)效率
奥托
等体吸热
等体放热
均为绝热过程,有
奥托
奥托
两个绝热
两个等体
过程
主体
大 气 压
随堂练习
1mol
单原子理想气体循环如图
105pa
10-3m-3
循环一次的
证明
TaTc = TbTd
为吸热过程
800 (J)
面积
100 (J)
因
故
致冷例题
卡诺致冷机使1kg 0 C的水变成 0 C的冰,需作多少功?
10.1
1kg 0 C
的水变0 C的冰
需取出热量
3.35 10
3.35 10
(J)
外界需向致冷机作功
3.32 10 (J)
低温热源
0 +273 = 273(K)
高温热源
27+273 = 300 (K)
环境温度 27 C
冰的溶解热为 3.35 10 J kg
被致冷的 0 C
水变 0 C的冰
