2.2《物质的制备》PPT课件(新人教版-选修6)
文档属性
| 名称 | 2.2《物质的制备》PPT课件(新人教版-选修6) |

|
|
| 格式 | zip | ||
| 文件大小 | 55.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-13 17:24:51 | ||
图片预览











文档简介
(共30张PPT)
新课标人教版课件系列
《高中化学》
选修6
2.2《物质的制备》
课题二
物质的制备
第二单元 物质的获取
一.制备物质的一般的方法
思考与交流:
1.能够通过化学反应产生二氧化碳气体的物质有哪些?
①CaCO3+HCl ②CaCO3
③Na2CO3+H2SO4 ④NaHCO3
⑤C+O2 ⑥CxHyOz+O2
一.制备物质的一般的方法
2.制取CO2气体的实验中,以什么物质为反应物(原料)?为什么?
CaCO3+HCl
3.反应的装置是如何选择和安装的?
一.制备物质的一般的方法
4.如果要制备干燥的气体产物,应如何设计装置?
酸性:浓硫酸、P2O5、硅胶
一.制备物质的一般的方法
确定原料
反应原理
设计反应途径
选择合理的仪器和装置
分离提纯
控制
反应
条件
目标产品
每一个环节都会影响所制备物质的质和量,每一个环节应该注意什么问题呢?
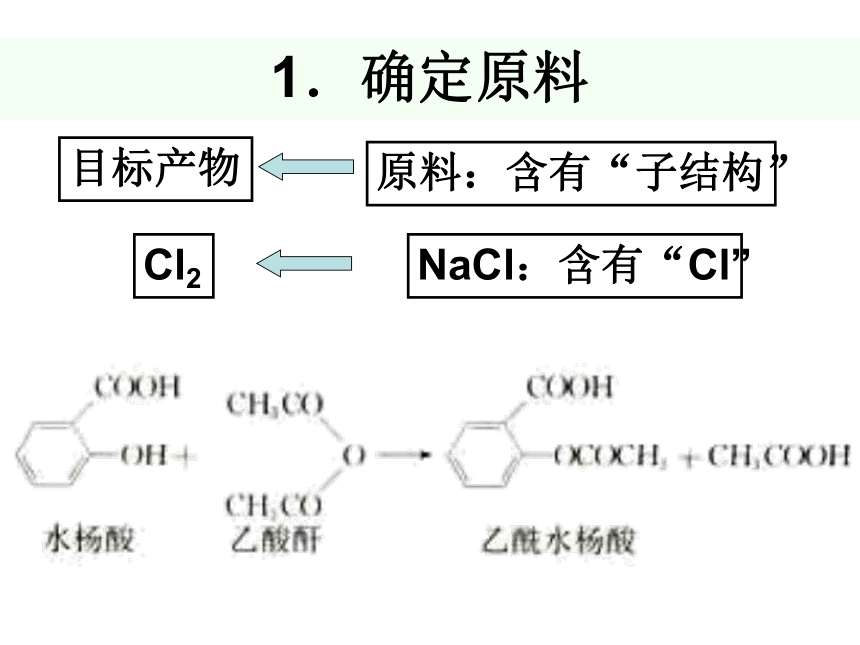
1.确定原料
目标产物
原料:含有“子结构”
Cl2
NaCl:含有“Cl”
原料也可以是一些废弃物:
Eg:可以选择适当的催化剂和温度,
使泡沫塑料降解,得到燃料油和燃气
【实践活动】P23
1.确定原料
2.设计反应路径
用铜制取硝酸铜的最佳方案: (1 )根据提高原子利用率、减少环境污染、简化操作的原则 ,选择最佳反应路线。例如 : ①铜 +浓硝酸 ②铜 +稀硝酸
③铜 +氧→氧化铜 ;
氧化铜 +硝酸→硝酸铜
3.优化条件
分析P24“实践活动”,试剂和用量都相同时,操作方法不同,现象和结果有何异同?
(1)Al3++3OH-=Al(OH)3↓
(2) Al3++4OH-=AlO2-+2H2O
3AlO2- + Al3+ + 6H2O =4Al(OH)3↓
小结
设计物质制备的实验方案时,应该遵循的优化原则是:
原料廉价,原理绿色,
条件优化,仪器简单,
分离方便。
硫酸亚铁铵的制备
实验原理:
亚铁盐在空气中易被氧化,但形成复盐硫酸亚铁铵FeSO4·(NH4)2SO4·6H2O后可稳定存在。
FeSO4 + (NH4)2SO4 + 6H2O =
FeSO4·(NH4)2SO4·6H2O
而硫酸亚铁可由铁屑和稀硫酸反应制得。
Fe + H2SO4 = FeSO4 + H2↑
流程图:
废铁屑
废铁屑
①10%碳酸
钠处理
②过滤
15mL
3mol/L硫酸
硫酸
亚铁
④过滤
③水浴加热
硫酸
亚铁
硫酸铵
⑤蒸发
结晶
硫酸亚铁铵
实验步骤 实验现象 解释和结论
1.铁屑的洗净去油污
用台式天平称取3.0 g 铁屑,放入小烧杯中,加入15 ml 质量分数为10%碳酸钠溶液。 铁屑开始呈现银白色光泽。
小火加热约10 min 后,倾倒去碳酸钠碱性溶液,用自来水冲洗后,再用蒸馏水把铁屑冲洗洁净。干燥后称得铁屑为2.9g。 过后光泽度有所下降,煮的过程中有刺激性气味气体。
小火加热约10 min 后,倾倒去碳酸钠碱性溶液,用自来水冲洗后,再用蒸馏水把铁屑冲洗洁净。干燥后称得铁屑为2.9g。 过后光泽度有所下降,煮的过程中有刺激性气味气体。 刺激性气味气体源于油污。
2. 硫酸亚铁的制备
把洗净的铁屑放入锥形瓶中,加入20ml 3mol/L 的H2SO4(记下液面),水浴加热,并不停摇动(不能蒸干,适当添水)
2. 硫酸亚铁的制备
把洗净的铁屑放入锥形瓶中,加入20ml 3mol/L 的H2SO4(记下液面),水浴加热,并不停摇动(不能蒸干,适当添水) 产生大量气泡,溶液逐渐变为浅绿色。放出有刺激性气味的气体。
当溶液呈浅绿色不冒出大量气泡时,趁热过滤,将滤液转移到蒸发皿中(残渣用少量蒸馏水洗2-3次)。 反应耗时较长,实际操作时加了20ml 3mol/L 的H2SO4,所以铁片可以反应完全,在残留少许铁屑时停止加热)反应时间约75min。 趁热过滤是避免晶体析出。残留铁屑称得约0.1g。
所以反应掉的Fe约为2.8g.
3. 硫酸亚铁铵的制备称硫酸铵6.6g(计算得),放在盛有硫酸亚铁溶液的蒸发皿中,适度搅拌,溶解后,加热蒸发浓缩,蒸发时控制火焰温度,缓缓加热。
3. 硫酸亚铁铵的制备称硫酸铵6.6g(计算得),放在盛有硫酸亚铁溶液的蒸发皿中,适度搅拌,溶解后,加热蒸发浓缩,蒸发时控制火焰温度,缓缓加热。 蒸发大约12min后,液面开始出现一层膜
3. 硫酸亚铁铵的制备: 称硫酸铵6.6g(计算得),放在盛有硫酸亚铁溶液的蒸发皿中,适度搅拌,溶解后,加热蒸发浓缩,蒸发时控制火焰温度,缓缓加热。 蒸发大约12min后,液面开始出现一层膜 溶解前适度搅拌是让硫酸亚铁与硫酸铵充分接触。控制火焰温度是防止晶体过热分解及局部氧化。
控制在酸性条件下进行,以避免亚铁离子水解。晶膜出现后,停止加热,静置冷却结晶,晶体用无水乙醇洗涤,放在两张干滤纸间压干,称重
控制在酸性条件下进行,以避免亚铁离子水解。晶膜出现后,停止加热,静置冷却结晶,晶体用无水乙醇洗涤,放在两张干滤纸间压干,称重 停止加热,放置冷却。有大量晶体析出。过滤得到浅蓝绿色晶体。
控制在酸性条件下进行,以避免亚铁离子水解。晶膜出现后,停止加热,静置冷却结晶,晶体用无水乙醇洗涤,放在两张干滤纸间压干,称重 停止加热,放置冷却。有大量晶体析出。过滤得到浅蓝绿色晶体。 出现晶膜后停止加热是避免其失去结晶水。
计算产率:
计算得理论产量应为为19.6g。实际称得产品约12.2g 。产率约为62% 。不过因为产品是用滤纸压干,会混有水份,实际产率应更低些。
实验体会:
1. 制备硫酸亚铁时要保持铁过量,水浴加热。
2. 硫酸亚铁铵的制备:加入硫酸铵后,应使其充分溶解后再往下进行。这样有利于保证产品的纯度。蒸发时要缓缓加热,以防局部过热。
3. 实验过程中应保持足够的酸度。如果溶液的酸性减弱,则亚铁盐(或铁盐)中Fe2+与水作用的程度将会增大。在制备(NH4)2SO4·FeSO4·6H2O过程中,为了使Fe2+ 不与水作用,溶液需要保持足够的酸度。
新课标人教版课件系列
《高中化学》
选修6
2.2《物质的制备》
课题二
物质的制备
第二单元 物质的获取
一.制备物质的一般的方法
思考与交流:
1.能够通过化学反应产生二氧化碳气体的物质有哪些?
①CaCO3+HCl ②CaCO3
③Na2CO3+H2SO4 ④NaHCO3
⑤C+O2 ⑥CxHyOz+O2
一.制备物质的一般的方法
2.制取CO2气体的实验中,以什么物质为反应物(原料)?为什么?
CaCO3+HCl
3.反应的装置是如何选择和安装的?
一.制备物质的一般的方法
4.如果要制备干燥的气体产物,应如何设计装置?
酸性:浓硫酸、P2O5、硅胶
一.制备物质的一般的方法
确定原料
反应原理
设计反应途径
选择合理的仪器和装置
分离提纯
控制
反应
条件
目标产品
每一个环节都会影响所制备物质的质和量,每一个环节应该注意什么问题呢?
1.确定原料
目标产物
原料:含有“子结构”
Cl2
NaCl:含有“Cl”
原料也可以是一些废弃物:
Eg:可以选择适当的催化剂和温度,
使泡沫塑料降解,得到燃料油和燃气
【实践活动】P23
1.确定原料
2.设计反应路径
用铜制取硝酸铜的最佳方案: (1 )根据提高原子利用率、减少环境污染、简化操作的原则 ,选择最佳反应路线。例如 : ①铜 +浓硝酸 ②铜 +稀硝酸
③铜 +氧→氧化铜 ;
氧化铜 +硝酸→硝酸铜
3.优化条件
分析P24“实践活动”,试剂和用量都相同时,操作方法不同,现象和结果有何异同?
(1)Al3++3OH-=Al(OH)3↓
(2) Al3++4OH-=AlO2-+2H2O
3AlO2- + Al3+ + 6H2O =4Al(OH)3↓
小结
设计物质制备的实验方案时,应该遵循的优化原则是:
原料廉价,原理绿色,
条件优化,仪器简单,
分离方便。
硫酸亚铁铵的制备
实验原理:
亚铁盐在空气中易被氧化,但形成复盐硫酸亚铁铵FeSO4·(NH4)2SO4·6H2O后可稳定存在。
FeSO4 + (NH4)2SO4 + 6H2O =
FeSO4·(NH4)2SO4·6H2O
而硫酸亚铁可由铁屑和稀硫酸反应制得。
Fe + H2SO4 = FeSO4 + H2↑
流程图:
废铁屑
废铁屑
①10%碳酸
钠处理
②过滤
15mL
3mol/L硫酸
硫酸
亚铁
④过滤
③水浴加热
硫酸
亚铁
硫酸铵
⑤蒸发
结晶
硫酸亚铁铵
实验步骤 实验现象 解释和结论
1.铁屑的洗净去油污
用台式天平称取3.0 g 铁屑,放入小烧杯中,加入15 ml 质量分数为10%碳酸钠溶液。 铁屑开始呈现银白色光泽。
小火加热约10 min 后,倾倒去碳酸钠碱性溶液,用自来水冲洗后,再用蒸馏水把铁屑冲洗洁净。干燥后称得铁屑为2.9g。 过后光泽度有所下降,煮的过程中有刺激性气味气体。
小火加热约10 min 后,倾倒去碳酸钠碱性溶液,用自来水冲洗后,再用蒸馏水把铁屑冲洗洁净。干燥后称得铁屑为2.9g。 过后光泽度有所下降,煮的过程中有刺激性气味气体。 刺激性气味气体源于油污。
2. 硫酸亚铁的制备
把洗净的铁屑放入锥形瓶中,加入20ml 3mol/L 的H2SO4(记下液面),水浴加热,并不停摇动(不能蒸干,适当添水)
2. 硫酸亚铁的制备
把洗净的铁屑放入锥形瓶中,加入20ml 3mol/L 的H2SO4(记下液面),水浴加热,并不停摇动(不能蒸干,适当添水) 产生大量气泡,溶液逐渐变为浅绿色。放出有刺激性气味的气体。
当溶液呈浅绿色不冒出大量气泡时,趁热过滤,将滤液转移到蒸发皿中(残渣用少量蒸馏水洗2-3次)。 反应耗时较长,实际操作时加了20ml 3mol/L 的H2SO4,所以铁片可以反应完全,在残留少许铁屑时停止加热)反应时间约75min。 趁热过滤是避免晶体析出。残留铁屑称得约0.1g。
所以反应掉的Fe约为2.8g.
3. 硫酸亚铁铵的制备称硫酸铵6.6g(计算得),放在盛有硫酸亚铁溶液的蒸发皿中,适度搅拌,溶解后,加热蒸发浓缩,蒸发时控制火焰温度,缓缓加热。
3. 硫酸亚铁铵的制备称硫酸铵6.6g(计算得),放在盛有硫酸亚铁溶液的蒸发皿中,适度搅拌,溶解后,加热蒸发浓缩,蒸发时控制火焰温度,缓缓加热。 蒸发大约12min后,液面开始出现一层膜
3. 硫酸亚铁铵的制备: 称硫酸铵6.6g(计算得),放在盛有硫酸亚铁溶液的蒸发皿中,适度搅拌,溶解后,加热蒸发浓缩,蒸发时控制火焰温度,缓缓加热。 蒸发大约12min后,液面开始出现一层膜 溶解前适度搅拌是让硫酸亚铁与硫酸铵充分接触。控制火焰温度是防止晶体过热分解及局部氧化。
控制在酸性条件下进行,以避免亚铁离子水解。晶膜出现后,停止加热,静置冷却结晶,晶体用无水乙醇洗涤,放在两张干滤纸间压干,称重
控制在酸性条件下进行,以避免亚铁离子水解。晶膜出现后,停止加热,静置冷却结晶,晶体用无水乙醇洗涤,放在两张干滤纸间压干,称重 停止加热,放置冷却。有大量晶体析出。过滤得到浅蓝绿色晶体。
控制在酸性条件下进行,以避免亚铁离子水解。晶膜出现后,停止加热,静置冷却结晶,晶体用无水乙醇洗涤,放在两张干滤纸间压干,称重 停止加热,放置冷却。有大量晶体析出。过滤得到浅蓝绿色晶体。 出现晶膜后停止加热是避免其失去结晶水。
计算产率:
计算得理论产量应为为19.6g。实际称得产品约12.2g 。产率约为62% 。不过因为产品是用滤纸压干,会混有水份,实际产率应更低些。
实验体会:
1. 制备硫酸亚铁时要保持铁过量,水浴加热。
2. 硫酸亚铁铵的制备:加入硫酸铵后,应使其充分溶解后再往下进行。这样有利于保证产品的纯度。蒸发时要缓缓加热,以防局部过热。
3. 实验过程中应保持足够的酸度。如果溶液的酸性减弱,则亚铁盐(或铁盐)中Fe2+与水作用的程度将会增大。在制备(NH4)2SO4·FeSO4·6H2O过程中,为了使Fe2+ 不与水作用,溶液需要保持足够的酸度。
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
