4.3《综合实验设计》PPT课件(新人教版-选修6)
文档属性
| 名称 | 4.3《综合实验设计》PPT课件(新人教版-选修6) |  | |
| 格式 | zip | ||
| 文件大小 | 308.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-13 17:24:51 | ||
图片预览








文档简介
(共30张PPT)
新课标人教版课件系列
《高中化学》
选修6
4.3《综合实验设计》
第四单元 研究型实验
课题三
综合实验设计
实践活动
现象
设计原理
当把胶头滴管里的水挤压进烧瓶中时,烧瓶里的气球逐渐鼓胀起来。
极易溶于水的氨气或HCl气体溶于水后,烧瓶里的气压变小,外边的空气经导管进入气球而使气球鼓胀,保持内外气压相等。
1、
2、
连接方式
实验时现象
设计原理
适用实验类型
U形气压计代替带气球的导管。
U管中红色水溶液左或右液面高低发生变化。
通过U管中红色水溶液左或右液面上升或降低,始终保持内外气压相等。
密闭容器内气压会改变的实验。
【思考与交流】
对教材中图4-4所示实验,可以做两方面改进:一是设法减少烧瓶内的压强;二是设法检测烧瓶内压强的变化。减少烧瓶内的压强,需制备收集纯净干燥氨气或氯化氢。因氨气或氯化氢有刺激性气味,污染空气,烧瓶中的气体可以改为二氧化碳,滴管中改为饱和氢氧化钠溶液。
另外,还可以使烧瓶中充满水蒸气,待冷却后,同样可发生气球自胀。
教材中图4-6微型导电测试笔使用纽扣电池实现了微型化,但纽扣电池的价格较普通电池高,可以考虑使用废旧小手电与普通干电池组装导电测试笔。
检测烧瓶内压强的变化,除可用气球外,还可以使用图4-5的气压计,即用气压计代替气球,观察气压计中液面变化,从而了解容器内压强变化。
本实验与喷泉实验原理相同。
图4-5检测气压变化的装置
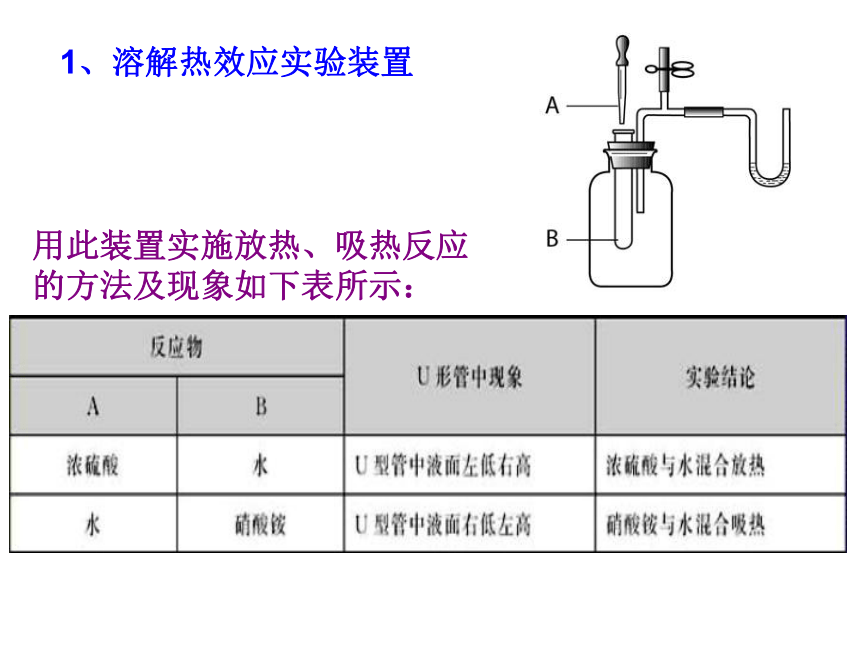
1、溶解热效应实验装置
用此装置实施放热、吸热反应的方法及现象如下表所示:
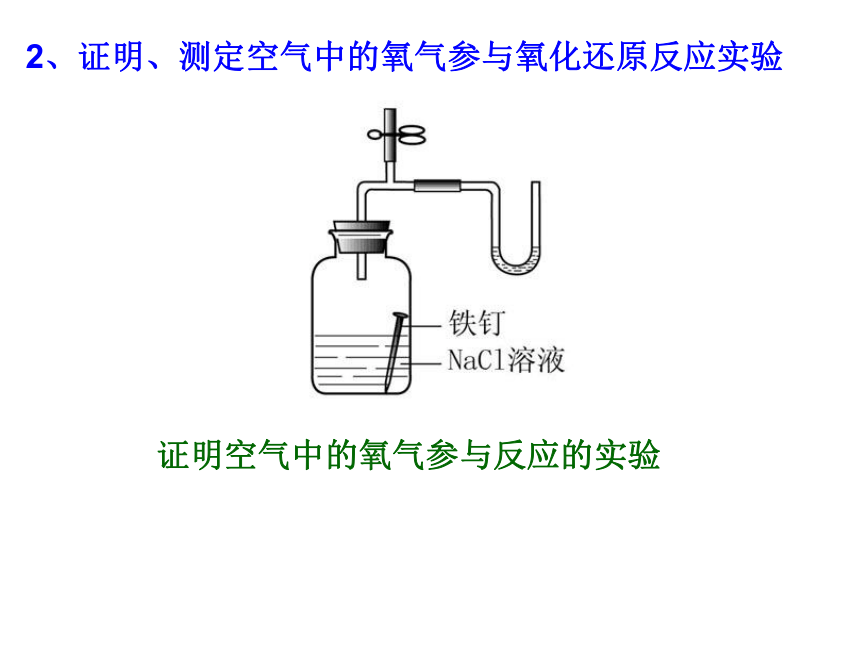
2、证明、测定空气中的氧气参与氧化还原反应实验
证明空气中的氧气参与反应的实验
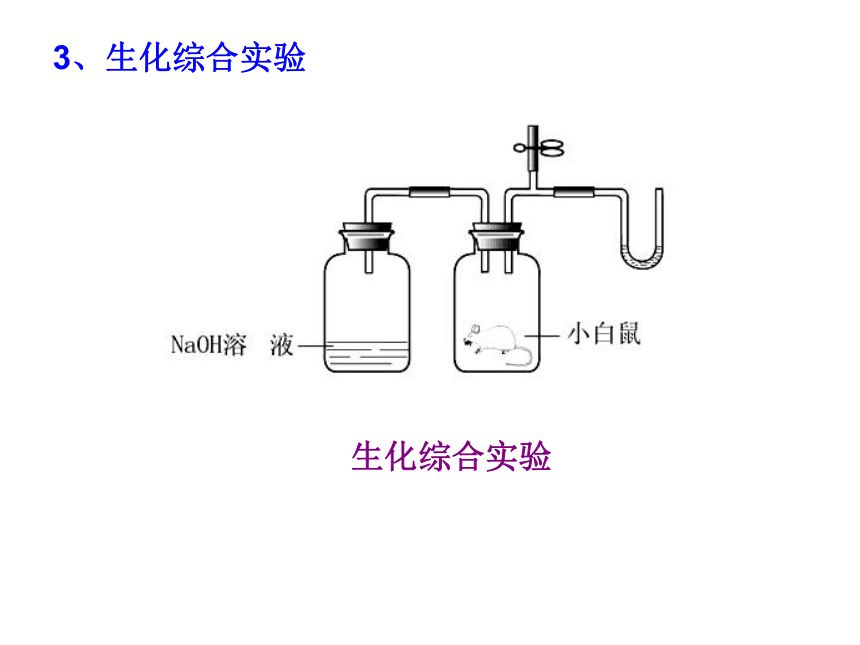
3、生化综合实验
生化综合实验
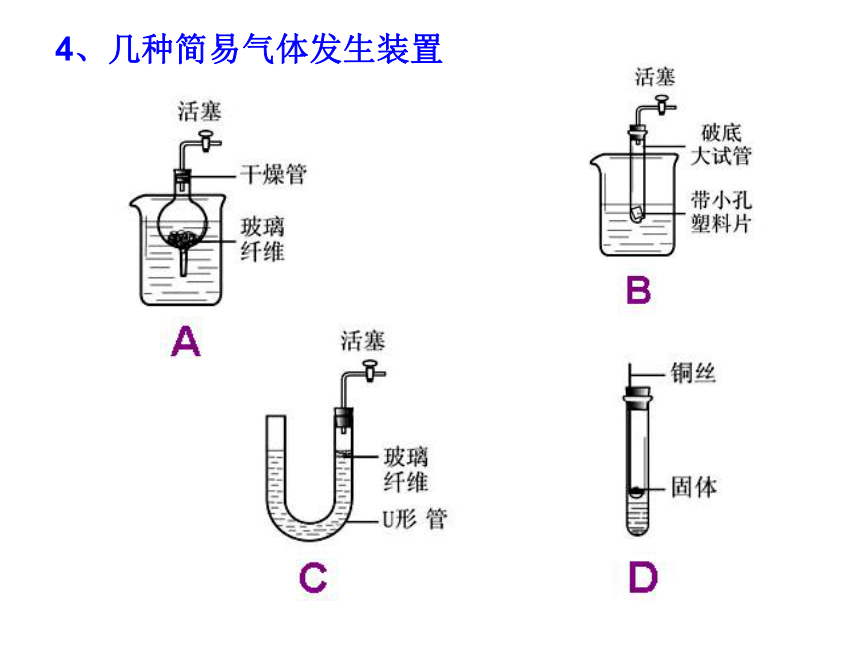
4、几种简易气体发生装置
化学实验方案的设计
近三年高考实验题及实验设计题
实验题分值 实验设计题及分值
2001年 30分 二氧化碳、硫化氢、氯化氢制取的设计 14分
2002年 28分 有机物中碳碳双键、醛基的检验,设计氨的喷泉实验 16分
2003年 22分 设计氢氧化亚铁的制取 22分
2004年《考试大纲》对实验设计考查的说明:
掌握实验的记录方法和运用化学知识设计一些基本实验:
1、根据实验现象观察、记录、分析或数据处理,得出正确结论。
2、根据实验试题要求,设计基本实验方案。
3、绘制和识别典型的实验仪器装置。
化学实验的设计与评价,近年来很受高考试题的垂青,这是高考中加强能力测试的必然方向。要求学生必须会根据反应原理、条件及相关反应物,选择合适的方法、顺序、仪器连接等,并会对实验方案实施评价。
一、回顾已学习的知识规律:
1、装置连接顺序:
① 实验装置的连接排列,一般应遵循:
在连接导管时: a 对制气装置、洗气瓶的进气管应 ;
b 干燥管应
气
水
c 量气装置的导管应
d 有易挥发液体反应或生成时,要设计 装置。
气体发生装置
除杂
干燥
主要性质实验
尾气的处理等程序。
气
“长进短出”
大口方向进气,小口出气 ;
“短进长出”;
冷凝回流
一、回顾已学习的知识规律
1、装置连接顺序
② 装配仪器时:
①实验装置的连接排列
加入试剂时:
实验开始时:
有些实验为防倒吸,往往最后停止加热或最后停止通气 ;
有些实验为防氧化往往最后停止通气。
③ 仪器拆卸的一般过程:
从下向上,从左往右;
先固后液 ;
先查仪器的气密性,
“从右到左,
再加药品,
后点酒精灯;
自上而下,
先拆主体,
后拆部件”。
一、回顾已学习的知识规律
3、装置的气密性的检查
关闭导气管上的活塞
从球形漏斗注入一定量的水
使漏斗中的水面高于容器中
的水面
(2)液差法——检查启普发生器气密性的简便方法:
(1)微热法
将导气管末端插入水中
用手握住烧瓶
导管末端有气泡产生
松开手后导管末端又有一段水柱上升。
静置片刻水面位置不变
1、装置连接顺序
2、操作顺序一般包括:
仪器连接
查气密性
装药品
仪器拆卸等。
防倒吸防氧化措施
实验
化学实验方案的设计
一、回顾已学习的知识规律
二、化学实验方案的基本内容:
1、实验名称
2、实验目的
3、实验原理
4、实验用品(仪器、药品及规格)
5、实验步骤 (包括仪器装配和操作)
6、实验现象及结果处理
7、问题和讨论
科学性
安全性
可行性
简约性
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求:
(即实验原理、操作程序和方法必须正确)
(即用药及操作要注意安全,注意环境保护等问题)
(要满足中学现有的实验条件)
(装置简单、步骤少、药品用量少、时间短等)
二、化学实验方案的基本内容
化学实验方案的设计
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求
二、化学实验方案的基本内容
四、实验设计的主要着手点:
例1、实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为mg)中氧化铜质量分数的方法,并填写表格中的有关内容。
实验可能用到的主要仪器:
(1)托盘天平 (2)启普发生器(3)硬质玻璃管(4)泥三角
(5)烧杯(6)坩埚(7)酒精灯(8)玻棒(9)漏斗(10)干燥管
实验可能用到的试剂: a.锌粒 b.稀硫酸 c.氯化钠溶液 d.浓硫酸
化学实验方案的设计
实验
方法 实验过程中所发生反应的化学方程式 实验所用仪器(用编号表示) 实验需直接测定的有关物理量(用文字说明)
1
2
……
实验可能用到的主要仪器:
(1)托盘天平 (2)启普发生器(3)硬质玻璃管(4)泥三角
(5)烧杯(6)坩埚(7)酒精灯(8)玻棒(9)漏斗(10)干燥管
实验可能用到的试剂: a.锌粒 b.稀硫酸 c.氯化钠溶液 d.浓硫酸
H2SO4+Cu O=CuSO4+H2O
(1)(5)(8)(9)
过滤后剩余固体的质量
H2SO4+Zn =ZnSO4+H2
H2+Cu O= Cu+H2O
(1)(2)(3)(7)
实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量)实验后Cu及硬质玻璃管的总质量
(1)(4)(6)(7)
(8)
实验前坩埚与样品总质量(或坩埚质量)
实验后坩埚与CuO总质量
2Cu+O2 =2CuO
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求
二、化学实验方案的基本内容
四、实验设计的主要着手点:
1、根据实验目的,阐明实验原理,选择合适的仪器和药品。
化学实验方案的设计
例2、工业上制纯碱时,第一步是通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶,它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl(饱和)=NaHCO3 +NH4Cl
以上反应的总结果是放热反应。请设计一个实验,用最简单的实验装置模拟实现这一过程,获得碳酸氢钠结晶。 可供选择的实验用品有:6mol L-1盐酸、6mol L-1硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,中学化学实验常用仪器。
(1)画出实验装置示意图(包括反应时容器中的物质),并在图中玻璃容器旁自左至右分别用A、B、C……符号标明(见题后说明)。
说明:①本题装置示意图中仪器可以用下面的方法表示。
敞口玻璃容器 有塞玻璃容器 玻璃漏斗 分液漏斗
玻璃导管 (但应标示在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的连接胶管等,在示意图中不必画出.如需加热,在需加热的仪器下方,标以“ ”表示。
(2)请写出在图上A、B、C……各玻璃容器中盛放物质的化学式或名称。
(3)利用本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐的结晶
(2)请写出在图上A、B、C……各玻璃容器中盛放物质的化学式或名称。
(3)利用本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐的结晶
A:CaCO3和6mol L-1的盐酸
取少量产品放在试管中用酒精灯加热至不再有气体放出时,停止加热,若有白色剩余物质,则所得到的产品不是NH4HCO3;待试管冷却后,向其中加入适量的盐酸,若产生大量气泡,说明产品为NaHCO3,若无气泡,则产品可能是食盐。
B:蒸馏水
C:冰水
D:被氯化钠饱和的浓氨水
E: 6mol L-1硫酸
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求
二、化学实验方案的基本内容
四、实验设计的主要着手点:
1、根据实验目的,阐明实验原理,选择合适的仪器和药品。
化学实验方案的设计
2、根据实验特点,设计实验装置,画出装置图。
例3、测量一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800mL烧杯、100mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g.cm-3)、水。按图示装置进行实验,回答下列问题。(设合金样品全部反应,产生的气体不超过100mL)
补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800mL烧杯底部,把短颈漏斗倒扣在样品上面。
②
③
…
例3、测量一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800mL烧杯、100mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g.cm-3)、水。按图示装置进行实验,回答下列问题。(设合金样品全部反应,产生的气体不超过100mL)
补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800mL烧杯底部,把短颈漏斗倒扣在样品上面。
②往烧杯中注入水,直到水面没过漏斗颈。
③在100mL量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈伸入量筒中。烧杯中水面到杯口至少保留约100mL空间。
④将长颈漏斗(或 玻璃棒)插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,至有气体产生。
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求
二、化学实验方案的基本内容
四、实验设计的主要着手点:
1、根据实验目的,阐明实验原理,选择合适的仪器和药品。
化学实验方案的设计
2、根据实验特点,设计实验装置,画出装置图。
3、根据实验要求,设计可行的操作步骤。
练习:某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图所示装置,对获得的铜粉(含炭)样品进行实验,图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
A
G
B
D
E
1、实验目的: 。
测定铜粉样品中铜的质量分数
2、实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱
石灰、浓硫酸等。
3、实验内容
实验步骤 实验现象 有关化学方程式
在G中加入样品粉末Wg,D中装入药品后并称量为m1g,连接好仪器后,检查气密性
打开A的活塞,慢慢滴加溶液
对G进行加热,当G中药品充分反应后,关闭A的活塞,停止加热
冷却后,称量D的质量为m2g
B,E中有气泡产生
G中红褐色粉末变成黑色
2H2O2 2H2O+O2
MnO2
2Cu+O2 =2CuO
C+O2 = CO2
4、计算:样品中铜的质量分数= 。(用含w,m1,m2的代数式表示)
科学性
安全性
可行性
简约性
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求
二、化学实验方案的基本内容
化学实验方案的设计
四、实验设计的主要着手点
1、根据实验目的,阐明实验原理,选择合适的仪器和药品
2、根据实验特点,设计实验装置,画出装置图
3、根据实验要求,设计可行的操作步骤
新课标人教版课件系列
《高中化学》
选修6
4.3《综合实验设计》
第四单元 研究型实验
课题三
综合实验设计
实践活动
现象
设计原理
当把胶头滴管里的水挤压进烧瓶中时,烧瓶里的气球逐渐鼓胀起来。
极易溶于水的氨气或HCl气体溶于水后,烧瓶里的气压变小,外边的空气经导管进入气球而使气球鼓胀,保持内外气压相等。
1、
2、
连接方式
实验时现象
设计原理
适用实验类型
U形气压计代替带气球的导管。
U管中红色水溶液左或右液面高低发生变化。
通过U管中红色水溶液左或右液面上升或降低,始终保持内外气压相等。
密闭容器内气压会改变的实验。
【思考与交流】
对教材中图4-4所示实验,可以做两方面改进:一是设法减少烧瓶内的压强;二是设法检测烧瓶内压强的变化。减少烧瓶内的压强,需制备收集纯净干燥氨气或氯化氢。因氨气或氯化氢有刺激性气味,污染空气,烧瓶中的气体可以改为二氧化碳,滴管中改为饱和氢氧化钠溶液。
另外,还可以使烧瓶中充满水蒸气,待冷却后,同样可发生气球自胀。
教材中图4-6微型导电测试笔使用纽扣电池实现了微型化,但纽扣电池的价格较普通电池高,可以考虑使用废旧小手电与普通干电池组装导电测试笔。
检测烧瓶内压强的变化,除可用气球外,还可以使用图4-5的气压计,即用气压计代替气球,观察气压计中液面变化,从而了解容器内压强变化。
本实验与喷泉实验原理相同。
图4-5检测气压变化的装置
1、溶解热效应实验装置
用此装置实施放热、吸热反应的方法及现象如下表所示:
2、证明、测定空气中的氧气参与氧化还原反应实验
证明空气中的氧气参与反应的实验
3、生化综合实验
生化综合实验
4、几种简易气体发生装置
化学实验方案的设计
近三年高考实验题及实验设计题
实验题分值 实验设计题及分值
2001年 30分 二氧化碳、硫化氢、氯化氢制取的设计 14分
2002年 28分 有机物中碳碳双键、醛基的检验,设计氨的喷泉实验 16分
2003年 22分 设计氢氧化亚铁的制取 22分
2004年《考试大纲》对实验设计考查的说明:
掌握实验的记录方法和运用化学知识设计一些基本实验:
1、根据实验现象观察、记录、分析或数据处理,得出正确结论。
2、根据实验试题要求,设计基本实验方案。
3、绘制和识别典型的实验仪器装置。
化学实验的设计与评价,近年来很受高考试题的垂青,这是高考中加强能力测试的必然方向。要求学生必须会根据反应原理、条件及相关反应物,选择合适的方法、顺序、仪器连接等,并会对实验方案实施评价。
一、回顾已学习的知识规律:
1、装置连接顺序:
① 实验装置的连接排列,一般应遵循:
在连接导管时: a 对制气装置、洗气瓶的进气管应 ;
b 干燥管应
气
水
c 量气装置的导管应
d 有易挥发液体反应或生成时,要设计 装置。
气体发生装置
除杂
干燥
主要性质实验
尾气的处理等程序。
气
“长进短出”
大口方向进气,小口出气 ;
“短进长出”;
冷凝回流
一、回顾已学习的知识规律
1、装置连接顺序
② 装配仪器时:
①实验装置的连接排列
加入试剂时:
实验开始时:
有些实验为防倒吸,往往最后停止加热或最后停止通气 ;
有些实验为防氧化往往最后停止通气。
③ 仪器拆卸的一般过程:
从下向上,从左往右;
先固后液 ;
先查仪器的气密性,
“从右到左,
再加药品,
后点酒精灯;
自上而下,
先拆主体,
后拆部件”。
一、回顾已学习的知识规律
3、装置的气密性的检查
关闭导气管上的活塞
从球形漏斗注入一定量的水
使漏斗中的水面高于容器中
的水面
(2)液差法——检查启普发生器气密性的简便方法:
(1)微热法
将导气管末端插入水中
用手握住烧瓶
导管末端有气泡产生
松开手后导管末端又有一段水柱上升。
静置片刻水面位置不变
1、装置连接顺序
2、操作顺序一般包括:
仪器连接
查气密性
装药品
仪器拆卸等。
防倒吸防氧化措施
实验
化学实验方案的设计
一、回顾已学习的知识规律
二、化学实验方案的基本内容:
1、实验名称
2、实验目的
3、实验原理
4、实验用品(仪器、药品及规格)
5、实验步骤 (包括仪器装配和操作)
6、实验现象及结果处理
7、问题和讨论
科学性
安全性
可行性
简约性
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求:
(即实验原理、操作程序和方法必须正确)
(即用药及操作要注意安全,注意环境保护等问题)
(要满足中学现有的实验条件)
(装置简单、步骤少、药品用量少、时间短等)
二、化学实验方案的基本内容
化学实验方案的设计
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求
二、化学实验方案的基本内容
四、实验设计的主要着手点:
例1、实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为mg)中氧化铜质量分数的方法,并填写表格中的有关内容。
实验可能用到的主要仪器:
(1)托盘天平 (2)启普发生器(3)硬质玻璃管(4)泥三角
(5)烧杯(6)坩埚(7)酒精灯(8)玻棒(9)漏斗(10)干燥管
实验可能用到的试剂: a.锌粒 b.稀硫酸 c.氯化钠溶液 d.浓硫酸
化学实验方案的设计
实验
方法 实验过程中所发生反应的化学方程式 实验所用仪器(用编号表示) 实验需直接测定的有关物理量(用文字说明)
1
2
……
实验可能用到的主要仪器:
(1)托盘天平 (2)启普发生器(3)硬质玻璃管(4)泥三角
(5)烧杯(6)坩埚(7)酒精灯(8)玻棒(9)漏斗(10)干燥管
实验可能用到的试剂: a.锌粒 b.稀硫酸 c.氯化钠溶液 d.浓硫酸
H2SO4+Cu O=CuSO4+H2O
(1)(5)(8)(9)
过滤后剩余固体的质量
H2SO4+Zn =ZnSO4+H2
H2+Cu O= Cu+H2O
(1)(2)(3)(7)
实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量)实验后Cu及硬质玻璃管的总质量
(1)(4)(6)(7)
(8)
实验前坩埚与样品总质量(或坩埚质量)
实验后坩埚与CuO总质量
2Cu+O2 =2CuO
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求
二、化学实验方案的基本内容
四、实验设计的主要着手点:
1、根据实验目的,阐明实验原理,选择合适的仪器和药品。
化学实验方案的设计
例2、工业上制纯碱时,第一步是通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶,它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O=NH4HCO3
NH4HCO3+NaCl(饱和)=NaHCO3 +NH4Cl
以上反应的总结果是放热反应。请设计一个实验,用最简单的实验装置模拟实现这一过程,获得碳酸氢钠结晶。 可供选择的实验用品有:6mol L-1盐酸、6mol L-1硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,中学化学实验常用仪器。
(1)画出实验装置示意图(包括反应时容器中的物质),并在图中玻璃容器旁自左至右分别用A、B、C……符号标明(见题后说明)。
说明:①本题装置示意图中仪器可以用下面的方法表示。
敞口玻璃容器 有塞玻璃容器 玻璃漏斗 分液漏斗
玻璃导管 (但应标示在液面上或液面下)
②铁架台、石棉网、酒精灯、玻璃导管之间的连接胶管等,在示意图中不必画出.如需加热,在需加热的仪器下方,标以“ ”表示。
(2)请写出在图上A、B、C……各玻璃容器中盛放物质的化学式或名称。
(3)利用本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐的结晶
(2)请写出在图上A、B、C……各玻璃容器中盛放物质的化学式或名称。
(3)利用本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐的结晶
A:CaCO3和6mol L-1的盐酸
取少量产品放在试管中用酒精灯加热至不再有气体放出时,停止加热,若有白色剩余物质,则所得到的产品不是NH4HCO3;待试管冷却后,向其中加入适量的盐酸,若产生大量气泡,说明产品为NaHCO3,若无气泡,则产品可能是食盐。
B:蒸馏水
C:冰水
D:被氯化钠饱和的浓氨水
E: 6mol L-1硫酸
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求
二、化学实验方案的基本内容
四、实验设计的主要着手点:
1、根据实验目的,阐明实验原理,选择合适的仪器和药品。
化学实验方案的设计
2、根据实验特点,设计实验装置,画出装置图。
例3、测量一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800mL烧杯、100mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g.cm-3)、水。按图示装置进行实验,回答下列问题。(设合金样品全部反应,产生的气体不超过100mL)
补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800mL烧杯底部,把短颈漏斗倒扣在样品上面。
②
③
…
例3、测量一定质量的铝锌合金与强酸溶液反应产生的氢气的体积,可以求得合金中铝和锌的质量分数。现有下列实验用品:中学化学实验常用仪器、800mL烧杯、100mL量筒、短颈玻璃漏斗、铜网、铝锌合金样品、浓盐酸(密度1.19g.cm-3)、水。按图示装置进行实验,回答下列问题。(设合金样品全部反应,产生的气体不超过100mL)
补充下列实验步骤,直到反应开始进行(铁架台和铁夹的安装可省略):
①将称量后的合金样品用铜网小心包裹好,放在800mL烧杯底部,把短颈漏斗倒扣在样品上面。
②往烧杯中注入水,直到水面没过漏斗颈。
③在100mL量筒中装满水,倒置在盛水的烧杯中(量筒中不应留有气泡),使漏斗颈伸入量筒中。烧杯中水面到杯口至少保留约100mL空间。
④将长颈漏斗(或 玻璃棒)插入烧杯并接近烧杯底部,通过它慢慢加入浓盐酸,至有气体产生。
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求
二、化学实验方案的基本内容
四、实验设计的主要着手点:
1、根据实验目的,阐明实验原理,选择合适的仪器和药品。
化学实验方案的设计
2、根据实验特点,设计实验装置,画出装置图。
3、根据实验要求,设计可行的操作步骤。
练习:某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图所示装置,对获得的铜粉(含炭)样品进行实验,图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
A
G
B
D
E
1、实验目的: 。
测定铜粉样品中铜的质量分数
2、实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱
石灰、浓硫酸等。
3、实验内容
实验步骤 实验现象 有关化学方程式
在G中加入样品粉末Wg,D中装入药品后并称量为m1g,连接好仪器后,检查气密性
打开A的活塞,慢慢滴加溶液
对G进行加热,当G中药品充分反应后,关闭A的活塞,停止加热
冷却后,称量D的质量为m2g
B,E中有气泡产生
G中红褐色粉末变成黑色
2H2O2 2H2O+O2
MnO2
2Cu+O2 =2CuO
C+O2 = CO2
4、计算:样品中铜的质量分数= 。(用含w,m1,m2的代数式表示)
科学性
安全性
可行性
简约性
一、回顾已学习的知识规律
三、设计化学实验时,应遵循四个基本要求
二、化学实验方案的基本内容
化学实验方案的设计
四、实验设计的主要着手点
1、根据实验目的,阐明实验原理,选择合适的仪器和药品
2、根据实验特点,设计实验装置,画出装置图
3、根据实验要求,设计可行的操作步骤
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
