4.0《研究型实验》PPT课件(新人教版-选修6)
文档属性
| 名称 | 4.0《研究型实验》PPT课件(新人教版-选修6) |  | |
| 格式 | zip | ||
| 文件大小 | 5.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-13 17:25:06 | ||
图片预览










文档简介
(共52张PPT)
新课标人教版课件系列
《高中化学》
选修6
第四单元
《研究型实验》
课题一
物质性质的探究
乙醇和苯的性质
课程标准
1、认识化学实验在学习与研究化学中的作用
2、具有安全意识,能顺利完成化学实验
3、能发现学习和生产、生活中有意义的化学问题,并进行实验探究
4、能根据具体情况设计解决化学问题的实验方案,并予以评价和优化
一、实验基本原理及其在实验化学中的地位
本实验从醇和酚的结构--官能团出发,探究了乙醇和苯酚的性质。从中我们认识到有机官能团对于有机物性质的决定作用,同时也认识到,由于两者连接的基团――烷烃基和苯基的差异,导致了具有相同的官能团的物质在性质上的巨大差异:物质的结构决定性质,性质必然反映结构特点,为我们在探究有机物的性质等方面提供了方法论上的指导作用。
三、实验目的:
1、通过观察苯酚晶体以及在水、乙醚中的溶解情况,认识苯酚的物理性质
2、通过乙醇与金属钠、脱水、氧化等实验进一步理解乙醇的结构,通过苯酚的化学性质实验,进一步体会苯酚与乙醇在性质上的差异
3、巩固试剂取用、溶解、振荡等基本实验操作
4、通过实验了解物质制取装置的特点,进一步巩固仪器的选用、装配和实验的基本操作
5、通过实验了解比较复杂实验设计的基本模式,并学习实验装置的连接方法
三、实验器材
仪器:试管、烧杯、分液漏斗、量筒、镊子、小刀、滤纸、温度计、导管、圆底烧瓶、锥形瓶、双孔橡胶塞、洗气瓶、试管夹、滴管、药匙、酒精灯、火柴、铁架台、铁圈、石棉网(单孔橡胶塞)
试剂:无水乙醇、金属钠、酚酞溶液、浓硫酸、2mol/LH2SO4溶液、2mol/LNaOH溶液、0.1mol/LFeCl3溶液、0.1mol/LKMnO4溶液、苯酚晶体、乙醚、5%K2CrO7溶液、稀盐酸、浓溴水、饱和NaHCO3溶液、沸石、CaCO3固体(40%甲醛溶液、浓氨水)
乙醇的性质
物理性质
1 颜色:
2 状态:
3 气味:
4 密度:
5 溶解性:与水 ,是很好的有机溶剂
二 化学性质
1 和金属 反应
2 和 发生取代反应
3 氧化反应:在空气中燃烧;
被氧化剂
4消去反应:分子内
5 酯化反应: 与乙酸在浓H2SO4催化下反应生成
钠
氢卤酸
氧化
脱水
乙酸乙酯
无色
液体
有特殊的香味
比水小
任意比互溶
苯酚的性质
物理性质
1 纯净的苯酚是 ,有特殊气味
2 常温时苯酚在水中的溶解度 ,当温度高于65℃时能跟水以 。苯酚易溶于酒精等有机溶剂中。
3 苯酚有毒,不慎沾到皮肤上,应立即用 洗涤。
二 化学性质
1 苯酚的酸性(石炭酸):能与金属 反应,能与 溶液反应
2 苯酚在空气中易 而变色略显粉红
3 苯环上的取代反应:与 反应
4 显色反应 :与 溶液反应
无色晶体
不大
任意比混溶
酒精
钠
碱性
被氧化
浓溴水
FeCl3
比较两者物理性质:
请用规范的操作从气味上识别无水乙醇和苯酚水溶液。
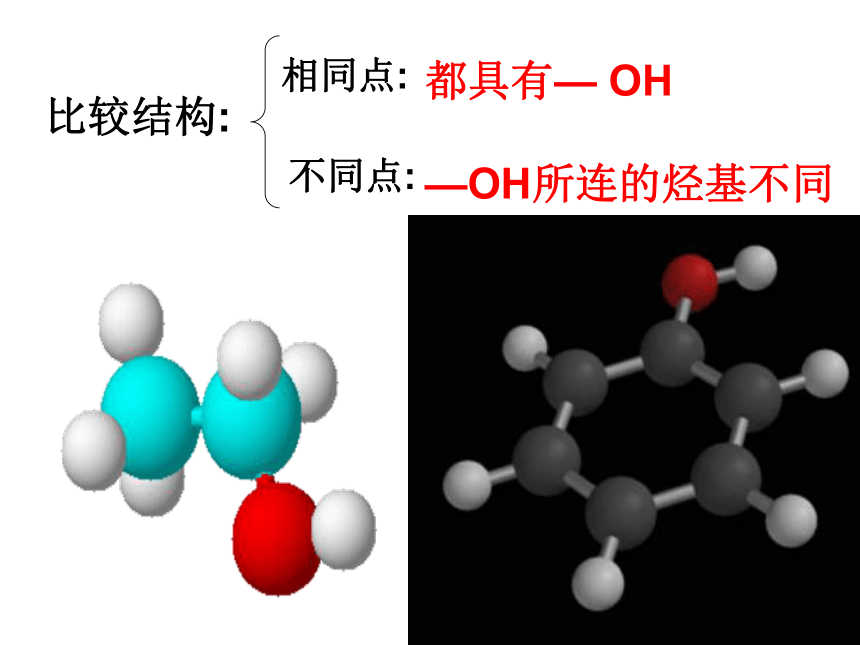
比较结构:
相同点:
不同点:
都具有— OH
—OH所连的烃基不同
实验内容 实验主要现象 实验结论 实验注意事项
1mLC2H5OH(2mL乙醚)+小块钠 钠沉在液体底部,并产生细小的气泡 钠可与乙醇反应生成气体 注意擦干金属钠表面的煤油
1.5gC6H5OH(2mL乙醚)+小块钠 钠浮在液面上四处游动,产生较多的气泡 钠可与苯酚反应生成气体 苯酚最好置于50℃左右热水中微热,以滴管取用一滴管,加入后充分振荡。
3-5滴K2Cr2O7(1mL
2mol/LH2SO4)滴入乙醇并振荡,微热 溶液从橙黄色变成蓝色 乙醇还原了K2Cr2O4生成了浅绿色的Cr2(SO4)2 也可用KMnO4(H+)溶液,效果更加明显
在如下附图一装置中加入15mL浓硫酸与乙醇(体积比3:1)的混合溶液,加入少量沸石,在洗气瓶中加入2mol/LNaOH溶液,迅速加热到170℃
①将生成的气体通入2mL溴水中
②将生成的气体通2mL0.1mol/L
KMnO4(H+)溶液中观察现象 (1)烧瓶中溶液逐渐变成黑色
(2)加热到170℃后产生大量气体,分别通入溴水、酸性KMnO4溶液中,两种溶液均迅速褪色 (1)乙醇在浓硫酸催化作用下,发生消去反应,生成气体乙烯
(2)乙烯被酸性KMnO4溶液氧化而使之褪色
(3)乙烯与溴水中的溴发生加成反应而使之褪色 (1)将浓硫酸与乙醇按比例预先混合可以节省时间,同时使实验更加安全
(2)加热时最好使用排灯,可以使温度更加迅速升高到170℃
(3)最好能在实验后采取措施将残余的C2H4气体加以处理,以教育学生提高环境保护意识。
苯酚的物理性质 溶解性 将少量苯酚(约0.5mL)加入2mL水中振荡,液体浑浊,加热,浑浊逐渐消失 苯酚在冷水中溶解度较小,温度升高溶解度增大 苯酚不宜太少
颜色状态气味 无色晶体,无气味 不纯净的苯酚为粉红色,且温度较高时为液体,有刺激性气味
*验证苯酚在不同温度下水中的溶解度
苯酚的化学性质(取前面配制的苯酚溶液数滴稀释到10mL待用) 取苯酚溶液2mL,滴入FeCl3溶液数滴 溶液变成紫色 苯酚遇到FeCl3会变成紫色 滴入FeCl3溶液数滴就可,FeCl3过多颜色加深反而会影响现象观察
取溶液2mL,滴加浓溴水 生成白色沉淀,振荡沉淀消失,继续加入又产生白色沉淀 苯酚和溴水可以反应 生成难溶于水的白色沉淀,此沉淀会溶于苯酚中 苯酚溶液越稀,白色沉淀的现象越明显
1、 如何证明苯酚的水溶液显酸性
2、 利用所给试剂:稀盐酸,大理石,饱和碳酸氢钠溶液,苯酚钠溶液,仪器自选。请你设计实验过程证明:盐酸,碳酸,苯酚的酸性强弱(可以简单画出装置图表达)
通过苯酚与NaOH溶液反应来证明
苯酚的酸性强弱:如附图二装置,在发生装置中加入CaCO3固体,分液漏斗中加入稀盐酸缓缓滴入锥形瓶中,将生成的气体中通入盛有C6H5ONa溶液的试管,观察现象 (1)烧瓶中产生大量气体
(2)盛有C6H5ONa溶液的试管中出现浑浊 根据复分解反应较强的酸可以制取相对较弱的酸的原则,证明酸性:
HCl>H2CO3>C6H5OH 盐酸不宜加入过快
稀盐酸
CaCO3固体
饱和NaHCO3
C6H5ONa溶液
通过实验证明:
(1)官能团决定有机物的性质
(2)官能团联接不同的基团对有机物性质有
不同的影响
你还能列举出有机分子中基团之间存在相互
影响的其他例子吗?
课题二
《身边化学问题的探究》
原电池实验的探究
第四单元 研究型实验
一、背景材料分析
(一)从现行教材看
子课题 1 原电池实验
子课题 2 制作氢氧燃料电池
子课题 3 金属的电化学腐蚀
拓展课题 干电池的模拟实验
课题1 原电池
教材资料:锌-铜-稀硫酸为材料的原电池。
专题作业:从理论上分析用铝-铜-氢氧化钠为材料,
能否形成原电池。
《化学2》第39~40页
《化学教学》2007(10)4页
《化学教育》2007(2)53页
(二)从学科指导看
基本要求:
通过原电池实验,加深对原电池工作原理的认识。
发展要求:
能根据已知的电池总反应式,判断电池的正负极,
书写电极反应式。
说 明:
电极的极化作用对原电池产生电流的影响只作一
般了解。
课时安排:
1 课时,(总 2 课时,制作氢氧燃料电池和析氢
腐蚀、吸氧腐蚀拟放在第二课时)
(三)从实验视角看
必修2第38页“化学能转变为电能的活动与探究”
一是电流微弱,
用灵敏检流计检测;
二是供电时间短暂,
电池的放电效率低;
三是锌极板有大量气泡,
干扰铜极板现象的观察。
(三)从实验视角看
选修3第12页“原电池的工作原理活动与探究”
克服了锌极板有大量气泡的现象
盐桥能说明内电路中离子的迁移
电流密度依然较小,不足以使小灯泡发亮
提出课题——用更有说服力的实验来证实
具有实际价值的电池
探究电池效率的因素,
放大电池的电流密度,
延长电池的工作时间,
。。。。。。。
二、实验基本原理
电子迁移
正极
负极
Cu2+ + 2e- = Cu
Zn - 2e- = Zn2+
电池反应 Zn + Cu2+ = Zn2+ + Cu
离子迁移
外电路
检流计
内电路
盐 桥
ZnSO4溶液
K+迁入
Cl- 迁入
CuSO4溶液
实验表明:
电池的电流密度的大小与电极的表面积、极板之
间的距离和介质等因素有关;
无论何种材料制作的原电池,电池的极化作用都
是很强的,极化作用会使电极的放电反应变得迟
钝,影响电池的工作时间,而去极化剂(如高锰
酸钾、重铬酸钾和过氧化氢等氧化剂)由于有效
降低了电极的极化作用,提高了电池的放电效率。
为此设计了如下图的实验装置。
铜锌原电池
三、实验操作要点
1.装置的组装
取一块锌片(6cm×3.3cm)和一块铜片
(6cm×3.3cm),两者之间放一块海绵(厚度2cm),
用橡皮筋固定好,用导线把小灯泡(2.5V 0.3A)和
锌片、铜片连接起来,插入放有50ml蒸馏水的100ml
小烧杯中,组装这样的装置多个备用。
2.去极化剂的选择
向三个装置中分别加入 10ml 的稀硫酸,编号为甲
乙、丙,观察小灯泡是否发光。
向甲装置中加入 5ml 3% 的双氧水,振荡溶液,
记录小灯泡发光的时间和亮度。
向乙装置中加入 0.5 g 的重铬酸钾晶体,振荡溶液,
记录小灯泡发光的时间和亮度。
向丙装置中加入 0.5 g 的高锰酸钾晶体,振荡溶液,
记录小灯泡发光的时间和亮度。
2.去极化剂的选择
加入物质 小灯泡发光的时间 小灯泡发光的亮度 实验结论
5ml 3%的双氧水 约6 min 灯丝亮 重铬酸钾
效果最好
0.5 g
重铬酸钾 约13 min 三者中最亮
0.5 g
高锰酸钾 约4 min 较双氧水亮
3.电极材料的选择
电极材料:Zn-C(直径1.1cm),与Zn-Cu对比
溶液介质:稀硫酸
去极化剂:重铬酸钾晶体
电极材料:Al -C (直径1.1cm),与Al-Cu对比
溶液介质:稀盐酸
去极化剂:重铬酸钾晶体
按照上述实验装置和操作方法进行实验,观察现象。
3.电极材料的选择
电极材料 电解液 小灯泡发光的亮度 实验结论
Zn - C 稀硫酸 亮,可照明 碳电极
优于
铜电极
Al - C 稀盐酸 亮,可照明
4.溶液介质的选择
Zn-C-NaOH: 小灯泡不亮,检流计偏转。
Al-C-NaOH: 小灯泡不亮,两极有气泡。
电极材料:Zn - C(直径1.1cm) ,Al - C
溶液介质:加入约 10 g 氢氧化钠固体
去极化剂:重铬酸钾晶体
按照上述实验装置和操作方法进行实验,观察实验
现象。
四、实验注意事项
1.电解质用浓硫酸或固体氢氧化钠立即加水配制成溶
液,由于它们溶解放热,形成热的介质,加快了电
极反应。
2.如要灯泡持续发亮,不断振荡是关键。可以用电极
搅拌溶液。海绵比两极板稍长,以防碰破烧杯底。
锌片和铜片先用碱液处理,再用酸液处理,然后用
蒸馏水漂洗。
第四单元 研究型实验
课题三
综合实验设计
实践活动
现象
设计原理
当把胶头滴管里的水挤压进烧瓶中时,烧瓶里的气球逐渐鼓胀起来。
极易溶于水的氨气或HCl气体溶于水后,烧瓶里的气压变小,外边的空气经导管进入气球而使气球鼓胀,保持内外气压相等。
1、
2、
连接方式
实验时现象
设计原理
适用实验类型
U形气压计代替带气球的导管。
U管中红色水溶液左或右液面高低发生变化。
通过U管中红色水溶液左或右液面上升或降低,始终保持内外气压相等。
密闭容器内气压会改变的实验。
【思考与交流】
对教材中图4-4所示实验,可以做两方面改进:一是设法减少烧瓶内的压强;二是设法检测烧瓶内压强的变化。减少烧瓶内的压强,需制备收集纯净干燥氨气或氯化氢。因氨气或氯化氢有刺激性气味,污染空气,烧瓶中的气体可以改为二氧化碳,滴管中改为饱和氢氧化钠溶液。
另外,还可以使烧瓶中充满水蒸气,待冷却后,同样可发生气球自胀。
教材中图4-6微型导电测试笔使用纽扣电池实现了微型化,但纽扣电池的价格较普通电池高,可以考虑使用废旧小手电与普通干电池组装导电测试笔。
检测烧瓶内压强的变化,除可用气球外,还可以使用图4-5的气压计,即用气压计代替气球,观察气压计中液面变化,从而了解容器内压强变化。
本实验与喷泉实验原理相同。
图4-5检测气压变化的装置
1、溶解热效应实验装置
用此装置实施放热、吸热反应的方法及现象如下表所示:
2、证明、测定空气中的氧气参与氧化还原反应实验
证明空气中的氧气参与反应的实验
3、生化综合实验
生化综合实验
4、几种简易气体发生装置
新课标人教版课件系列
《高中化学》
选修6
第四单元
《研究型实验》
课题一
物质性质的探究
乙醇和苯的性质
课程标准
1、认识化学实验在学习与研究化学中的作用
2、具有安全意识,能顺利完成化学实验
3、能发现学习和生产、生活中有意义的化学问题,并进行实验探究
4、能根据具体情况设计解决化学问题的实验方案,并予以评价和优化
一、实验基本原理及其在实验化学中的地位
本实验从醇和酚的结构--官能团出发,探究了乙醇和苯酚的性质。从中我们认识到有机官能团对于有机物性质的决定作用,同时也认识到,由于两者连接的基团――烷烃基和苯基的差异,导致了具有相同的官能团的物质在性质上的巨大差异:物质的结构决定性质,性质必然反映结构特点,为我们在探究有机物的性质等方面提供了方法论上的指导作用。
三、实验目的:
1、通过观察苯酚晶体以及在水、乙醚中的溶解情况,认识苯酚的物理性质
2、通过乙醇与金属钠、脱水、氧化等实验进一步理解乙醇的结构,通过苯酚的化学性质实验,进一步体会苯酚与乙醇在性质上的差异
3、巩固试剂取用、溶解、振荡等基本实验操作
4、通过实验了解物质制取装置的特点,进一步巩固仪器的选用、装配和实验的基本操作
5、通过实验了解比较复杂实验设计的基本模式,并学习实验装置的连接方法
三、实验器材
仪器:试管、烧杯、分液漏斗、量筒、镊子、小刀、滤纸、温度计、导管、圆底烧瓶、锥形瓶、双孔橡胶塞、洗气瓶、试管夹、滴管、药匙、酒精灯、火柴、铁架台、铁圈、石棉网(单孔橡胶塞)
试剂:无水乙醇、金属钠、酚酞溶液、浓硫酸、2mol/LH2SO4溶液、2mol/LNaOH溶液、0.1mol/LFeCl3溶液、0.1mol/LKMnO4溶液、苯酚晶体、乙醚、5%K2CrO7溶液、稀盐酸、浓溴水、饱和NaHCO3溶液、沸石、CaCO3固体(40%甲醛溶液、浓氨水)
乙醇的性质
物理性质
1 颜色:
2 状态:
3 气味:
4 密度:
5 溶解性:与水 ,是很好的有机溶剂
二 化学性质
1 和金属 反应
2 和 发生取代反应
3 氧化反应:在空气中燃烧;
被氧化剂
4消去反应:分子内
5 酯化反应: 与乙酸在浓H2SO4催化下反应生成
钠
氢卤酸
氧化
脱水
乙酸乙酯
无色
液体
有特殊的香味
比水小
任意比互溶
苯酚的性质
物理性质
1 纯净的苯酚是 ,有特殊气味
2 常温时苯酚在水中的溶解度 ,当温度高于65℃时能跟水以 。苯酚易溶于酒精等有机溶剂中。
3 苯酚有毒,不慎沾到皮肤上,应立即用 洗涤。
二 化学性质
1 苯酚的酸性(石炭酸):能与金属 反应,能与 溶液反应
2 苯酚在空气中易 而变色略显粉红
3 苯环上的取代反应:与 反应
4 显色反应 :与 溶液反应
无色晶体
不大
任意比混溶
酒精
钠
碱性
被氧化
浓溴水
FeCl3
比较两者物理性质:
请用规范的操作从气味上识别无水乙醇和苯酚水溶液。
比较结构:
相同点:
不同点:
都具有— OH
—OH所连的烃基不同
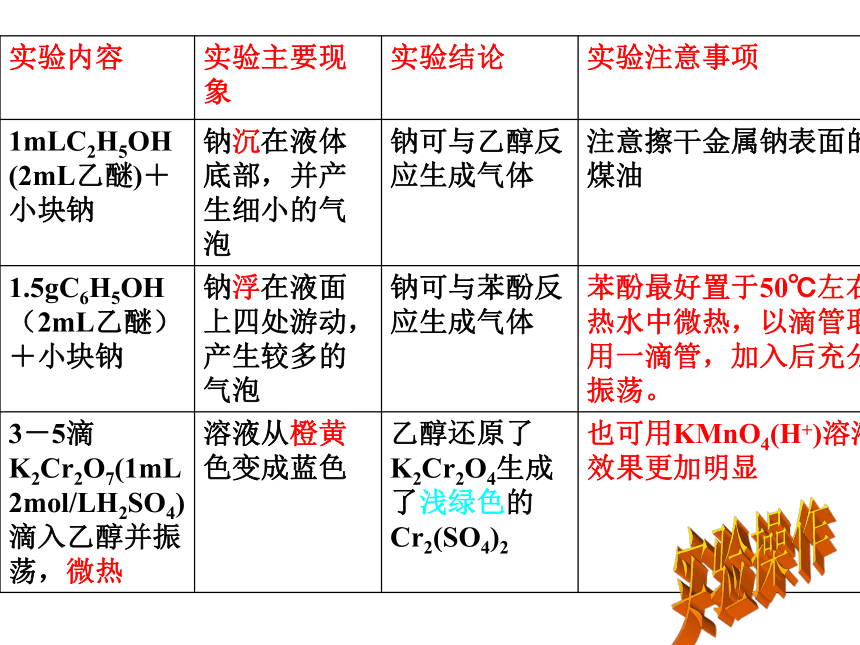
实验内容 实验主要现象 实验结论 实验注意事项
1mLC2H5OH(2mL乙醚)+小块钠 钠沉在液体底部,并产生细小的气泡 钠可与乙醇反应生成气体 注意擦干金属钠表面的煤油
1.5gC6H5OH(2mL乙醚)+小块钠 钠浮在液面上四处游动,产生较多的气泡 钠可与苯酚反应生成气体 苯酚最好置于50℃左右热水中微热,以滴管取用一滴管,加入后充分振荡。
3-5滴K2Cr2O7(1mL
2mol/LH2SO4)滴入乙醇并振荡,微热 溶液从橙黄色变成蓝色 乙醇还原了K2Cr2O4生成了浅绿色的Cr2(SO4)2 也可用KMnO4(H+)溶液,效果更加明显
在如下附图一装置中加入15mL浓硫酸与乙醇(体积比3:1)的混合溶液,加入少量沸石,在洗气瓶中加入2mol/LNaOH溶液,迅速加热到170℃
①将生成的气体通入2mL溴水中
②将生成的气体通2mL0.1mol/L
KMnO4(H+)溶液中观察现象 (1)烧瓶中溶液逐渐变成黑色
(2)加热到170℃后产生大量气体,分别通入溴水、酸性KMnO4溶液中,两种溶液均迅速褪色 (1)乙醇在浓硫酸催化作用下,发生消去反应,生成气体乙烯
(2)乙烯被酸性KMnO4溶液氧化而使之褪色
(3)乙烯与溴水中的溴发生加成反应而使之褪色 (1)将浓硫酸与乙醇按比例预先混合可以节省时间,同时使实验更加安全
(2)加热时最好使用排灯,可以使温度更加迅速升高到170℃
(3)最好能在实验后采取措施将残余的C2H4气体加以处理,以教育学生提高环境保护意识。
苯酚的物理性质 溶解性 将少量苯酚(约0.5mL)加入2mL水中振荡,液体浑浊,加热,浑浊逐渐消失 苯酚在冷水中溶解度较小,温度升高溶解度增大 苯酚不宜太少
颜色状态气味 无色晶体,无气味 不纯净的苯酚为粉红色,且温度较高时为液体,有刺激性气味
*验证苯酚在不同温度下水中的溶解度
苯酚的化学性质(取前面配制的苯酚溶液数滴稀释到10mL待用) 取苯酚溶液2mL,滴入FeCl3溶液数滴 溶液变成紫色 苯酚遇到FeCl3会变成紫色 滴入FeCl3溶液数滴就可,FeCl3过多颜色加深反而会影响现象观察
取溶液2mL,滴加浓溴水 生成白色沉淀,振荡沉淀消失,继续加入又产生白色沉淀 苯酚和溴水可以反应 生成难溶于水的白色沉淀,此沉淀会溶于苯酚中 苯酚溶液越稀,白色沉淀的现象越明显
1、 如何证明苯酚的水溶液显酸性
2、 利用所给试剂:稀盐酸,大理石,饱和碳酸氢钠溶液,苯酚钠溶液,仪器自选。请你设计实验过程证明:盐酸,碳酸,苯酚的酸性强弱(可以简单画出装置图表达)
通过苯酚与NaOH溶液反应来证明
苯酚的酸性强弱:如附图二装置,在发生装置中加入CaCO3固体,分液漏斗中加入稀盐酸缓缓滴入锥形瓶中,将生成的气体中通入盛有C6H5ONa溶液的试管,观察现象 (1)烧瓶中产生大量气体
(2)盛有C6H5ONa溶液的试管中出现浑浊 根据复分解反应较强的酸可以制取相对较弱的酸的原则,证明酸性:
HCl>H2CO3>C6H5OH 盐酸不宜加入过快
稀盐酸
CaCO3固体
饱和NaHCO3
C6H5ONa溶液
通过实验证明:
(1)官能团决定有机物的性质
(2)官能团联接不同的基团对有机物性质有
不同的影响
你还能列举出有机分子中基团之间存在相互
影响的其他例子吗?
课题二
《身边化学问题的探究》
原电池实验的探究
第四单元 研究型实验
一、背景材料分析
(一)从现行教材看
子课题 1 原电池实验
子课题 2 制作氢氧燃料电池
子课题 3 金属的电化学腐蚀
拓展课题 干电池的模拟实验
课题1 原电池
教材资料:锌-铜-稀硫酸为材料的原电池。
专题作业:从理论上分析用铝-铜-氢氧化钠为材料,
能否形成原电池。
《化学2》第39~40页
《化学教学》2007(10)4页
《化学教育》2007(2)53页
(二)从学科指导看
基本要求:
通过原电池实验,加深对原电池工作原理的认识。
发展要求:
能根据已知的电池总反应式,判断电池的正负极,
书写电极反应式。
说 明:
电极的极化作用对原电池产生电流的影响只作一
般了解。
课时安排:
1 课时,(总 2 课时,制作氢氧燃料电池和析氢
腐蚀、吸氧腐蚀拟放在第二课时)
(三)从实验视角看
必修2第38页“化学能转变为电能的活动与探究”
一是电流微弱,
用灵敏检流计检测;
二是供电时间短暂,
电池的放电效率低;
三是锌极板有大量气泡,
干扰铜极板现象的观察。
(三)从实验视角看
选修3第12页“原电池的工作原理活动与探究”
克服了锌极板有大量气泡的现象
盐桥能说明内电路中离子的迁移
电流密度依然较小,不足以使小灯泡发亮
提出课题——用更有说服力的实验来证实
具有实际价值的电池
探究电池效率的因素,
放大电池的电流密度,
延长电池的工作时间,
。。。。。。。
二、实验基本原理
电子迁移
正极
负极
Cu2+ + 2e- = Cu
Zn - 2e- = Zn2+
电池反应 Zn + Cu2+ = Zn2+ + Cu
离子迁移
外电路
检流计
内电路
盐 桥
ZnSO4溶液
K+迁入
Cl- 迁入
CuSO4溶液
实验表明:
电池的电流密度的大小与电极的表面积、极板之
间的距离和介质等因素有关;
无论何种材料制作的原电池,电池的极化作用都
是很强的,极化作用会使电极的放电反应变得迟
钝,影响电池的工作时间,而去极化剂(如高锰
酸钾、重铬酸钾和过氧化氢等氧化剂)由于有效
降低了电极的极化作用,提高了电池的放电效率。
为此设计了如下图的实验装置。
铜锌原电池
三、实验操作要点
1.装置的组装
取一块锌片(6cm×3.3cm)和一块铜片
(6cm×3.3cm),两者之间放一块海绵(厚度2cm),
用橡皮筋固定好,用导线把小灯泡(2.5V 0.3A)和
锌片、铜片连接起来,插入放有50ml蒸馏水的100ml
小烧杯中,组装这样的装置多个备用。
2.去极化剂的选择
向三个装置中分别加入 10ml 的稀硫酸,编号为甲
乙、丙,观察小灯泡是否发光。
向甲装置中加入 5ml 3% 的双氧水,振荡溶液,
记录小灯泡发光的时间和亮度。
向乙装置中加入 0.5 g 的重铬酸钾晶体,振荡溶液,
记录小灯泡发光的时间和亮度。
向丙装置中加入 0.5 g 的高锰酸钾晶体,振荡溶液,
记录小灯泡发光的时间和亮度。
2.去极化剂的选择
加入物质 小灯泡发光的时间 小灯泡发光的亮度 实验结论
5ml 3%的双氧水 约6 min 灯丝亮 重铬酸钾
效果最好
0.5 g
重铬酸钾 约13 min 三者中最亮
0.5 g
高锰酸钾 约4 min 较双氧水亮
3.电极材料的选择
电极材料:Zn-C(直径1.1cm),与Zn-Cu对比
溶液介质:稀硫酸
去极化剂:重铬酸钾晶体
电极材料:Al -C (直径1.1cm),与Al-Cu对比
溶液介质:稀盐酸
去极化剂:重铬酸钾晶体
按照上述实验装置和操作方法进行实验,观察现象。
3.电极材料的选择
电极材料 电解液 小灯泡发光的亮度 实验结论
Zn - C 稀硫酸 亮,可照明 碳电极
优于
铜电极
Al - C 稀盐酸 亮,可照明
4.溶液介质的选择
Zn-C-NaOH: 小灯泡不亮,检流计偏转。
Al-C-NaOH: 小灯泡不亮,两极有气泡。
电极材料:Zn - C(直径1.1cm) ,Al - C
溶液介质:加入约 10 g 氢氧化钠固体
去极化剂:重铬酸钾晶体
按照上述实验装置和操作方法进行实验,观察实验
现象。
四、实验注意事项
1.电解质用浓硫酸或固体氢氧化钠立即加水配制成溶
液,由于它们溶解放热,形成热的介质,加快了电
极反应。
2.如要灯泡持续发亮,不断振荡是关键。可以用电极
搅拌溶液。海绵比两极板稍长,以防碰破烧杯底。
锌片和铜片先用碱液处理,再用酸液处理,然后用
蒸馏水漂洗。
第四单元 研究型实验
课题三
综合实验设计
实践活动
现象
设计原理
当把胶头滴管里的水挤压进烧瓶中时,烧瓶里的气球逐渐鼓胀起来。
极易溶于水的氨气或HCl气体溶于水后,烧瓶里的气压变小,外边的空气经导管进入气球而使气球鼓胀,保持内外气压相等。
1、
2、
连接方式
实验时现象
设计原理
适用实验类型
U形气压计代替带气球的导管。
U管中红色水溶液左或右液面高低发生变化。
通过U管中红色水溶液左或右液面上升或降低,始终保持内外气压相等。
密闭容器内气压会改变的实验。
【思考与交流】
对教材中图4-4所示实验,可以做两方面改进:一是设法减少烧瓶内的压强;二是设法检测烧瓶内压强的变化。减少烧瓶内的压强,需制备收集纯净干燥氨气或氯化氢。因氨气或氯化氢有刺激性气味,污染空气,烧瓶中的气体可以改为二氧化碳,滴管中改为饱和氢氧化钠溶液。
另外,还可以使烧瓶中充满水蒸气,待冷却后,同样可发生气球自胀。
教材中图4-6微型导电测试笔使用纽扣电池实现了微型化,但纽扣电池的价格较普通电池高,可以考虑使用废旧小手电与普通干电池组装导电测试笔。
检测烧瓶内压强的变化,除可用气球外,还可以使用图4-5的气压计,即用气压计代替气球,观察气压计中液面变化,从而了解容器内压强变化。
本实验与喷泉实验原理相同。
图4-5检测气压变化的装置
1、溶解热效应实验装置
用此装置实施放热、吸热反应的方法及现象如下表所示:
2、证明、测定空气中的氧气参与氧化还原反应实验
证明空气中的氧气参与反应的实验
3、生化综合实验
生化综合实验
4、几种简易气体发生装置
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
