第一单元 溶液 能力提升_2021-2022学年鲁教版(五四制)九年级全一册化学单元测试卷(含解析)
文档属性
| 名称 | 第一单元 溶液 能力提升_2021-2022学年鲁教版(五四制)九年级全一册化学单元测试卷(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 365.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-28 10:46:33 | ||
图片预览

文档简介
第一单元
溶液
能力提升
—2021-2022学年鲁教版(五四制)九年级全一册化学单元测试卷
(时间:
45分钟
满分:100分)
一、选择题:本大题共15小题,每小题4分,共60分
1.下列生活中的现象,与原溶质溶解性无关的是(
)
A.揭开啤酒瓶盖,有大量气泡溢出
B.盛石灰水的瓶口有一层白膜
C.烧开水时,沸腾前有大量气泡
D.咸菜长期放置在空气中,表面有一层“白霜”
2.下列关于乳化说法正确的是(
)
A.利用乳化作用将油污溶解而除去
B.向植物油与水的混合物中加入乳化剂,可得到溶液
C.用醋洗去水壶里的水垢是乳化现象
D.洗洁精能够除去油污,是因为洗洁精能使油污分散成细小的油滴,随水流走
3.在实验室欲将80g溶质质量分数为25%的蔗糖溶液浓度增大至40%,简单易行的方法是(
)
A.再溶解20g蔗糖
B.恒温蒸发25mL水
C.再溶解40g蔗糖
D.恒温蒸发40mL水
4.下列现象不能说明气体的溶解度随温度升高而减小的是(
)
A.天气闷热时,池塘里的鱼浮出水面
B.喝下汽水时,感到有气体冲击胃,易打嗝
C.打开啤酒瓶盖,有大量气泡逸出
D.烧开水时,沸腾前有气泡逸出
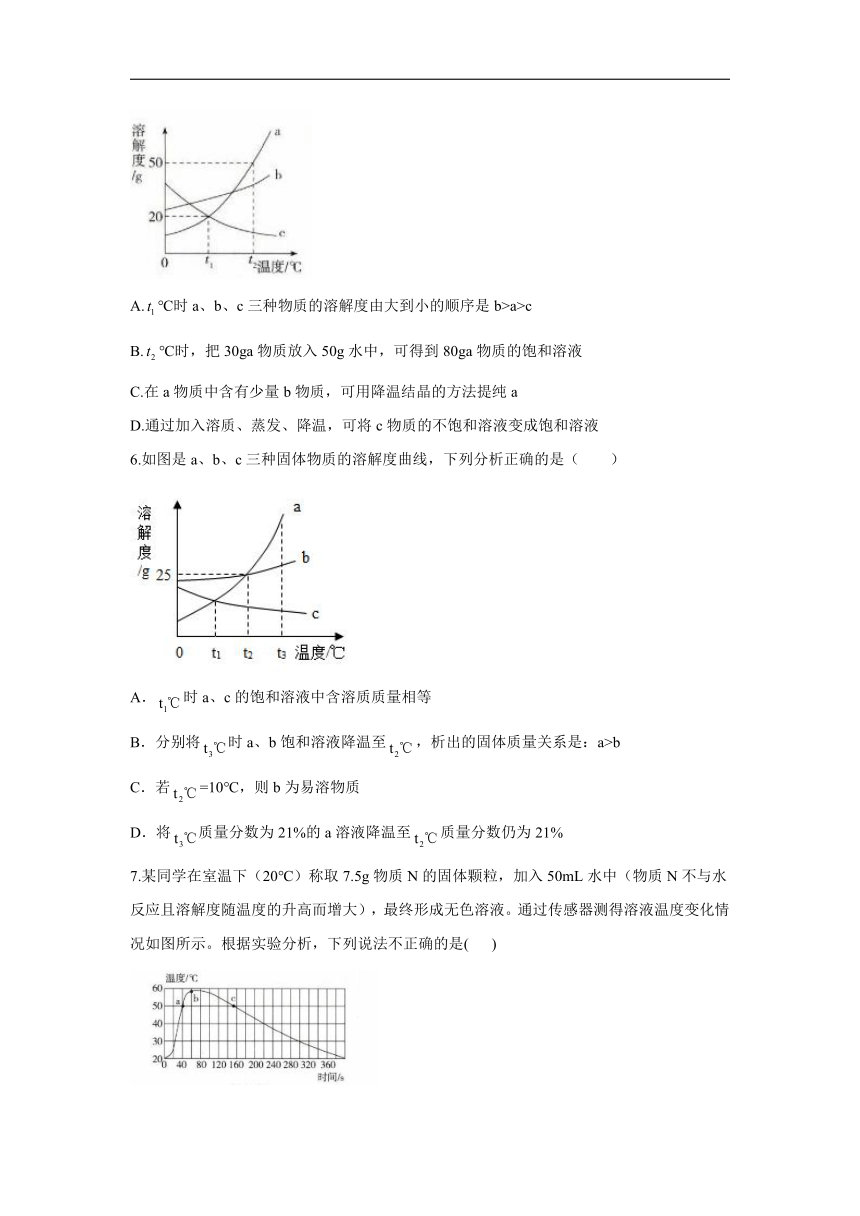
5.如图是a、b、c三种物质的溶解度曲线。下列说法正确的是(
)
A.℃时a、b、c三种物质的溶解度由大到小的顺序是b>a>c
B.℃时,把30ga物质放入50g水中,可得到80ga物质的饱和溶液
C.在a物质中含有少量b物质,可用降温结晶的方法提纯a
D.通过加入溶质、蒸发、降温,可将c物质的不饱和溶液变成饱和溶液
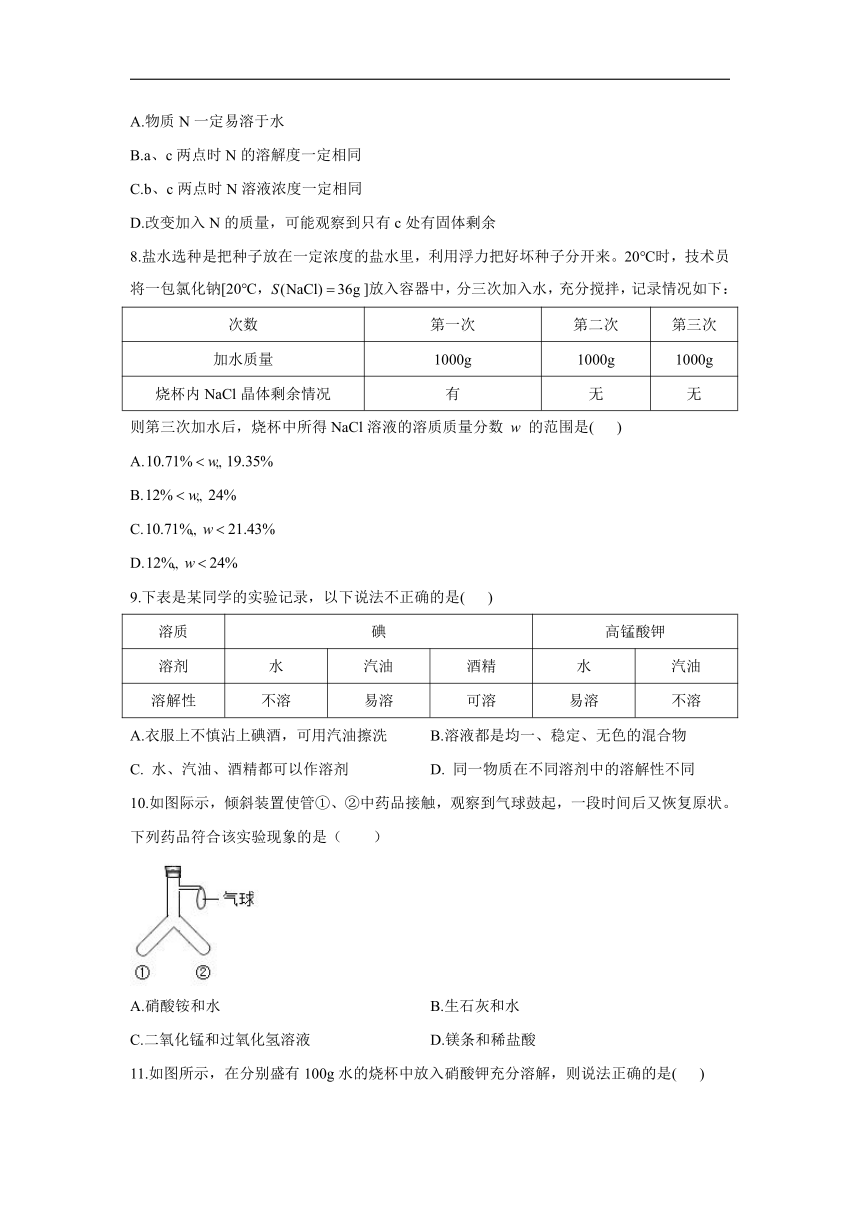
6.如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是( )
A.时a、c的饱和溶液中含溶质质量相等
B.分别将时a、b饱和溶液降温至,析出的固体质量关系是:a>b
C.若=10℃,则b为易溶物质
D.将质量分数为21%的a溶液降温至质量分数仍为21%
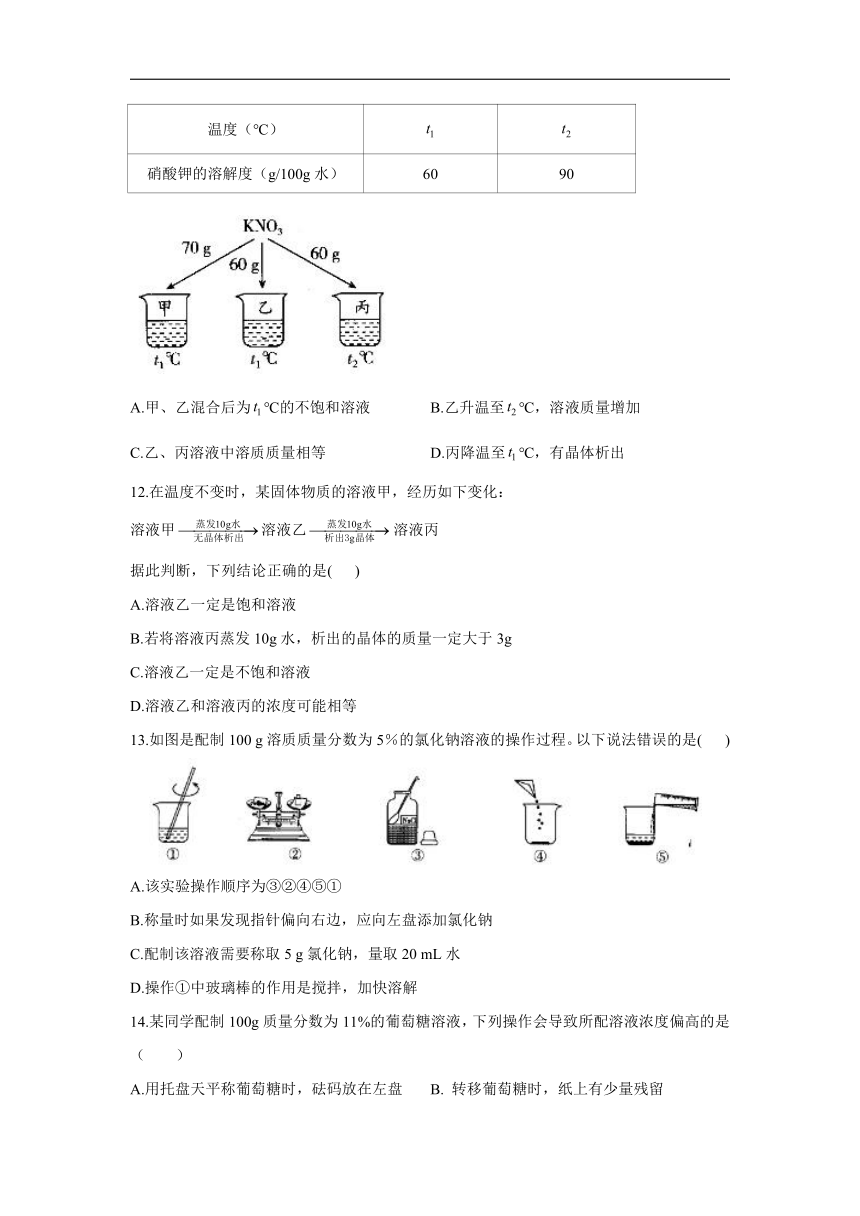
7.某同学在室温下(20℃)称取7.5g物质N的固体颗粒,加入50mL水中(物质N不与水反应且溶解度随温度的升高而增大),最终形成无色溶液。通过传感器测得溶液温度变化情况如图所示。根据实验分析,下列说法不正确的是(
)
A.物质N一定易溶于水
B.a、c两点时N的溶解度一定相同
C.b、c两点时N溶液浓度一定相同
D.改变加入N的质量,可能观察到只有c处有固体剩余
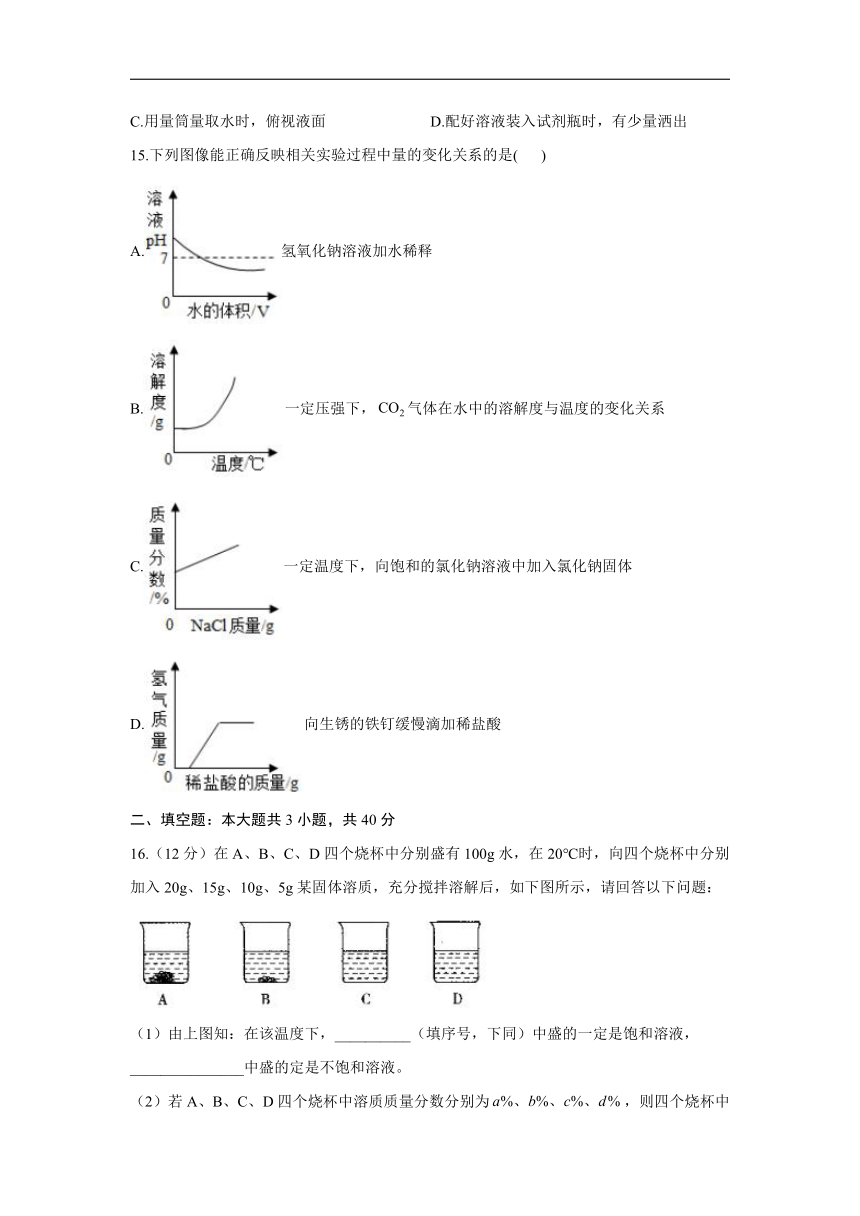
8.盐水选种是把种子放在一定浓度的盐水里,利用浮力把好坏种子分开来。20℃时,技术员将一包氯化钠[20℃,]放入容器中,分三次加入水,充分搅拌,记录情况如下:
次数
第一次
第二次
第三次
加水质量
1000g
1000g
1000g
烧杯内NaCl晶体剩余情况
有
无
无
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数的范围是(
)
A.
B.
C.
D.
9.下表是某同学的实验记录,以下说法不正确的是(
)
溶质
碘
高锰酸钾
溶剂
水
汽油
酒精
水
汽油
溶解性
不溶
易溶
可溶
易溶
不溶
A.衣服上不慎沾上碘酒,可用汽油擦洗
B.溶液都是均一、稳定、无色的混合物
C.
水、汽油、酒精都可以作溶剂
D.
同一物质在不同溶剂中的溶解性不同
10.如图际示,倾斜装置使管①、②中药品接触,观察到气球鼓起,一段时间后又恢复原状。下列药品符合该实验现象的是( )
A.硝酸铵和水
B.生石灰和水
C.二氧化锰和过氧化氢溶液
D.镁条和稀盐酸
11.如图所示,在分别盛有100g水的烧杯中放入硝酸钾充分溶解,则说法正确的是(
)
温度(℃)
硝酸钾的溶解度(g/100g水)
60
90
A.甲、乙混合后为℃的不饱和溶液
B.乙升温至℃,溶液质量增加
C.乙、丙溶液中溶质质量相等
D.丙降温至℃,有晶体析出
12.在温度不变时,某固体物质的溶液甲,经历如下变化:
溶液甲溶液乙溶液丙
据此判断,下列结论正确的是(
)
A.溶液乙一定是饱和溶液
B.若将溶液丙蒸发10g水,析出的晶体的质量一定大于3g
C.溶液乙一定是不饱和溶液
D.溶液乙和溶液丙的浓度可能相等
13.如图是配制100
g溶质质量分数为5%的氯化钠溶液的操作过程。以下说法错误的是(
)
A.该实验操作顺序为③②④⑤①
B.称量时如果发现指针偏向右边,应向左盘添加氯化钠
C.配制该溶液需要称取5
g氯化钠,量取20
mL水
D.操作①中玻璃棒的作用是搅拌,加快溶解
14.某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是(
)
A.用托盘天平称葡萄糖时,砝码放在左盘
B.
转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面
D.配好溶液装入试剂瓶时,有少量洒出
15.下列图像能正确反映相关实验过程中量的变化关系的是(
)
A.氢氧化钠溶液加水稀释
B.一定压强下,气体在水中的溶解度与温度的变化关系
C.一定温度下,向饱和的氯化钠溶液中加入氯化钠固体
D.向生锈的铁钉缓慢滴加稀盐酸
二、填空题:本大题共3小题,共40分
16.(12分)在A、B、C、D四个烧杯中分别盛有100g水,在20℃时,向四个烧杯中分别加入20g、15g、10g、5g某固体溶质,充分搅拌溶解后,如下图所示,请回答以下问题:
(1)由上图知:在该温度下,__________(填序号,下同)中盛的一定是饱和溶液,_______________中盛的定是不饱和溶液。
(2)若A、B、C、D四个烧杯中溶质质量分数分别为,则四个烧杯中溶质质量分数的关系是____________________。
(3)在该温度下,将A与D混合恰好得到该溶质的饱和溶液,则上图C烧杯中的溶液_____________(填“是”或“不是”)20℃时该溶质的饱和溶液。
(4)若固体溶质是硝酸钾,对A、B两个烧杯同时升高温度,固体物质先消失的烧杯是__________(填序号,下同);当A、B烧杯中溶质全都溶解后,所得溶液溶质质量分数较大的是________烧杯。
17.(12分)如表是硝酸钾和氯化铵在不同温度时的溶解度。分析表中数据,回答问题。
温度/℃
0
20
40
60
溶解度/g
硝酸钾
13.3
31.6
63.9
110
氯化铵
29.4
37.2
45.8
55.2
(1)图Ⅰ中,甲可表示______(填化学式)的溶解度曲线。
(2)40℃时,两种物质的饱和溶液中,溶质质量分数较小的是______(填化学式)。
(3)20℃时,按图Ⅱ所示操作,B中溶液的溶质与溶剂质量比为______(填最简整数比);C中的溶液是______(填“饱和”或“不饱和”)溶液。
(4)60℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到60℃,剩余溶液的质量:硝酸钾溶液______(填“>”“<”或“=”)氯化铵溶液。
(5)室温下,将盛有硝酸钾的饱和溶液的试管放入盛有水的烧杯中,再向烧杯内的水中加入一定量的硝酸铵并搅拌,试管内可以观察到的现象是______。
18.(16分)农业上常用质量分数为16%的氯化钠溶液进行选种。现需要配制80g溶质质量分数为16%的氯化钠溶液,请按要求回答下列问题:
(1)该实验正确的操作顺序是________(填序号)。
A.①②③④⑤
B.④⑤①②③
C.④⑤②①③
D.④①⑤②③
(2)配制80g溶质质量分数为16%的氯化钠溶液需要氯化钠________g,量取所用的水最好选用规格的量筒________(填序号)(已知)。
A.100mL
B.50mL
C.10mL
(3)用托盘天平称量所需的氯化钠时,发现天平指针偏向右盘,应________(填序号)。
A.增加适量氯化钠固体
B.减少适量氯化钠固体
C.调节平衡螺母
D.减少砝码
(4)溶解时,将水倒入盛氯化钠的烧杯中,用玻璃棒进行搅拌,其目的是________。
(5)将配制好的溶液装瓶并贴上标签。标签上需要书写的内容是________和________。
(6)若配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是________(填序号)。
A.用量筒量取水时俯视读数
B.往烧杯中倾倒量取好的蒸馏水时,少量水溅出
C.所用氯化钠晶体未充分干燥
D.转移已称好的氯化钠固体时,部分撒落在烧杯外
答案以及解析
1.答案:B
解析:A项,气体的溶解度与压强有关,压强变小气体的溶解度减小。B项,白膜是氢氧化钙与二氧化碳的反应产物,与氢氧化钙的溶解性无关。C项,气体的溶解度与温度有关,温度升高气体的溶解度减小。D项,“白霜”的产生与晶体的析出有关,该过程是蒸发水分,溶剂减少,晶体析出。
2.答案:D
解析:利用乳化作用除油污是将大的油滴分散成细小的油滴随水冲走,故A错误,D正确;加入乳化剂,能将植物油分散成细小的油滴,形成的混合物仍是乳浊液,故B错误;用醋洗去水壶中的水垢是因为水垢中的物质能和醋反应而溶解,故C错误。
3.答案:A
解析:常通过两种方式:①加入溶质,②蒸发溶剂。①加入蔗糖:设需要加入蔗糖的质量为,则:,解得:=20g;②蒸发溶剂:设要蒸发水的质量为,根据溶液稀释前后溶质的质量不变,则:,解得:=30g,
30g水的体积约为30mL。
4.答案:C
解析:C项,打开啤酒瓶盖,压强变小,二氧化碳的溶解度减小,因此有气泡逸出。
5.答案:C
解析:℃时a、b、c三种物质的溶解度由大到小的顺序是b>a=c,A错误;℃时,a的溶解度是50g,把30ga物质放入50g水中,可得到a物质的饱和溶液的质量为25g+50g=75g,B错误;a物质的溶解度受温度变化影响较大,b物质的溶解度受温度变化影响较小,a物质中含有少量b物质,可用降温结晶的方法得到a物质,C正确;c的溶解度随温度的降低而增大,通过降温不能将c物质的不饱和溶液转变成饱和溶液,D错误。
6.答案:C
解析:
A.
时,a、c溶解度相等,但不确定a、c的饱和溶液质量,不能确定所含溶质质量,说法错误;
B.
不确定a、b饱和溶液质量,不能确定析出的固体质量关系,说法错误;
C.
b的溶解度随温度升高而增大,时b的溶解度为25g,若=10℃,20℃b的溶解度大于10g,则b为易溶物质,说法正确;
D.
a的溶解度随温度降低而减小,将质量分数为21%的a溶液降温至析出晶体,溶液质量分数小于21%,说法错误。故选:C。
7.答案:D
解析:20℃时,7.5g物质N的固体颗粒加入50mL水中最终形成无色溶液,所以可推知20℃时物质N的溶解度大于10g,属于易溶物,故A正确。分析曲线图可知a、c两点对应温度都是50℃,所以a、c两点时N的溶解度相同,故B正确。依据题意可知,b、c两点时N溶液都为不饱和溶液,溶液的溶质质量分数都为,故C正确。a、c两点对应的温度相同,则所对应的N的溶解度相同,而溶剂质量未发生改变,所以c点若有固体剩余,则a点也一定有固体剩余,故D错误。
8.答案:A
解析:20℃时,NaCl溶解度为36g,此时100%怒水中最多可溶解NaCl的质量为360g。第一次加入1000g水,氯化钠晶体有剩余,则NaCl的总质量大于360g;第二次加入1000g水,氯化钠晶体没有剩余,则NaCl的总质量小于或等于720g;则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数的范围是,即。故选A。
9.答案:B
解析:溶液都是均一、稳定的混合物,但不一定是无色的,如高锰酸钾溶液呈紫色,硫酸铜溶液是蓝色的。
10.答案:B
解析:A、硝酸铵溶于水吸热,气球会缩小,故选项错误;
B、生石灰与水反应放出大量的热,使装置内空气受热膨胀,观察到气球鼓起;一段时间后,温度恢复至常温,又恢复原状,故选项正确;
C、过氧化氢在二氧化锰的催化作用下生成水和氧气,观察到气球鼓起;一段时间后,气球不会恢复原状,故选项错误;
D、镁与稀盐酸反应生成氯化镁和氢气,观察到气球鼓起;一段时间后,气球不会恢复原状,故选项错误。
故选B。
11.答案:C
解析:℃时盛有100g水的烧杯中最多溶解硝酸钾60g,甲、乙均为饱和溶液,混合后为℃的饱和溶液,A错误;℃盛有100g水的烧杯中最多溶解硝酸钾60g,乙为恰好饱和的溶液,乙升温至℃,溶液质量不变,B错误;乙、丙加入的硝酸钾均能全部溶解,乙、丙溶液中溶质质量相等,C正确;丙降温至℃,恰好形成饱和溶液,没有晶体析出,D错误。
12.答案:D
解析:由于溶液乙中不存在未溶解的溶质,因此溶液乙可能是饱和溶液也可能是不饱和溶液,A、C错误;由于溶液乙可能是不饱和溶液,而丙是饱和溶液,因此溶液丙若再蒸发10g水,析出的晶体可能大于3g,若溶液乙为饱和溶液时,若再蒸发10g水,析出的晶体可能等于3g,B错误;由于溶液乙蒸发掉10g水后,析出了3g晶体,则溶液丙一定是饱和溶液,如果溶液乙也是饱和的,则溶液乙和溶液丙的浓度相等,D正确。
13.答案:C
解析:溶质质量=溶液质量溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g5%=5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-5g
95g(合95mL)。
14.答案:C
解析:本题考查溶液的配制。称量葡萄糖时,砝码放在左盘,称量的葡萄糖质量少于需要称量的质量,导致所配溶液的溶质质量分数偏低,A错;转移葡萄糖时,纸上有少量残留,会使倒入烧杯中的葡萄糖减少,配制溶液的溶质质量分数偏低,B错;用量筒量取水时,俯视液面,使量取的水小于需要量取的量,导致配制溶液的溶质质量分数偏高,C正确;配好的溶液洒出,对溶液的溶质质量分数没有影响,D错。
15.答案:D
解析:A、向氢氧化钠溶液中滴加足量的水,溶液酸性减弱,但是仍为碱性,则溶液的pH会逐渐减小至接近7,但不会小于7,错误;B、气体的溶解度随着温度的升高而减小,错误;C、一定温度下,向饱和的氯化钠溶液中加入氯化钠固体,氯化钠不会继续溶解,溶质的质量分数不会改变,错误;D、向生锈的铁钉缓慢滴加稀盐酸,铁锈先与酸反应生成氯化铁和水,当铁锈完全反应后,铁与酸反应生成氢气,直到铁完全反应后氢气的质量不再改变,正确。故选D。
16.答案:(1)AB;D(2)(3)不是(4)B;A
解析:
(1)与晶体共存的溶液一定为饱和溶液,则A、B一定是饱和溶液,没有晶体存在的溶液不一定是不饱和溶液,但对比C、D可知,D中至少能再溶解5g溶质,则一定是不饱和溶液;
(3)A、D混合为饱和溶液,则该温度下饱和溶液中溶质质量分数,C中溶质质量分数为,故C为不饱和溶液。
17.答案:(1)
(2)
(3)93:250;不饱和
(4)
(5)有白色晶体析出
解析:(1)由表格和图Ⅰ可知,甲是硝酸钾的溶解度曲线,乙是氯化铵的溶解度曲线。
(2)40℃时,两种物质的饱和溶液中,溶质质量分数较小的是,因为该温度下硝酸钾的溶解度大于氯化铵。
(3)20℃时,氯化铵的溶解度是37.2g,50g水中最多可溶解氯化铵18.6g,因此B中溶液的溶质与溶剂质量比=18.6g:50g=93:250;C中的溶液是不饱和溶液。
(4)60℃时硝酸钾的溶解度大于氯化铵,将两种物质的饱和溶液各100g分别加热蒸发10g水后,再恢复到60℃,析出硝酸钾晶体的质量大于氯化铵,所以剩余溶液的质量:硝酸钾溶液小于氯化铵溶液。
(5)硝酸钾的溶解度随着温度的降低而减小,硝酸铵溶于水吸热,所以试管内可以观察到的现象是有白色晶体析出。
18.答案:(1)B(2)12.8;A(3)A(4)加速溶解(5)氯化钠溶液;16%(6)CD
解析:(1)配制溶液的一般步骤是计算、称量(量取)溶解,故正确的操作顺序是④⑤①②③。
(2)配制80g溶质质量分数为16%的氯化钠溶液需要氯化钠的质量为80g×16%=12.8g,水的质量为67.2g,合67.2mL,需要选择100mL的量筒。
(3)指针偏向分度盘的右侧,说明所取的氯化钠偏少,应继续在左盘上添加氯化钠,直至天平平衡。
(4)溶解时,玻璃棒的作用是加速溶解。
(5)标签上应注明溶液名称和溶质质量分数,故应写的内容是氯化钠溶液和16%。
(6)俯视读数,量取的水实际体积偏小,会导致溶质质量分数偏大;倾倒量取好的蒸馏水时有少量水溅出,溶剂质量减小,会导致溶质质量分数偏大;氯化钠不干燥,实际溶解的溶质质量小,会导致溶质质量分数偏小;氯化钠在转移时撒出,会导致溶质质量分数偏小。
溶液
能力提升
—2021-2022学年鲁教版(五四制)九年级全一册化学单元测试卷
(时间:
45分钟
满分:100分)
一、选择题:本大题共15小题,每小题4分,共60分
1.下列生活中的现象,与原溶质溶解性无关的是(
)
A.揭开啤酒瓶盖,有大量气泡溢出
B.盛石灰水的瓶口有一层白膜
C.烧开水时,沸腾前有大量气泡
D.咸菜长期放置在空气中,表面有一层“白霜”
2.下列关于乳化说法正确的是(
)
A.利用乳化作用将油污溶解而除去
B.向植物油与水的混合物中加入乳化剂,可得到溶液
C.用醋洗去水壶里的水垢是乳化现象
D.洗洁精能够除去油污,是因为洗洁精能使油污分散成细小的油滴,随水流走
3.在实验室欲将80g溶质质量分数为25%的蔗糖溶液浓度增大至40%,简单易行的方法是(
)
A.再溶解20g蔗糖
B.恒温蒸发25mL水
C.再溶解40g蔗糖
D.恒温蒸发40mL水
4.下列现象不能说明气体的溶解度随温度升高而减小的是(
)
A.天气闷热时,池塘里的鱼浮出水面
B.喝下汽水时,感到有气体冲击胃,易打嗝
C.打开啤酒瓶盖,有大量气泡逸出
D.烧开水时,沸腾前有气泡逸出
5.如图是a、b、c三种物质的溶解度曲线。下列说法正确的是(
)
A.℃时a、b、c三种物质的溶解度由大到小的顺序是b>a>c
B.℃时,把30ga物质放入50g水中,可得到80ga物质的饱和溶液
C.在a物质中含有少量b物质,可用降温结晶的方法提纯a
D.通过加入溶质、蒸发、降温,可将c物质的不饱和溶液变成饱和溶液
6.如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是( )
A.时a、c的饱和溶液中含溶质质量相等
B.分别将时a、b饱和溶液降温至,析出的固体质量关系是:a>b
C.若=10℃,则b为易溶物质
D.将质量分数为21%的a溶液降温至质量分数仍为21%
7.某同学在室温下(20℃)称取7.5g物质N的固体颗粒,加入50mL水中(物质N不与水反应且溶解度随温度的升高而增大),最终形成无色溶液。通过传感器测得溶液温度变化情况如图所示。根据实验分析,下列说法不正确的是(
)
A.物质N一定易溶于水
B.a、c两点时N的溶解度一定相同
C.b、c两点时N溶液浓度一定相同
D.改变加入N的质量,可能观察到只有c处有固体剩余
8.盐水选种是把种子放在一定浓度的盐水里,利用浮力把好坏种子分开来。20℃时,技术员将一包氯化钠[20℃,]放入容器中,分三次加入水,充分搅拌,记录情况如下:
次数
第一次
第二次
第三次
加水质量
1000g
1000g
1000g
烧杯内NaCl晶体剩余情况
有
无
无
则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数的范围是(
)
A.
B.
C.
D.
9.下表是某同学的实验记录,以下说法不正确的是(
)
溶质
碘
高锰酸钾
溶剂
水
汽油
酒精
水
汽油
溶解性
不溶
易溶
可溶
易溶
不溶
A.衣服上不慎沾上碘酒,可用汽油擦洗
B.溶液都是均一、稳定、无色的混合物
C.
水、汽油、酒精都可以作溶剂
D.
同一物质在不同溶剂中的溶解性不同
10.如图际示,倾斜装置使管①、②中药品接触,观察到气球鼓起,一段时间后又恢复原状。下列药品符合该实验现象的是( )
A.硝酸铵和水
B.生石灰和水
C.二氧化锰和过氧化氢溶液
D.镁条和稀盐酸
11.如图所示,在分别盛有100g水的烧杯中放入硝酸钾充分溶解,则说法正确的是(
)
温度(℃)
硝酸钾的溶解度(g/100g水)
60
90
A.甲、乙混合后为℃的不饱和溶液
B.乙升温至℃,溶液质量增加
C.乙、丙溶液中溶质质量相等
D.丙降温至℃,有晶体析出
12.在温度不变时,某固体物质的溶液甲,经历如下变化:
溶液甲溶液乙溶液丙
据此判断,下列结论正确的是(
)
A.溶液乙一定是饱和溶液
B.若将溶液丙蒸发10g水,析出的晶体的质量一定大于3g
C.溶液乙一定是不饱和溶液
D.溶液乙和溶液丙的浓度可能相等
13.如图是配制100
g溶质质量分数为5%的氯化钠溶液的操作过程。以下说法错误的是(
)
A.该实验操作顺序为③②④⑤①
B.称量时如果发现指针偏向右边,应向左盘添加氯化钠
C.配制该溶液需要称取5
g氯化钠,量取20
mL水
D.操作①中玻璃棒的作用是搅拌,加快溶解
14.某同学配制100g质量分数为11%的葡萄糖溶液,下列操作会导致所配溶液浓度偏高的是(
)
A.用托盘天平称葡萄糖时,砝码放在左盘
B.
转移葡萄糖时,纸上有少量残留
C.用量筒量取水时,俯视液面
D.配好溶液装入试剂瓶时,有少量洒出
15.下列图像能正确反映相关实验过程中量的变化关系的是(
)
A.氢氧化钠溶液加水稀释
B.一定压强下,气体在水中的溶解度与温度的变化关系
C.一定温度下,向饱和的氯化钠溶液中加入氯化钠固体
D.向生锈的铁钉缓慢滴加稀盐酸
二、填空题:本大题共3小题,共40分
16.(12分)在A、B、C、D四个烧杯中分别盛有100g水,在20℃时,向四个烧杯中分别加入20g、15g、10g、5g某固体溶质,充分搅拌溶解后,如下图所示,请回答以下问题:
(1)由上图知:在该温度下,__________(填序号,下同)中盛的一定是饱和溶液,_______________中盛的定是不饱和溶液。
(2)若A、B、C、D四个烧杯中溶质质量分数分别为,则四个烧杯中溶质质量分数的关系是____________________。
(3)在该温度下,将A与D混合恰好得到该溶质的饱和溶液,则上图C烧杯中的溶液_____________(填“是”或“不是”)20℃时该溶质的饱和溶液。
(4)若固体溶质是硝酸钾,对A、B两个烧杯同时升高温度,固体物质先消失的烧杯是__________(填序号,下同);当A、B烧杯中溶质全都溶解后,所得溶液溶质质量分数较大的是________烧杯。
17.(12分)如表是硝酸钾和氯化铵在不同温度时的溶解度。分析表中数据,回答问题。
温度/℃
0
20
40
60
溶解度/g
硝酸钾
13.3
31.6
63.9
110
氯化铵
29.4
37.2
45.8
55.2
(1)图Ⅰ中,甲可表示______(填化学式)的溶解度曲线。
(2)40℃时,两种物质的饱和溶液中,溶质质量分数较小的是______(填化学式)。
(3)20℃时,按图Ⅱ所示操作,B中溶液的溶质与溶剂质量比为______(填最简整数比);C中的溶液是______(填“饱和”或“不饱和”)溶液。
(4)60℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到60℃,剩余溶液的质量:硝酸钾溶液______(填“>”“<”或“=”)氯化铵溶液。
(5)室温下,将盛有硝酸钾的饱和溶液的试管放入盛有水的烧杯中,再向烧杯内的水中加入一定量的硝酸铵并搅拌,试管内可以观察到的现象是______。
18.(16分)农业上常用质量分数为16%的氯化钠溶液进行选种。现需要配制80g溶质质量分数为16%的氯化钠溶液,请按要求回答下列问题:
(1)该实验正确的操作顺序是________(填序号)。
A.①②③④⑤
B.④⑤①②③
C.④⑤②①③
D.④①⑤②③
(2)配制80g溶质质量分数为16%的氯化钠溶液需要氯化钠________g,量取所用的水最好选用规格的量筒________(填序号)(已知)。
A.100mL
B.50mL
C.10mL
(3)用托盘天平称量所需的氯化钠时,发现天平指针偏向右盘,应________(填序号)。
A.增加适量氯化钠固体
B.减少适量氯化钠固体
C.调节平衡螺母
D.减少砝码
(4)溶解时,将水倒入盛氯化钠的烧杯中,用玻璃棒进行搅拌,其目的是________。
(5)将配制好的溶液装瓶并贴上标签。标签上需要书写的内容是________和________。
(6)若配制所得的氯化钠溶液中氯化钠的质量分数偏小,可能的原因是________(填序号)。
A.用量筒量取水时俯视读数
B.往烧杯中倾倒量取好的蒸馏水时,少量水溅出
C.所用氯化钠晶体未充分干燥
D.转移已称好的氯化钠固体时,部分撒落在烧杯外
答案以及解析
1.答案:B
解析:A项,气体的溶解度与压强有关,压强变小气体的溶解度减小。B项,白膜是氢氧化钙与二氧化碳的反应产物,与氢氧化钙的溶解性无关。C项,气体的溶解度与温度有关,温度升高气体的溶解度减小。D项,“白霜”的产生与晶体的析出有关,该过程是蒸发水分,溶剂减少,晶体析出。
2.答案:D
解析:利用乳化作用除油污是将大的油滴分散成细小的油滴随水冲走,故A错误,D正确;加入乳化剂,能将植物油分散成细小的油滴,形成的混合物仍是乳浊液,故B错误;用醋洗去水壶中的水垢是因为水垢中的物质能和醋反应而溶解,故C错误。
3.答案:A
解析:常通过两种方式:①加入溶质,②蒸发溶剂。①加入蔗糖:设需要加入蔗糖的质量为,则:,解得:=20g;②蒸发溶剂:设要蒸发水的质量为,根据溶液稀释前后溶质的质量不变,则:,解得:=30g,
30g水的体积约为30mL。
4.答案:C
解析:C项,打开啤酒瓶盖,压强变小,二氧化碳的溶解度减小,因此有气泡逸出。
5.答案:C
解析:℃时a、b、c三种物质的溶解度由大到小的顺序是b>a=c,A错误;℃时,a的溶解度是50g,把30ga物质放入50g水中,可得到a物质的饱和溶液的质量为25g+50g=75g,B错误;a物质的溶解度受温度变化影响较大,b物质的溶解度受温度变化影响较小,a物质中含有少量b物质,可用降温结晶的方法得到a物质,C正确;c的溶解度随温度的降低而增大,通过降温不能将c物质的不饱和溶液转变成饱和溶液,D错误。
6.答案:C
解析:
A.
时,a、c溶解度相等,但不确定a、c的饱和溶液质量,不能确定所含溶质质量,说法错误;
B.
不确定a、b饱和溶液质量,不能确定析出的固体质量关系,说法错误;
C.
b的溶解度随温度升高而增大,时b的溶解度为25g,若=10℃,20℃b的溶解度大于10g,则b为易溶物质,说法正确;
D.
a的溶解度随温度降低而减小,将质量分数为21%的a溶液降温至析出晶体,溶液质量分数小于21%,说法错误。故选:C。
7.答案:D
解析:20℃时,7.5g物质N的固体颗粒加入50mL水中最终形成无色溶液,所以可推知20℃时物质N的溶解度大于10g,属于易溶物,故A正确。分析曲线图可知a、c两点对应温度都是50℃,所以a、c两点时N的溶解度相同,故B正确。依据题意可知,b、c两点时N溶液都为不饱和溶液,溶液的溶质质量分数都为,故C正确。a、c两点对应的温度相同,则所对应的N的溶解度相同,而溶剂质量未发生改变,所以c点若有固体剩余,则a点也一定有固体剩余,故D错误。
8.答案:A
解析:20℃时,NaCl溶解度为36g,此时100%怒水中最多可溶解NaCl的质量为360g。第一次加入1000g水,氯化钠晶体有剩余,则NaCl的总质量大于360g;第二次加入1000g水,氯化钠晶体没有剩余,则NaCl的总质量小于或等于720g;则第三次加水后,烧杯中所得NaCl溶液的溶质质量分数的范围是,即。故选A。
9.答案:B
解析:溶液都是均一、稳定的混合物,但不一定是无色的,如高锰酸钾溶液呈紫色,硫酸铜溶液是蓝色的。
10.答案:B
解析:A、硝酸铵溶于水吸热,气球会缩小,故选项错误;
B、生石灰与水反应放出大量的热,使装置内空气受热膨胀,观察到气球鼓起;一段时间后,温度恢复至常温,又恢复原状,故选项正确;
C、过氧化氢在二氧化锰的催化作用下生成水和氧气,观察到气球鼓起;一段时间后,气球不会恢复原状,故选项错误;
D、镁与稀盐酸反应生成氯化镁和氢气,观察到气球鼓起;一段时间后,气球不会恢复原状,故选项错误。
故选B。
11.答案:C
解析:℃时盛有100g水的烧杯中最多溶解硝酸钾60g,甲、乙均为饱和溶液,混合后为℃的饱和溶液,A错误;℃盛有100g水的烧杯中最多溶解硝酸钾60g,乙为恰好饱和的溶液,乙升温至℃,溶液质量不变,B错误;乙、丙加入的硝酸钾均能全部溶解,乙、丙溶液中溶质质量相等,C正确;丙降温至℃,恰好形成饱和溶液,没有晶体析出,D错误。
12.答案:D
解析:由于溶液乙中不存在未溶解的溶质,因此溶液乙可能是饱和溶液也可能是不饱和溶液,A、C错误;由于溶液乙可能是不饱和溶液,而丙是饱和溶液,因此溶液丙若再蒸发10g水,析出的晶体可能大于3g,若溶液乙为饱和溶液时,若再蒸发10g水,析出的晶体可能等于3g,B错误;由于溶液乙蒸发掉10g水后,析出了3g晶体,则溶液丙一定是饱和溶液,如果溶液乙也是饱和的,则溶液乙和溶液丙的浓度相等,D正确。
13.答案:C
解析:溶质质量=溶液质量溶质的质量分数,配制100g溶质质量分数为5%的氯化钠溶液,需氯化钠的质量=100g5%=5g;溶剂质量=溶液质量-溶质质量,则所需水的质量=100g-5g
95g(合95mL)。
14.答案:C
解析:本题考查溶液的配制。称量葡萄糖时,砝码放在左盘,称量的葡萄糖质量少于需要称量的质量,导致所配溶液的溶质质量分数偏低,A错;转移葡萄糖时,纸上有少量残留,会使倒入烧杯中的葡萄糖减少,配制溶液的溶质质量分数偏低,B错;用量筒量取水时,俯视液面,使量取的水小于需要量取的量,导致配制溶液的溶质质量分数偏高,C正确;配好的溶液洒出,对溶液的溶质质量分数没有影响,D错。
15.答案:D
解析:A、向氢氧化钠溶液中滴加足量的水,溶液酸性减弱,但是仍为碱性,则溶液的pH会逐渐减小至接近7,但不会小于7,错误;B、气体的溶解度随着温度的升高而减小,错误;C、一定温度下,向饱和的氯化钠溶液中加入氯化钠固体,氯化钠不会继续溶解,溶质的质量分数不会改变,错误;D、向生锈的铁钉缓慢滴加稀盐酸,铁锈先与酸反应生成氯化铁和水,当铁锈完全反应后,铁与酸反应生成氢气,直到铁完全反应后氢气的质量不再改变,正确。故选D。
16.答案:(1)AB;D(2)(3)不是(4)B;A
解析:
(1)与晶体共存的溶液一定为饱和溶液,则A、B一定是饱和溶液,没有晶体存在的溶液不一定是不饱和溶液,但对比C、D可知,D中至少能再溶解5g溶质,则一定是不饱和溶液;
(3)A、D混合为饱和溶液,则该温度下饱和溶液中溶质质量分数,C中溶质质量分数为,故C为不饱和溶液。
17.答案:(1)
(2)
(3)93:250;不饱和
(4)
(5)有白色晶体析出
解析:(1)由表格和图Ⅰ可知,甲是硝酸钾的溶解度曲线,乙是氯化铵的溶解度曲线。
(2)40℃时,两种物质的饱和溶液中,溶质质量分数较小的是,因为该温度下硝酸钾的溶解度大于氯化铵。
(3)20℃时,氯化铵的溶解度是37.2g,50g水中最多可溶解氯化铵18.6g,因此B中溶液的溶质与溶剂质量比=18.6g:50g=93:250;C中的溶液是不饱和溶液。
(4)60℃时硝酸钾的溶解度大于氯化铵,将两种物质的饱和溶液各100g分别加热蒸发10g水后,再恢复到60℃,析出硝酸钾晶体的质量大于氯化铵,所以剩余溶液的质量:硝酸钾溶液小于氯化铵溶液。
(5)硝酸钾的溶解度随着温度的降低而减小,硝酸铵溶于水吸热,所以试管内可以观察到的现象是有白色晶体析出。
18.答案:(1)B(2)12.8;A(3)A(4)加速溶解(5)氯化钠溶液;16%(6)CD
解析:(1)配制溶液的一般步骤是计算、称量(量取)溶解,故正确的操作顺序是④⑤①②③。
(2)配制80g溶质质量分数为16%的氯化钠溶液需要氯化钠的质量为80g×16%=12.8g,水的质量为67.2g,合67.2mL,需要选择100mL的量筒。
(3)指针偏向分度盘的右侧,说明所取的氯化钠偏少,应继续在左盘上添加氯化钠,直至天平平衡。
(4)溶解时,玻璃棒的作用是加速溶解。
(5)标签上应注明溶液名称和溶质质量分数,故应写的内容是氯化钠溶液和16%。
(6)俯视读数,量取的水实际体积偏小,会导致溶质质量分数偏大;倾倒量取好的蒸馏水时有少量水溅出,溶剂质量减小,会导致溶质质量分数偏大;氯化钠不干燥,实际溶解的溶质质量小,会导致溶质质量分数偏小;氯化钠在转移时撒出,会导致溶质质量分数偏小。
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
