2021-2022学年初中化学人教版九年级下册 第十一单元 课题1 第3课时 盐的化学性质 课件(26张PPT)
文档属性
| 名称 | 2021-2022学年初中化学人教版九年级下册 第十一单元 课题1 第3课时 盐的化学性质 课件(26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-28 17:22:25 | ||
图片预览




文档简介
(共26张PPT)
第3课时
盐的化学性质
R·九年级化学下册
第十一单元
盐
化肥
课题1
生活中常见的盐
学习目标
1.能根据复分解反应的条件判断酸、碱、盐
之间的反应能否发生。
2.归纳盐的相似化学性质。
3.根据不同标准将物质分类。
课前自学准备
课标要求
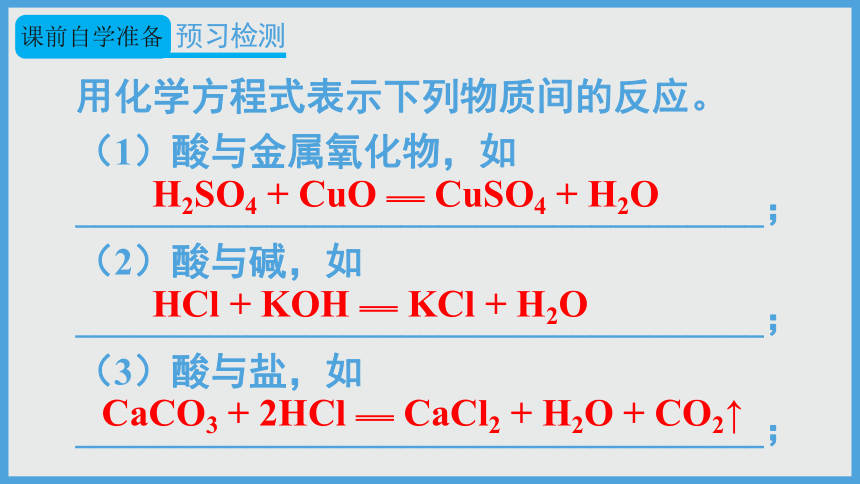
用化学方程式表示下列物质间的反应。
(1)酸与金属氧化物,如
____________________________________;
(2)酸与碱,如
____________________________________;
(3)酸与盐,如
____________________________________;
课前自学准备
预习检测
用化学方程式表示下列物质间的反应。
(4)碱与盐,如
____________________________________;
(5)盐与盐,如
____________________________________。
迄今为止,在初中化学中,我们已经学习了关于空气、氧气、水、碳、二氧化碳、氧化铜、铁、铝、硫酸、氢氧化钠和氯化钠等一系列物质的知识。为方便记忆和进一步学习,我们应该对学过的物质进行整理和分类。
讨论
课堂教学展示
新课导入
知识点1
物质的分类
课堂教学展示
课堂探究
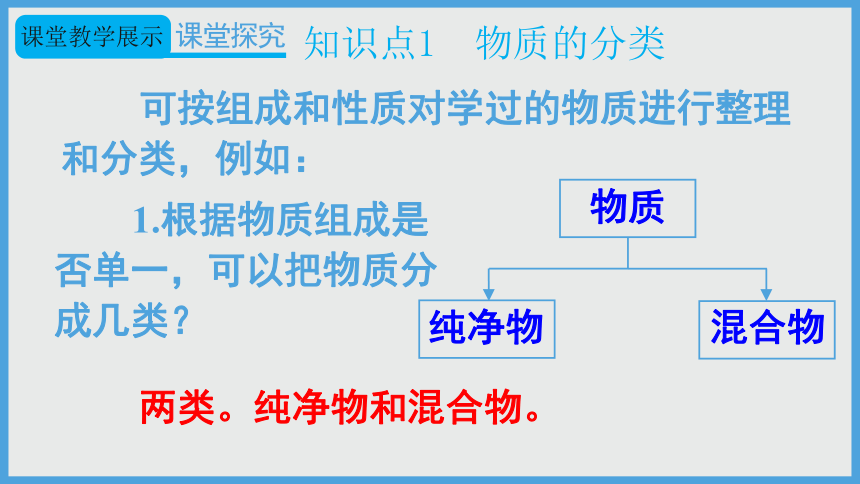
可按组成和性质对学过的物质进行整理和分类,例如:
1.根据物质组成是否单一,可以把物质分成几类?
两类。纯净物和混合物。
物质
纯净物
混合物
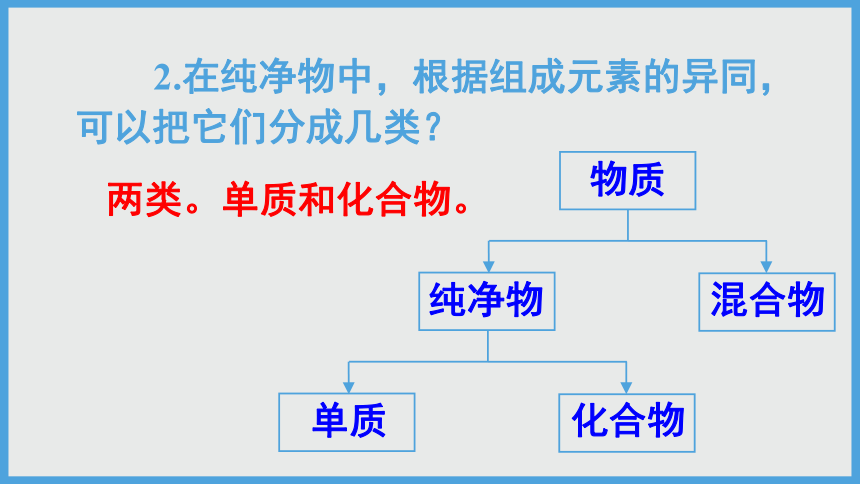
2.在纯净物中,根据组成元素的异同,可以把它们分成几类?
两类。单质和化合物。
物质
纯净物
混合物
单质
化合物
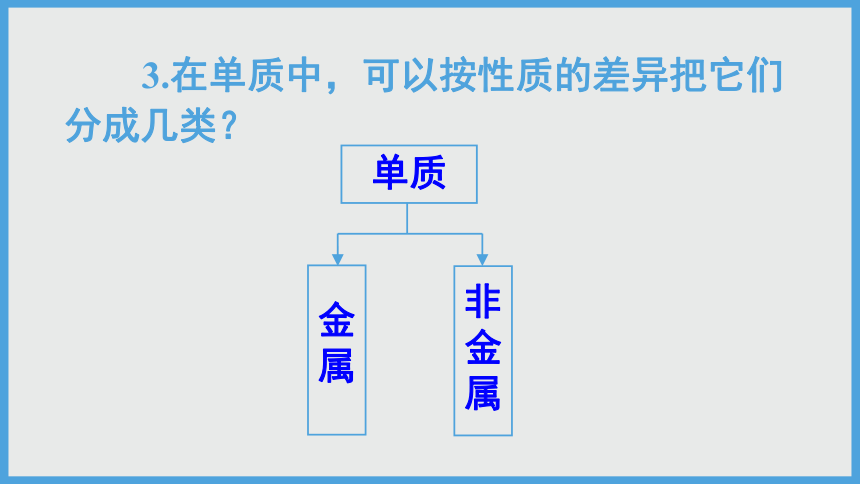
3.在单质中,可以按性质的差异把它们分成几类?
单质
金属
非金属
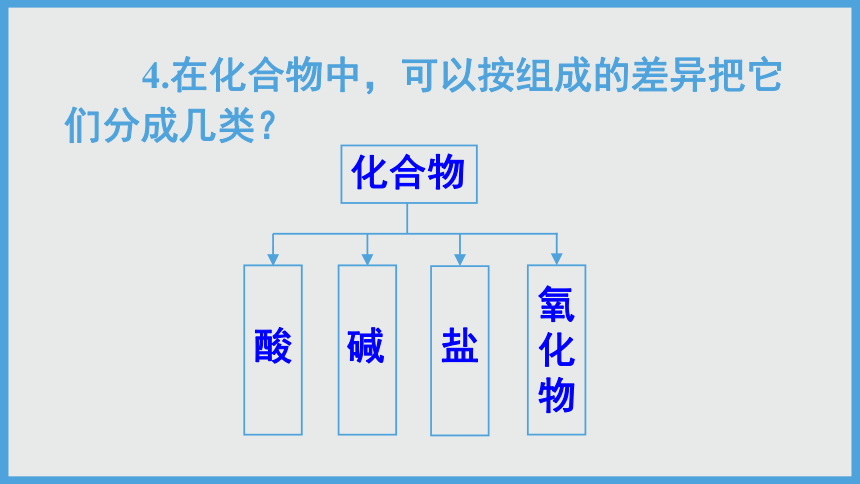
4.在化合物中,可以按组成的差异把它们分成几类?
化合物
酸
氧化物
碱
盐
将讨论的结果分别填入图11-5相应的实线方框内,并在其相邻的虚线方框内列举具体的物质(写化学式)。
纯净物
混合物
单质
化合物
金属
非金属
酸
氧化物
碱
盐
物质
NaCl
NaOH
H2SO4
CO2
CuO
H2O
O2
、
C
Fe
、
Al
空气
例
2015年5月28日,广东省发布“输入性中东呼吸综合症”疑似病例后,许多中小学校为预防传染病的扩散,要求学生在饭前便后用84消毒液洗手。84消毒液的主要成分是次氯酸钠(NaClO),则NaClO属于(
)
A.氧化物
B.酸
C.碱
D.盐
解析:NaClO含有钠离子和次氯酸根离子,因此属于盐。
课堂教学展示
典例剖析
D
上一单元我们学习酸、碱的性质时,发现并归纳出了酸、碱的通性,那么盐是否也有相似的化学性质呢?
知识点2
盐的化学性质
思考
1.盐
+
金属→盐
+
金属
反应条件:①参加反应的盐必须溶于水;
②“前换后”(或说“强换弱”):即在金属活动性顺序表中,排在前面的金属能把排在后面的金属从其盐溶液中置换出来(除K、Ca、Na外)。
③K、Ca、Na
在盐溶液中一般先容易与水反应。
归纳
盐的化学性质有:
1.盐
+
金属→盐
+
金属
如:Fe
+
CuSO4=Cu
+
FeSO4
Cu
+
2AgNO3=2Ag
+
Cu(NO3)2
(前置后,盐溶液)
(湿法冶金)
2.盐
+
酸→盐
+
酸
条件:满足复分解反应的条件即可;
(1)只能强酸制弱酸;
(2)如果反应物和生成物中的酸性相近,则生成物中必须有沉淀。
2.盐
+
酸→盐
+
酸
如:CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑(正)
HCl
+
AgNO3
=
AgCl↓
+
HNO3(正)
H2CO3
+
CaCl2
=
CaCO3↓
+
2HCl(误)
Na2SO4
+
2HCl
=
2NaCl
+
H2SO4(误)
3.盐
+
碱→盐
+
碱
条件:①满足复分解条件,即有沉淀或气体或水生成;②反应物均必须可溶。
如:
CuSO4
+
2NaOH
=
Na2SO4
+
Cu(OH)2↓
(正)
Na2CO3
+Ca(OH)2
=
2NaOH
+
CaCO3↓(正)
NaOH
+
KCl
=
NaCl
+
KOH(误)
如:AgNO3+NaCl
=
AgCl↓+NaNO3(正)
BaCl2
+
Na2SO4=BaSO4↓+
2NaCl(正)
BaCO3
+
Na2SO4=BaSO4↓+
Na2CO3(误)
4.盐
+
盐→盐
+
盐
条件:①满足复分解条件,②反应物均必须可溶。
例
下列物质在水溶液中能大量共存的是(
)
A.HCl、Ca(OH)2、NaNO3
B.NaCl、K2CO3、H2SO4
C.HCl、BaCl2、CuSO4
D.KNO3、NaOH、Na2CO3
生成H2O
课堂教学展示
典例剖析
D
生成CO2和H2O
生成BaSO4沉淀
本节课我们主要学习了:
1.物质按不同组成、结构等进行分类的方法;
2.盐的化学性质。
(1)和金属反应(2)和酸反应
(3)和某些碱反应(4)和某些盐反应
课堂教学展示
课堂小结
课后反馈总结
课后作业
1.从课后习题中选取;
2.完成练习册本课时的习题。
练习与应用(P78)
课后反馈总结
课本习题
2.通过一个阶段的化学学习,我们已经认识了许多物质,它们有的是单质,有的是氧化物,有的是酸、碱、盐。请用化学式各举几个例子。
解答:开放性试题,举例如下:
5.亚硝酸钠是一种工业用盐,它有毒、有咸味,外形与食盐相似。人若误食会引起
中毒,危害人体健康,甚至致人死亡。亚硝酸钠的水溶液呈碱性,食盐水溶液呈中性。如果让你来鉴别亚硝酸钠和食盐,你选用什么试剂,如何操作?
解:无色酚酞溶液。操作:取少量盐溶于水中制成溶液,再加入2滴无色的酚酞,若溶液变红色,则原物质为亚硝酸钠;若溶液不变色,则原物质为食盐。
第3课时
盐的化学性质
R·九年级化学下册
第十一单元
盐
化肥
课题1
生活中常见的盐
学习目标
1.能根据复分解反应的条件判断酸、碱、盐
之间的反应能否发生。
2.归纳盐的相似化学性质。
3.根据不同标准将物质分类。
课前自学准备
课标要求
用化学方程式表示下列物质间的反应。
(1)酸与金属氧化物,如
____________________________________;
(2)酸与碱,如
____________________________________;
(3)酸与盐,如
____________________________________;
课前自学准备
预习检测
用化学方程式表示下列物质间的反应。
(4)碱与盐,如
____________________________________;
(5)盐与盐,如
____________________________________。
迄今为止,在初中化学中,我们已经学习了关于空气、氧气、水、碳、二氧化碳、氧化铜、铁、铝、硫酸、氢氧化钠和氯化钠等一系列物质的知识。为方便记忆和进一步学习,我们应该对学过的物质进行整理和分类。
讨论
课堂教学展示
新课导入
知识点1
物质的分类
课堂教学展示
课堂探究
可按组成和性质对学过的物质进行整理和分类,例如:
1.根据物质组成是否单一,可以把物质分成几类?
两类。纯净物和混合物。
物质
纯净物
混合物
2.在纯净物中,根据组成元素的异同,可以把它们分成几类?
两类。单质和化合物。
物质
纯净物
混合物
单质
化合物
3.在单质中,可以按性质的差异把它们分成几类?
单质
金属
非金属
4.在化合物中,可以按组成的差异把它们分成几类?
化合物
酸
氧化物
碱
盐
将讨论的结果分别填入图11-5相应的实线方框内,并在其相邻的虚线方框内列举具体的物质(写化学式)。
纯净物
混合物
单质
化合物
金属
非金属
酸
氧化物
碱
盐
物质
NaCl
NaOH
H2SO4
CO2
CuO
H2O
O2
、
C
Fe
、
Al
空气
例
2015年5月28日,广东省发布“输入性中东呼吸综合症”疑似病例后,许多中小学校为预防传染病的扩散,要求学生在饭前便后用84消毒液洗手。84消毒液的主要成分是次氯酸钠(NaClO),则NaClO属于(
)
A.氧化物
B.酸
C.碱
D.盐
解析:NaClO含有钠离子和次氯酸根离子,因此属于盐。
课堂教学展示
典例剖析
D
上一单元我们学习酸、碱的性质时,发现并归纳出了酸、碱的通性,那么盐是否也有相似的化学性质呢?
知识点2
盐的化学性质
思考
1.盐
+
金属→盐
+
金属
反应条件:①参加反应的盐必须溶于水;
②“前换后”(或说“强换弱”):即在金属活动性顺序表中,排在前面的金属能把排在后面的金属从其盐溶液中置换出来(除K、Ca、Na外)。
③K、Ca、Na
在盐溶液中一般先容易与水反应。
归纳
盐的化学性质有:
1.盐
+
金属→盐
+
金属
如:Fe
+
CuSO4=Cu
+
FeSO4
Cu
+
2AgNO3=2Ag
+
Cu(NO3)2
(前置后,盐溶液)
(湿法冶金)
2.盐
+
酸→盐
+
酸
条件:满足复分解反应的条件即可;
(1)只能强酸制弱酸;
(2)如果反应物和生成物中的酸性相近,则生成物中必须有沉淀。
2.盐
+
酸→盐
+
酸
如:CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑(正)
HCl
+
AgNO3
=
AgCl↓
+
HNO3(正)
H2CO3
+
CaCl2
=
CaCO3↓
+
2HCl(误)
Na2SO4
+
2HCl
=
2NaCl
+
H2SO4(误)
3.盐
+
碱→盐
+
碱
条件:①满足复分解条件,即有沉淀或气体或水生成;②反应物均必须可溶。
如:
CuSO4
+
2NaOH
=
Na2SO4
+
Cu(OH)2↓
(正)
Na2CO3
+Ca(OH)2
=
2NaOH
+
CaCO3↓(正)
NaOH
+
KCl
=
NaCl
+
KOH(误)
如:AgNO3+NaCl
=
AgCl↓+NaNO3(正)
BaCl2
+
Na2SO4=BaSO4↓+
2NaCl(正)
BaCO3
+
Na2SO4=BaSO4↓+
Na2CO3(误)
4.盐
+
盐→盐
+
盐
条件:①满足复分解条件,②反应物均必须可溶。
例
下列物质在水溶液中能大量共存的是(
)
A.HCl、Ca(OH)2、NaNO3
B.NaCl、K2CO3、H2SO4
C.HCl、BaCl2、CuSO4
D.KNO3、NaOH、Na2CO3
生成H2O
课堂教学展示
典例剖析
D
生成CO2和H2O
生成BaSO4沉淀
本节课我们主要学习了:
1.物质按不同组成、结构等进行分类的方法;
2.盐的化学性质。
(1)和金属反应(2)和酸反应
(3)和某些碱反应(4)和某些盐反应
课堂教学展示
课堂小结
课后反馈总结
课后作业
1.从课后习题中选取;
2.完成练习册本课时的习题。
练习与应用(P78)
课后反馈总结
课本习题
2.通过一个阶段的化学学习,我们已经认识了许多物质,它们有的是单质,有的是氧化物,有的是酸、碱、盐。请用化学式各举几个例子。
解答:开放性试题,举例如下:
5.亚硝酸钠是一种工业用盐,它有毒、有咸味,外形与食盐相似。人若误食会引起
中毒,危害人体健康,甚至致人死亡。亚硝酸钠的水溶液呈碱性,食盐水溶液呈中性。如果让你来鉴别亚硝酸钠和食盐,你选用什么试剂,如何操作?
解:无色酚酞溶液。操作:取少量盐溶于水中制成溶液,再加入2滴无色的酚酞,若溶液变红色,则原物质为亚硝酸钠;若溶液不变色,则原物质为食盐。
同课章节目录
