2021-2022学年初中化学人教版九年级下册 第九单元 课题3 第2课时 溶质质量分数的综合计算 课件(25张PPT)
文档属性
| 名称 | 2021-2022学年初中化学人教版九年级下册 第九单元 课题3 第2课时 溶质质量分数的综合计算 课件(25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-28 17:20:22 | ||
图片预览








文档简介
(共25张PPT)
第2课时
溶质质量分数的综合计算
R·九年级化学下册
第九单元
溶液
课题3
溶液的浓度
课前自学准备
课标要求
学习目标
初步学会溶质的质量分数与化学方程式的综合计算。
学习难点
学习重点
溶质的质量分数与化学方程式的综合计算。
溶质的质量分数与化学方程式的综合计算。
1.
溶液的稀释、浓缩、混合的计算
(1)溶液在稀释前后,
保持不变。
(2)溶液的浓缩是指将溶液蒸发水分,使其浓
度变大。溶液在浓缩前后,
保持不变。
(3)将两种溶液混合时,混合前两种溶液中溶
质的质量和,等于
质量。
课前自学准备
预习检测
溶质质量
溶质质量
混合溶液中溶质
2.
溶质的质量分数与化学方程式的综合计算溶液中
进行的反应,一般只与溶质有关,因此在比例式
中列出的必须是溶质的实际质量,而不是溶液的
质量,计算所得溶液的质量时,需减去生成气体
或沉淀的质量。
课前自学准备
预习检测
课堂教学展示
复习导入
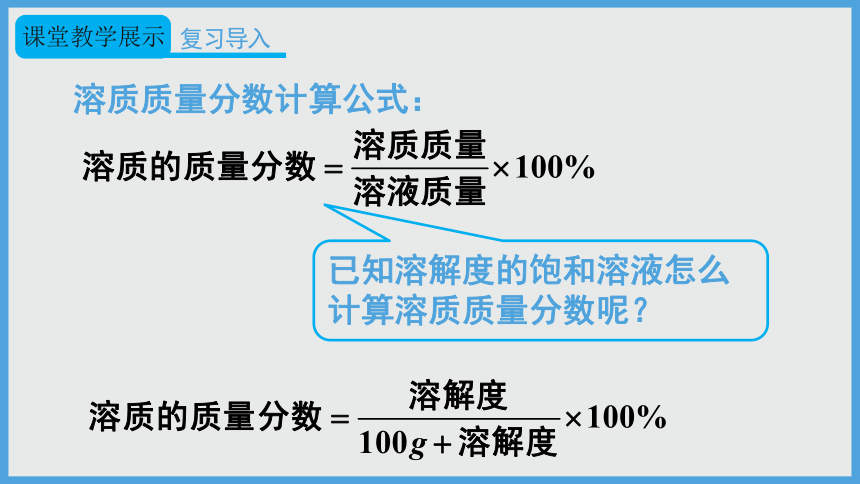
溶质质量分数计算公式:
已知溶解度的饱和溶液怎么计算溶质质量分数呢?
课堂教学展示
课堂探究
知识点1
溶液的稀释、浓缩、混合的计算
若要将氯化钠溶液稀释或浓缩,那么如何将溶质的质量分数减小或增大呢?
氯化钠溶液
增加溶质的质量,可使溶质的质量分数增大。
增大溶剂的质量,可使溶质的质量分数减小。
蒸发溶剂可使溶质的质量分数增大。
氯化钠溶液
【例】化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释成20%的稀硫酸,需要水的质量是多少?
课堂教学展示
典例剖析
解:设需要加水的质量为x。
依据稀释前后溶质质量不变,则有:
50g×98%=(50g+x)×20%
解得:x=195g
答:需要水的质量为195g。
练习
将50g质量分数为20%的硝酸钾溶液加水稀释到200g,稀释后所得溶液中溶质的质量分数是多少?需加水的质量是多少?
稀释前后溶质的质量不变
解:设稀释后所得溶液中溶质的质量分数为x。
则50g×20%=200g×x,
解得x=5%。
需加水的质量为200g-50g=150g
课堂教学展示
课堂探究
知识点2
质量分数与化学方程式的综合计算
【例】100g某硫酸溶液恰好与13g锌完全反应。这种硫酸溶液中溶质的质量分数是多少?
溶质是什么?
涉及的化学方程式:
Zn
+
H2SO4=ZnSO4
+
H2↑
?
解:设这种硫酸溶液中溶质的质量为x。
Zn
+
H2SO4=ZnSO4
+
H2↑
65
98
13g
x
溶质的质量分数为:
答:这种硫酸溶液中溶质的质量分数为19.6%。
x=19.6g
①先利用化学方程式求出溶质的质量;
②再利用溶质的质量分数定义来求解。
归纳
硫酸铜溶液对过氧化氢(H2O2)的分解有催化作用。取8.5%的过氧化氢溶液40g倒入小烧杯中,向其中加入20%的硫酸铜溶液6.6g使过氧化氢完全分解。计算:
(1)产生氧气的质量。
(2)反应后所得溶液中硫酸铜的质量分数。
练习
2H2O2
2H2O+O2↑
CuSO4
68
3.4g
32
x
解:(1)过氧化氢溶液中溶质的质量为
40g×8.5%=3.4g。
设产生氧气的质量为x。
(2)原硫酸铜溶液中溶质的质量为
6.6g×20%=1.32g,
反应后所得溶液的质量为40g+6.6g-1.6g=45g,
反应后所得溶液中硫酸铜的质量分数为
课堂教学展示
课堂小结
1.溶液稀释和增浓计算
加溶质
蒸发掉溶剂
混合加入更浓的溶液
找到溶液前后的不变量列出等量关系式
加溶剂
蒸发掉溶质
混合加入更稀的溶液
(1)正确书写化学方程式。
(2)找准代入方程式中的纯净物质量,计算溶质和溶液质量。
2.化学方程式和溶液综合计算
1.从课后习题中选取;
2.完成练习册本课时的习题。
课后反馈总结
课后作业
课后反馈总结
课本习题
练习与应用(P65)
3.
把100
g质量分数为98%的浓硫酸稀释成10%的稀
硫酸,需要水的质量是多少?
解:100g×98%=[100g+m(水)]×10%,
解得:m(水)=880g。
4.配制500
mL质量分数为10%的氢氧化钠溶液
(密度为1.1
g/cm3),需要氢氧化钠和水的质
量各是多少?
解:
m(NaOH)=500mL×1.1g/cm3×10%=55g;
m(水)=500mL×1.1g/cm3-55g=495g。
5.
100
g某硫酸恰好与13
g锌完全起反应。试计算这
种硫酸中溶质的质量分数。
解:设这种硫酸溶液中溶质的质量为x。
Zn
+
H2SO4=ZnSO4
+
H2↑
65
98
13g
x
溶质的质量分数为:
答:这种硫酸溶液中溶质的质量分数为19.6%。
x=19.6g
6.
73
g质量分数为20%的盐酸与足量大理石反应,
生成二氧化碳的质量是多少?这些二氧化碳的体
积(标准状况)是多少?(在标准状况下,二氧
化碳的密度为1.977
g/L。)
解:设生成二氧化碳的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
73
73g×20%
44
x
x=8.8g
8.
某注射用药液的配制方法如下:
(1)把1.0
g药品溶于水配制成4.0
mL溶液a;
(2)取0.1
mL溶液a,加水稀释至1.0
mL,得到溶液b;
(3)取0.1
mL溶液b,加水稀释至1.0
mL,得到溶液c;
(4)取0.2
mL溶液c,加水稀释至1.0
mL,得到溶液d。
由于在整个配制过程中药液很稀,其密度可近似看
做1
g/cm3。试求:
①最终得到的药液(溶液d)中的溶质的质量分数;
②1.0
g该药品可配制溶液d的体积是多少?
第2课时
溶质质量分数的综合计算
R·九年级化学下册
第九单元
溶液
课题3
溶液的浓度
课前自学准备
课标要求
学习目标
初步学会溶质的质量分数与化学方程式的综合计算。
学习难点
学习重点
溶质的质量分数与化学方程式的综合计算。
溶质的质量分数与化学方程式的综合计算。
1.
溶液的稀释、浓缩、混合的计算
(1)溶液在稀释前后,
保持不变。
(2)溶液的浓缩是指将溶液蒸发水分,使其浓
度变大。溶液在浓缩前后,
保持不变。
(3)将两种溶液混合时,混合前两种溶液中溶
质的质量和,等于
质量。
课前自学准备
预习检测
溶质质量
溶质质量
混合溶液中溶质
2.
溶质的质量分数与化学方程式的综合计算溶液中
进行的反应,一般只与溶质有关,因此在比例式
中列出的必须是溶质的实际质量,而不是溶液的
质量,计算所得溶液的质量时,需减去生成气体
或沉淀的质量。
课前自学准备
预习检测
课堂教学展示
复习导入
溶质质量分数计算公式:
已知溶解度的饱和溶液怎么计算溶质质量分数呢?
课堂教学展示
课堂探究
知识点1
溶液的稀释、浓缩、混合的计算
若要将氯化钠溶液稀释或浓缩,那么如何将溶质的质量分数减小或增大呢?
氯化钠溶液
增加溶质的质量,可使溶质的质量分数增大。
增大溶剂的质量,可使溶质的质量分数减小。
蒸发溶剂可使溶质的质量分数增大。
氯化钠溶液
【例】化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释成20%的稀硫酸,需要水的质量是多少?
课堂教学展示
典例剖析
解:设需要加水的质量为x。
依据稀释前后溶质质量不变,则有:
50g×98%=(50g+x)×20%
解得:x=195g
答:需要水的质量为195g。
练习
将50g质量分数为20%的硝酸钾溶液加水稀释到200g,稀释后所得溶液中溶质的质量分数是多少?需加水的质量是多少?
稀释前后溶质的质量不变
解:设稀释后所得溶液中溶质的质量分数为x。
则50g×20%=200g×x,
解得x=5%。
需加水的质量为200g-50g=150g
课堂教学展示
课堂探究
知识点2
质量分数与化学方程式的综合计算
【例】100g某硫酸溶液恰好与13g锌完全反应。这种硫酸溶液中溶质的质量分数是多少?
溶质是什么?
涉及的化学方程式:
Zn
+
H2SO4=ZnSO4
+
H2↑
?
解:设这种硫酸溶液中溶质的质量为x。
Zn
+
H2SO4=ZnSO4
+
H2↑
65
98
13g
x
溶质的质量分数为:
答:这种硫酸溶液中溶质的质量分数为19.6%。
x=19.6g
①先利用化学方程式求出溶质的质量;
②再利用溶质的质量分数定义来求解。
归纳
硫酸铜溶液对过氧化氢(H2O2)的分解有催化作用。取8.5%的过氧化氢溶液40g倒入小烧杯中,向其中加入20%的硫酸铜溶液6.6g使过氧化氢完全分解。计算:
(1)产生氧气的质量。
(2)反应后所得溶液中硫酸铜的质量分数。
练习
2H2O2
2H2O+O2↑
CuSO4
68
3.4g
32
x
解:(1)过氧化氢溶液中溶质的质量为
40g×8.5%=3.4g。
设产生氧气的质量为x。
(2)原硫酸铜溶液中溶质的质量为
6.6g×20%=1.32g,
反应后所得溶液的质量为40g+6.6g-1.6g=45g,
反应后所得溶液中硫酸铜的质量分数为
课堂教学展示
课堂小结
1.溶液稀释和增浓计算
加溶质
蒸发掉溶剂
混合加入更浓的溶液
找到溶液前后的不变量列出等量关系式
加溶剂
蒸发掉溶质
混合加入更稀的溶液
(1)正确书写化学方程式。
(2)找准代入方程式中的纯净物质量,计算溶质和溶液质量。
2.化学方程式和溶液综合计算
1.从课后习题中选取;
2.完成练习册本课时的习题。
课后反馈总结
课后作业
课后反馈总结
课本习题
练习与应用(P65)
3.
把100
g质量分数为98%的浓硫酸稀释成10%的稀
硫酸,需要水的质量是多少?
解:100g×98%=[100g+m(水)]×10%,
解得:m(水)=880g。
4.配制500
mL质量分数为10%的氢氧化钠溶液
(密度为1.1
g/cm3),需要氢氧化钠和水的质
量各是多少?
解:
m(NaOH)=500mL×1.1g/cm3×10%=55g;
m(水)=500mL×1.1g/cm3-55g=495g。
5.
100
g某硫酸恰好与13
g锌完全起反应。试计算这
种硫酸中溶质的质量分数。
解:设这种硫酸溶液中溶质的质量为x。
Zn
+
H2SO4=ZnSO4
+
H2↑
65
98
13g
x
溶质的质量分数为:
答:这种硫酸溶液中溶质的质量分数为19.6%。
x=19.6g
6.
73
g质量分数为20%的盐酸与足量大理石反应,
生成二氧化碳的质量是多少?这些二氧化碳的体
积(标准状况)是多少?(在标准状况下,二氧
化碳的密度为1.977
g/L。)
解:设生成二氧化碳的质量为x.
CaCO3+2HCl=CaCl2+H2O+CO2↑
73
73g×20%
44
x
x=8.8g
8.
某注射用药液的配制方法如下:
(1)把1.0
g药品溶于水配制成4.0
mL溶液a;
(2)取0.1
mL溶液a,加水稀释至1.0
mL,得到溶液b;
(3)取0.1
mL溶液b,加水稀释至1.0
mL,得到溶液c;
(4)取0.2
mL溶液c,加水稀释至1.0
mL,得到溶液d。
由于在整个配制过程中药液很稀,其密度可近似看
做1
g/cm3。试求:
①最终得到的药液(溶液d)中的溶质的质量分数;
②1.0
g该药品可配制溶液d的体积是多少?
同课章节目录
