2021-2022学年初中化学人教版九年级上册 第三单元 课题3 元素 教案
文档属性
| 名称 | 2021-2022学年初中化学人教版九年级上册 第三单元 课题3 元素 教案 |  | |
| 格式 | zip | ||
| 文件大小 | 351.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-28 17:44:28 | ||
图片预览



文档简介
第三单元
物质构成的奥秘
课题3
元素
教学目标
一、知识与技能
1.了解元素的概念,统一对物质的宏观组成与微观结构的认识。
2.了解元素符号所表示的意义,学会元素符号的正确写法,逐步记住一些常见的元素符号。
3.初步认识元素周期表,知道它是学习和研究化学的工具,能根据原子序数,在元素周期表中找到指定元素和有关该元素的一些其他信息。
二、过程与方法
1.通过微观想象、分析、讨论、对比,认识到化学反应中分子可以发生变化而元素不发生变化。
2.通过联想记忆、卡片问答等趣味活动,帮助学生认识元素符号。
3.通过展示元素周期表,让学生进一步了解元素的有关知识,并能根据原子序数在元素周期表中找到指定元素和有关该元素的一些其他的信息。
教学重点
1.元素的概念。
2.元素符号。
3.对元素周期表的认识。
教学难点
1.元素概念的内涵。
2.元素与原子的区别和联系。
3.利用元素周期表查取一些简单信息。
新课引入
我们每时每刻都在与化学元素打交道,吸入的空气中含有氧气,氧气由氧元素组成;水中含有氢元素、氧元素;吃的蔬菜中含有铁元素,铁锈中也含有铁元素;海水中含有大量的钠元素、镁元素……这节课我们就来研究元素。
[问题导入][师]
同学们在过去已经学了几年英语了,那么你们知道英语里最基本的成分是什么吗?
[生]字母。
[师]好,老师今天就来考考你们。
[板书]在黑板上写下三个字母:a
r
e
[提问]这三个字母能组成多少单词?
[生]are、era、ear、area、rear……
[师]26个英文字母,借助不同的组合,构成了人们用以交换意见和传递思想的无数字眼。我们生活的这个世界上有两千多万种的物质,也是由100多种基本成分相互组合形成的,这些基本成分被我们称为——元素(可以鼓励学生一起说出元素这个词)。这节课我们一起来学习元素的有关知识。
教学过程
1.元素
[投影]介绍几种原子
[讲解]我们把质子数都是6的一类原子叫做碳元素,而质子数都是8的一类原子叫做氧元素等等。
(1)定义:具有相同核电荷数(即质子数)的一类原子的总称。
[思考]怎样区分氢元素和氧元素?
[归纳]元素的种类是由核内质子数决定的。也就是说质子数不同,元素的种类就不同。
例:所有核电荷数为8的氧原子总称为氧元素,所有核电荷数为1的氢原子总称为氢元素等等。
(2)特点:元素是一类原子的总称,是宏观概念,只讲种类,不讲个数。
[讲解]由定义可知,元素是一类原子的总称,具体说就是具有相同核电荷数的一类原子的总称。是宏观概念,只讲种类,不讲个数。那么在用元素描述物质的组成时,只能说该物质由几种元素组成,而不能说该物质由几个元素组成。
(3)元素在自然界中的存在。
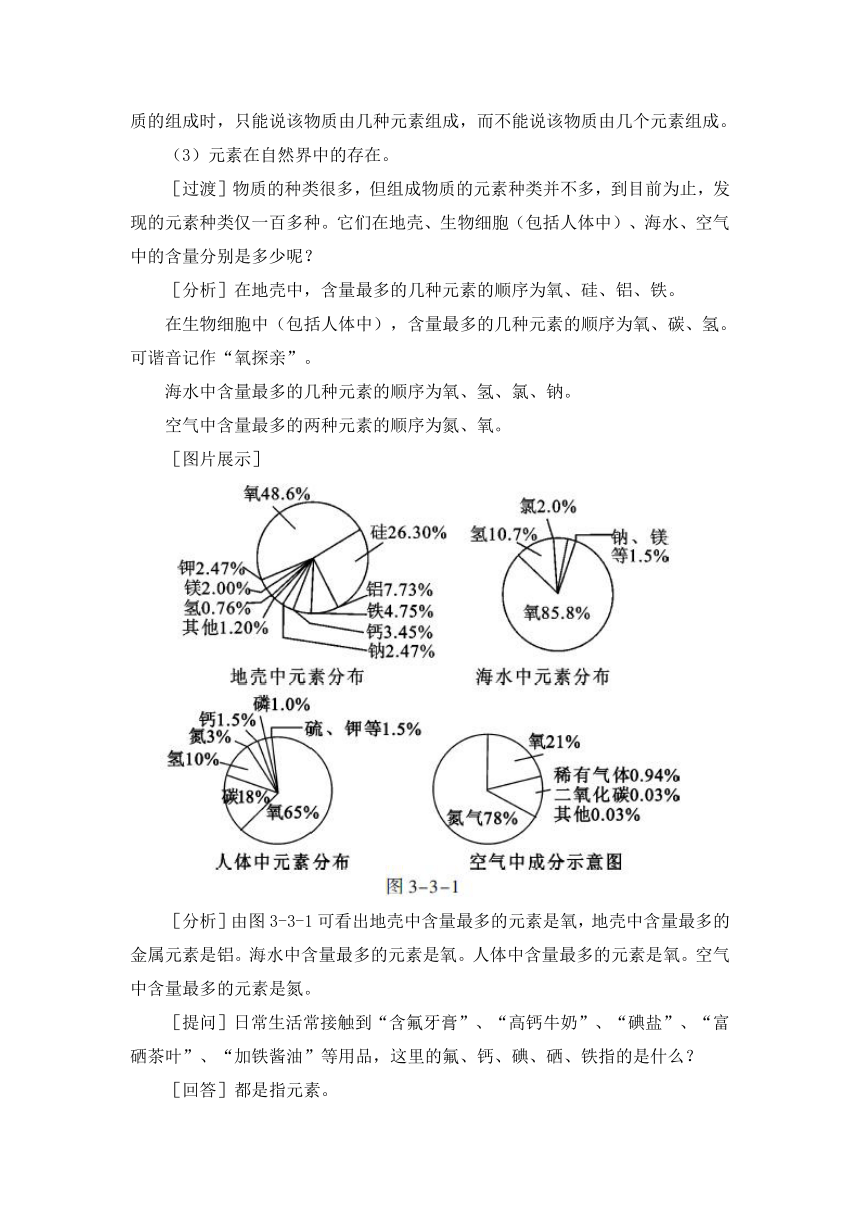
[过渡]物质的种类很多,但组成物质的元素种类并不多,到目前为止,发现的元素种类仅一百多种。它们在地壳、生物细胞(包括人体中)、海水、空气中的含量分别是多少呢?
[分析]在地壳中,含量最多的几种元素的顺序为氧、硅、铝、铁。
在生物细胞中(包括人体中),含量最多的几种元素的顺序为氧、碳、氢。可谐音记作“氧探亲”。
海水中含量最多的几种元素的顺序为氧、氢、氯、钠。
空气中含量最多的两种元素的顺序为氮、氧。
[图片展示]
[分析]由图3-3-1可看出地壳中含量最多的元素是氧,地壳中含量最多的金属元素是铝。海水中含量最多的元素是氧。人体中含量最多的元素是氧。空气中含量最多的元素是氮。
[提问]日常生活常接触到“含氟牙膏”、“高钙牛奶”、“碘盐”、“富硒茶叶”、“加铁酱油”等用品,这里的氟、钙、碘、硒、铁指的是什么?
[回答]都是指元素。
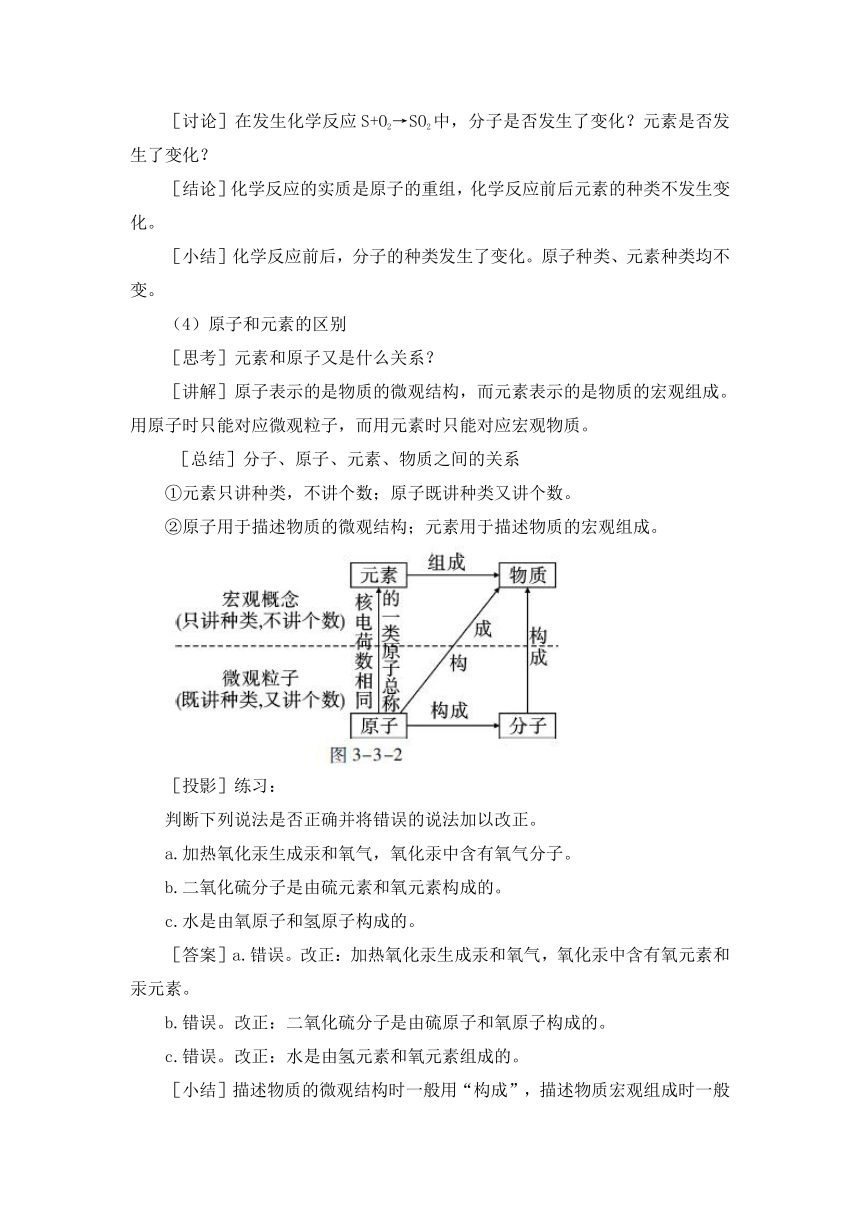
[讨论]在发生化学反应S+O2→SO2中,分子是否发生了变化?元素是否发生了变化?
[结论]化学反应的实质是原子的重组,化学反应前后元素的种类不发生变化。
[小结]化学反应前后,分子的种类发生了变化。原子种类、元素种类均不变。
(4)原子和元素的区别
[思考]元素和原子又是什么关系?
[讲解]原子表示的是物质的微观结构,而元素表示的是物质的宏观组成。用原子时只能对应微观粒子,而用元素时只能对应宏观物质。
[总结]分子、原子、元素、物质之间的关系
①元素只讲种类,不讲个数;原子既讲种类又讲个数。
②原子用于描述物质的微观结构;元素用于描述物质的宏观组成。
[投影]练习:
判断下列说法是否正确并将错误的说法加以改正。
a.加热氧化汞生成汞和氧气,氧化汞中含有氧气分子。
b.二氧化硫分子是由硫元素和氧元素构成的。
c.水是由氧原子和氢原子构成的。
[答案]a.错误。改正:加热氧化汞生成汞和氧气,氧化汞中含有氧元素和汞元素。
b.错误。改正:二氧化硫分子是由硫原子和氧原子构成的。
c.错误。改正:水是由氢元素和氧元素组成的。
[小结]描述物质的微观结构时一般用“构成”,描述物质宏观组成时一般用“组成”,对应关系如下:
宏观→物质→元素→组成
微观→分子→原子→构成
2.元素符号
(1)书写
[过渡]了解了元素的定义以及它的特点后,我们再来看元素的表示。“知识是无国界的”,但各个国家有各自不同的语言和文字,若用各自的文字来表示,则给学术交流带来很多的不便,从而也会阻碍化学前进的脚步。所以为了书写和学术交流的方便,国际上采用统一的符号——元素符号,来表示元素。
[阅读]请大家阅读资料,了解元素符号的来源和书写方法。
[小结]①发明元素符号的是道尔顿,他曾用图形加字母的方式作为元素符号。但随着发现的元素越来越多,符号设计越来越复杂,这种符号不便于书写和记忆,未能广泛采用。
②现在国际上统一采用元素拉丁文名称的第一个字母来表示元素,书写时要大写。如,氧——O、氢——H、碳——C。
③若几种元素拉丁文名称的第一个字母相同时,就附加一个小写字母来表示。如,铜——Cu、钙——Ca、氯——Cl。
[归纳]元素符号的书写方法:第一个字母一定要大写,第二个字母一定要小写,即“一大二小”。
[提问]从课本的表格中,我们可以得到哪些信息?
[回答]
①知道一种元素,可以查出元素符号。
②知道一种元素,还可以查出该元素的相对原子质量。
[说明]相对原子质量一般是不要求记忆的,做题时可查阅此表格或后面的相对原子质量表,有的题中会给出,但是元素符号却必须要记下来。
(2)意义
[思考]
元素符号表示什么意义呢?
[讲解]
[思考]如果在元素符号前面加上化学计量数是否还能表示该元素?
[小结]如果在元素符号前面加上化学计量数,就只表示该元素原子的个数,不能表示该元素。如:H既表示氢元素,又表示一个氢原子;2H只能表示两个氢原子。(元素符号前面加数字只具有微观意义)
[练习]下列符号各表示什么意义?
①
2N
②
3S
③
nFe
[答案]①2N表示2个氮原子
②3S表示3个硫原子
③nFe表示n个铁原子
(3)元素的分类
[思考]我们已经知道了元素符号的书写方法和意义,再来想想元素中文名称有什么特点呢?
[回答]元素中文名称造字有规律,从它们的偏旁就可以知道它们属于哪一类元素:有“钅”字旁的是金属元素,有“石”字旁的是固态非金属元素,有“气”字头的是气态非金属元素,有“氵”字旁的是液态非金属元素。只有汞例外,通常状况下它是液态金属元素。
[思考]请大家结合教材资料,来分析一下元素可以怎么分类?
3.元素周期表
[过渡]超市中的商品成千上万种,为了便于顾客选购,必须将商品分门别类、有序地摆放。同样组成物质的一百多种元素,为了便于研究元素的性质和用途,也需将它们按其内在规律排列。一百多种元素按怎样的规律排列呢?
[投影]展示门捷列夫头像和元素周期表,简介元素周期表的形成史。指导学生阅读教材中相关内容。
(1)每一格,包含元素的原子序数、元素符号、元素名称、相对原子质量等内容。
(2)原子序数=核电荷数=核内质子数。
(3)元素周期表按颜色分为金属元素区和非金属元素区。
[活动与探究]
指导学生结合附录(元素周期表)完成教材P63的探究“在元素周期表中查找元素”。
课堂小结
1.元素表示物质的宏观组成,它只讲种类不讲个数。
2.元素用统一的元素符号表示,我们不仅要认识元素符号,还要会写、会读、会用元素符号来表示元素。
3.元素符号具有两个意义;它既可表示一种元素,又可表示该元素的一个原子。
4.元素周期表中,原子序数=核电荷数=核内质子数=核外电子数。
板书设计
教学反思
元素的概念教学是本课的重点,也是难点。在概念的形成过程中,从分析具体物质的组成出发,使学生知道不同物质里可以含有同种类的原子,然后指出这些原子之所以相同,是因为它们具有相同的核电荷数并由此引出元素的概念。学生往往在分析宏观组成时用的“元素”概念与微观构成时的“原子、分子”易混淆,要多结合实例比较元素与原子的区别和联系。
元素符号的教学要注意两点:一是分散难点,逐步记忆,即在化学课一开头就以化学符号的形式有计划地逐渐给出元素符号和化学式,让学生逐渐熟悉,自然记住,到学习本课题时,已经认识并记住了一些常见元素符号,这样就减轻了对枯燥乏味的元素符号的记忆负担。
这节课需充分利用信息资源,要使得较为抽象的概念变得较为浅显易懂,注意发挥学生的主体地位,充分体现以学生为中心,教师讲解为辅的新课程理念,活跃课堂气氛,达到较好的教学效果。21教
例题展示
类型一
元素种类的判断
例1不同种元素最本质的区别是(
A
)
A.质子数
B.中子数
C.电子数
D.相对原子质量
解析:决定元素种类的是质子数(即核电荷数)。
类型二
元素符号的书写
例2下列各组元素符号的第一个大写字母相同的是(
B
)
A.氢、氧、汞
B.铜、氯、碳
C.镁、银、汞
D.镁、锰、钠
解析:A项中各元素的元素符号分别为H、O、Hg,第一个大写字母都不同,故A错;B项中各元素的元素符号分别为Cu、Cl、C,第一个大写字母都是C,故B正确;C项中各元素的元素符号分别为Mg、Ag、Hg,第一个大写字母都不同,故C错;D项中各元素的元素符号分别为Mg、Mn、Na,Na与其他两个元素的第一个大写字母不同,故D错。
类型三
元素符号的意义
例3下列符号各表示哪些意义?
(1)O:氧元素、一个氧原子。
(2)2Cu:2个铜原子。
(3)Fe:铁元素、一个铁原子、铁这种物质。
解析:元素符号前若出现系数,则只能表示几个原子,若没有系数,则可以表示元素或该元素的一个原子。若由原子直接构成的物质,元素符号还可用于直接表示该物质。
类型四
元素周期表中一格的信息
例4如图3-3-3是元素周期表中的一格,依据图中的信息,判断下列说法错误的是(
D
)
A.该元素原子的质子数为14
B.该元素属于非金属元素
C.该元素一个原子的原子核外有14个电子
D.该元素的相对原子质量为28.09
g
解析:图中左上角的“14”代表原子序数为14,即该元素原子的质子数为14,A选项正确;硅元素的“硅”字是“石”旁,属于非金属元素,B选项正确;由核电荷数等于核外电子数知C选项也是正确的;相对原子质量的单位为“1”,一般省略不写,故D项错误。
课后作业
一、当堂反馈
1.豆类、动物肝脏中含有丰富的铁和锌,这里的“铁”“锌”是指(
C
)
A.原子
B.分子
C.元素
D.单质
解析:物质是由元素组成的,生活中的物品、商品的组成成分一般指的是元素。
2.不同元素间最本质的区别是(
C
)
A.中子数不同
B.电子数不同
C.质子数不同
D.相对原子质量不同
解析:元素的种类取决于原子的质子数。质子数不同,元素的种类则不同。
3.元素符号“Cd”不能表示(
D
)
A.镉元素
B.金属镉
C.一个镉原子
D.一个镉分子
解析:元素符号可表示一种元素或这种元素的一个原子,像金属和稀有气体这些由原子构成的物质,其元素符号还表示这种物质,故Cd可表示镉元素、一个镉原子、金属镉;金属镉是由原子构成的,不存在分子。
4.元素在自然界里分布不均匀,如智利富藏铜矿、澳大利亚多铁矿、我国山东富含黄金,但从整个地壳中元素的含量来看,最丰富的金属元素是(
C
)
A.O
B.Si
C.Al
D.Fe
5.海南省澄迈县盛产“富硒西瓜”,图3-3-4是硒元素在元素周期表中的部分信息,下列有关说法正确的是(
D
)
A.硒元素属于金属元素
B.硒元素的相对原子质量是78.96
g
C.硒原子核内有78个质子
D.硒元素的原子序数为34
解析:由元素周期表可知硒元素属于非金属元素,相对原子质量为78.96,硒元素的原子核内有34个质子,原子核外有34个电子,原子序数为34。
6.下图所示是元素周期表中的一部分,根据表中信息回答下列问题。
(1)用M代表的13号元素的元素符号是Al。
(2)氯元素的原子序数n等于17,它的相对原子质量是35.45。
(3)氧、氟、硫、氯都属于非金属(填“金属”或“非金属”)元素。
解析:根据原子序数变化规律可判断出n=17,掌握表中数字的含义可写出相对原子质量的数值,根据汉字特点可知氧、氟、硫、氯都属于非金属元素。
二、课后练习
1.下列各组元素中,元素符号的第一个字母相同的一组是(
A
)
A.氯、碳、钙、铜
B.氢、汞、铁、银
C.钠、镁、氧、氮
D.锰、硫、锌、钡
解析:A中氯元素的符号为Cl,碳元素的符号为C,钙元素的符号为Ca,铜元素的符号为Cu,第一个字母均相同。
2.正在生产中的国产大型客机C919部分机身采用了新型的铝锂合金,这种材料具有较高的强度和适宜的延展性。铝锂合金中的铝(Al)元素与锂(Li)元素的本质区别是(
C
)
A.元素符号不同
B.原子质量不同
C.原子的质子数不同
D.原子的电子数不同
解析:决定元素种类的是质子数,不同元素之间最本质的区别是质子数或核电荷数不同。
3.钒被誉为“合金的维生素”,图3-3-5钒元素的部分信息如图3-3-5所示。下列有关钒的说法正确的是(
B
)
A.属于非金属元素
B.原子序数为23
C.原子核外电子数为28
D.相对原子质量为50.94
g
4.下列符号表示2个氧原子的是(
C
)
A.O2
B.2O2
C.2O
D.O2-
5.回答下列问题。
(1)请用化学用语表示:3个钾原子3K,2个氮分子2N2。
(2)图3-3-6是铝原子的结构示意图和在周期表中的位置图,则铝原子的核电荷数是13,铝元素的相对原子质量是26.98。
(3)物质①牛奶、②食醋、③蔗糖、④矿泉水中属于纯净物的是③(填序号)。
6.图3-3-7Ⅰ是元素周期表中的一部分,Ⅱ是硒原子的结构示意图。据图回答问题:
(1)图3-3-7Ⅱ中m的值为34,n的值为6。
(2)硒元素位于元素周期表中的第4周期。
解析:由图Ⅰ可知,硒元素的原子序数=34,所以m=34,n=34-2-8-18=6。
7.元素周期表是学习和研究化学的重要工具,试根据图3-3-8回答相应问题。
(1)图甲是铯元素在元素周期表中的信息,则铯元素属于金属(填“金属”或“非金属”)元素,该元素原子的核外电子数为55。
(2)图乙为元素周期表的一部分,X、Y、Z代表三种不同元素,以下AC判断正确。
A.原子序数Z>Y
B.核外电子数X=Y
C.Y和Z处于同一周期
物质构成的奥秘
课题3
元素
教学目标
一、知识与技能
1.了解元素的概念,统一对物质的宏观组成与微观结构的认识。
2.了解元素符号所表示的意义,学会元素符号的正确写法,逐步记住一些常见的元素符号。
3.初步认识元素周期表,知道它是学习和研究化学的工具,能根据原子序数,在元素周期表中找到指定元素和有关该元素的一些其他信息。
二、过程与方法
1.通过微观想象、分析、讨论、对比,认识到化学反应中分子可以发生变化而元素不发生变化。
2.通过联想记忆、卡片问答等趣味活动,帮助学生认识元素符号。
3.通过展示元素周期表,让学生进一步了解元素的有关知识,并能根据原子序数在元素周期表中找到指定元素和有关该元素的一些其他的信息。
教学重点
1.元素的概念。
2.元素符号。
3.对元素周期表的认识。
教学难点
1.元素概念的内涵。
2.元素与原子的区别和联系。
3.利用元素周期表查取一些简单信息。
新课引入
我们每时每刻都在与化学元素打交道,吸入的空气中含有氧气,氧气由氧元素组成;水中含有氢元素、氧元素;吃的蔬菜中含有铁元素,铁锈中也含有铁元素;海水中含有大量的钠元素、镁元素……这节课我们就来研究元素。
[问题导入][师]
同学们在过去已经学了几年英语了,那么你们知道英语里最基本的成分是什么吗?
[生]字母。
[师]好,老师今天就来考考你们。
[板书]在黑板上写下三个字母:a
r
e
[提问]这三个字母能组成多少单词?
[生]are、era、ear、area、rear……
[师]26个英文字母,借助不同的组合,构成了人们用以交换意见和传递思想的无数字眼。我们生活的这个世界上有两千多万种的物质,也是由100多种基本成分相互组合形成的,这些基本成分被我们称为——元素(可以鼓励学生一起说出元素这个词)。这节课我们一起来学习元素的有关知识。
教学过程
1.元素
[投影]介绍几种原子
[讲解]我们把质子数都是6的一类原子叫做碳元素,而质子数都是8的一类原子叫做氧元素等等。
(1)定义:具有相同核电荷数(即质子数)的一类原子的总称。
[思考]怎样区分氢元素和氧元素?
[归纳]元素的种类是由核内质子数决定的。也就是说质子数不同,元素的种类就不同。
例:所有核电荷数为8的氧原子总称为氧元素,所有核电荷数为1的氢原子总称为氢元素等等。
(2)特点:元素是一类原子的总称,是宏观概念,只讲种类,不讲个数。
[讲解]由定义可知,元素是一类原子的总称,具体说就是具有相同核电荷数的一类原子的总称。是宏观概念,只讲种类,不讲个数。那么在用元素描述物质的组成时,只能说该物质由几种元素组成,而不能说该物质由几个元素组成。
(3)元素在自然界中的存在。
[过渡]物质的种类很多,但组成物质的元素种类并不多,到目前为止,发现的元素种类仅一百多种。它们在地壳、生物细胞(包括人体中)、海水、空气中的含量分别是多少呢?
[分析]在地壳中,含量最多的几种元素的顺序为氧、硅、铝、铁。
在生物细胞中(包括人体中),含量最多的几种元素的顺序为氧、碳、氢。可谐音记作“氧探亲”。
海水中含量最多的几种元素的顺序为氧、氢、氯、钠。
空气中含量最多的两种元素的顺序为氮、氧。
[图片展示]
[分析]由图3-3-1可看出地壳中含量最多的元素是氧,地壳中含量最多的金属元素是铝。海水中含量最多的元素是氧。人体中含量最多的元素是氧。空气中含量最多的元素是氮。
[提问]日常生活常接触到“含氟牙膏”、“高钙牛奶”、“碘盐”、“富硒茶叶”、“加铁酱油”等用品,这里的氟、钙、碘、硒、铁指的是什么?
[回答]都是指元素。
[讨论]在发生化学反应S+O2→SO2中,分子是否发生了变化?元素是否发生了变化?
[结论]化学反应的实质是原子的重组,化学反应前后元素的种类不发生变化。
[小结]化学反应前后,分子的种类发生了变化。原子种类、元素种类均不变。
(4)原子和元素的区别
[思考]元素和原子又是什么关系?
[讲解]原子表示的是物质的微观结构,而元素表示的是物质的宏观组成。用原子时只能对应微观粒子,而用元素时只能对应宏观物质。
[总结]分子、原子、元素、物质之间的关系
①元素只讲种类,不讲个数;原子既讲种类又讲个数。
②原子用于描述物质的微观结构;元素用于描述物质的宏观组成。
[投影]练习:
判断下列说法是否正确并将错误的说法加以改正。
a.加热氧化汞生成汞和氧气,氧化汞中含有氧气分子。
b.二氧化硫分子是由硫元素和氧元素构成的。
c.水是由氧原子和氢原子构成的。
[答案]a.错误。改正:加热氧化汞生成汞和氧气,氧化汞中含有氧元素和汞元素。
b.错误。改正:二氧化硫分子是由硫原子和氧原子构成的。
c.错误。改正:水是由氢元素和氧元素组成的。
[小结]描述物质的微观结构时一般用“构成”,描述物质宏观组成时一般用“组成”,对应关系如下:
宏观→物质→元素→组成
微观→分子→原子→构成
2.元素符号
(1)书写
[过渡]了解了元素的定义以及它的特点后,我们再来看元素的表示。“知识是无国界的”,但各个国家有各自不同的语言和文字,若用各自的文字来表示,则给学术交流带来很多的不便,从而也会阻碍化学前进的脚步。所以为了书写和学术交流的方便,国际上采用统一的符号——元素符号,来表示元素。
[阅读]请大家阅读资料,了解元素符号的来源和书写方法。
[小结]①发明元素符号的是道尔顿,他曾用图形加字母的方式作为元素符号。但随着发现的元素越来越多,符号设计越来越复杂,这种符号不便于书写和记忆,未能广泛采用。
②现在国际上统一采用元素拉丁文名称的第一个字母来表示元素,书写时要大写。如,氧——O、氢——H、碳——C。
③若几种元素拉丁文名称的第一个字母相同时,就附加一个小写字母来表示。如,铜——Cu、钙——Ca、氯——Cl。
[归纳]元素符号的书写方法:第一个字母一定要大写,第二个字母一定要小写,即“一大二小”。
[提问]从课本的表格中,我们可以得到哪些信息?
[回答]
①知道一种元素,可以查出元素符号。
②知道一种元素,还可以查出该元素的相对原子质量。
[说明]相对原子质量一般是不要求记忆的,做题时可查阅此表格或后面的相对原子质量表,有的题中会给出,但是元素符号却必须要记下来。
(2)意义
[思考]
元素符号表示什么意义呢?
[讲解]
[思考]如果在元素符号前面加上化学计量数是否还能表示该元素?
[小结]如果在元素符号前面加上化学计量数,就只表示该元素原子的个数,不能表示该元素。如:H既表示氢元素,又表示一个氢原子;2H只能表示两个氢原子。(元素符号前面加数字只具有微观意义)
[练习]下列符号各表示什么意义?
①
2N
②
3S
③
nFe
[答案]①2N表示2个氮原子
②3S表示3个硫原子
③nFe表示n个铁原子
(3)元素的分类
[思考]我们已经知道了元素符号的书写方法和意义,再来想想元素中文名称有什么特点呢?
[回答]元素中文名称造字有规律,从它们的偏旁就可以知道它们属于哪一类元素:有“钅”字旁的是金属元素,有“石”字旁的是固态非金属元素,有“气”字头的是气态非金属元素,有“氵”字旁的是液态非金属元素。只有汞例外,通常状况下它是液态金属元素。
[思考]请大家结合教材资料,来分析一下元素可以怎么分类?
3.元素周期表
[过渡]超市中的商品成千上万种,为了便于顾客选购,必须将商品分门别类、有序地摆放。同样组成物质的一百多种元素,为了便于研究元素的性质和用途,也需将它们按其内在规律排列。一百多种元素按怎样的规律排列呢?
[投影]展示门捷列夫头像和元素周期表,简介元素周期表的形成史。指导学生阅读教材中相关内容。
(1)每一格,包含元素的原子序数、元素符号、元素名称、相对原子质量等内容。
(2)原子序数=核电荷数=核内质子数。
(3)元素周期表按颜色分为金属元素区和非金属元素区。
[活动与探究]
指导学生结合附录(元素周期表)完成教材P63的探究“在元素周期表中查找元素”。
课堂小结
1.元素表示物质的宏观组成,它只讲种类不讲个数。
2.元素用统一的元素符号表示,我们不仅要认识元素符号,还要会写、会读、会用元素符号来表示元素。
3.元素符号具有两个意义;它既可表示一种元素,又可表示该元素的一个原子。
4.元素周期表中,原子序数=核电荷数=核内质子数=核外电子数。
板书设计
教学反思
元素的概念教学是本课的重点,也是难点。在概念的形成过程中,从分析具体物质的组成出发,使学生知道不同物质里可以含有同种类的原子,然后指出这些原子之所以相同,是因为它们具有相同的核电荷数并由此引出元素的概念。学生往往在分析宏观组成时用的“元素”概念与微观构成时的“原子、分子”易混淆,要多结合实例比较元素与原子的区别和联系。
元素符号的教学要注意两点:一是分散难点,逐步记忆,即在化学课一开头就以化学符号的形式有计划地逐渐给出元素符号和化学式,让学生逐渐熟悉,自然记住,到学习本课题时,已经认识并记住了一些常见元素符号,这样就减轻了对枯燥乏味的元素符号的记忆负担。
这节课需充分利用信息资源,要使得较为抽象的概念变得较为浅显易懂,注意发挥学生的主体地位,充分体现以学生为中心,教师讲解为辅的新课程理念,活跃课堂气氛,达到较好的教学效果。21教
例题展示
类型一
元素种类的判断
例1不同种元素最本质的区别是(
A
)
A.质子数
B.中子数
C.电子数
D.相对原子质量
解析:决定元素种类的是质子数(即核电荷数)。
类型二
元素符号的书写
例2下列各组元素符号的第一个大写字母相同的是(
B
)
A.氢、氧、汞
B.铜、氯、碳
C.镁、银、汞
D.镁、锰、钠
解析:A项中各元素的元素符号分别为H、O、Hg,第一个大写字母都不同,故A错;B项中各元素的元素符号分别为Cu、Cl、C,第一个大写字母都是C,故B正确;C项中各元素的元素符号分别为Mg、Ag、Hg,第一个大写字母都不同,故C错;D项中各元素的元素符号分别为Mg、Mn、Na,Na与其他两个元素的第一个大写字母不同,故D错。
类型三
元素符号的意义
例3下列符号各表示哪些意义?
(1)O:氧元素、一个氧原子。
(2)2Cu:2个铜原子。
(3)Fe:铁元素、一个铁原子、铁这种物质。
解析:元素符号前若出现系数,则只能表示几个原子,若没有系数,则可以表示元素或该元素的一个原子。若由原子直接构成的物质,元素符号还可用于直接表示该物质。
类型四
元素周期表中一格的信息
例4如图3-3-3是元素周期表中的一格,依据图中的信息,判断下列说法错误的是(
D
)
A.该元素原子的质子数为14
B.该元素属于非金属元素
C.该元素一个原子的原子核外有14个电子
D.该元素的相对原子质量为28.09
g
解析:图中左上角的“14”代表原子序数为14,即该元素原子的质子数为14,A选项正确;硅元素的“硅”字是“石”旁,属于非金属元素,B选项正确;由核电荷数等于核外电子数知C选项也是正确的;相对原子质量的单位为“1”,一般省略不写,故D项错误。
课后作业
一、当堂反馈
1.豆类、动物肝脏中含有丰富的铁和锌,这里的“铁”“锌”是指(
C
)
A.原子
B.分子
C.元素
D.单质
解析:物质是由元素组成的,生活中的物品、商品的组成成分一般指的是元素。
2.不同元素间最本质的区别是(
C
)
A.中子数不同
B.电子数不同
C.质子数不同
D.相对原子质量不同
解析:元素的种类取决于原子的质子数。质子数不同,元素的种类则不同。
3.元素符号“Cd”不能表示(
D
)
A.镉元素
B.金属镉
C.一个镉原子
D.一个镉分子
解析:元素符号可表示一种元素或这种元素的一个原子,像金属和稀有气体这些由原子构成的物质,其元素符号还表示这种物质,故Cd可表示镉元素、一个镉原子、金属镉;金属镉是由原子构成的,不存在分子。
4.元素在自然界里分布不均匀,如智利富藏铜矿、澳大利亚多铁矿、我国山东富含黄金,但从整个地壳中元素的含量来看,最丰富的金属元素是(
C
)
A.O
B.Si
C.Al
D.Fe
5.海南省澄迈县盛产“富硒西瓜”,图3-3-4是硒元素在元素周期表中的部分信息,下列有关说法正确的是(
D
)
A.硒元素属于金属元素
B.硒元素的相对原子质量是78.96
g
C.硒原子核内有78个质子
D.硒元素的原子序数为34
解析:由元素周期表可知硒元素属于非金属元素,相对原子质量为78.96,硒元素的原子核内有34个质子,原子核外有34个电子,原子序数为34。
6.下图所示是元素周期表中的一部分,根据表中信息回答下列问题。
(1)用M代表的13号元素的元素符号是Al。
(2)氯元素的原子序数n等于17,它的相对原子质量是35.45。
(3)氧、氟、硫、氯都属于非金属(填“金属”或“非金属”)元素。
解析:根据原子序数变化规律可判断出n=17,掌握表中数字的含义可写出相对原子质量的数值,根据汉字特点可知氧、氟、硫、氯都属于非金属元素。
二、课后练习
1.下列各组元素中,元素符号的第一个字母相同的一组是(
A
)
A.氯、碳、钙、铜
B.氢、汞、铁、银
C.钠、镁、氧、氮
D.锰、硫、锌、钡
解析:A中氯元素的符号为Cl,碳元素的符号为C,钙元素的符号为Ca,铜元素的符号为Cu,第一个字母均相同。
2.正在生产中的国产大型客机C919部分机身采用了新型的铝锂合金,这种材料具有较高的强度和适宜的延展性。铝锂合金中的铝(Al)元素与锂(Li)元素的本质区别是(
C
)
A.元素符号不同
B.原子质量不同
C.原子的质子数不同
D.原子的电子数不同
解析:决定元素种类的是质子数,不同元素之间最本质的区别是质子数或核电荷数不同。
3.钒被誉为“合金的维生素”,图3-3-5钒元素的部分信息如图3-3-5所示。下列有关钒的说法正确的是(
B
)
A.属于非金属元素
B.原子序数为23
C.原子核外电子数为28
D.相对原子质量为50.94
g
4.下列符号表示2个氧原子的是(
C
)
A.O2
B.2O2
C.2O
D.O2-
5.回答下列问题。
(1)请用化学用语表示:3个钾原子3K,2个氮分子2N2。
(2)图3-3-6是铝原子的结构示意图和在周期表中的位置图,则铝原子的核电荷数是13,铝元素的相对原子质量是26.98。
(3)物质①牛奶、②食醋、③蔗糖、④矿泉水中属于纯净物的是③(填序号)。
6.图3-3-7Ⅰ是元素周期表中的一部分,Ⅱ是硒原子的结构示意图。据图回答问题:
(1)图3-3-7Ⅱ中m的值为34,n的值为6。
(2)硒元素位于元素周期表中的第4周期。
解析:由图Ⅰ可知,硒元素的原子序数=34,所以m=34,n=34-2-8-18=6。
7.元素周期表是学习和研究化学的重要工具,试根据图3-3-8回答相应问题。
(1)图甲是铯元素在元素周期表中的信息,则铯元素属于金属(填“金属”或“非金属”)元素,该元素原子的核外电子数为55。
(2)图乙为元素周期表的一部分,X、Y、Z代表三种不同元素,以下AC判断正确。
A.原子序数Z>Y
B.核外电子数X=Y
C.Y和Z处于同一周期
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
