2021-2022学年人教版九年级化学下册第9单元 课题1《溶液的形成》课件(40张PPT)
文档属性
| 名称 | 2021-2022学年人教版九年级化学下册第9单元 课题1《溶液的形成》课件(40张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-29 10:25:29 | ||
图片预览







文档简介
(共40张PPT)
课题1
溶液的形成
第九单元之
是不是纯净水呢?
一、教学目标:
(1)了解溶质、溶剂、溶液的基本概念。
(2)认识溶液的基本特征是均一性、稳定性。
(3)了解溶液在工农业生产和生活中的应用。
1、知识目标:
2、能力目标:
3、情感目标:
培养学生的合作精神及实事求是的科学态度。
学习科学探究和科学实验的方法,练习观察,记录、分析和解决问题的思维能力。
二、教学重点、难点
重点
1、建立溶液的概念。
2、认识溶液、溶质、溶剂三者的
难点
1、从微观上认识溶液。
2、理解溶质、溶剂的辨证关系。
关系。
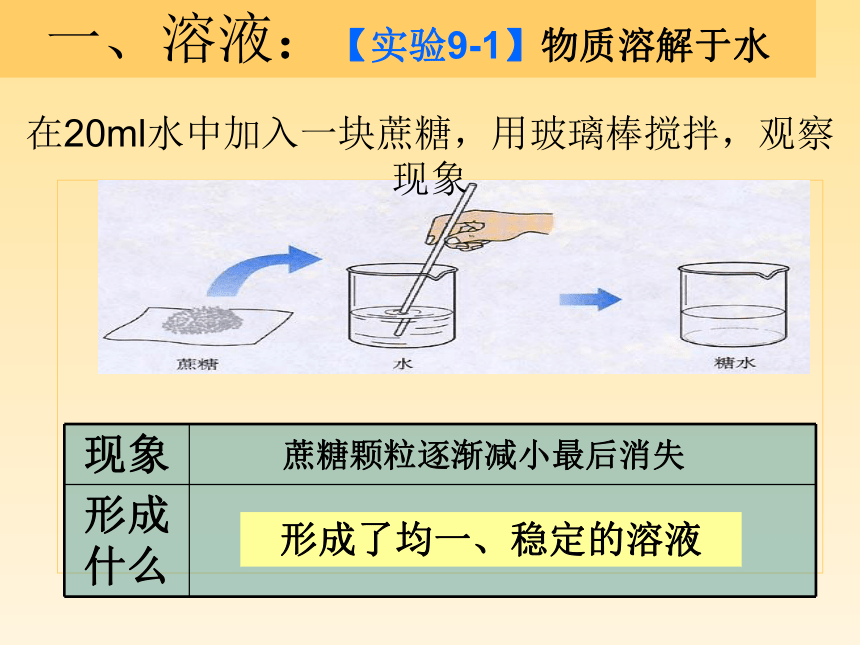
一、溶液:【实验9-1】物质溶解于水
现象
形成什么
蔗糖颗粒逐渐减小最后消失
形成了均一、稳定的溶液
在20ml水中加入一块蔗糖,用玻璃棒搅拌,观察现象
怎样解释食盐、蔗糖在水中的变化呢?
思考:
蔗糖在水中的分散
蔗糖在水中的分散
氯化钠溶于水的情况:
a.
溶解前
b.
溶解中
c.
溶解后
溶剂
溶质
食盐在水中的分散
+
-
食盐在水中的分散
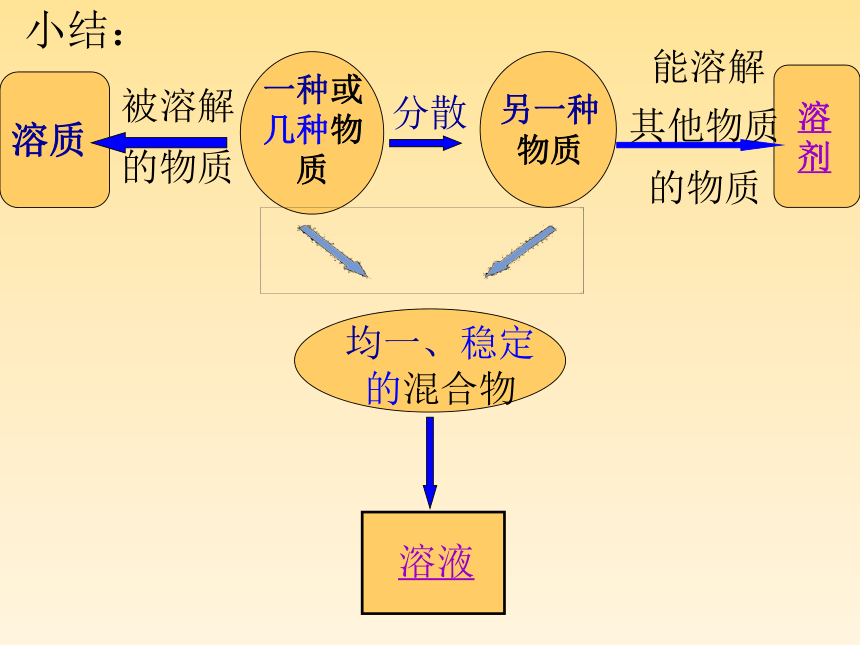
小结:
溶质
被溶解
的物质
一种或
几种物
质
分散
另一种
物质
溶
剂
均一、稳定
的混合物
溶液
能溶解
其他物质
的物质
另一种
物质
一种或几
种物质
均一稳定的混合物
能溶解其它物质的物质
分散
溶
剂
溶
质
固体液体气体
见水的是溶最剂常
溶液
被溶解的物质
小
结
均一性:溶液各处的性质、浓度都相同。
稳定性:溶液放置较长时间后,溶质不会分离
出来.
溶液是:
一种或几种物质分散到另一种物
质里,形成
均一的、稳定的
混合物。
小结:
(1)特征:均一、稳定。
均一:是指溶液中任意一部分的组成和性
稳定:是指外界条件不变时(温度、溶剂量、
(2)组成:由溶质和溶剂两部分组成。
溶质:被溶解的物质。
溶剂:能溶解其他物质的物质。水是最常见的
溶剂。
溶液质量=溶质质量+溶剂质量;溶液体积不等于溶质体积+溶剂体积
溶液的特征及组成:
质完全相同。
气体、压强等),溶质也不会从溶剂中分离出来。
(3)溶液的形成过程是溶质的分子(或离子)均匀扩散到溶剂分子之间
关于溶液的认识
(2)溶液一定是无色透明的吗?
(3)均一、稳定的液体一定是溶液吗?
(1)溶液的特征是什么?
均一性、稳定性。
不一定。如CuSO4溶液是蓝色的。
不一定。如水就不是溶液、
酒精也不是溶液。
问题与思考
课堂练习一
1.下列叙述是否正确,正确在括号内打“?”
不正确在括号内打“?”。
(1)凡是无色、透明的液体都是溶液
(
)
(2)溶液中只能有一种溶质
(
)
(3)溶液一定是
无色的
(
)
(4)氯化钠易溶于水,少量的氯化钠投入
水中后,液体各部分密度相等
(
)
2.下列不属于溶液的是
(
)
A
糖水
B
汽水
C
食盐水
D
蒸馏水
?
?
?
?
D
3.分别指出下列各溶液中的溶质、溶剂
(1)蔗糖溶液中,
溶质是
,溶剂是
;
(2)高锰酸钾溶液中,
溶质是
,溶剂
是
;
(3)稀硫酸中,
溶质是
,溶剂是
;
蔗糖
水
高锰酸钾
水
硫酸
水
讨论:
水能溶解所有的物质吗?
除了水还有其他的溶剂吗?
探究:溶质与溶剂的关系
在两支试管中各加入2mL~3mL水,分别加入1~2小粒碘或高锰酸钾;另取两支试管各加入2mL~3mL汽油,再分别加入1~2小粒碘或高锰酸钾。振荡,观察现象。
[实验]9-2
不同的溶质在不同的溶剂中的溶解性
?
)
编号
溶剂
溶质
现
象
1
水
碘
2
水
高锰酸钾
3
汽油
碘
4
汽油
高锰酸钾
结论:
碘几乎不溶于水
碘溶于汽油,溶液呈棕色
高锰酸钾不溶于汽油
高锰酸钾溶于水,呈紫红色
由1、2、3、4可得水、汽油都可以做溶剂
[1、3]
:同种溶质在不同溶剂中,溶解能力不同
[1、2]
:不同溶质在同种溶剂中,溶解能力不同
溶剂
溶质
振荡前现象
振荡后现象
静置后现象
乙醇
【实验9-3】(水和乙醇能够互溶吗)
水
结
论
分层
均匀混合
不分层
乙醇与水互溶
1、溶液中溶质与溶剂的确定
①气体和液体、固体和液体形成的溶液:气体、固体是溶质。
②液体和液体形成的溶液:量多的是溶剂,量少的溶质;若溶液中有水,则水是溶剂。
2、溶液的读法
(1)全称:(溶质)的(溶剂)溶液。
如,氯化钠的水溶液,碘的汽油溶液。
(2)简称:若溶剂为水,可直接读(溶质)溶液。
如,氯化钠溶液,硫酸铜溶液。
(3)俗称:
如,糖水、碘酒、石灰水、盐酸
判断下列溶液中的溶质和溶剂
溶液
溶质
溶剂
氢氧化钠溶液
食盐水
石灰水
医用酒精
碘酒
盐酸
稀硫酸
10ml汽油,90ml植物油
90ml酒精,10ml水
NaOH
H2O
NaCl
Ca(OH)2
C2H5OH
I2
HCl气体
H2SO4
汽油
酒精
植物油
H2O
H2O
H2O
H2O
C2H5OH
H2O
H2O
溶液的用途
无土栽培的植物
在营养液中
医药用品
课堂练习二
1.组成溶液的溶质
(
)
A.只能是固体
B.只能是液体
C.只能是气体
D.可以是固体、液体、气体
2.下列有关溶液的说法,正确的是
(
)
A
一种物质分散到另一种里就形成了溶液
B
溶质不一定是固体,溶剂也不一定是水
C
溶液中只含有一种溶质
D
均一、稳定、透明的液体都是溶液
D
B
3.分别指出下列各溶液中的溶质、溶剂
(1)氯化钠溶液中,
溶质是
,溶剂是
;
(2)医用酒精溶液中,
溶质是
,溶剂
是
;
(3)碘酒溶液中,
溶质是
,溶剂是
;
(4)盐酸溶液中,
溶质是
,溶剂是
;
氯化钠
水
酒精
水
碘
酒精
氯化氢
水
6.5g金属锌与100g稀硫酸恰好完全反应:
(1)在100g稀硫酸中,溶质的化学式为
,
其质量为
,溶剂的化学式为
,
其质量为
。
(2)完全反应后,所得溶液中溶质的化学式
,溶质的质量为
,溶液的
质量为
。
H2SO4
9.8g
H2O
90.2g
ZnSO4
16.1g
106.3g
二、溶解时的吸热或放热现象
探究:溶解时的吸热或放热现家
二、溶解时的吸热或放热现象
活动与探究
现有试管、烧杯、玻璃棒、温度计等仪器和固态NaCl、NH4NO3、NaOH(你还可选用其他仪器和药品),试设计实验方案,探究它们溶解于水时是放出热量还是吸收热量。
1、实验方案
(1)分别向三只烧杯中倒入一定质量的水,然后测出水温
(2)分别将一定量的三种固体放入上述三只烧杯中,搅拌并测出温度
(3)比较前后温度变化
根据实验记录实验结果,完成第29页表格.
2、画出所设计的实验简图
实验现象纪录
水中加入的溶质
NaCl
NH4NO3
NaOH
加入溶质前水的温度/℃
加入溶质后水的温度/℃
温度基本不变
温度降低
温度升高
结论
有的物质溶解时可能吸热,有的物质溶解时可能放热。
溶解现象
小结:
物质在溶解的过程中有的吸收热量,有的放出热量。
原因:
扩散过程=水合过程:温度变化不明显
吸热=放热
扩散过程>水合过程:温度降低
吸热>放热
扩散过程<水合过程:温度升高
吸热<放热
扩散过程:
会吸热
水合过程:
会放热
【实验9-4】(水和油的小实验)
现象
倒掉液体后试管是否干净
振荡前
振荡后
静置后
水和植物油
水和植物油及洗涤剂
液体分层
液体分层
形成乳状浑浊液体
形成乳状
浑浊液体
液体分层
液体不分层
试管
不干净
试管
较干净
三、乳化现象
乳浊液:
1、乳浊液:小液滴分散到液体里形成的混合物
2、特征:不均一、不稳定、静置液体分层
3、乳化功能:
洗涤剂去污原理:洗涤剂具有乳化功能,能将油滴分散成无数细小的液滴,随水流走。
问:洗涤剂和汽油去除油污的原理的区别
植物油大油滴
洗涤剂
分散成小油滴
(乳化)
水冲洗
(乳浊液)
随水流走
植物油大油滴
汽油
植物油的汽油溶液
(溶解)
水冲洗
随水流走
用洗发剂洗去头发上的油脂
用肥皂、洗衣粉洗去衣服上的污渍
问:生活中还有这样的例子吗?
去污原理分析:
用洗涤剂去油污
洗涤剂是乳化剂,能使油分散成无数细小的液滴而不聚成大的油珠。这些小液滴能随水流走。达到洗净衣物的目的。
反馈矫正:
(1)溶液的特征是什么?能举例说明吗?
(2)溶液一定是无色透明的吗?
(3)均一、稳定的液体一定是溶液吗?(举例)
(4)碘酒里的溶质和溶剂各是什么?
(5)将蔗糖溶液和NaCl溶液混合后还是溶液吗?
溶质是什么?
课外研究:
1、家庭小实验
,
清洗餐具
。
2、将家中的日用品溶于水。探究溶解时的吸
热、放热现象
课题1
溶液的形成
第九单元之
是不是纯净水呢?
一、教学目标:
(1)了解溶质、溶剂、溶液的基本概念。
(2)认识溶液的基本特征是均一性、稳定性。
(3)了解溶液在工农业生产和生活中的应用。
1、知识目标:
2、能力目标:
3、情感目标:
培养学生的合作精神及实事求是的科学态度。
学习科学探究和科学实验的方法,练习观察,记录、分析和解决问题的思维能力。
二、教学重点、难点
重点
1、建立溶液的概念。
2、认识溶液、溶质、溶剂三者的
难点
1、从微观上认识溶液。
2、理解溶质、溶剂的辨证关系。
关系。
一、溶液:【实验9-1】物质溶解于水
现象
形成什么
蔗糖颗粒逐渐减小最后消失
形成了均一、稳定的溶液
在20ml水中加入一块蔗糖,用玻璃棒搅拌,观察现象
怎样解释食盐、蔗糖在水中的变化呢?
思考:
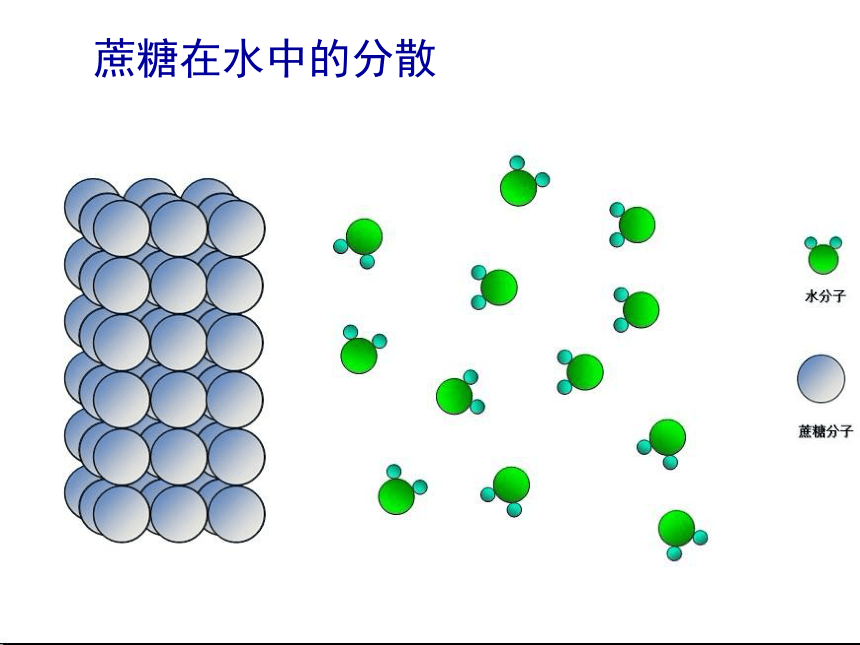
蔗糖在水中的分散
蔗糖在水中的分散
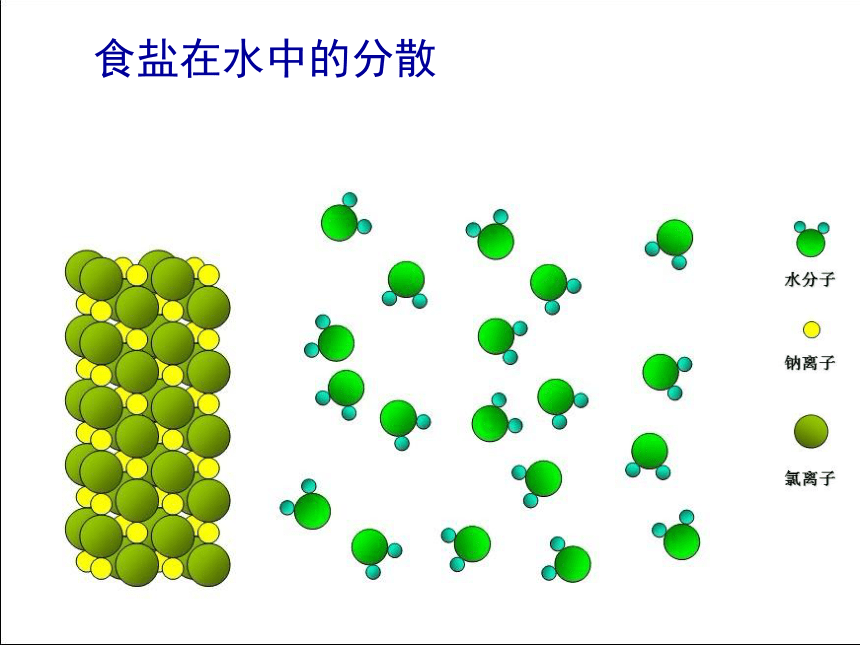
氯化钠溶于水的情况:
a.
溶解前
b.
溶解中
c.
溶解后
溶剂
溶质
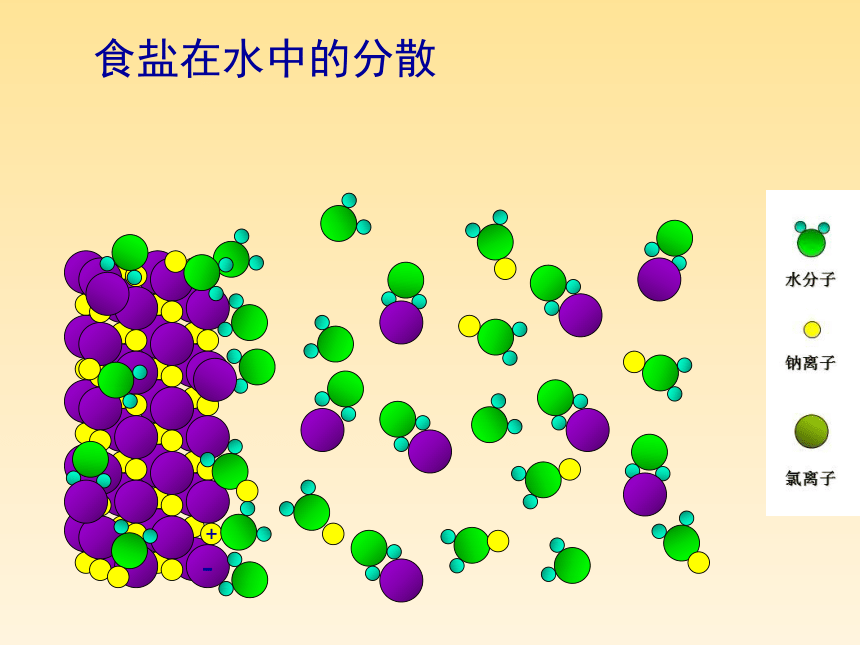
食盐在水中的分散
+
-
食盐在水中的分散
小结:
溶质
被溶解
的物质
一种或
几种物
质
分散
另一种
物质
溶
剂
均一、稳定
的混合物
溶液
能溶解
其他物质
的物质
另一种
物质
一种或几
种物质
均一稳定的混合物
能溶解其它物质的物质
分散
溶
剂
溶
质
固体液体气体
见水的是溶最剂常
溶液
被溶解的物质
小
结
均一性:溶液各处的性质、浓度都相同。
稳定性:溶液放置较长时间后,溶质不会分离
出来.
溶液是:
一种或几种物质分散到另一种物
质里,形成
均一的、稳定的
混合物。
小结:
(1)特征:均一、稳定。
均一:是指溶液中任意一部分的组成和性
稳定:是指外界条件不变时(温度、溶剂量、
(2)组成:由溶质和溶剂两部分组成。
溶质:被溶解的物质。
溶剂:能溶解其他物质的物质。水是最常见的
溶剂。
溶液质量=溶质质量+溶剂质量;溶液体积不等于溶质体积+溶剂体积
溶液的特征及组成:
质完全相同。
气体、压强等),溶质也不会从溶剂中分离出来。
(3)溶液的形成过程是溶质的分子(或离子)均匀扩散到溶剂分子之间
关于溶液的认识
(2)溶液一定是无色透明的吗?
(3)均一、稳定的液体一定是溶液吗?
(1)溶液的特征是什么?
均一性、稳定性。
不一定。如CuSO4溶液是蓝色的。
不一定。如水就不是溶液、
酒精也不是溶液。
问题与思考
课堂练习一
1.下列叙述是否正确,正确在括号内打“?”
不正确在括号内打“?”。
(1)凡是无色、透明的液体都是溶液
(
)
(2)溶液中只能有一种溶质
(
)
(3)溶液一定是
无色的
(
)
(4)氯化钠易溶于水,少量的氯化钠投入
水中后,液体各部分密度相等
(
)
2.下列不属于溶液的是
(
)
A
糖水
B
汽水
C
食盐水
D
蒸馏水
?
?
?
?
D
3.分别指出下列各溶液中的溶质、溶剂
(1)蔗糖溶液中,
溶质是
,溶剂是
;
(2)高锰酸钾溶液中,
溶质是
,溶剂
是
;
(3)稀硫酸中,
溶质是
,溶剂是
;
蔗糖
水
高锰酸钾
水
硫酸
水
讨论:
水能溶解所有的物质吗?
除了水还有其他的溶剂吗?
探究:溶质与溶剂的关系
在两支试管中各加入2mL~3mL水,分别加入1~2小粒碘或高锰酸钾;另取两支试管各加入2mL~3mL汽油,再分别加入1~2小粒碘或高锰酸钾。振荡,观察现象。
[实验]9-2
不同的溶质在不同的溶剂中的溶解性
?
)
编号
溶剂
溶质
现
象
1
水
碘
2
水
高锰酸钾
3
汽油
碘
4
汽油
高锰酸钾
结论:
碘几乎不溶于水
碘溶于汽油,溶液呈棕色
高锰酸钾不溶于汽油
高锰酸钾溶于水,呈紫红色
由1、2、3、4可得水、汽油都可以做溶剂
[1、3]
:同种溶质在不同溶剂中,溶解能力不同
[1、2]
:不同溶质在同种溶剂中,溶解能力不同
溶剂
溶质
振荡前现象
振荡后现象
静置后现象
乙醇
【实验9-3】(水和乙醇能够互溶吗)
水
结
论
分层
均匀混合
不分层
乙醇与水互溶
1、溶液中溶质与溶剂的确定
①气体和液体、固体和液体形成的溶液:气体、固体是溶质。
②液体和液体形成的溶液:量多的是溶剂,量少的溶质;若溶液中有水,则水是溶剂。
2、溶液的读法
(1)全称:(溶质)的(溶剂)溶液。
如,氯化钠的水溶液,碘的汽油溶液。
(2)简称:若溶剂为水,可直接读(溶质)溶液。
如,氯化钠溶液,硫酸铜溶液。
(3)俗称:
如,糖水、碘酒、石灰水、盐酸
判断下列溶液中的溶质和溶剂
溶液
溶质
溶剂
氢氧化钠溶液
食盐水
石灰水
医用酒精
碘酒
盐酸
稀硫酸
10ml汽油,90ml植物油
90ml酒精,10ml水
NaOH
H2O
NaCl
Ca(OH)2
C2H5OH
I2
HCl气体
H2SO4
汽油
酒精
植物油
H2O
H2O
H2O
H2O
C2H5OH
H2O
H2O
溶液的用途
无土栽培的植物
在营养液中
医药用品
课堂练习二
1.组成溶液的溶质
(
)
A.只能是固体
B.只能是液体
C.只能是气体
D.可以是固体、液体、气体
2.下列有关溶液的说法,正确的是
(
)
A
一种物质分散到另一种里就形成了溶液
B
溶质不一定是固体,溶剂也不一定是水
C
溶液中只含有一种溶质
D
均一、稳定、透明的液体都是溶液
D
B
3.分别指出下列各溶液中的溶质、溶剂
(1)氯化钠溶液中,
溶质是
,溶剂是
;
(2)医用酒精溶液中,
溶质是
,溶剂
是
;
(3)碘酒溶液中,
溶质是
,溶剂是
;
(4)盐酸溶液中,
溶质是
,溶剂是
;
氯化钠
水
酒精
水
碘
酒精
氯化氢
水
6.5g金属锌与100g稀硫酸恰好完全反应:
(1)在100g稀硫酸中,溶质的化学式为
,
其质量为
,溶剂的化学式为
,
其质量为
。
(2)完全反应后,所得溶液中溶质的化学式
,溶质的质量为
,溶液的
质量为
。
H2SO4
9.8g
H2O
90.2g
ZnSO4
16.1g
106.3g
二、溶解时的吸热或放热现象
探究:溶解时的吸热或放热现家
二、溶解时的吸热或放热现象
活动与探究
现有试管、烧杯、玻璃棒、温度计等仪器和固态NaCl、NH4NO3、NaOH(你还可选用其他仪器和药品),试设计实验方案,探究它们溶解于水时是放出热量还是吸收热量。
1、实验方案
(1)分别向三只烧杯中倒入一定质量的水,然后测出水温
(2)分别将一定量的三种固体放入上述三只烧杯中,搅拌并测出温度
(3)比较前后温度变化
根据实验记录实验结果,完成第29页表格.
2、画出所设计的实验简图
实验现象纪录
水中加入的溶质
NaCl
NH4NO3
NaOH
加入溶质前水的温度/℃
加入溶质后水的温度/℃
温度基本不变
温度降低
温度升高
结论
有的物质溶解时可能吸热,有的物质溶解时可能放热。
溶解现象
小结:
物质在溶解的过程中有的吸收热量,有的放出热量。
原因:
扩散过程=水合过程:温度变化不明显
吸热=放热
扩散过程>水合过程:温度降低
吸热>放热
扩散过程<水合过程:温度升高
吸热<放热
扩散过程:
会吸热
水合过程:
会放热
【实验9-4】(水和油的小实验)
现象
倒掉液体后试管是否干净
振荡前
振荡后
静置后
水和植物油
水和植物油及洗涤剂
液体分层
液体分层
形成乳状浑浊液体
形成乳状
浑浊液体
液体分层
液体不分层
试管
不干净
试管
较干净
三、乳化现象
乳浊液:
1、乳浊液:小液滴分散到液体里形成的混合物
2、特征:不均一、不稳定、静置液体分层
3、乳化功能:
洗涤剂去污原理:洗涤剂具有乳化功能,能将油滴分散成无数细小的液滴,随水流走。
问:洗涤剂和汽油去除油污的原理的区别
植物油大油滴
洗涤剂
分散成小油滴
(乳化)
水冲洗
(乳浊液)
随水流走
植物油大油滴
汽油
植物油的汽油溶液
(溶解)
水冲洗
随水流走
用洗发剂洗去头发上的油脂
用肥皂、洗衣粉洗去衣服上的污渍
问:生活中还有这样的例子吗?
去污原理分析:
用洗涤剂去油污
洗涤剂是乳化剂,能使油分散成无数细小的液滴而不聚成大的油珠。这些小液滴能随水流走。达到洗净衣物的目的。
反馈矫正:
(1)溶液的特征是什么?能举例说明吗?
(2)溶液一定是无色透明的吗?
(3)均一、稳定的液体一定是溶液吗?(举例)
(4)碘酒里的溶质和溶剂各是什么?
(5)将蔗糖溶液和NaCl溶液混合后还是溶液吗?
溶质是什么?
课外研究:
1、家庭小实验
,
清洗餐具
。
2、将家中的日用品溶于水。探究溶解时的吸
热、放热现象
同课章节目录
