高中化学人教版(2019)必修第一册第三章 第一节 铁及其化合物 第1课时 铁单质及其氧化物(共40张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册第三章 第一节 铁及其化合物 第1课时 铁单质及其氧化物(共40张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 7.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-30 12:15:57 | ||
图片预览








文档简介
(共40张PPT)
第1课时
铁单质及其氧化物
【预习提纲】课本P64—67,《导》62—69
一、铁单质
1.铁在地壳中含量居___位,仅次于氧、硅、铝。具有___性、____性、____性。主要以___形式存在,在化合物中铁元素的化合价主要有___价和___价。铁生锈的条件是与______同时接触。
2.化学性质
(1)与非金属单质反应
Fe
+
O2=
Fe
+
Cl2=
Fe
+
I2=
Fe
+
S
=
【预习提纲】课本P64—67,《导》62—69
(2)与非氧化性酸和某些盐反应
Fe
+
H2SO4
=
Fe
+
CuSO4
=
Fe
+
FeCl3
=
要求:写出反应的化学方程式和离子方程式
(3)与水反应
Fe
+
H2O
=
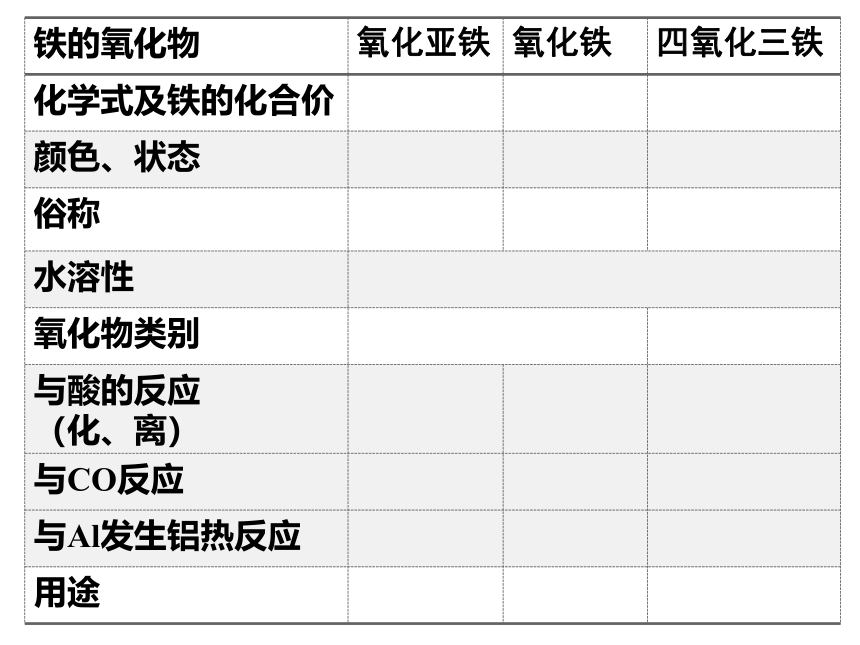
二、铁的氧化物
铁的氧化物
氧化亚铁
氧化铁
四氧化三铁
化学式及铁的化合价
颜色、状态
俗称
水溶性
氧化物类别
与酸的反应
(化、离)
与CO反应
与Al发生铝热反应
用途
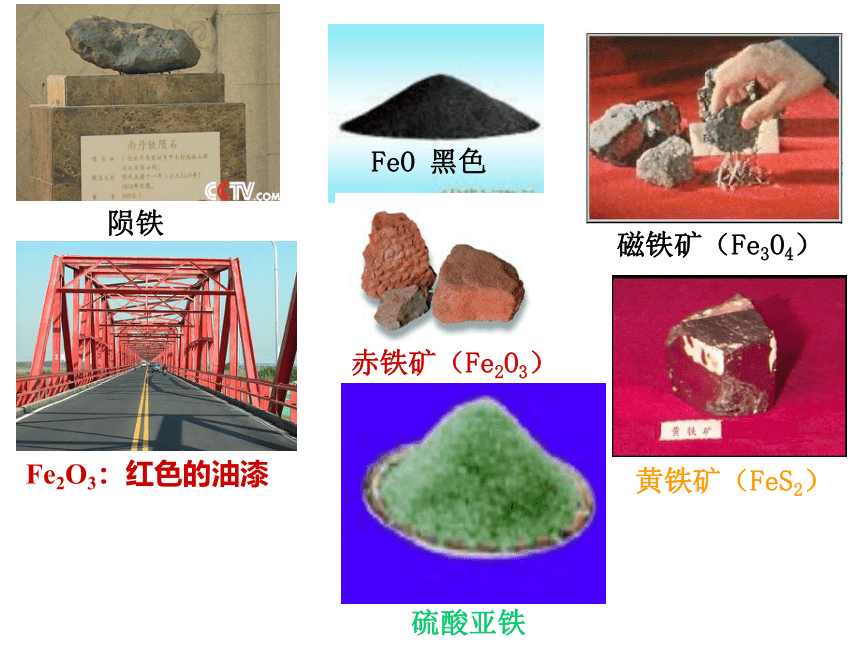
FeO
黑色
硫酸亚铁
磁铁矿(Fe3O4)
Fe2O3:红色的油漆
黄铁矿(FeS2)
陨铁
赤铁矿(Fe2O3)
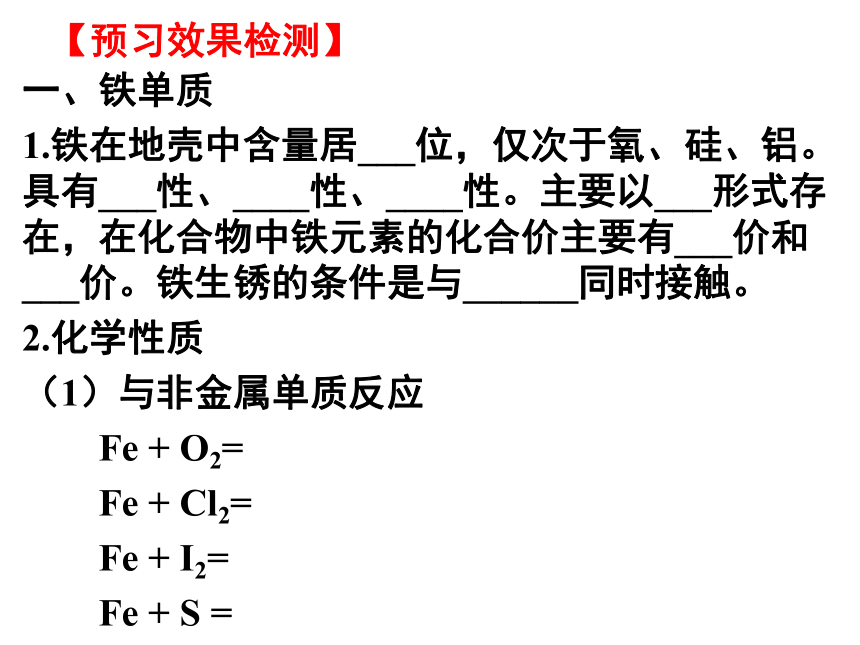
【预习效果检测】
一、铁单质
1.铁在地壳中含量居___位,仅次于氧、硅、铝。具有___性、____性、____性。主要以___形式存在,在化合物中铁元素的化合价主要有___价和___价。铁生锈的条件是与______同时接触。
2.化学性质
(1)与非金属单质反应
Fe
+
O2=
Fe
+
Cl2=
Fe
+
I2=
Fe
+
S
=
【预习效果检测】
(2)与非氧化性酸和某些盐反应
Fe
+
H2SO4
=
Fe
+
CuSO4
=
Fe
+
FeCl3
=
(3)与水反应
Fe
+
H2O
=
二、铁的氧化物
【活动一】小组讨论交流,回答下列问题。
1.比较铁与O2、Cl2的反应,试比较O2与Cl2的氧化性强弱。
2.铁在形成化合物时,其化合物有时是+2价,有时是+3价,生成物中铁的价态由什么决定?
取决于氧化剂氧化性的强弱:
(1)Fe被弱氧化剂如S、I2、H+
、Fe3+、Cu2+
等氧化为+2价;
(2)Fe被强化剂如Cl2、HNO3、浓H2SO4等氧化为+3价。
【活动二】认真阅读课本P66页【思考与讨论】,完成下列问题。
1.Fe与水蒸气反应实验原理:
2.要想完成这个实验,实验装置至少由由几个部分来完成,分别是哪几个部分?
(1)水蒸气的发生装置(2)水蒸气与铁粉反应装置
(3)产物的检验(收集)装置
方案3:
【实验现象】
加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声,反应后,试管内的固体仍呈黑色。
【方程式】
3Fe
+
4H2O(g)
Fe3O4
+
4H2
铁的氧化物(物理性质)
铁的氧化物
氧化亚铁
氧化铁
四氧化三铁
化学式及铁的化合价
颜色、状态
俗称
水溶性
FeO
Fe2O3
Fe3O4
黑色粉末
红棕色粉末
黑色晶体
铁红
磁性氧化铁
都不溶于水且不与水反应
---------
+2
+3
【活动三】
+2
+3
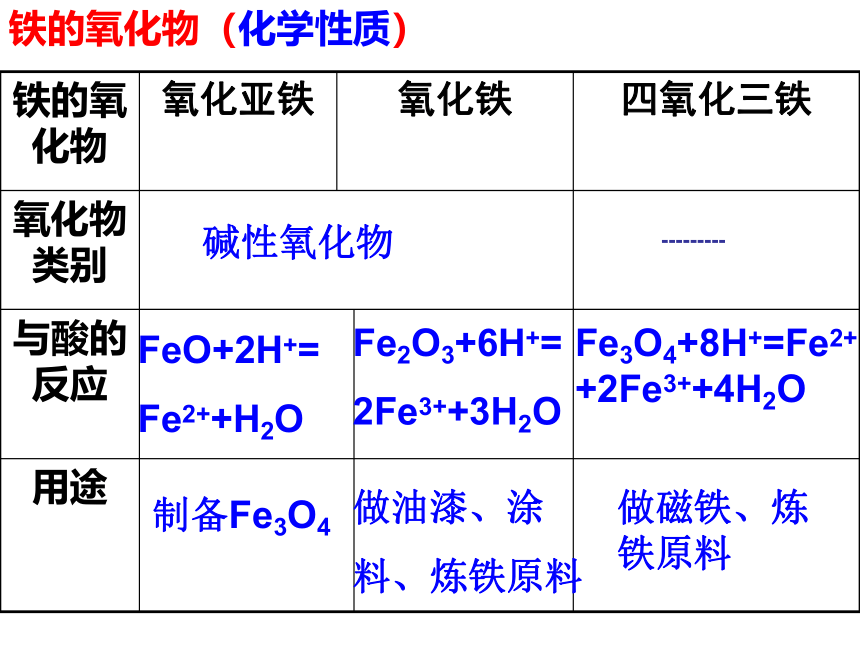
铁的氧化物(化学性质)
铁的氧化物
氧化亚铁
氧化铁
四氧化三铁
氧化物类别
与酸的反应
用途
制备Fe3O4
碱性氧化物
---------
FeO+2H+=
Fe2++H2O
Fe2O3+6H+=
2Fe3++3H2O
做油漆、涂
料、炼铁原料
做磁铁、炼铁原料
Fe3O4+8H+=Fe2+
+2Fe3++4H2O
氧化铁颜料的应用
汽车涂料
木器涂料
外墙涂料
印刷油墨
美术涂料
化妆品
第2课时
铁的氢氧化物
【预习提纲】课本P67—68,《导》62—69
Fe(OH)2
Fe(OH)3
颜色
溶解性
稳定性
制备
与盐酸反应
转化
化学方程式
现象
三、铁的氢氧化物
【活动一】探究铁的氢氧化物的制备和性质
方案一:能否通过铁和水反应制得?
方案三:用可溶性铁盐、亚铁盐与碱溶液反应?
【思考】如何制备铁的氢氧化物
?
?
方案二:能否通过铁的氧化物和水反应制得?
FeCl3溶液
FeSO4溶液
加NaOH溶液
化学方程式
先产生白色絮状沉淀,迅速变为灰绿色沉淀,最后变为红褐色沉淀
红褐色沉淀
实验3-1:在FeCl3、FeSO4分别加入NaOH溶液
二、铁的氢氧化物
1、Fe(OH)3及Fe(OH)2的制备
小组讨论:
1.氢氧化亚铁实际是白色的固体,为什么在实验中几乎观察不到白色,而最终沉淀变成了红褐色呢?
2.如何防止Fe(OH)2被氧化,你觉得关键是什么?你有哪些方案?
除去试管和溶液中氧气,创造无氧环境
1、溶液现配现用,且配制溶液的蒸馏水事先加热煮沸,除去O2。
方案
2、加入NaOH溶液的胶头滴管的尖端插入
FeSO4溶液液面以下。
3.加入有机覆盖层,隔绝O2。如植物油、苯
4、装置密封且将装置内的空气排尽。
《导》P69
Fe(OH)2的制备方法
例题:《导》P66
例1
常见装置:
1、在试管A和B中加入试剂,打开止水夹,塞紧塞子,B管中观察到的现象为
________,
目的是
________________。
B导管口有气泡
排除B试管中的空气
2、这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由
是
_______________________________________________
__________________________
试管Ⅰ生成的氢气充满试管Ⅰ和试管Ⅱ,外界空气不容易进入。
(1)
Fe(OH)3的性质
①
与酸反应
②
受热可分解
(难溶于水的红褐色固体)
(2)
Fe(OH)2的性质
①
与酸反应
②
不稳定,易被空气中的氧气氧化
Fe(OH)2+2HCl=FeCl2+2H2O
4Fe(OH)2
+
O2
+
2H2O
=
4Fe(OH)3
(氧化剂)
(还原剂)
2Fe(OH)3
=
Fe2O3
+
3H2O
Fe(OH)3
+
3HCl
=
FeCl3
+
3H2O
【活动二】
Fe(OH)2、Fe(OH)3
化学性质
(难溶于水的白色固体)
【反思】在空气中加热Fe(OH)2能得到FeO吗?为什么?
第3课时
铁盐及亚铁盐
铁是人体必需的微量元素中含量最多的一种(约4~5克),缺铁性贫血已成为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。那铁元素在人体中又是以什么形式存在呢?
都是亚铁!
如何检验?
【预习提纲】认真阅读课本P68—69,结合《导》P65课前预学区、P69完成预习笔记。
①观察颜色法:Fe2+
,Fe3+
。
②KSCN法:滴入KSCN溶液,呈_____色的溶液中含有Fe3+。
③碱液法:分别加入碱液,生成
色沉
淀的溶液中含有Fe3+;先生成
色沉淀,又迅速转变为
色,最后变为
色的溶液中含有Fe2+。
④苯酚:能使苯酚溶液显紫色的是Fe3+
⑤Cu片:铜片被腐蚀,溶液变为蓝色的是_____。
⑥K3Fe(CN)6:生成蓝色沉淀的是_______。
⑦酸性KMnO4溶液:能使KMnO4溶液褪色的是_____。
⑧淀粉KI溶液:能使淀粉KI溶液变蓝的是______。
1.Fe3+溶液和Fe2+溶液的鉴别方法:
四
.
铁盐和亚铁盐
了解FeCl3制作印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
从化学走向社会
Cu
+
2Fe3+
=
2Fe2+
+
Cu2+
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到
2~3年的保质期?
从生活走进化学
密封包装
薄膜防止Fe2+被氧化
Vc会有什么作用?
实验:在氯化铁滴加硫氰化钾溶液,再加入维生素C
氯化铁溶液,滴加硫氰化钾溶液后显红色,加入维生素C红色褪去,说明维生素C将Fe3+,还原为Fe2+
Vc
维生素C和补铁试剂同时使用,可以保证吸收的都是亚铁离子
2.Fe、Fe3+和Fe2+的相互转化:“铁三角”
3.(1)如何除去FeCl2溶液中的少量FeCl3?
方法_____________
,
离子方程式_____________。
(2)如何除去FeCl3溶液中的少量FeCl2?方法_____________
,
离子方程式_____________。
(3)如何除去FeCl2溶液中的少量CuCl2?
方法_____________
,
离子方程式___________。
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈红色
溶液颜色无变化
FeCl2
FeCl3
1、总结Fe3+溶液和Fe2+溶液的鉴别方法。
【活动一】
①观察颜色法:Fe2+
,Fe3+
。
②KSCN法:滴入KSCN溶液,呈_____色的溶液中含有Fe3+。
③碱液法:分别加入碱液,生成
色沉
淀的溶液中含有Fe3+;先生成
色沉淀,又迅速转变为
色,最后变为
色的溶液中含有Fe2+。
④苯酚:能使苯酚溶液显紫色的是Fe3+
⑤Cu片:铜片被腐蚀,溶液变为蓝色的是_____。
⑥K3Fe(CN)6:生成蓝色沉淀的是_______。
⑦酸性KMnO4溶液:能使KMnO4溶液褪色的是_____。
⑧淀粉KI溶液:能使淀粉KI溶液变蓝的是______。
浅绿色
棕黄色
血红
红褐
白
灰绿
红褐
(1)Fe3+溶液和Fe2+溶液的鉴别方法:
四
.
铁盐和亚铁盐
【思考与交流】
1.怎样用化学方法检验FeSO4试剂是否变质?
2.如何检验FeCl3溶液中含有FeCl2?
3.如何检验FeCl2溶液中含有FeCl3?
苹果汁是人们喜爱的饮料,但是现榨的苹果汁在空气中会慢慢的由浅绿色变为棕黄色,为什么呢?
新鲜苹果汁
放置一段时间
2.总结Fe3+与Fe2+在什么条件下可以相互转化。
【活动二】
现象
反应的离子方程式
FeCl3溶液中加入铁粉
滴加几滴KSCN溶液
取上层清液,滴加几滴氯水,振荡
溶液由黄色变为浅绿色
2Fe3+
+
Fe
=3
Fe2+
溶液变为红色
无明显现象
2Fe2+
+
Cl2==
2Fe3+
+2Cl-
1.阅读课本P68[实验3-3],(1)总结实验步骤;(2)观察演示实验,完成下表。
Fe2+
Fe3+
氧化剂(Cl2、H2O2、KMnO4等)
还原剂(Fe、
Cu
等)
(2)相互转化:
思考1:实验室中硫酸亚铁或氯化亚铁溶液长时间放置将会有什么变化?
如何防止硫酸亚铁或氯化亚铁溶液变质?
可行的办法是______________
写出反应方程式_______________________
思考2:(1)如何除去FeCl2溶液中的少量FeCl3?
方法_____________
,
离子方程式_____________。
(2)如何除去FeCl3溶液中的少量FeCl2?方法_____________
,
离子方程式_____________。
(3)如何除去FeCl2溶液中的少量CuCl2?
方法_____________
,
离子方程式_____________。
铁三角
强还原剂(
Al、CO、C
)
强氧化剂(Cl2、HNO3)
还原剂(
Fe、Cu、S2-、I-、H2S
)
强氧化剂(
O2、Cl2、HNO3)
强还原剂(C、CO、Al)
弱氧化剂(Cu2+、H+、I2、S)
Fe
Fe3+
Fe2+
铁及其化合物转化关系
Fe
Fe(OH)3
Fe(OH)2
Fe3+
Fe2+
Fe3O4
Fe2O3
第1课时
铁单质及其氧化物
【预习提纲】课本P64—67,《导》62—69
一、铁单质
1.铁在地壳中含量居___位,仅次于氧、硅、铝。具有___性、____性、____性。主要以___形式存在,在化合物中铁元素的化合价主要有___价和___价。铁生锈的条件是与______同时接触。
2.化学性质
(1)与非金属单质反应
Fe
+
O2=
Fe
+
Cl2=
Fe
+
I2=
Fe
+
S
=
【预习提纲】课本P64—67,《导》62—69
(2)与非氧化性酸和某些盐反应
Fe
+
H2SO4
=
Fe
+
CuSO4
=
Fe
+
FeCl3
=
要求:写出反应的化学方程式和离子方程式
(3)与水反应
Fe
+
H2O
=
二、铁的氧化物
铁的氧化物
氧化亚铁
氧化铁
四氧化三铁
化学式及铁的化合价
颜色、状态
俗称
水溶性
氧化物类别
与酸的反应
(化、离)
与CO反应
与Al发生铝热反应
用途
FeO
黑色
硫酸亚铁
磁铁矿(Fe3O4)
Fe2O3:红色的油漆
黄铁矿(FeS2)
陨铁
赤铁矿(Fe2O3)
【预习效果检测】
一、铁单质
1.铁在地壳中含量居___位,仅次于氧、硅、铝。具有___性、____性、____性。主要以___形式存在,在化合物中铁元素的化合价主要有___价和___价。铁生锈的条件是与______同时接触。
2.化学性质
(1)与非金属单质反应
Fe
+
O2=
Fe
+
Cl2=
Fe
+
I2=
Fe
+
S
=
【预习效果检测】
(2)与非氧化性酸和某些盐反应
Fe
+
H2SO4
=
Fe
+
CuSO4
=
Fe
+
FeCl3
=
(3)与水反应
Fe
+
H2O
=
二、铁的氧化物
【活动一】小组讨论交流,回答下列问题。
1.比较铁与O2、Cl2的反应,试比较O2与Cl2的氧化性强弱。
2.铁在形成化合物时,其化合物有时是+2价,有时是+3价,生成物中铁的价态由什么决定?
取决于氧化剂氧化性的强弱:
(1)Fe被弱氧化剂如S、I2、H+
、Fe3+、Cu2+
等氧化为+2价;
(2)Fe被强化剂如Cl2、HNO3、浓H2SO4等氧化为+3价。
【活动二】认真阅读课本P66页【思考与讨论】,完成下列问题。
1.Fe与水蒸气反应实验原理:
2.要想完成这个实验,实验装置至少由由几个部分来完成,分别是哪几个部分?
(1)水蒸气的发生装置(2)水蒸气与铁粉反应装置
(3)产物的检验(收集)装置
方案3:
【实验现象】
加热时试管内铁粉红热,点燃肥皂泡可听到爆鸣声,反应后,试管内的固体仍呈黑色。
【方程式】
3Fe
+
4H2O(g)
Fe3O4
+
4H2
铁的氧化物(物理性质)
铁的氧化物
氧化亚铁
氧化铁
四氧化三铁
化学式及铁的化合价
颜色、状态
俗称
水溶性
FeO
Fe2O3
Fe3O4
黑色粉末
红棕色粉末
黑色晶体
铁红
磁性氧化铁
都不溶于水且不与水反应
---------
+2
+3
【活动三】
+2
+3
铁的氧化物(化学性质)
铁的氧化物
氧化亚铁
氧化铁
四氧化三铁
氧化物类别
与酸的反应
用途
制备Fe3O4
碱性氧化物
---------
FeO+2H+=
Fe2++H2O
Fe2O3+6H+=
2Fe3++3H2O
做油漆、涂
料、炼铁原料
做磁铁、炼铁原料
Fe3O4+8H+=Fe2+
+2Fe3++4H2O
氧化铁颜料的应用
汽车涂料
木器涂料
外墙涂料
印刷油墨
美术涂料
化妆品
第2课时
铁的氢氧化物
【预习提纲】课本P67—68,《导》62—69
Fe(OH)2
Fe(OH)3
颜色
溶解性
稳定性
制备
与盐酸反应
转化
化学方程式
现象
三、铁的氢氧化物
【活动一】探究铁的氢氧化物的制备和性质
方案一:能否通过铁和水反应制得?
方案三:用可溶性铁盐、亚铁盐与碱溶液反应?
【思考】如何制备铁的氢氧化物
?
?
方案二:能否通过铁的氧化物和水反应制得?
FeCl3溶液
FeSO4溶液
加NaOH溶液
化学方程式
先产生白色絮状沉淀,迅速变为灰绿色沉淀,最后变为红褐色沉淀
红褐色沉淀
实验3-1:在FeCl3、FeSO4分别加入NaOH溶液
二、铁的氢氧化物
1、Fe(OH)3及Fe(OH)2的制备
小组讨论:
1.氢氧化亚铁实际是白色的固体,为什么在实验中几乎观察不到白色,而最终沉淀变成了红褐色呢?
2.如何防止Fe(OH)2被氧化,你觉得关键是什么?你有哪些方案?
除去试管和溶液中氧气,创造无氧环境
1、溶液现配现用,且配制溶液的蒸馏水事先加热煮沸,除去O2。
方案
2、加入NaOH溶液的胶头滴管的尖端插入
FeSO4溶液液面以下。
3.加入有机覆盖层,隔绝O2。如植物油、苯
4、装置密封且将装置内的空气排尽。
《导》P69
Fe(OH)2的制备方法
例题:《导》P66
例1
常见装置:
1、在试管A和B中加入试剂,打开止水夹,塞紧塞子,B管中观察到的现象为
________,
目的是
________________。
B导管口有气泡
排除B试管中的空气
2、这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由
是
_______________________________________________
__________________________
试管Ⅰ生成的氢气充满试管Ⅰ和试管Ⅱ,外界空气不容易进入。
(1)
Fe(OH)3的性质
①
与酸反应
②
受热可分解
(难溶于水的红褐色固体)
(2)
Fe(OH)2的性质
①
与酸反应
②
不稳定,易被空气中的氧气氧化
Fe(OH)2+2HCl=FeCl2+2H2O
4Fe(OH)2
+
O2
+
2H2O
=
4Fe(OH)3
(氧化剂)
(还原剂)
2Fe(OH)3
=
Fe2O3
+
3H2O
Fe(OH)3
+
3HCl
=
FeCl3
+
3H2O
【活动二】
Fe(OH)2、Fe(OH)3
化学性质
(难溶于水的白色固体)
【反思】在空气中加热Fe(OH)2能得到FeO吗?为什么?
第3课时
铁盐及亚铁盐
铁是人体必需的微量元素中含量最多的一种(约4~5克),缺铁性贫血已成为仅次于结核病的全球患病率最高、耗资最大的公共卫生问题。那铁元素在人体中又是以什么形式存在呢?
都是亚铁!
如何检验?
【预习提纲】认真阅读课本P68—69,结合《导》P65课前预学区、P69完成预习笔记。
①观察颜色法:Fe2+
,Fe3+
。
②KSCN法:滴入KSCN溶液,呈_____色的溶液中含有Fe3+。
③碱液法:分别加入碱液,生成
色沉
淀的溶液中含有Fe3+;先生成
色沉淀,又迅速转变为
色,最后变为
色的溶液中含有Fe2+。
④苯酚:能使苯酚溶液显紫色的是Fe3+
⑤Cu片:铜片被腐蚀,溶液变为蓝色的是_____。
⑥K3Fe(CN)6:生成蓝色沉淀的是_______。
⑦酸性KMnO4溶液:能使KMnO4溶液褪色的是_____。
⑧淀粉KI溶液:能使淀粉KI溶液变蓝的是______。
1.Fe3+溶液和Fe2+溶液的鉴别方法:
四
.
铁盐和亚铁盐
了解FeCl3制作印刷电路板
制作过程:
先在塑料板上镀上一层铜,然后在设计好的铜线路上涂上一层石蜡,把板浸到氯化铁溶液中,没有在线路上的铜即没有被石蜡覆盖住的铜就被反应掉。
从化学走向社会
Cu
+
2Fe3+
=
2Fe2+
+
Cu2+
亚铁盐是可以被氧化的,补铁的试剂是亚铁盐,补铁药品如何达到
2~3年的保质期?
从生活走进化学
密封包装
薄膜防止Fe2+被氧化
Vc会有什么作用?
实验:在氯化铁滴加硫氰化钾溶液,再加入维生素C
氯化铁溶液,滴加硫氰化钾溶液后显红色,加入维生素C红色褪去,说明维生素C将Fe3+,还原为Fe2+
Vc
维生素C和补铁试剂同时使用,可以保证吸收的都是亚铁离子
2.Fe、Fe3+和Fe2+的相互转化:“铁三角”
3.(1)如何除去FeCl2溶液中的少量FeCl3?
方法_____________
,
离子方程式_____________。
(2)如何除去FeCl3溶液中的少量FeCl2?方法_____________
,
离子方程式_____________。
(3)如何除去FeCl2溶液中的少量CuCl2?
方法_____________
,
离子方程式___________。
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈红色
溶液颜色无变化
FeCl2
FeCl3
1、总结Fe3+溶液和Fe2+溶液的鉴别方法。
【活动一】
①观察颜色法:Fe2+
,Fe3+
。
②KSCN法:滴入KSCN溶液,呈_____色的溶液中含有Fe3+。
③碱液法:分别加入碱液,生成
色沉
淀的溶液中含有Fe3+;先生成
色沉淀,又迅速转变为
色,最后变为
色的溶液中含有Fe2+。
④苯酚:能使苯酚溶液显紫色的是Fe3+
⑤Cu片:铜片被腐蚀,溶液变为蓝色的是_____。
⑥K3Fe(CN)6:生成蓝色沉淀的是_______。
⑦酸性KMnO4溶液:能使KMnO4溶液褪色的是_____。
⑧淀粉KI溶液:能使淀粉KI溶液变蓝的是______。
浅绿色
棕黄色
血红
红褐
白
灰绿
红褐
(1)Fe3+溶液和Fe2+溶液的鉴别方法:
四
.
铁盐和亚铁盐
【思考与交流】
1.怎样用化学方法检验FeSO4试剂是否变质?
2.如何检验FeCl3溶液中含有FeCl2?
3.如何检验FeCl2溶液中含有FeCl3?
苹果汁是人们喜爱的饮料,但是现榨的苹果汁在空气中会慢慢的由浅绿色变为棕黄色,为什么呢?
新鲜苹果汁
放置一段时间
2.总结Fe3+与Fe2+在什么条件下可以相互转化。
【活动二】
现象
反应的离子方程式
FeCl3溶液中加入铁粉
滴加几滴KSCN溶液
取上层清液,滴加几滴氯水,振荡
溶液由黄色变为浅绿色
2Fe3+
+
Fe
=3
Fe2+
溶液变为红色
无明显现象
2Fe2+
+
Cl2==
2Fe3+
+2Cl-
1.阅读课本P68[实验3-3],(1)总结实验步骤;(2)观察演示实验,完成下表。
Fe2+
Fe3+
氧化剂(Cl2、H2O2、KMnO4等)
还原剂(Fe、
Cu
等)
(2)相互转化:
思考1:实验室中硫酸亚铁或氯化亚铁溶液长时间放置将会有什么变化?
如何防止硫酸亚铁或氯化亚铁溶液变质?
可行的办法是______________
写出反应方程式_______________________
思考2:(1)如何除去FeCl2溶液中的少量FeCl3?
方法_____________
,
离子方程式_____________。
(2)如何除去FeCl3溶液中的少量FeCl2?方法_____________
,
离子方程式_____________。
(3)如何除去FeCl2溶液中的少量CuCl2?
方法_____________
,
离子方程式_____________。
铁三角
强还原剂(
Al、CO、C
)
强氧化剂(Cl2、HNO3)
还原剂(
Fe、Cu、S2-、I-、H2S
)
强氧化剂(
O2、Cl2、HNO3)
强还原剂(C、CO、Al)
弱氧化剂(Cu2+、H+、I2、S)
Fe
Fe3+
Fe2+
铁及其化合物转化关系
Fe
Fe(OH)3
Fe(OH)2
Fe3+
Fe2+
Fe3O4
Fe2O3
