浙教版科学2021-2022学年上学期九年级“培优提高”讲义(五):常见的碱(1)【word,含答案】
文档属性
| 名称 | 浙教版科学2021-2022学年上学期九年级“培优提高”讲义(五):常见的碱(1)【word,含答案】 |  | |
| 格式 | doc | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-09-01 19:29:56 | ||
图片预览




文档简介
氢氧化钠的物理性质
用药匙取少许氢氧化钠固体,放在表面皿上,如图1-23所示,观察它的颜色、状态等。几分钟以后再观察这些氢氧化钠,你发现有什么变化?
暴露在空气中的某些固态物质容易吸收空气里的水分,表面潮湿而逐步溶解,这种现象叫潮解(
deliquescence)
潮解是物理性质,因吸水质量增加。
干燥范围:(1)碱性气体
(NH3)
(2)中性气体
(H2、O2、N2等)
不能干燥酸性气体
(HCl、CO2、SO2、H2S等)
二、氢氧化钠的化学性质
可溶性碱:常见有NaOH、KOH、LiOH、NH4OH......能溶于水,溶液中有OH-,能使紫色石蕊试液、无色酚酞试液变色
微溶性碱:常见有Ca(OH)2,溶解度随温度增加而减小,微溶于水,溶液中有少量OH-,能使紫色石蕊试液、无色酚酞试液变色
难溶性碱:常见有Cu(OH)2、Mg(OH)2、Fe(OH)2、Fe(OH)3、Al(OH)3......由于不溶于水,不能使紫色石蕊试液、无色酚酞试液变色
1.可溶性碱能跟酸碱指示剂作用。
2.碱溶液+非金属氧化物→盐
+
水
SO2+2NaOH=Na2S03+H20
工业上常用碱溶液来吸收酸性气体。如CO2、SO2、HCl气体等
NaOH溶液
除去某些气体中混有的杂质CO2:2NaOH
+
CO2
=
Na2CO3
+
H2O
气体通过NaOH后,虽然除尽杂质CO2,但同时带出了水分,还要用浓硫酸吸收水分。
NaOH溶液为什么不用玻璃塞(主要物质是SiO2)?
SiO2
+2NaOH=Na2SiO3+H2O
因此盛放氢氧化钠溶液的试剂瓶不能用玻璃瓶盖,要用橡胶瓶盖或木塞。因为玻璃主要成分是二氧化硅。
3.碱溶液+盐→另一种碱
+
另一种盐
2NaOH+CuCl2=
Cu(OH)2↓+2NaCl
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
4.
碱溶液
+
酸→盐
+
水
2NaOH+H2SO4
=Na2SO4+2H2O
三、氢氧化钠的用途
例1、将10克20%的稀硫酸和10克20%的氢氧化钾溶液混合后,加入指示剂,下列叙述中正确的是( )
A.紫色石蕊变红
B.石蕊不变色
C.无色酚酞变红
D.无法判断
例2、仅通过右图实验现象,下列说法不合理的是(?)
A.此实验能证明大气压的存在
B.如果要证明CO2会与NaOH反应,还需要用水来做对照
C.CO2被NaOH溶液吸收后,瓶内气压一定减小
D.此实验证明CO2既会与NaOH反应,又会与水反应。
例3、为了证明CO2和NaOH是否发生了化学反应,设计实验如图所示:
(1)小明质疑如图实验还不足以说明CO2和NaOH发生了反应,其理由是
(2)为弥补如图实验不足,还可设计另一个实验,请简述实验过程
(3)实验后,向变瘪塑料瓶的溶液中加入______,观察到_______现象,从而证明CO2与NaOH溶液已经发生了反应。
例4、小丽利用底部有一小孔的大试管,如图甲所示装配成一个制取CO2气体的装置。
(1)实验前,关闭止水夹,先将试管底部稍浸没在水中,再用双手紧握试管,观察到
,则说明装置气密性良好。
(2)小丽将CO2通入盛有NaOH溶液的试管中,观察不到明显现象。那么CO2与NaOH是否发生反应?为此又做了实验:在集满CO2的软塑料瓶(如图乙)中加入适量的NaOH溶液,盖紧瓶塞振荡,发现瓶变瘪,于是认为CO2与NaOH发生了反应。小衢提出质疑,你认为导致软塑料瓶变瘪的原因还有可能是
。
(3)小科从变瘪的软塑料瓶中取出少量试液置于试管中,滴入
溶液,观察到有白色沉淀产生,就证明了CO2与NaOH的反应确实已经发生。
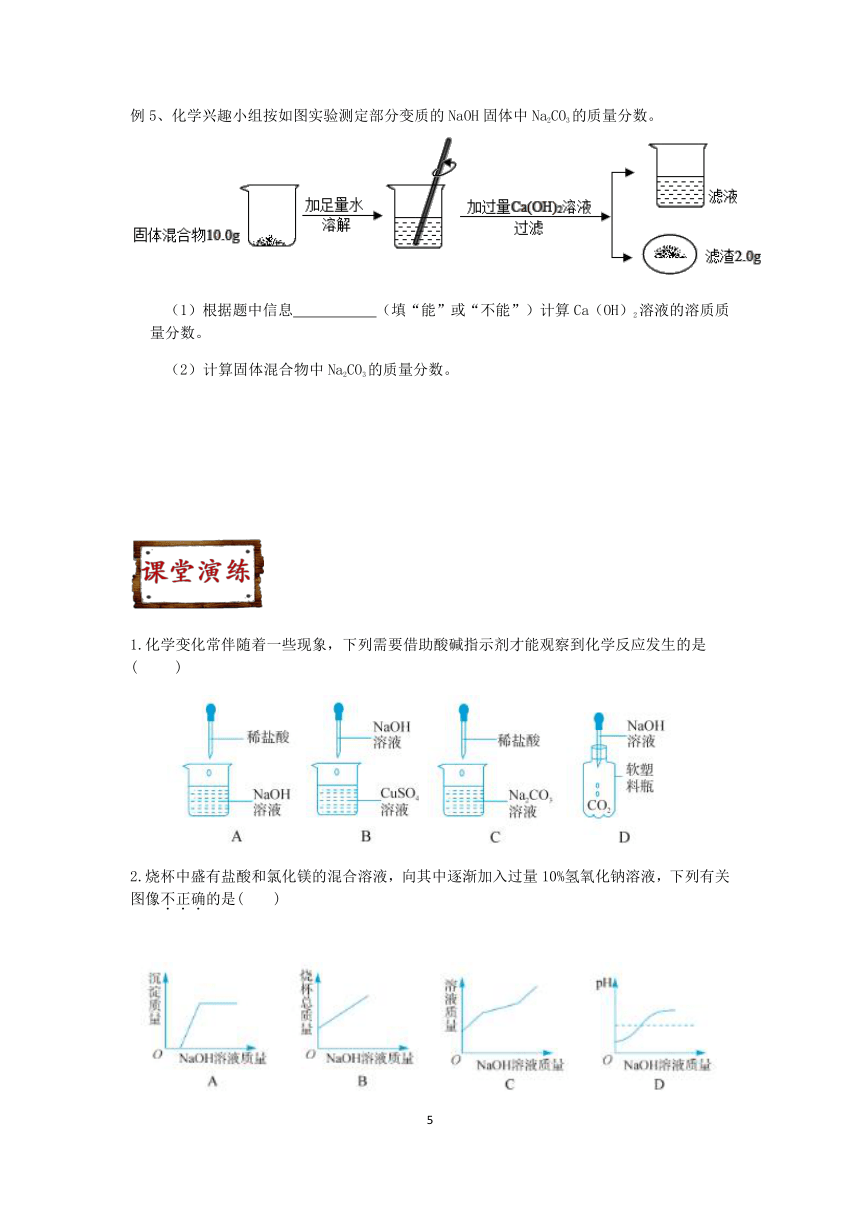
例5、化学兴趣小组按如图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
(1)根据题中信息
(填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数。
(2)计算固体混合物中Na2CO3的质量分数。
1.化学变化常伴随着一些现象,下列需要借助酸碱指示剂才能观察到化学反应发生的是(
)
2.烧杯中盛有盐酸和氯化镁的混合溶液,向其中逐渐加入过量10%氢氧化钠溶液,下列有关图像不正确的是(
)
3.下列图象,能表示加水稀释pH=10的溶液的是(
)
4、装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。有关量的变化情况见图(横坐标表示氢氧化钡溶液的质量,纵坐标表示小烧杯中量的变化)。其中肯定不正确的是( )
A.
B.
C.
D.
5、为完全中和某盐酸溶液,需a克质量分别为4%的NaOH溶液。如果改用a克质量分数为4%的KOH溶液,反应后溶液的pH(
)
A.大于7
B.小于7
C.等于7
D.无法判断
6.如图是稀HCl和NaOH溶液反应的pH变化曲线图,据图分析能得出的结论正确是(?)
A.该反应是稀HC1滴到NaOH溶液中
B.a克是指加入NaOH溶液的质量
C.A点时,溶液的溶质为NaOH、NaCl
D.B点表示稀盐酸和加入的NaOH溶液质量一定相同
7.小金通过图示装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量的20%NaOH溶液,振荡集气瓶后打开止水夹。
(1)打开止水夹后观察到的现象是__________________________________。
(2)反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质是________________。
8.某兴趣小组的同学探究一瓶敞口放置的NaOH溶液(原质量分数为10%)是否变质,进行了下述实验:
(1)小江加入的“?”是
。
(2)小江认为小柯的实验和结论不正确,理由是
。
(3)小龙将沉淀过滤、洗涤、干燥,称量质量为1.97克。已知小龙所取的待测溶液质量为10克,请根据化学方程式计算,该待测溶液中变质生成物的质量分数为
。
1.下列物质与水蒸气的混合物,既能用浓硫酸干燥,又能用氢氧化钠固体干燥的是(
)
A.SO2 B.HCl C.O2 D.CO2
2.NaOH溶液与稀盐酸反应过程中温度和pH的变化如图所示。下列说法正确的是(
)
A.60s时,溶液中溶质为NaOH和NaC1
B.该实验是将稀盐酸滴入NaOH溶液
C.NaOH溶液与稀盐酸反应为吸热反应
D.在20s到40s之间某时刻,两溶液恰好完全反应
3.如图所示,在一个盛有氢氧化钠溶液的容器中有一支燃着的蜡烛。现用一只杯子将蜡烛罩住,过一会儿,可能发生的现象是(
)
A.蜡烛继续燃烧,杯内液面不变
B.火焰逐渐熄灭,杯内液面下降
C.蜡烛燃烧更旺,杯内液面上升
D.火焰逐渐熄灭,杯内液面上升
4.小红同学用下图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
I.为了验证反应①,小红将无色酚酞试液滴入NaOH溶液中,溶液由无色变成
II.依据反应④说明NaOH必须密封保存,否则在空气中要变质,其化学反应方程式为:
III.除反应物本身,不用其他物质,为了验证反应③能够发生,你选择的物质是
a.Na2CO3
b.HC1
c.FeCl3
d.Ba(NO3)2
其化学反应方程式为:
5.小刚和小丽两位同学用如图所示装置进行实验,验证C02与NaOH是否发生反应.
(1)小刚用A装置未看到明显的现象,他认为CO2与Na0H不发生反应;
(2)小丽用B装置进行实验,看到气球变鼓,认为CO2与NaOH发生反应.
老师指出:CO2与水接触也能看到上述现象,因此上述实验不足以证明C02与NaOH发生了反应,两位同学经过认真思考,决定从分液漏斗再向B烧瓶中加入足量的稀盐酸,又看到气球变瘪,从而确定CO2与NaOH发生了反应.解释球变鼓的原因:
变瘪的原因:
(3)证明C中的CO2与NaOH溶液发生反应,两位同学认为利用该装置做个对比实验,补做实验的实验操作:
实验现象和结论:
6.实验室中有一瓶部分变质了的NaOH溶液,小丽为了测定溶液中溶质的Na2CO3的质量分数,现取20g待测溶液,向其中逐滴加入CaCl2溶液,产生沉淀质量与所加CaCl2质量的关系如图所示.
(1)B点处所得溶液中溶质有
。
(2)若加入的CaCl2溶液的质量分数为11.1%则需该溶液的质量为
(3)求待测溶液中Na2CO3的质量分数。(
写出计算过程)
参考答案
例1、A
例2、D
例3、CO2+H2O=H2CO3
将氢氧化钠溶液换成等体积的水,做同样的实验,看现象是否有差别
稀盐酸
有气泡产生.
例4、试管底部有气泡逸出
二氧化碳溶于水(或二氧化碳与水反应)
氯化钙(氯化钡、硝酸钙、硝酸钡等,合理即可)
例5、(1)不能
(2)设生成2.0g碳酸钙需要的碳酸钠的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106
100
x
2.0g
=
x=2.12g
固体混合物中Na2CO3的质量分数为×100%=21.2%
1.A
2.D
3.D
4、B
5、B
6.B
7.CaCl2溶液通过导管进入左边集气瓶,且集气瓶原有溶液中出现白色沉淀(合理即可)
NaCl、NaOH和Ca(OH)2
【解析】(1)二氧化碳和氢氧化钠反应生成碳酸钠和水,导致左边集气瓶中的气压减小,打开止水夹后,氯化钙溶液被压入左边集气瓶中,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠。
8.(1)稀HCl(或稀H2SO4或稀HNO3)
(2)碳酸钠也呈碱性,也能使无色酚酞试液变红(或部分变质,剩余的氢氧化钠也能使酚酞试液变红)
(3)10.6%
【解析】(1)根据实验现象可知,应加入稀酸溶液与变质后产生的碳酸钠反应产生气泡。(2)变质后产生的Na2CO3及剩余的氢氧化钠均能使酚酞变红。(3)由表中实验现象可知,生成的沉淀为BaCO3,根据BaCO3质量,可求出Na2CO3质量。
(3)设该溶液中Na2CO3的质量为x。
Na2CO3+BaCl2===BaCO3↓+2NaCl
106
197
x
1.97克
x=1.06克
该溶液中Na2CO3的质量分数Na2CO3%=10.6%。
1.C
2.A
3.D
4.(1)红
(2)2NaOH+CO2=Na2CO3+H2O
(3)C
?FeCl3+3NaOH=Fe(OH)3↓+3NaCl
5.二氧化碳与氢氧化钠反应瓶中压强减小,使气球鼓起;
稀盐酸与生成的碳酸钠反应生成二氧化碳,瓶中压强增大,使气球变瘪
在烧杯中注入同体积的水,取同样大的试管充满CO2后,倒扣在水槽中
装氢氧化钠溶液的烧杯液面下降的高度比装水的烧杯多
6.(1)Na2CO3、NaOH和NaCl
(2)10g
(3)设溶液中Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106
111
x
1.11g
解得:x=1.06g
待测溶液中Na2CO3的质量分数为:=5.3%
2021-2022学年上学期浙教版科学九年级“培优提高”讲义(五)
常见的碱(1)
用药匙取少许氢氧化钠固体,放在表面皿上,如图1-23所示,观察它的颜色、状态等。几分钟以后再观察这些氢氧化钠,你发现有什么变化?
暴露在空气中的某些固态物质容易吸收空气里的水分,表面潮湿而逐步溶解,这种现象叫潮解(
deliquescence)
潮解是物理性质,因吸水质量增加。
干燥范围:(1)碱性气体
(NH3)
(2)中性气体
(H2、O2、N2等)
不能干燥酸性气体
(HCl、CO2、SO2、H2S等)
二、氢氧化钠的化学性质
可溶性碱:常见有NaOH、KOH、LiOH、NH4OH......能溶于水,溶液中有OH-,能使紫色石蕊试液、无色酚酞试液变色
微溶性碱:常见有Ca(OH)2,溶解度随温度增加而减小,微溶于水,溶液中有少量OH-,能使紫色石蕊试液、无色酚酞试液变色
难溶性碱:常见有Cu(OH)2、Mg(OH)2、Fe(OH)2、Fe(OH)3、Al(OH)3......由于不溶于水,不能使紫色石蕊试液、无色酚酞试液变色
1.可溶性碱能跟酸碱指示剂作用。
2.碱溶液+非金属氧化物→盐
+
水
SO2+2NaOH=Na2S03+H20
工业上常用碱溶液来吸收酸性气体。如CO2、SO2、HCl气体等
NaOH溶液
除去某些气体中混有的杂质CO2:2NaOH
+
CO2
=
Na2CO3
+
H2O
气体通过NaOH后,虽然除尽杂质CO2,但同时带出了水分,还要用浓硫酸吸收水分。
NaOH溶液为什么不用玻璃塞(主要物质是SiO2)?
SiO2
+2NaOH=Na2SiO3+H2O
因此盛放氢氧化钠溶液的试剂瓶不能用玻璃瓶盖,要用橡胶瓶盖或木塞。因为玻璃主要成分是二氧化硅。
3.碱溶液+盐→另一种碱
+
另一种盐
2NaOH+CuCl2=
Cu(OH)2↓+2NaCl
3NaOH+FeCl3=Fe(OH)3↓+3NaCl
4.
碱溶液
+
酸→盐
+
水
2NaOH+H2SO4
=Na2SO4+2H2O
三、氢氧化钠的用途
例1、将10克20%的稀硫酸和10克20%的氢氧化钾溶液混合后,加入指示剂,下列叙述中正确的是( )
A.紫色石蕊变红
B.石蕊不变色
C.无色酚酞变红
D.无法判断
例2、仅通过右图实验现象,下列说法不合理的是(?)
A.此实验能证明大气压的存在
B.如果要证明CO2会与NaOH反应,还需要用水来做对照
C.CO2被NaOH溶液吸收后,瓶内气压一定减小
D.此实验证明CO2既会与NaOH反应,又会与水反应。
例3、为了证明CO2和NaOH是否发生了化学反应,设计实验如图所示:
(1)小明质疑如图实验还不足以说明CO2和NaOH发生了反应,其理由是
(2)为弥补如图实验不足,还可设计另一个实验,请简述实验过程
(3)实验后,向变瘪塑料瓶的溶液中加入______,观察到_______现象,从而证明CO2与NaOH溶液已经发生了反应。
例4、小丽利用底部有一小孔的大试管,如图甲所示装配成一个制取CO2气体的装置。
(1)实验前,关闭止水夹,先将试管底部稍浸没在水中,再用双手紧握试管,观察到
,则说明装置气密性良好。
(2)小丽将CO2通入盛有NaOH溶液的试管中,观察不到明显现象。那么CO2与NaOH是否发生反应?为此又做了实验:在集满CO2的软塑料瓶(如图乙)中加入适量的NaOH溶液,盖紧瓶塞振荡,发现瓶变瘪,于是认为CO2与NaOH发生了反应。小衢提出质疑,你认为导致软塑料瓶变瘪的原因还有可能是
。
(3)小科从变瘪的软塑料瓶中取出少量试液置于试管中,滴入
溶液,观察到有白色沉淀产生,就证明了CO2与NaOH的反应确实已经发生。
例5、化学兴趣小组按如图实验测定部分变质的NaOH固体中Na2CO3的质量分数。
(1)根据题中信息
(填“能”或“不能”)计算Ca(OH)2溶液的溶质质量分数。
(2)计算固体混合物中Na2CO3的质量分数。
1.化学变化常伴随着一些现象,下列需要借助酸碱指示剂才能观察到化学反应发生的是(
)
2.烧杯中盛有盐酸和氯化镁的混合溶液,向其中逐渐加入过量10%氢氧化钠溶液,下列有关图像不正确的是(
)
3.下列图象,能表示加水稀释pH=10的溶液的是(
)
4、装有50g稀硫酸的小烧杯中,不断慢慢滴加10%的Ba(OH)2溶液至过量。有关量的变化情况见图(横坐标表示氢氧化钡溶液的质量,纵坐标表示小烧杯中量的变化)。其中肯定不正确的是( )
A.
B.
C.
D.
5、为完全中和某盐酸溶液,需a克质量分别为4%的NaOH溶液。如果改用a克质量分数为4%的KOH溶液,反应后溶液的pH(
)
A.大于7
B.小于7
C.等于7
D.无法判断
6.如图是稀HCl和NaOH溶液反应的pH变化曲线图,据图分析能得出的结论正确是(?)
A.该反应是稀HC1滴到NaOH溶液中
B.a克是指加入NaOH溶液的质量
C.A点时,溶液的溶质为NaOH、NaCl
D.B点表示稀盐酸和加入的NaOH溶液质量一定相同
7.小金通过图示装置验证CO2能与NaOH发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量的20%NaOH溶液,振荡集气瓶后打开止水夹。
(1)打开止水夹后观察到的现象是__________________________________。
(2)反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质是________________。
8.某兴趣小组的同学探究一瓶敞口放置的NaOH溶液(原质量分数为10%)是否变质,进行了下述实验:
(1)小江加入的“?”是
。
(2)小江认为小柯的实验和结论不正确,理由是
。
(3)小龙将沉淀过滤、洗涤、干燥,称量质量为1.97克。已知小龙所取的待测溶液质量为10克,请根据化学方程式计算,该待测溶液中变质生成物的质量分数为
。
1.下列物质与水蒸气的混合物,既能用浓硫酸干燥,又能用氢氧化钠固体干燥的是(
)
A.SO2 B.HCl C.O2 D.CO2
2.NaOH溶液与稀盐酸反应过程中温度和pH的变化如图所示。下列说法正确的是(
)
A.60s时,溶液中溶质为NaOH和NaC1
B.该实验是将稀盐酸滴入NaOH溶液
C.NaOH溶液与稀盐酸反应为吸热反应
D.在20s到40s之间某时刻,两溶液恰好完全反应
3.如图所示,在一个盛有氢氧化钠溶液的容器中有一支燃着的蜡烛。现用一只杯子将蜡烛罩住,过一会儿,可能发生的现象是(
)
A.蜡烛继续燃烧,杯内液面不变
B.火焰逐渐熄灭,杯内液面下降
C.蜡烛燃烧更旺,杯内液面上升
D.火焰逐渐熄灭,杯内液面上升
4.小红同学用下图总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学反应)。
I.为了验证反应①,小红将无色酚酞试液滴入NaOH溶液中,溶液由无色变成
II.依据反应④说明NaOH必须密封保存,否则在空气中要变质,其化学反应方程式为:
III.除反应物本身,不用其他物质,为了验证反应③能够发生,你选择的物质是
a.Na2CO3
b.HC1
c.FeCl3
d.Ba(NO3)2
其化学反应方程式为:
5.小刚和小丽两位同学用如图所示装置进行实验,验证C02与NaOH是否发生反应.
(1)小刚用A装置未看到明显的现象,他认为CO2与Na0H不发生反应;
(2)小丽用B装置进行实验,看到气球变鼓,认为CO2与NaOH发生反应.
老师指出:CO2与水接触也能看到上述现象,因此上述实验不足以证明C02与NaOH发生了反应,两位同学经过认真思考,决定从分液漏斗再向B烧瓶中加入足量的稀盐酸,又看到气球变瘪,从而确定CO2与NaOH发生了反应.解释球变鼓的原因:
变瘪的原因:
(3)证明C中的CO2与NaOH溶液发生反应,两位同学认为利用该装置做个对比实验,补做实验的实验操作:
实验现象和结论:
6.实验室中有一瓶部分变质了的NaOH溶液,小丽为了测定溶液中溶质的Na2CO3的质量分数,现取20g待测溶液,向其中逐滴加入CaCl2溶液,产生沉淀质量与所加CaCl2质量的关系如图所示.
(1)B点处所得溶液中溶质有
。
(2)若加入的CaCl2溶液的质量分数为11.1%则需该溶液的质量为
(3)求待测溶液中Na2CO3的质量分数。(
写出计算过程)
参考答案
例1、A
例2、D
例3、CO2+H2O=H2CO3
将氢氧化钠溶液换成等体积的水,做同样的实验,看现象是否有差别
稀盐酸
有气泡产生.
例4、试管底部有气泡逸出
二氧化碳溶于水(或二氧化碳与水反应)
氯化钙(氯化钡、硝酸钙、硝酸钡等,合理即可)
例5、(1)不能
(2)设生成2.0g碳酸钙需要的碳酸钠的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106
100
x
2.0g
=
x=2.12g
固体混合物中Na2CO3的质量分数为×100%=21.2%
1.A
2.D
3.D
4、B
5、B
6.B
7.CaCl2溶液通过导管进入左边集气瓶,且集气瓶原有溶液中出现白色沉淀(合理即可)
NaCl、NaOH和Ca(OH)2
【解析】(1)二氧化碳和氢氧化钠反应生成碳酸钠和水,导致左边集气瓶中的气压减小,打开止水夹后,氯化钙溶液被压入左边集气瓶中,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠。
8.(1)稀HCl(或稀H2SO4或稀HNO3)
(2)碳酸钠也呈碱性,也能使无色酚酞试液变红(或部分变质,剩余的氢氧化钠也能使酚酞试液变红)
(3)10.6%
【解析】(1)根据实验现象可知,应加入稀酸溶液与变质后产生的碳酸钠反应产生气泡。(2)变质后产生的Na2CO3及剩余的氢氧化钠均能使酚酞变红。(3)由表中实验现象可知,生成的沉淀为BaCO3,根据BaCO3质量,可求出Na2CO3质量。
(3)设该溶液中Na2CO3的质量为x。
Na2CO3+BaCl2===BaCO3↓+2NaCl
106
197
x
1.97克
x=1.06克
该溶液中Na2CO3的质量分数Na2CO3%=10.6%。
1.C
2.A
3.D
4.(1)红
(2)2NaOH+CO2=Na2CO3+H2O
(3)C
?FeCl3+3NaOH=Fe(OH)3↓+3NaCl
5.二氧化碳与氢氧化钠反应瓶中压强减小,使气球鼓起;
稀盐酸与生成的碳酸钠反应生成二氧化碳,瓶中压强增大,使气球变瘪
在烧杯中注入同体积的水,取同样大的试管充满CO2后,倒扣在水槽中
装氢氧化钠溶液的烧杯液面下降的高度比装水的烧杯多
6.(1)Na2CO3、NaOH和NaCl
(2)10g
(3)设溶液中Na2CO3的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106
111
x
1.11g
解得:x=1.06g
待测溶液中Na2CO3的质量分数为:=5.3%
2021-2022学年上学期浙教版科学九年级“培优提高”讲义(五)
常见的碱(1)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
