1.1.2《原子结构—构造原理》PPT课件(新人教版-选修3)
文档属性
| 名称 | 1.1.2《原子结构—构造原理》PPT课件(新人教版-选修3) |

|
|
| 格式 | zip | ||
| 文件大小 | 348.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-17 00:00:00 | ||
图片预览






文档简介
(共18张PPT)
新课标人教版课件系列
《高中化学》
选修3
1.1.2《原子结构—
构造原理》
教学目标
一、知识与能力
1.知道原子核外电子的排布遵循能量最低原理2.知道原子的基态和激发态的涵义3.初步知道原子核外电子的跃迁及吸收或发射光谱,了解其简单应用
二、教学重点
1.能根据构造原理写出1至36号元素原子的电子排布式。
2.知道原子核外电子的排布遵循能量最低原理
三、教学难点:
1.知道原子核外电子的排布遵循能量最低原理
2.基态、激发态与光谱
四、教学方法:
讲授法、指导阅读法、讨论归纳法、讲练结合法等
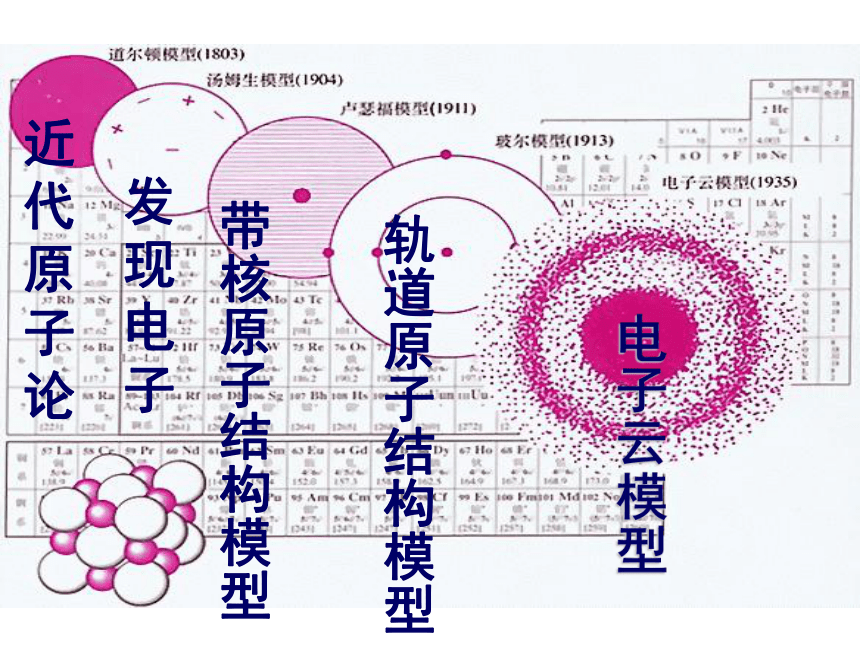
近代原子论
发现电子
带核原子结构模型
轨道原子结构模型
电子云模型
能层:在多电子原子的核外电子的能量是不同的,按电子能量的差异,可以将核外电子分为不同的能层.
能级:在多电子原子中,同一能层的电子的能量也可能不同,可以将它们分为不同的能级.
1.道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代原子——分子学说的观点看,你认为不正确的是( )
A 只有① B 只有② C 只有③ D ①②③
2.在同一个原子中,离核越近、n越小的电子层能量 。在同一电子层中,各亚层的能量按s、p、d、f的次序 。
3.理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级分别为 。
三、构造原理
★原子的电子排布遵循构造原理使整个原子的能量处于最低状态,简称能量最低原理
ns<(n-2)f<(n-1)d各能级的能量高低顺序
n表示能层序数
1.下列各原子的电子排布正确的是( )
A.Be 1s22s12p1 B.C 1s22s22p2 C.He 1s12s1 D.Cl 1s22s22p63s23p5
BD
2.书写下列原子的电子排布式
S Fe Sc V Se Ga Br
3.下列各原子或离子的电子排布式错误的是( )
A Al 1s22s22p63s23p1
B O2- 1s22s22p6
C Na+ 1s22s22p6
D Si 1s22s22p2
D
思考与交流
电子排布式可以简化,如可以把钠的电子排布式写成【Ne】3s1。试问:上式方括号中的符号的意义是什么?你能仿照钠原子的简化电子排布式写出O、Si、Fe的简化电子排布式吗?
四、基态与激发态、原子光谱
1.基态原子与激发态原子
处于最低能量的原子叫做基态原子
当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子
可利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
不同元素的原子发生跃迁时会吸收或释放不同的能量
表现为光的形式
用光谱仪摄取
得到各种元素的电子的吸收光谱或发射光谱
1、判断下列表达是正确还是错误
1)1s22p1属于基态;
2)1s22s2 2p63s2 3p63d54s1属于激发态;
3)1s22s2 2p63d1属于激发态;
4)1s22s2 2p63p1属于基态;
答案: (1) x(2) x(3)√(4) x
课堂练习
小结:
1.各原子轨道的能量高低比较
(1)ns(2)1s<2s<3s<4s
(3)同一能层同一能级的各原子轨道能量相等: 2Px=2Py=2Pz
2.
电子层 原子轨道类型 原子轨道数目 可容纳电子数
1
2
3
4
n
1s
2s,2p
4s,4p,4d,4f
3s,3p,3d
1
4
9
16
n2
——
2
8
18
32
2n2
3.基态原子核外电子排布的规则与思路
①已知核外电子数目先按照能量最低原理从1s排起
②其间应考虑是否需应用泡利原理和洪特规则,特别是要求画外围轨道表示式
③最后考虑是否需要应用量子力学关于全空、半充满、全充满的排布规定,如Cr、Cu等原子
★要求:1-36号元素原子
新课标人教版课件系列
《高中化学》
选修3
1.1.2《原子结构—
构造原理》
教学目标
一、知识与能力
1.知道原子核外电子的排布遵循能量最低原理2.知道原子的基态和激发态的涵义3.初步知道原子核外电子的跃迁及吸收或发射光谱,了解其简单应用
二、教学重点
1.能根据构造原理写出1至36号元素原子的电子排布式。
2.知道原子核外电子的排布遵循能量最低原理
三、教学难点:
1.知道原子核外电子的排布遵循能量最低原理
2.基态、激发态与光谱
四、教学方法:
讲授法、指导阅读法、讨论归纳法、讲练结合法等
近代原子论
发现电子
带核原子结构模型
轨道原子结构模型
电子云模型
能层:在多电子原子的核外电子的能量是不同的,按电子能量的差异,可以将核外电子分为不同的能层.
能级:在多电子原子中,同一能层的电子的能量也可能不同,可以将它们分为不同的能级.
1.道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代原子——分子学说的观点看,你认为不正确的是( )
A 只有① B 只有② C 只有③ D ①②③
2.在同一个原子中,离核越近、n越小的电子层能量 。在同一电子层中,各亚层的能量按s、p、d、f的次序 。
3.理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级分别为 。
三、构造原理
★原子的电子排布遵循构造原理使整个原子的能量处于最低状态,简称能量最低原理
ns<(n-2)f<(n-1)d
n表示能层序数
1.下列各原子的电子排布正确的是( )
A.Be 1s22s12p1 B.C 1s22s22p2 C.He 1s12s1 D.Cl 1s22s22p63s23p5
BD
2.书写下列原子的电子排布式
S Fe Sc V Se Ga Br
3.下列各原子或离子的电子排布式错误的是( )
A Al 1s22s22p63s23p1
B O2- 1s22s22p6
C Na+ 1s22s22p6
D Si 1s22s22p2
D
思考与交流
电子排布式可以简化,如可以把钠的电子排布式写成【Ne】3s1。试问:上式方括号中的符号的意义是什么?你能仿照钠原子的简化电子排布式写出O、Si、Fe的简化电子排布式吗?
四、基态与激发态、原子光谱
1.基态原子与激发态原子
处于最低能量的原子叫做基态原子
当基态原子的电子吸收能量后,电子会跃迁到较高能级,变成激发态原子
可利用原子光谱上的特征谱线来鉴定元素,称为光谱分析
不同元素的原子发生跃迁时会吸收或释放不同的能量
表现为光的形式
用光谱仪摄取
得到各种元素的电子的吸收光谱或发射光谱
1、判断下列表达是正确还是错误
1)1s22p1属于基态;
2)1s22s2 2p63s2 3p63d54s1属于激发态;
3)1s22s2 2p63d1属于激发态;
4)1s22s2 2p63p1属于基态;
答案: (1) x(2) x(3)√(4) x
课堂练习
小结:
1.各原子轨道的能量高低比较
(1)ns
(3)同一能层同一能级的各原子轨道能量相等: 2Px=2Py=2Pz
2.
电子层 原子轨道类型 原子轨道数目 可容纳电子数
1
2
3
4
n
1s
2s,2p
4s,4p,4d,4f
3s,3p,3d
1
4
9
16
n2
——
2
8
18
32
2n2
3.基态原子核外电子排布的规则与思路
①已知核外电子数目先按照能量最低原理从1s排起
②其间应考虑是否需应用泡利原理和洪特规则,特别是要求画外围轨道表示式
③最后考虑是否需要应用量子力学关于全空、半充满、全充满的排布规定,如Cr、Cu等原子
★要求:1-36号元素原子
