1.1.3《原子结构—电子云与原子轨道》PPT课件(新人教版-选修3)
文档属性
| 名称 | 1.1.3《原子结构—电子云与原子轨道》PPT课件(新人教版-选修3) |  | |
| 格式 | zip | ||
| 文件大小 | 247.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-17 08:05:50 | ||
图片预览






文档简介
(共19张PPT)
新课标人教版课件系列
《高中化学》
选修3
1.1.3《原子结构—
电子云与原子轨道》
教学目标
一、知识与能力
1. 了解电子云和原子轨道的含义。
2. 知道原子核外电子的排布遵循能量最低原理
二、教学重难点
1. 原子轨道的含义
2. 泡利原理和洪特规则
三、教学方法
以科学探究、思考与交流等方式,探究泡利原则、洪特规则以及原子结构之间的关系,充分认识结构决定性质的化学基础
四、教具准备
多媒体
1、判断下列表达是正确还是错误
1)1s22p1属于基态;
2)1s22s2 2p63s2 3p63d54s1属于激发态;
3)1s22s2 2p63d1属于激发态;
4)1s22s2 2p63p1属于基态;
答案: (1) x(2) x(3)√(4) x
课堂练习
五、电子云与原子轨道
思考: 宏观物体与微观物体(电子)的运动有什么区别
宏观物体的运动特征:
可以准确地测出它们在某一时刻所处的位置及运行的速度;
可以描画它们的运动轨迹。
微观物体的运动特征:
电子的质量很小,只有9.11×10-31千克;
核外电子的运动范围很小(相对于宏观物体而言);
电子的运动速度很大;
测不准
1、电子云
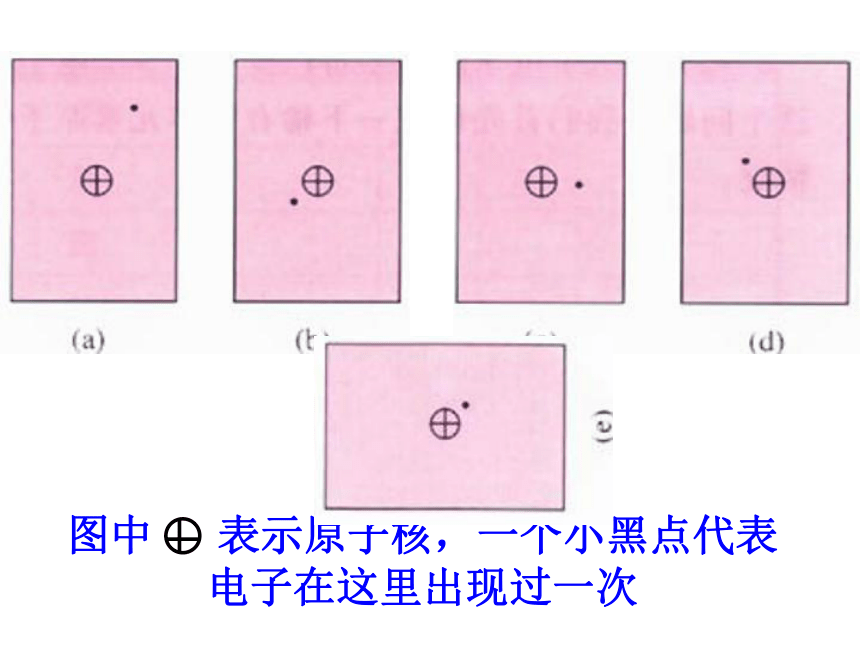
图中 表示原子核,一个小黑点代表电子在这里出现过一次
小黑点的疏密表示电子在核外空间单位体积内出现的概率的大小。
1s电子在原子核外出现的概率分布图
★量子力学中将这种电子云轮廓图称为 “原子轨道”
a.s电子的原子轨道(电子云)形状 是以原子核为中心的球体,只有一个伸展方向
2、原子轨道
2.p电子云/原子轨道的形状是纺锤形(或称为哑铃形),其伸展方向是互向垂直的三个方向(Px、Py、Pz)。
P电子原子轨道半径同样随着n增大而增大
科学探究
观察图1-14,这些图称为原子的电子轨道表示式
1.每个原子轨道最多只能容纳几个电子?
2.当电子排在同一个能级内时,有什么规律?
★核外电子排布规则:
1.能量最低原理
2.泡利不相容原理
3.洪特规则
4.补充规则
相对稳定的状态
全充满(p6,d10,f14)
全空时(p0,d0,f0)
半充满(p3,d5,f7)
24Cr原子的电子排布图:
1s22s22p63s23p63d54s1
不是3d44s2
例:
注意
小结:
1.各原子轨道的能量高低比较
(1)ns(2)1s<2s<3s<4s
(3)同一能层同一能级的各原子轨道能量相等: 2Px=2Py=2Pz
电子层 原子轨道类型 原子轨道数目 可容纳电子数
1
2
3
4
n
1s
2s,2p
4s,4p,4d,4f
3s,3p,3d
1
4
9
16
n2
——
2
8
18
32
2n2
3.基态原子核外电子排布的规则与思路
①已知核外电子数目先按照能量最低原理从1s排起
②其间应考虑是否需应用泡利原理和洪特规则,特别是要求画外围轨道表示式
③最后考虑是否需要应用量子力学关于全空、半充满、全充满的排布规定,如Cr、Cu等原子
★要求:1-36号元素原子
新课标人教版课件系列
《高中化学》
选修3
1.1.3《原子结构—
电子云与原子轨道》
教学目标
一、知识与能力
1. 了解电子云和原子轨道的含义。
2. 知道原子核外电子的排布遵循能量最低原理
二、教学重难点
1. 原子轨道的含义
2. 泡利原理和洪特规则
三、教学方法
以科学探究、思考与交流等方式,探究泡利原则、洪特规则以及原子结构之间的关系,充分认识结构决定性质的化学基础
四、教具准备
多媒体
1、判断下列表达是正确还是错误
1)1s22p1属于基态;
2)1s22s2 2p63s2 3p63d54s1属于激发态;
3)1s22s2 2p63d1属于激发态;
4)1s22s2 2p63p1属于基态;
答案: (1) x(2) x(3)√(4) x
课堂练习
五、电子云与原子轨道
思考: 宏观物体与微观物体(电子)的运动有什么区别
宏观物体的运动特征:
可以准确地测出它们在某一时刻所处的位置及运行的速度;
可以描画它们的运动轨迹。
微观物体的运动特征:
电子的质量很小,只有9.11×10-31千克;
核外电子的运动范围很小(相对于宏观物体而言);
电子的运动速度很大;
测不准
1、电子云
图中 表示原子核,一个小黑点代表电子在这里出现过一次
小黑点的疏密表示电子在核外空间单位体积内出现的概率的大小。
1s电子在原子核外出现的概率分布图
★量子力学中将这种电子云轮廓图称为 “原子轨道”
a.s电子的原子轨道(电子云)形状 是以原子核为中心的球体,只有一个伸展方向
2、原子轨道
2.p电子云/原子轨道的形状是纺锤形(或称为哑铃形),其伸展方向是互向垂直的三个方向(Px、Py、Pz)。
P电子原子轨道半径同样随着n增大而增大
科学探究
观察图1-14,这些图称为原子的电子轨道表示式
1.每个原子轨道最多只能容纳几个电子?
2.当电子排在同一个能级内时,有什么规律?
★核外电子排布规则:
1.能量最低原理
2.泡利不相容原理
3.洪特规则
4.补充规则
相对稳定的状态
全充满(p6,d10,f14)
全空时(p0,d0,f0)
半充满(p3,d5,f7)
24Cr原子的电子排布图:
1s22s22p63s23p63d54s1
不是3d44s2
例:
注意
小结:
1.各原子轨道的能量高低比较
(1)ns
(3)同一能层同一能级的各原子轨道能量相等: 2Px=2Py=2Pz
电子层 原子轨道类型 原子轨道数目 可容纳电子数
1
2
3
4
n
1s
2s,2p
4s,4p,4d,4f
3s,3p,3d
1
4
9
16
n2
——
2
8
18
32
2n2
3.基态原子核外电子排布的规则与思路
①已知核外电子数目先按照能量最低原理从1s排起
②其间应考虑是否需应用泡利原理和洪特规则,特别是要求画外围轨道表示式
③最后考虑是否需要应用量子力学关于全空、半充满、全充满的排布规定,如Cr、Cu等原子
★要求:1-36号元素原子
