云南省曲靖市罗平县2020-2021学年高一下学期期末考试理科化学试题 Word版含答案
文档属性
| 名称 | 云南省曲靖市罗平县2020-2021学年高一下学期期末考试理科化学试题 Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 624.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-01 16:32:24 | ||
图片预览


文档简介
罗平县2020-2021学年(下)学期高一年级期末考试
理科化学试卷
试卷满分:100分
考试时间:90
分钟
可能用到的相对原子质量:
H-1
C-12
N-14
O
-16
Ne-20
Na-23
Si-28
K-39
Cl-
35.5
Fe-56
第
I
卷
选择题(共48分)
一、选择题(本题包括16小题,每小题3分,共48分,在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.(精选)化学与生活、科技密切相关,下列说法正确的是(
)
A.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
B.2020年我国发射的嫦娥5号探月器的太阳能电池板的主要成分是
C.我国海洋开发走向“深蓝”,“蛟龙号”外壳材料使用的钛合金属于化合物
D氢氧化钠、氢氧化铝、碳酸钠都是常见的胃酸的中和剂
2.(精选)下列叙述中正确的是(
)
A.HClO是弱酸,所以
NaClO是弱电解质
B.35Cl与37Cl互为同位素,物理性质几乎相同,化学性质不同
C.
溶液、胶体与沉淀本质区别是有没有丁达尔效应
D.
用电子式表示CaCl2的形成过程:
3.(改编)设代表阿伏加德罗常数的值,下列说法正确的是(
)
A.
标准状况下,22.4L氖气与22.4L氢气所含原子数均为2
B.
28g铁与足量盐酸反应转移的电子数为
C.
标准状况下,22.4L
CCl4所含氯原子数均为4
D.
0.1个CO分子在标准状况下的体积约是4.48L
4.(精选)下列离子方程式的书写正确的是(
)
A.氢氧化镁和盐酸反应:
B.Ag与稀硫酸反应:
C.用小苏打治疗胃酸过多:
D.将Na
加入CuSO4溶液中:2Na
+
Cu2+
=
Cu
+
2Na+
5.(改编)设为阿伏加德罗常数的值。如图表示在表面与CO反应转化成无害气体的过程。下列说法正确的是(
)
A.由图可知存在反应:CO2
+
==
+
CO
B.转化成无害气体时的催化剂是
C.每1
mol转化为失去电子数为2
D.1
g
的含有质子数为1
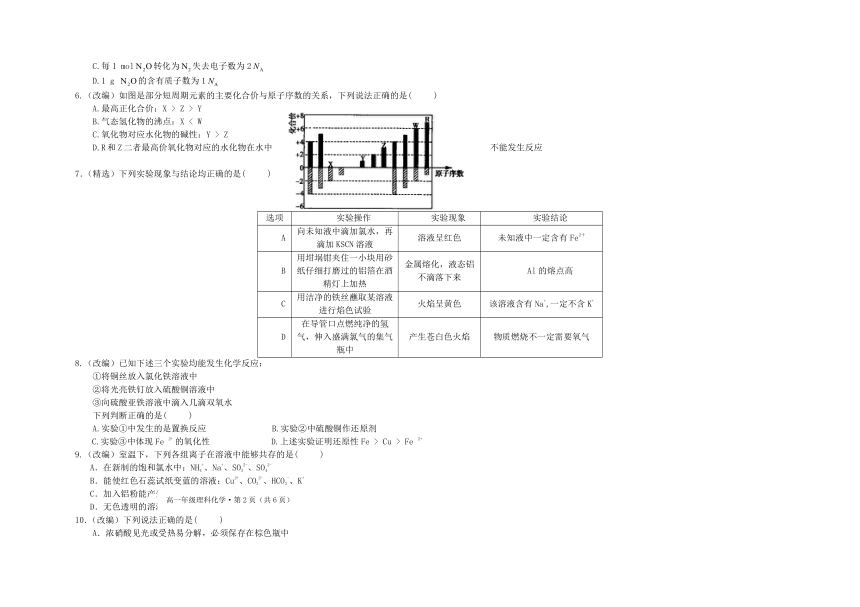
6.(改编)如图是部分短周期元素的主要化合价与原子序数的关系,下列说法正确的是(
)
A.最高正化合价:X
>
Z
>
Y
B.气态氢化物的沸点:X
<
W
C.氧化物对应水化物的碱性:Y
>
Z
D.R和Z二者最高价氧化物对应的水化物在水中
不能发生反应
7.(精选)下列实验现象与结论均正确的是(
)
选项
实验操作
实验现象
实验结论
A
向未知液中滴加氯水,再滴加KSCN溶液
溶液呈红色
未知液中一定含有Fe2+
B
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
金属熔化,液态铝不滴落下来
Al的熔点高
C
用洁净的铁丝蘸取某溶液进行焰色试验
火焰呈黄色
该溶液含有Na+,一定不含K+
D
在导管口点燃纯净的氢气,伸入盛满氯气的集气瓶中
产生苍白色火焰
物质燃烧不一定需要氧气
8.(改编)已知下述三个实验均能发生化学反应:
①将铜丝放入氯化铁溶液中
②将光亮铁钉放入硫酸铜溶液中
③向硫酸亚铁溶液中滴入几滴双氧水
下列判断正确的是(
)
A.实验①中发生的是置换反应
B.实验②中硫酸铜作还原剂
C.实验③中体现Fe
2+
的氧化性
D.上述实验证明还原性Fe
>
Cu
>
Fe
2+
9.(改编)室温下,下列各组离子在溶液中能够共存的是(
)
A.在新制的饱和氯水中:NH4+、Na+、SO32-、SO42-
B.能使红色石蕊试纸变蓝的溶液:Cu2+、CO32-、HCO3-、K+
C.加入铝粉能产生氢气的溶液中:Fe2+、Na+、NO3-、SO42-
D.无色透明的溶液中:Na+、CO32-、K+、Cl-
10.(改编)下列说法正确的是(
)
A.浓硝酸见光或受热易分解,必须保存在棕色瓶中
B.浓硝酸和铜反应有红棕色气体产生,只表现氧化性
C.浓硫酸具有吸水性,能使蔗糖碳化
D.常温下,浓硫酸与铁、铝不反应,所以铁制、铝制容器能盛放浓硫酸
11.(改编)在2L密闭容器中发生反应4A(s)+3B(g)2C(g)+D(g),经2min,B的物质的量减少0.6mol,下列对该反应速率表示正确的是(
)
A.在2?min末的反应速率:v(B)=0.3?mol?L-1?min-1
B.用A表示的反应速率为:v(A)=0.2?mol?L-1?min-1
C.在这两分钟内,用C表示的速率的值逐渐增大,B表示的速率的值逐渐减小
D.分别用B、C表示的反应速率其比值为3:2
12.(改编)下列关于能量的叙述错误是(
)
A.右图是NH4Cl和Ba(OH)2?8H2O的反应能量变化图
B.石墨转化为金刚石是吸热反应,则石墨比金刚石稳定
C.化学反应必然伴随能量的变化
D.原电池是一种将化学能转化为电能的装置
13.(改编)如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是(
)
选项
M
N
P
A
锌
铜
稀硫酸
B
铜
铁
浓硝酸
C
银
锌
硝酸银溶液
D
铝
铁
硝酸铁溶液
14.(改编)在一定条件下,在容积不变的密闭容器中,1molN2和3mol
H2发生反应N2(g)+3H2(g)
2NH3(g)。下列说法正确的是(
)
A.N2、
H2和NH3的物质的量比为1:3:2时,该反应达到平衡
B.该反应达到平衡时,vNH3(正)=2vN2(逆)
C.达到平衡时,混合气体密度不随时间变化
D.提高该反应的温度,可以实现H2的完全转化
15.(精选)有4种碳架如下的烃,下列说法正确的是(
)
①a和d是同分异构体 ②b和c是同系物 ③a和b都能发生加成反应 ④只有b和c能发生取代反应
A.①④
B.
②③
C.
①②
D.①②③
16.(精选)“绿色化学”提倡,设计制备物质的方案时,要从经济、技术、环保等方面考虑,以下由铜制取硝酸铜的四种方案中,可比较符合“绿色化学”的概念且可行的是(
)
A.Cu→Cu(NO3)2
B.Cu→CuO→Cu(NO3)2
C.Cu
→CuCl2→Cu(NO3)2
D.Cu
→CuSO4→Cu(NO3)2
第
II
卷
非选择题(共52分)
二、填空题(本题包括4小题,共52分。)
17、(改编)(16分)
I、SO2是重要的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。
(1)
向食品中添加适量的SO2可以起到防腐、漂白、抗氧化的作用,则葡萄酒中添加适量的SO2的作用是
。
(2)有学者提出利用Fe3+
、
Fe2+等离子的作用,在常温下将SO2氧化成SO42-而实现SO2的回收利用。写出Fe3+将SO2氧化成SO42-反应的离子方程式:
。
(3)
SO2有毒,且能形成酸雨,是大气主要污染物之一。某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。“二氧化硫吸收塔”中发生反应的化学方程式为
,该流程中可循环利用的物质为
(填化学式)。
II、为探索工业含铝、铁、铜合金废料的再利用,某同学实设计的回收利用方案如下:
(1)步骤1的实验操作是
,气体X的化学式是
。
(2)检验滤液D是否含有Fe3+的最佳试剂为
(填序号)
A、KMnO4
B、NaOH
C、KSCN
D、氯水
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:
、冷却结晶、 过滤、自然干燥,在这一系列操作中没有用到的仪器有
。
A.蒸发皿
B.烧杯
C.石棉网
D.玻璃棒
(4)
写出步骤1的主要化学反应方程式
。
(5)
写出反应①的离子方程式
。
(6)滤渣E转化为CuSO4溶液的过程中需加一种氧化剂,则试剂Y应该是
A、H2O2 B、C
C、H2 D、铁单质
18、(改编)(14分)下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系(部分反应条件已省略),其中A、B是单质,A的焰色试验为黄色,C、D是化合物,其他物质已经给出化学式,依据转化关系回答下列问题(出现A、B、C、D请用元素符号表示):
(1)元素A的原子结构示意图
,
元素B在周期表中的位置为
。
(2)
C物质的名称
_,D的电子式
_。
(3)离子半径A+
?02-(填“<”“>”或“=”),
①的基本反应类型
。
(4)
D气体与氨气在空气中相遇发生反应,产生的现象是
,所得产物NH4Cl的化学键类型是
。
(5)化合物C
可在呼吸面具中作为氧气的来源,用化学方程式描述其原因:
。
(6)A单质可以通过电解熔融ACl制取,化学反应方程式
,写出足量的D溶液与Na2CO3,溶液反应的离子方程式
。
19、(改编)
(10分)
I、某温度下,在2
L容器中三种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。
(1)该反应的化学方程式是_____________________
(2)在t1
min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是________。
A.
X、Y、Z的反应速率相等
B.X、Y的反应速率比为2∶3
C.
Z的物质的量不在变化
D.
生成3
mol
Y的同时生成1
mol
Z
(3)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1
mol氨气分解成氮气和氢气要吸收46
kJ的热量,则至t1
min时,该反应吸收的热量为________;用N2表示这段时间内该反应的平均速率V=
.(用含t1的式子表示)
II.如图所示,组成一个原电池。
(1)当电解质溶液为稀硫酸时,镁片的电极是 极(填“正”或“负”),其中铝片上电极反应式
,外电
路中的电子是
极流向
极。(填“铝片”或“镁片”)
(2)当电解质溶液为氢氧化钠溶液时,镁片电极是
极(填“正”或“负”),该反应是
(填“氧化”或“还原”)反应。
20、(改编)(12分)高分子化合物F的合成路线,已知A是石油化学工业的重要的基本原料,相对分子质量为28,在一定条件下能发生下图所示转化关系。
(1)A的结构简式是
。
(2)A→B的反应类型是
,E→F的反应类型是
。
(3)C中含有的官能团是
(填名称)。
(4)写出B→C的化学反应方程式:
。
(5)写出D+CH2=CHCH2OH→E的化学反应方程式:
。
(6)写出与CH2=CHCH2OH互为同分异构体,醛的结构简式
,酮的结构简式
。
高一理科化学
答案
1、
选择题(每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
B
C
D
D
题号
9
10
11
12
13
14
15
16
答案
D
A
D
A
C
B
C
B
2、
二、填空题(共4题,共52分)
17、I、(1)抗氧化
(2)
2Fe3+?+SO2
+2H20
?=
2Fe2+
+
SO42-?+4H+?
(3)SO2?+?(NH4)2SO3+2H20
=
2?NH4HSO3
?(NH4)2SO3
和NH4HSO3
II、(1)?过滤.
CO2
(2)?C
(3)蒸发浓缩.
C
(4)
2Al+
2NaOH+
2H2O?
=2NaA1O2
+
3H2↑
?(5)
Al(OH)3+3H+
=A13+
+
3H2O
?
?(6)
A
18、(1)
一
IA
(2)过氧化钠
(3)
<
化合反应
(4)
?冒白烟
离子键,共价键
(5)
2Na2O2
+
2CO2
=2Na2CO3?+?O2↑
(6)
2NaCl?(熔融)
=
2Na?+?Cl2↑
2H+?+CO32-
=
CO2↑?+H2O
19、I、(1)
2X(g)3Y(g)
+
Z(g)
(2)
C
(3)36.8
KJ
v=0.2/t1
mol/(L.min)
II.
(1)
负
2H+?+2e-
=
H2↑
镁片
铝片
(2)
正极
还原
20、
(1)
CH2=CH2
(2)
加成
加聚
(3)醛基
(4)略(5)略(6)CH3CH2CHO
CH3COCH3
高一年级理科化学·第1页(共6页)
高一年级理科化学·第2页(共6页)
高一年级理科化学·第3页(共6页)
步骤1
高一年级理科化学·第4页(共6页)
高一年级理科化学·第5页(共6页)
[
CH2-CH
]n
CH2OOCCH3
一定条件
A
B
C
D
催化剂
H2O
催化剂
催化剂
O2
O2
CH2=CHCH2OH
浓硫酸
△
E
高分子化合物F
理科化学试卷
试卷满分:100分
考试时间:90
分钟
可能用到的相对原子质量:
H-1
C-12
N-14
O
-16
Ne-20
Na-23
Si-28
K-39
Cl-
35.5
Fe-56
第
I
卷
选择题(共48分)
一、选择题(本题包括16小题,每小题3分,共48分,在每小题给出的四个选项中,只有一项是符合题目要求的。)
1.(精选)化学与生活、科技密切相关,下列说法正确的是(
)
A.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
B.2020年我国发射的嫦娥5号探月器的太阳能电池板的主要成分是
C.我国海洋开发走向“深蓝”,“蛟龙号”外壳材料使用的钛合金属于化合物
D氢氧化钠、氢氧化铝、碳酸钠都是常见的胃酸的中和剂
2.(精选)下列叙述中正确的是(
)
A.HClO是弱酸,所以
NaClO是弱电解质
B.35Cl与37Cl互为同位素,物理性质几乎相同,化学性质不同
C.
溶液、胶体与沉淀本质区别是有没有丁达尔效应
D.
用电子式表示CaCl2的形成过程:
3.(改编)设代表阿伏加德罗常数的值,下列说法正确的是(
)
A.
标准状况下,22.4L氖气与22.4L氢气所含原子数均为2
B.
28g铁与足量盐酸反应转移的电子数为
C.
标准状况下,22.4L
CCl4所含氯原子数均为4
D.
0.1个CO分子在标准状况下的体积约是4.48L
4.(精选)下列离子方程式的书写正确的是(
)
A.氢氧化镁和盐酸反应:
B.Ag与稀硫酸反应:
C.用小苏打治疗胃酸过多:
D.将Na
加入CuSO4溶液中:2Na
+
Cu2+
=
Cu
+
2Na+
5.(改编)设为阿伏加德罗常数的值。如图表示在表面与CO反应转化成无害气体的过程。下列说法正确的是(
)
A.由图可知存在反应:CO2
+
==
+
CO
B.转化成无害气体时的催化剂是
C.每1
mol转化为失去电子数为2
D.1
g
的含有质子数为1
6.(改编)如图是部分短周期元素的主要化合价与原子序数的关系,下列说法正确的是(
)
A.最高正化合价:X
>
Z
>
Y
B.气态氢化物的沸点:X
<
W
C.氧化物对应水化物的碱性:Y
>
Z
D.R和Z二者最高价氧化物对应的水化物在水中
不能发生反应
7.(精选)下列实验现象与结论均正确的是(
)
选项
实验操作
实验现象
实验结论
A
向未知液中滴加氯水,再滴加KSCN溶液
溶液呈红色
未知液中一定含有Fe2+
B
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
金属熔化,液态铝不滴落下来
Al的熔点高
C
用洁净的铁丝蘸取某溶液进行焰色试验
火焰呈黄色
该溶液含有Na+,一定不含K+
D
在导管口点燃纯净的氢气,伸入盛满氯气的集气瓶中
产生苍白色火焰
物质燃烧不一定需要氧气
8.(改编)已知下述三个实验均能发生化学反应:
①将铜丝放入氯化铁溶液中
②将光亮铁钉放入硫酸铜溶液中
③向硫酸亚铁溶液中滴入几滴双氧水
下列判断正确的是(
)
A.实验①中发生的是置换反应
B.实验②中硫酸铜作还原剂
C.实验③中体现Fe
2+
的氧化性
D.上述实验证明还原性Fe
>
Cu
>
Fe
2+
9.(改编)室温下,下列各组离子在溶液中能够共存的是(
)
A.在新制的饱和氯水中:NH4+、Na+、SO32-、SO42-
B.能使红色石蕊试纸变蓝的溶液:Cu2+、CO32-、HCO3-、K+
C.加入铝粉能产生氢气的溶液中:Fe2+、Na+、NO3-、SO42-
D.无色透明的溶液中:Na+、CO32-、K+、Cl-
10.(改编)下列说法正确的是(
)
A.浓硝酸见光或受热易分解,必须保存在棕色瓶中
B.浓硝酸和铜反应有红棕色气体产生,只表现氧化性
C.浓硫酸具有吸水性,能使蔗糖碳化
D.常温下,浓硫酸与铁、铝不反应,所以铁制、铝制容器能盛放浓硫酸
11.(改编)在2L密闭容器中发生反应4A(s)+3B(g)2C(g)+D(g),经2min,B的物质的量减少0.6mol,下列对该反应速率表示正确的是(
)
A.在2?min末的反应速率:v(B)=0.3?mol?L-1?min-1
B.用A表示的反应速率为:v(A)=0.2?mol?L-1?min-1
C.在这两分钟内,用C表示的速率的值逐渐增大,B表示的速率的值逐渐减小
D.分别用B、C表示的反应速率其比值为3:2
12.(改编)下列关于能量的叙述错误是(
)
A.右图是NH4Cl和Ba(OH)2?8H2O的反应能量变化图
B.石墨转化为金刚石是吸热反应,则石墨比金刚石稳定
C.化学反应必然伴随能量的变化
D.原电池是一种将化学能转化为电能的装置
13.(改编)如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是(
)
选项
M
N
P
A
锌
铜
稀硫酸
B
铜
铁
浓硝酸
C
银
锌
硝酸银溶液
D
铝
铁
硝酸铁溶液
14.(改编)在一定条件下,在容积不变的密闭容器中,1molN2和3mol
H2发生反应N2(g)+3H2(g)
2NH3(g)。下列说法正确的是(
)
A.N2、
H2和NH3的物质的量比为1:3:2时,该反应达到平衡
B.该反应达到平衡时,vNH3(正)=2vN2(逆)
C.达到平衡时,混合气体密度不随时间变化
D.提高该反应的温度,可以实现H2的完全转化
15.(精选)有4种碳架如下的烃,下列说法正确的是(
)
①a和d是同分异构体 ②b和c是同系物 ③a和b都能发生加成反应 ④只有b和c能发生取代反应
A.①④
B.
②③
C.
①②
D.①②③
16.(精选)“绿色化学”提倡,设计制备物质的方案时,要从经济、技术、环保等方面考虑,以下由铜制取硝酸铜的四种方案中,可比较符合“绿色化学”的概念且可行的是(
)
A.Cu→Cu(NO3)2
B.Cu→CuO→Cu(NO3)2
C.Cu
→CuCl2→Cu(NO3)2
D.Cu
→CuSO4→Cu(NO3)2
第
II
卷
非选择题(共52分)
二、填空题(本题包括4小题,共52分。)
17、(改编)(16分)
I、SO2是重要的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。
(1)
向食品中添加适量的SO2可以起到防腐、漂白、抗氧化的作用,则葡萄酒中添加适量的SO2的作用是
。
(2)有学者提出利用Fe3+
、
Fe2+等离子的作用,在常温下将SO2氧化成SO42-而实现SO2的回收利用。写出Fe3+将SO2氧化成SO42-反应的离子方程式:
。
(3)
SO2有毒,且能形成酸雨,是大气主要污染物之一。某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。“二氧化硫吸收塔”中发生反应的化学方程式为
,该流程中可循环利用的物质为
(填化学式)。
II、为探索工业含铝、铁、铜合金废料的再利用,某同学实设计的回收利用方案如下:
(1)步骤1的实验操作是
,气体X的化学式是
。
(2)检验滤液D是否含有Fe3+的最佳试剂为
(填序号)
A、KMnO4
B、NaOH
C、KSCN
D、氯水
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:
、冷却结晶、 过滤、自然干燥,在这一系列操作中没有用到的仪器有
。
A.蒸发皿
B.烧杯
C.石棉网
D.玻璃棒
(4)
写出步骤1的主要化学反应方程式
。
(5)
写出反应①的离子方程式
。
(6)滤渣E转化为CuSO4溶液的过程中需加一种氧化剂,则试剂Y应该是
A、H2O2 B、C
C、H2 D、铁单质
18、(改编)(14分)下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系(部分反应条件已省略),其中A、B是单质,A的焰色试验为黄色,C、D是化合物,其他物质已经给出化学式,依据转化关系回答下列问题(出现A、B、C、D请用元素符号表示):
(1)元素A的原子结构示意图
,
元素B在周期表中的位置为
。
(2)
C物质的名称
_,D的电子式
_。
(3)离子半径A+
?02-(填“<”“>”或“=”),
①的基本反应类型
。
(4)
D气体与氨气在空气中相遇发生反应,产生的现象是
,所得产物NH4Cl的化学键类型是
。
(5)化合物C
可在呼吸面具中作为氧气的来源,用化学方程式描述其原因:
。
(6)A单质可以通过电解熔融ACl制取,化学反应方程式
,写出足量的D溶液与Na2CO3,溶液反应的离子方程式
。
19、(改编)
(10分)
I、某温度下,在2
L容器中三种气态物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。
(1)该反应的化学方程式是_____________________
(2)在t1
min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是________。
A.
X、Y、Z的反应速率相等
B.X、Y的反应速率比为2∶3
C.
Z的物质的量不在变化
D.
生成3
mol
Y的同时生成1
mol
Z
(3)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1
mol氨气分解成氮气和氢气要吸收46
kJ的热量,则至t1
min时,该反应吸收的热量为________;用N2表示这段时间内该反应的平均速率V=
.(用含t1的式子表示)
II.如图所示,组成一个原电池。
(1)当电解质溶液为稀硫酸时,镁片的电极是 极(填“正”或“负”),其中铝片上电极反应式
,外电
路中的电子是
极流向
极。(填“铝片”或“镁片”)
(2)当电解质溶液为氢氧化钠溶液时,镁片电极是
极(填“正”或“负”),该反应是
(填“氧化”或“还原”)反应。
20、(改编)(12分)高分子化合物F的合成路线,已知A是石油化学工业的重要的基本原料,相对分子质量为28,在一定条件下能发生下图所示转化关系。
(1)A的结构简式是
。
(2)A→B的反应类型是
,E→F的反应类型是
。
(3)C中含有的官能团是
(填名称)。
(4)写出B→C的化学反应方程式:
。
(5)写出D+CH2=CHCH2OH→E的化学反应方程式:
。
(6)写出与CH2=CHCH2OH互为同分异构体,醛的结构简式
,酮的结构简式
。
高一理科化学
答案
1、
选择题(每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
B
C
D
D
题号
9
10
11
12
13
14
15
16
答案
D
A
D
A
C
B
C
B
2、
二、填空题(共4题,共52分)
17、I、(1)抗氧化
(2)
2Fe3+?+SO2
+2H20
?=
2Fe2+
+
SO42-?+4H+?
(3)SO2?+?(NH4)2SO3+2H20
=
2?NH4HSO3
?(NH4)2SO3
和NH4HSO3
II、(1)?过滤.
CO2
(2)?C
(3)蒸发浓缩.
C
(4)
2Al+
2NaOH+
2H2O?
=2NaA1O2
+
3H2↑
?(5)
Al(OH)3+3H+
=A13+
+
3H2O
?
?(6)
A
18、(1)
一
IA
(2)过氧化钠
(3)
<
化合反应
(4)
?冒白烟
离子键,共价键
(5)
2Na2O2
+
2CO2
=2Na2CO3?+?O2↑
(6)
2NaCl?(熔融)
=
2Na?+?Cl2↑
2H+?+CO32-
=
CO2↑?+H2O
19、I、(1)
2X(g)3Y(g)
+
Z(g)
(2)
C
(3)36.8
KJ
v=0.2/t1
mol/(L.min)
II.
(1)
负
2H+?+2e-
=
H2↑
镁片
铝片
(2)
正极
还原
20、
(1)
CH2=CH2
(2)
加成
加聚
(3)醛基
(4)略(5)略(6)CH3CH2CHO
CH3COCH3
高一年级理科化学·第1页(共6页)
高一年级理科化学·第2页(共6页)
高一年级理科化学·第3页(共6页)
步骤1
高一年级理科化学·第4页(共6页)
高一年级理科化学·第5页(共6页)
[
CH2-CH
]n
CH2OOCCH3
一定条件
A
B
C
D
催化剂
H2O
催化剂
催化剂
O2
O2
CH2=CHCH2OH
浓硫酸
△
E
高分子化合物F
同课章节目录
