莫昌嘉著《化学的捷径》第一章 组成与结构规律 第二节 分子类规律(三)
文档属性
| 名称 | 莫昌嘉著《化学的捷径》第一章 组成与结构规律 第二节 分子类规律(三) |

|
|
| 格式 | |||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-01 00:00:00 | ||
图片预览




文档简介
形成配位键;磷与氢也容易形成共价键,因此亚磷酸的结构式
读书笔
疋
演变而来
样的结
保证磷原
有3个共价键
为中心原子
原子为氧原
结合的氧原子的负化合价的绝对值为6,大于N的负化合价
值3,所以
围必有3个共价键,其结构式为
略
(四)水化物的结构规律
现只讨论共价型水化物的结杉
观察MCJ表不难发现
(1)在MCJ表中第一周期共价型的水化物(即最高f
共价水化物)都是以中心原子为中心的四面体
当中心原子所连结的基团或原子相同时,就必为正四面体
结构。当中心原子周
成键电子对时,其结构为
四面体或四面体结构
形结构。如
O
莫昌嘉
学·—原《化
读书笔记
溶液中跟水
形结构
变成正四面体结构
(2)在MCJ表中第二周期共价型水化物(含氧酸
各族元素的第
价水化物
角锥形结构,当
原子直接连接的原子或原子团相同时,则为正三角锥
形结构。当中心原子周围只有3对成键电子对时,其结构
为正三角锥形或三角锥形结构,即三形结构。如
(三角锥形)
第三周期共价型水化物(含氧酸)
共价水化物都为∨形或∧形结构。当中心原子周围只有2对
成键电子对时
构为V形结构
形结构
第四周期共价型水化物(含氧酸
第4高价的共价水化物都为直线型结构。当中心原子周
对成键电子对
构为直线形结构
结
0
第一章组成与结构
物的结构数与其
周围的成键电子对数相等
读书笔
分子式的含氧酸(如
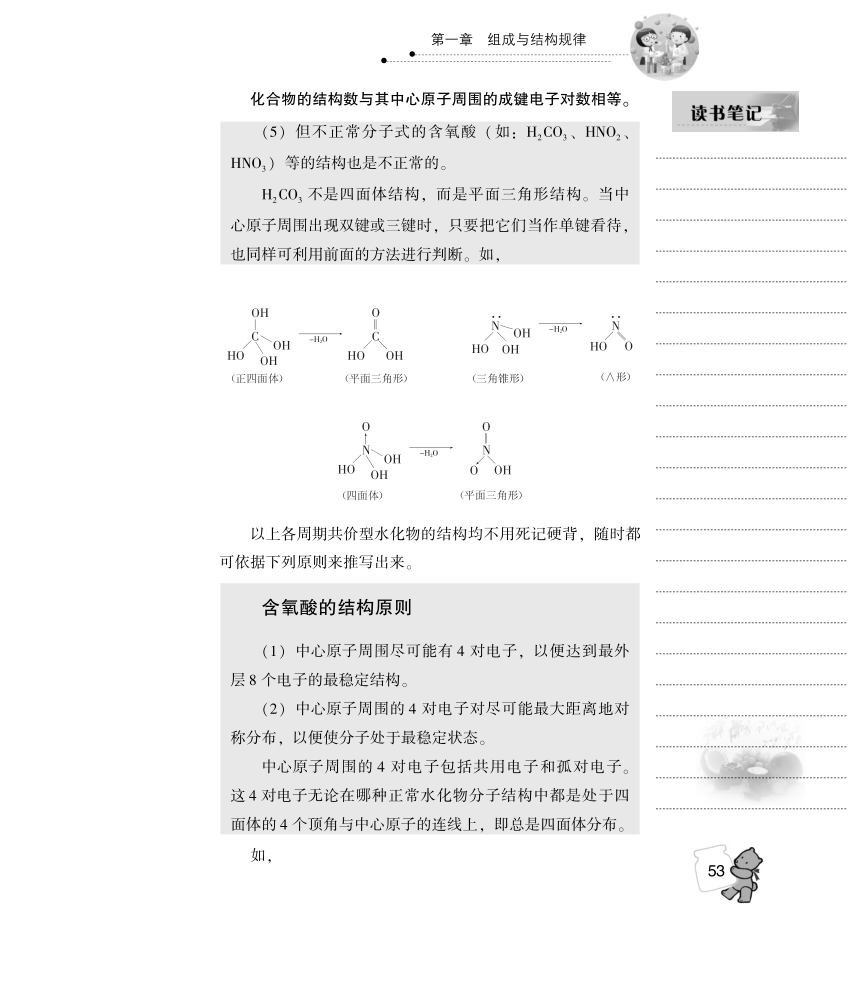
O3)等的结构也是不正常的
CO3不是四面体结构,而是平面三角形结构。当
原子
现双键或三键
把它们当作单键看待
也同样可利用前面的方法进行判断。如
角锥形
以上各周期共价型水化物的结构均不用死记硬
氧酸的结构原
原子周围
有4对
便达到最外
层
最稳定
原子周围的4对电子对尽可能最大距离地对
称分
便使分子处于最稳定状态
原子周围的4
共用电子和孤对电
这4对电子无论在哪种正常水化物分子结构中都是处于四
的4个顶角
原子的连线上,即总是四面体分布
莫昌嘉
《化
读书笔记
在上述4个分子结构中,虽然中心原子周围的四对电子都
是4面体的分布。但是分子结构却不都是四面体。只有4对电
全部是成键电子时才可能是四面体分子结构。凡有孤对
存在时都不可能是四面体分子结构,分子结构只决定于成键
对的分布,与孤对
分布无关(严格地说也有关,因为
孤对电子的分布也影响着成键电子对的分布
为HCO
原子周围有4对成键
听以HCIO4分子呈四面体结构
且由于Cl原子周围的4个化学键(共价键)不完全相同,所
以这4个共价键(或成键电子对)不可能正四面体对称分布
CO3分子中C原子周围有3对成键电子和1对孤对
子,所以HCO3分子呈三角锥形结构
ClO,分子
周围有2对成键电子和2对孤
所
2分子
形结构
原子周
对成键电子(和3
所
构。所以,当中心原子周围
的成键电子对总数分别为
原子的化合价分
为最高、第2高、第3高、第4高价时,其结构也分别为
述的四(四面体)
角锥形)
直线
形)
遇到不正常的水化物
只要把双键看作单键(因
都处在同一方
然后使电子对尽可能最大距
称分布即可作出正确的判断。如
读书笔
疋
演变而来
样的结
保证磷原
有3个共价键
为中心原子
原子为氧原
结合的氧原子的负化合价的绝对值为6,大于N的负化合价
值3,所以
围必有3个共价键,其结构式为
略
(四)水化物的结构规律
现只讨论共价型水化物的结杉
观察MCJ表不难发现
(1)在MCJ表中第一周期共价型的水化物(即最高f
共价水化物)都是以中心原子为中心的四面体
当中心原子所连结的基团或原子相同时,就必为正四面体
结构。当中心原子周
成键电子对时,其结构为
四面体或四面体结构
形结构。如
O
莫昌嘉
学·—原《化
读书笔记
溶液中跟水
形结构
变成正四面体结构
(2)在MCJ表中第二周期共价型水化物(含氧酸
各族元素的第
价水化物
角锥形结构,当
原子直接连接的原子或原子团相同时,则为正三角锥
形结构。当中心原子周围只有3对成键电子对时,其结构
为正三角锥形或三角锥形结构,即三形结构。如
(三角锥形)
第三周期共价型水化物(含氧酸)
共价水化物都为∨形或∧形结构。当中心原子周围只有2对
成键电子对时
构为V形结构
形结构
第四周期共价型水化物(含氧酸
第4高价的共价水化物都为直线型结构。当中心原子周
对成键电子对
构为直线形结构
结
0
第一章组成与结构
物的结构数与其
周围的成键电子对数相等
读书笔
分子式的含氧酸(如
O3)等的结构也是不正常的
CO3不是四面体结构,而是平面三角形结构。当
原子
现双键或三键
把它们当作单键看待
也同样可利用前面的方法进行判断。如
角锥形
以上各周期共价型水化物的结构均不用死记硬
氧酸的结构原
原子周围
有4对
便达到最外
层
最稳定
原子周围的4对电子对尽可能最大距离地对
称分
便使分子处于最稳定状态
原子周围的4
共用电子和孤对电
这4对电子无论在哪种正常水化物分子结构中都是处于四
的4个顶角
原子的连线上,即总是四面体分布
莫昌嘉
《化
读书笔记
在上述4个分子结构中,虽然中心原子周围的四对电子都
是4面体的分布。但是分子结构却不都是四面体。只有4对电
全部是成键电子时才可能是四面体分子结构。凡有孤对
存在时都不可能是四面体分子结构,分子结构只决定于成键
对的分布,与孤对
分布无关(严格地说也有关,因为
孤对电子的分布也影响着成键电子对的分布
为HCO
原子周围有4对成键
听以HCIO4分子呈四面体结构
且由于Cl原子周围的4个化学键(共价键)不完全相同,所
以这4个共价键(或成键电子对)不可能正四面体对称分布
CO3分子中C原子周围有3对成键电子和1对孤对
子,所以HCO3分子呈三角锥形结构
ClO,分子
周围有2对成键电子和2对孤
所
2分子
形结构
原子周
对成键电子(和3
所
构。所以,当中心原子周围
的成键电子对总数分别为
原子的化合价分
为最高、第2高、第3高、第4高价时,其结构也分别为
述的四(四面体)
角锥形)
直线
形)
遇到不正常的水化物
只要把双键看作单键(因
都处在同一方
然后使电子对尽可能最大距
称分布即可作出正确的判断。如
同课章节目录
