高中化学人教版(2019)选择性必修第一册1.2 反应热的计算 课件 (22张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修第一册1.2 反应热的计算 课件 (22张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 755.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-02 00:00:00 | ||
图片预览






文档简介
(共22张PPT)
高中化学
反应热的计算
1.盖斯定律的定义:
一个化学反应,不管是一步完成还是分几步完成的,其反应热是相同的。这就是盖斯定律。即:在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
盖斯定律
盖斯定律
2.盖斯定律的理解
盖斯定律
盖斯定律
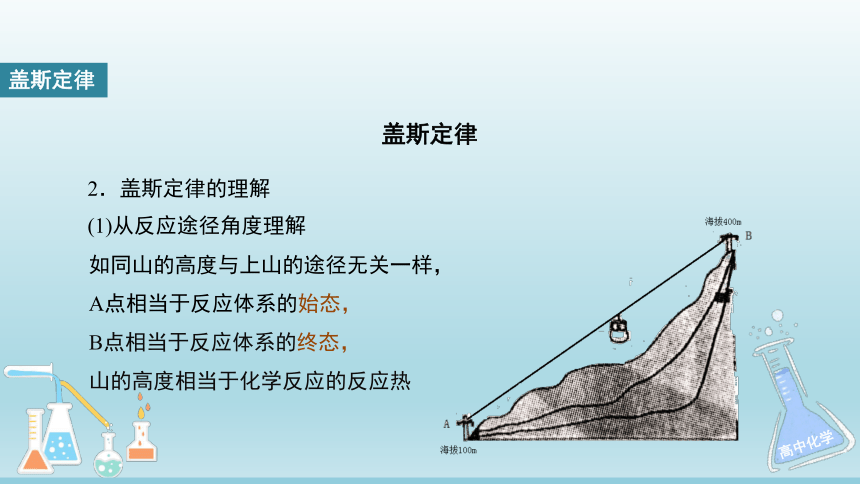
(1)从反应途径角度理解
如同山的高度与上山的途径无关一样,
A点相当于反应体系的始态,
B点相当于反应体系的终态,
山的高度相当于化学反应的反应热
2.盖斯定律的理解
盖斯定律
盖斯定律
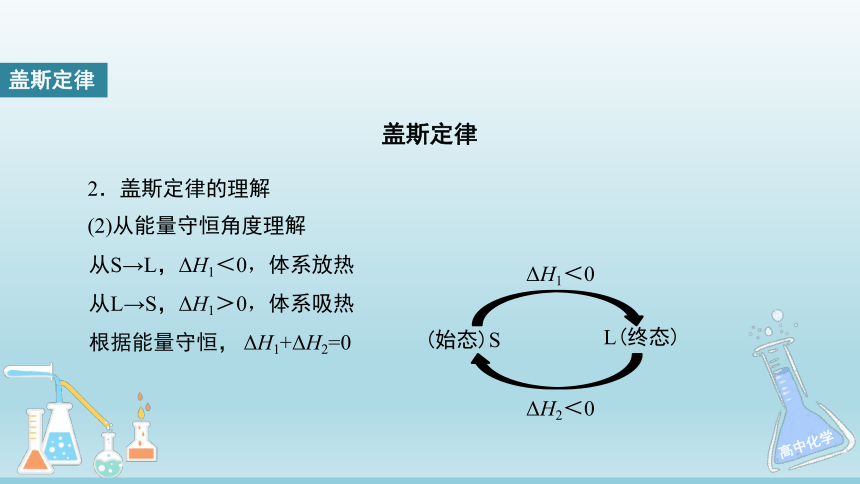
(2)从能量守恒角度理解
ΔH1<0
ΔH2<0
(始态)S
L(终态)
从S→L,ΔH1<0,体系放热
从L→S,ΔH1>0,体系吸热
根据能量守恒,
ΔH1+ΔH2=0
2.盖斯定律的理解
盖斯定律
盖斯定律
(3)盖斯定律深入理解
①反应热效应只与始态、终态有关,与过程无关。
②反应热总值一定。如图表示始态到终态的反应热。
则ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5
3.盖斯定律的意义
盖斯定律
盖斯定律
在众多的化学反应中,有些反应进行得很慢,有些反应不容易直接发生,有些反应的生成物不纯(往往有副反应发生),这给直接测定反应热造成了困难。利用盖斯定律,可以间接地将它们的反应热计算出来
1.反应热计算的依据和方法
应用热的计算
应用热的计算
计算依据
计算方法
热化学方程式
盖斯定律
燃烧热
化学键的变化
反应物和生成物的总能量
热化学方程式可以左右颠倒同时改变ΔH的正负号,各物质的化学计量数及ΔH数值的绝对值可以同时扩大或缩小相同的倍数
根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式
可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热
ΔH=反应物的化学键断裂所吸收的能量之和?生成物的化学键形成所放出的能量之和
ΔH=E生成物?E反应物
1.反应热计算的依据和方法
应用热的计算
应用热的计算
计算依据
计算方法
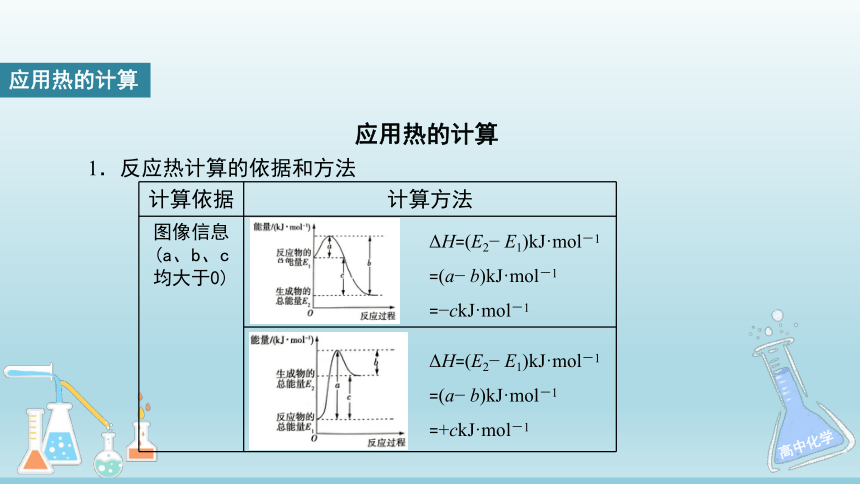
图像信息
(a、b、c均大于0)
ΔH=(E2?
E1)kJ·mol-1
=(a?
b)kJ·mol-1
=?ckJ·mol-1
ΔH=(E2?
E1)kJ·mol-1
=(a?
b)kJ·mol-1
=+ckJ·mol-1
2.反应热计算的注意事项
应用热的计算
应用热的计算
反应热
化学计量数
完全反应
正负号
反应热的数值与热化学方程式中各物质前的化学计量数成正比,因此,热化学方程式中各物质前的化学计量数改变时,其反应热数值需同时进行相同倍数的改变
热化学方程式中的反应热是指反应按所给形式完全进行时的反应热
正、逆反应的反应热数值相等,符号相反
1.虚拟途径法
应用盖斯定律计算反应热的常用方法
应用盖斯定律计算反应热的常用方法
由A生成D可以有两个途径:
(1)由A直接生成D,反应热为ΔH;
(2)由A生成B,由B生成C,再由C生成D,每一步的反应热分别为ΔH1、
ΔH2、
ΔH3,则反应热的关系如下
A
B
C
D
ΔH1
ΔH2
ΔH3
ΔH=ΔH1+ΔH2+ΔH3
2.加和法
应用盖斯定律计算反应热的常用方法
应用盖斯定律计算反应热的常用方法
①根据待求解的热化学方程式调整可用的已知热化学方程式的方向,同时调整ΔH的符号
②根据待求解的热化学方程式调整可用的已知热化学方程式的方向,同时调整ΔH的符号
找出
调整
加和
求焓
根据待求的热化学方程式和生成物找出可用的已知热化学方程式
将调整好的热化学方程式进行加和以得到待求解的热化学方程式
ΔH随热化学方程式的调整而进行相应的加、减、乘、除运算
2.加和法
应用盖斯定律计算反应热的常用方法
应用盖斯定律计算反应热的常用方法
ΔH1=?393.5
kJ·mol-1
对于反应
的反应热无法直接测得,则可根据加和法由下面两个反应的反应热计算出来:
C(s)+
O2(g)
CO(g)
1
2
①C(s)+
O2(g)
CO2(g)
②CO(s)+
O2(g)
CO2(g)
1
2
ΔH2=?283.0
kJ·mol-1
C(s)+
O2(g)
CO(g)
1
2
则①?②得
ΔH3=?110.5
kJ·mol-1
2.加和法
应用盖斯定律计算反应热的常用方法
应用盖斯定律计算反应热的常用方法
ΔH1=?393.5
kJ·mol-1
①C(s)+
O2(g)
CO2(g)
②CO(s)+
O2(g)
CO2(g)
1
2
ΔH2=?283.0
kJ·mol-1
C(s)+
O2(g)
CO(g)
1
2
则①?②得
ΔH3=?110.5
kJ·mol-1
该过程虚拟为下图所以:
C(s)+
O2(g)
CO2(g)
CO(s)+
O2(g)
1
2
ΔH3
ΔH1
ΔH2
2.加和法
应用盖斯定律计算反应热的常用方法
应用盖斯定律计算反应热的常用方法
该过程虚拟为下图所以:
C(s)+
O2(g)
CO2(g)
CO(s)+
O2(g)
1
2
ΔH3
ΔH1
ΔH2
则根据盖斯定律:
ΔH1=ΔH2+ΔH3
即
ΔH3=ΔH1?ΔH2=
?393.5
kJ·mol-1?(?283.0
kJ·mol-1
)=
?110.5
kJ·mol-1
C(s)+
O2(g)
CO(g)
1
2
所以
ΔH3=?110.5
kJ·mol-1
应用盖斯定律计算反应热的注意事项
应用盖斯定律计算反应热的注意事项
1
2
3
4
热化学方程式乘以某数(整数或分数)时,反应热数值也必须同时乘以该数。
热化学方程式相加减时,同种物质(相同状态)之间可相加减。
将一个热化学方程式逆向书写时,ΔH的符号必须随之改变,但其绝对值不变。
在设计反应过程中,可能会遇到同一物质三态(固、液、气)间的相互转化,状态由固→液→气变化时,会吸热;反之,会放热。
1、已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8
kJ·mol-1、-1411.0
kJ·mol-1和-1366.8
kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为
(
)
A.-44.2
kJ·mol-1
B.+44.2
kJ·mol-1
C.-330
kJ·mol-1
D.+330
kJ·mol-1
A
随堂检测
2、已知:C(s)+
O2(g)===CO(g) ΔH=-110.5
kJ·mol-1①
C(s)+O2(g)===CO2(g) ΔH=-393.51
kJ·mol-1②
计算反应C(s)+CO2(g)===2CO(g)的反应热ΔH的值为(
)
A.-283.01
kJ·mol-1
B.+172.51
kJ·mol-1
C.+283.1
kJ·mol-1
D.+504.00
kJ·mol-1
随堂检测
B
3、已知下列三个热化学方程式:
①H2(g)+O2(g)===H2O(g)
ΔH=-241.8
kJ·mol-1
②C(s)+O2(g)===CO2(g)
ΔH=-393.5
kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131
kJ·mol-1
写出碳燃烧生成CO和CO燃烧的热化学方程式。
随堂检测
4、已知在25
℃、101
kPa下,1
g
C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40
kJ热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+O2(g)===8CO2(g)+9H2O(g)
ΔH=-48.40
kJ·mol-1
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-5
517.6
kJ·mol-1
C.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=+5
517.6
kJ·mol-1
D.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-48.40
kJ·mol-1
随堂检测
B
5、白磷与氧可发生如下反应:2P4+5O2===2P4O5。已知断裂下列化学键需要吸收的能量分别为:P-P:a
kJ·mol-1、P-O:b
kJ·mol-1、P=O:c
kJ·mol-1、O=O:d
kJ·mol-1。根据图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b)
kJ·mol-1
B.(4c+12b-6a-5d)
kJ·mol-1
C.(4c+12b-4a-5d)
kJ·mol-1
D.(4a+5d-4c-12b)
kJ·mol-1
随堂检测
A
知识小结
盖斯定律
A
反应热的计算
B
应用盖斯定律计算反应热的常用方法
C
高中化学
再见
高中化学
反应热的计算
1.盖斯定律的定义:
一个化学反应,不管是一步完成还是分几步完成的,其反应热是相同的。这就是盖斯定律。即:在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
盖斯定律
盖斯定律
2.盖斯定律的理解
盖斯定律
盖斯定律
(1)从反应途径角度理解
如同山的高度与上山的途径无关一样,
A点相当于反应体系的始态,
B点相当于反应体系的终态,
山的高度相当于化学反应的反应热
2.盖斯定律的理解
盖斯定律
盖斯定律
(2)从能量守恒角度理解
ΔH1<0
ΔH2<0
(始态)S
L(终态)
从S→L,ΔH1<0,体系放热
从L→S,ΔH1>0,体系吸热
根据能量守恒,
ΔH1+ΔH2=0
2.盖斯定律的理解
盖斯定律
盖斯定律
(3)盖斯定律深入理解
①反应热效应只与始态、终态有关,与过程无关。
②反应热总值一定。如图表示始态到终态的反应热。
则ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5
3.盖斯定律的意义
盖斯定律
盖斯定律
在众多的化学反应中,有些反应进行得很慢,有些反应不容易直接发生,有些反应的生成物不纯(往往有副反应发生),这给直接测定反应热造成了困难。利用盖斯定律,可以间接地将它们的反应热计算出来
1.反应热计算的依据和方法
应用热的计算
应用热的计算
计算依据
计算方法
热化学方程式
盖斯定律
燃烧热
化学键的变化
反应物和生成物的总能量
热化学方程式可以左右颠倒同时改变ΔH的正负号,各物质的化学计量数及ΔH数值的绝对值可以同时扩大或缩小相同的倍数
根据盖斯定律,可以将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式
可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热
ΔH=反应物的化学键断裂所吸收的能量之和?生成物的化学键形成所放出的能量之和
ΔH=E生成物?E反应物
1.反应热计算的依据和方法
应用热的计算
应用热的计算
计算依据
计算方法
图像信息
(a、b、c均大于0)
ΔH=(E2?
E1)kJ·mol-1
=(a?
b)kJ·mol-1
=?ckJ·mol-1
ΔH=(E2?
E1)kJ·mol-1
=(a?
b)kJ·mol-1
=+ckJ·mol-1
2.反应热计算的注意事项
应用热的计算
应用热的计算
反应热
化学计量数
完全反应
正负号
反应热的数值与热化学方程式中各物质前的化学计量数成正比,因此,热化学方程式中各物质前的化学计量数改变时,其反应热数值需同时进行相同倍数的改变
热化学方程式中的反应热是指反应按所给形式完全进行时的反应热
正、逆反应的反应热数值相等,符号相反
1.虚拟途径法
应用盖斯定律计算反应热的常用方法
应用盖斯定律计算反应热的常用方法
由A生成D可以有两个途径:
(1)由A直接生成D,反应热为ΔH;
(2)由A生成B,由B生成C,再由C生成D,每一步的反应热分别为ΔH1、
ΔH2、
ΔH3,则反应热的关系如下
A
B
C
D
ΔH1
ΔH2
ΔH3
ΔH=ΔH1+ΔH2+ΔH3
2.加和法
应用盖斯定律计算反应热的常用方法
应用盖斯定律计算反应热的常用方法
①根据待求解的热化学方程式调整可用的已知热化学方程式的方向,同时调整ΔH的符号
②根据待求解的热化学方程式调整可用的已知热化学方程式的方向,同时调整ΔH的符号
找出
调整
加和
求焓
根据待求的热化学方程式和生成物找出可用的已知热化学方程式
将调整好的热化学方程式进行加和以得到待求解的热化学方程式
ΔH随热化学方程式的调整而进行相应的加、减、乘、除运算
2.加和法
应用盖斯定律计算反应热的常用方法
应用盖斯定律计算反应热的常用方法
ΔH1=?393.5
kJ·mol-1
对于反应
的反应热无法直接测得,则可根据加和法由下面两个反应的反应热计算出来:
C(s)+
O2(g)
CO(g)
1
2
①C(s)+
O2(g)
CO2(g)
②CO(s)+
O2(g)
CO2(g)
1
2
ΔH2=?283.0
kJ·mol-1
C(s)+
O2(g)
CO(g)
1
2
则①?②得
ΔH3=?110.5
kJ·mol-1
2.加和法
应用盖斯定律计算反应热的常用方法
应用盖斯定律计算反应热的常用方法
ΔH1=?393.5
kJ·mol-1
①C(s)+
O2(g)
CO2(g)
②CO(s)+
O2(g)
CO2(g)
1
2
ΔH2=?283.0
kJ·mol-1
C(s)+
O2(g)
CO(g)
1
2
则①?②得
ΔH3=?110.5
kJ·mol-1
该过程虚拟为下图所以:
C(s)+
O2(g)
CO2(g)
CO(s)+
O2(g)
1
2
ΔH3
ΔH1
ΔH2
2.加和法
应用盖斯定律计算反应热的常用方法
应用盖斯定律计算反应热的常用方法
该过程虚拟为下图所以:
C(s)+
O2(g)
CO2(g)
CO(s)+
O2(g)
1
2
ΔH3
ΔH1
ΔH2
则根据盖斯定律:
ΔH1=ΔH2+ΔH3
即
ΔH3=ΔH1?ΔH2=
?393.5
kJ·mol-1?(?283.0
kJ·mol-1
)=
?110.5
kJ·mol-1
C(s)+
O2(g)
CO(g)
1
2
所以
ΔH3=?110.5
kJ·mol-1
应用盖斯定律计算反应热的注意事项
应用盖斯定律计算反应热的注意事项
1
2
3
4
热化学方程式乘以某数(整数或分数)时,反应热数值也必须同时乘以该数。
热化学方程式相加减时,同种物质(相同状态)之间可相加减。
将一个热化学方程式逆向书写时,ΔH的符号必须随之改变,但其绝对值不变。
在设计反应过程中,可能会遇到同一物质三态(固、液、气)间的相互转化,状态由固→液→气变化时,会吸热;反之,会放热。
1、已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8
kJ·mol-1、-1411.0
kJ·mol-1和-1366.8
kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为
(
)
A.-44.2
kJ·mol-1
B.+44.2
kJ·mol-1
C.-330
kJ·mol-1
D.+330
kJ·mol-1
A
随堂检测
2、已知:C(s)+
O2(g)===CO(g) ΔH=-110.5
kJ·mol-1①
C(s)+O2(g)===CO2(g) ΔH=-393.51
kJ·mol-1②
计算反应C(s)+CO2(g)===2CO(g)的反应热ΔH的值为(
)
A.-283.01
kJ·mol-1
B.+172.51
kJ·mol-1
C.+283.1
kJ·mol-1
D.+504.00
kJ·mol-1
随堂检测
B
3、已知下列三个热化学方程式:
①H2(g)+O2(g)===H2O(g)
ΔH=-241.8
kJ·mol-1
②C(s)+O2(g)===CO2(g)
ΔH=-393.5
kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g)
ΔH=+131
kJ·mol-1
写出碳燃烧生成CO和CO燃烧的热化学方程式。
随堂检测
4、已知在25
℃、101
kPa下,1
g
C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40
kJ热量。表示上述反应的热化学方程式正确的是( )
A.C8H18(l)+O2(g)===8CO2(g)+9H2O(g)
ΔH=-48.40
kJ·mol-1
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-5
517.6
kJ·mol-1
C.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=+5
517.6
kJ·mol-1
D.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-48.40
kJ·mol-1
随堂检测
B
5、白磷与氧可发生如下反应:2P4+5O2===2P4O5。已知断裂下列化学键需要吸收的能量分别为:P-P:a
kJ·mol-1、P-O:b
kJ·mol-1、P=O:c
kJ·mol-1、O=O:d
kJ·mol-1。根据图所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
A.(6a+5d-4c-12b)
kJ·mol-1
B.(4c+12b-6a-5d)
kJ·mol-1
C.(4c+12b-4a-5d)
kJ·mol-1
D.(4a+5d-4c-12b)
kJ·mol-1
随堂检测
A
知识小结
盖斯定律
A
反应热的计算
B
应用盖斯定律计算反应热的常用方法
C
高中化学
再见
