3.1.2《晶胞及晶胞中微粒个数的确定》PPT课件(新人教版-选修3)
文档属性
| 名称 | 3.1.2《晶胞及晶胞中微粒个数的确定》PPT课件(新人教版-选修3) |  | |
| 格式 | zip | ||
| 文件大小 | 363.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-18 14:37:38 | ||
图片预览







文档简介
(共44张PPT)
新课标人教版课件系列
《高中化学》
选修3
3.1《晶体的常识》
第二课时
3.1.2《晶胞及晶胞中
微粒个数的确定》
二、晶胞
二、晶胞
定义:晶体中重复出现的最基本的结构单元
体心立方
简单立方
面心立方
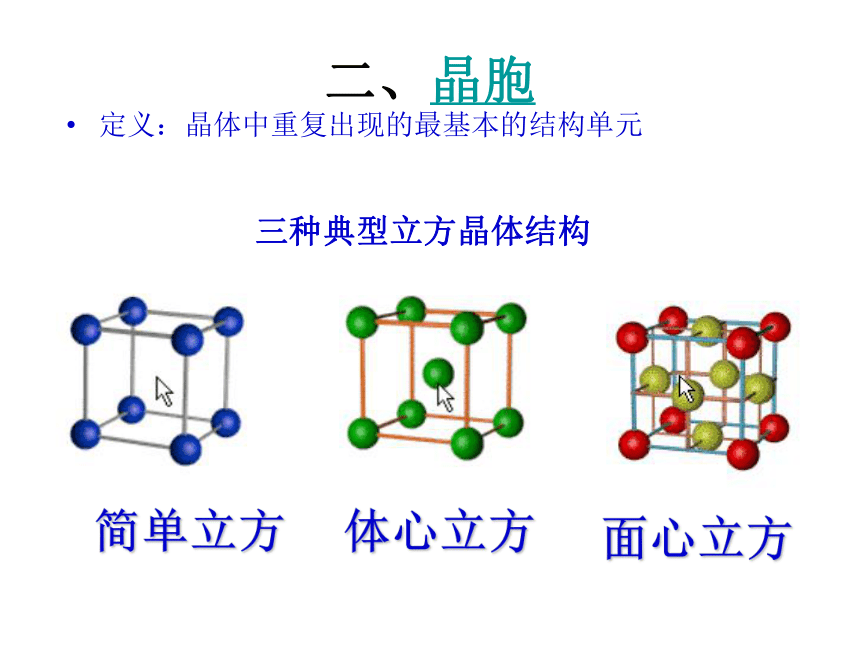
三种典型立方晶体结构
1、简单立方:又称简立方,自然界中简单立方晶体比较少见.VI A族元素晶体钋 Po在室温时是简单立方结构.简立方的配位数为 6。
2、体心立方:碱金属 Li、Na、K等是体心立方结构.体心立方的配位数是 8。
3、面心立方:Cu、Ag、Au 等金属晶体的结构是面心立方.面心立方的配位数为 12,
这是简单晶体可能具有的最高配位数,面心立方是自然界最密集的堆积方式之一,称为面心
立方密堆积,简称立方密堆积或立方密积.
晶胞中粒子数的计算方法:
晶体结构类习题最常见的题型就是已知晶胞的结构而求晶体的化学式。解答这类习题首先要明确一个概念:由晶胞构成的晶体,其化学式不一定是表示一个分子中含有多少个原子,而是表示每个晶胞中平均含有各类原子的个数,即各类原子的最简个数比。解答这类习题,通常采用分摊法。
在一个晶胞结构中出现的多个原子,这些原子并不是只为这个晶胞所独立占有,而是为多个晶胞所共有,那么,在一个晶胞结构中出现的每个原子,这个晶体能分摊到多少比例呢。这就是分摊法。分摊法的根本目的就是算出一个晶胞单独占有的各类原子的个数。
分摊法的根本原则是:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1/x。
在立体晶胞中,原子可以位于它的顶点,也可以位于它的棱上,还可以在它的面上(不含棱),当然,它的体内也可以有原子;
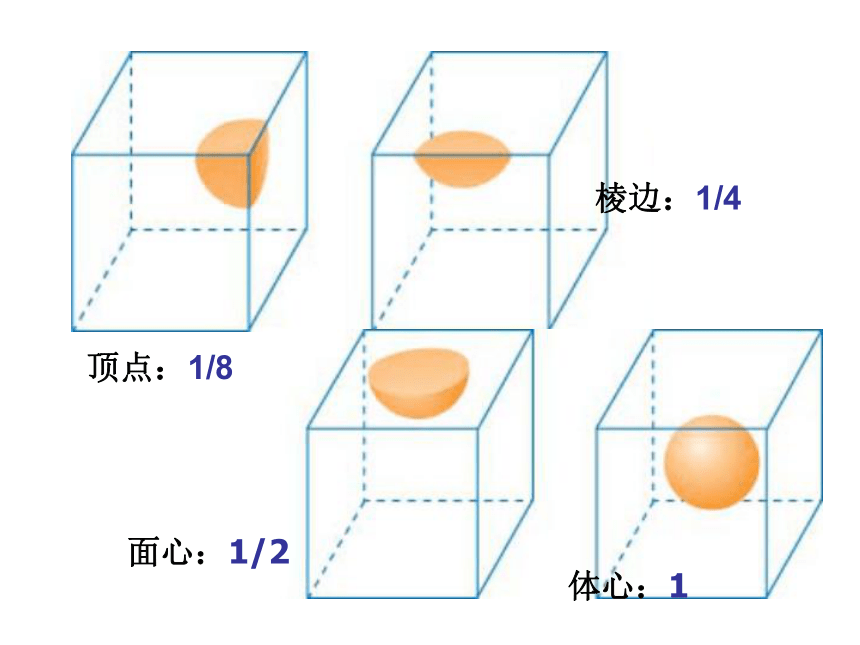
每个顶点被8个晶胞共有,所以晶胞对自己顶点上的每个原子只占1/8份额;
每条棱被4个晶胞共有,所以晶胞对自己棱上的每个原子只占1/4份额;
每个面被2个晶胞共有,所以晶胞对自己面上(不含棱)的每个原子只占1/2份额;
晶胞体内的原子不与其他晶胞分享,完全属于该晶胞。
体心:1
面心:1/2
顶点:1/8
棱边:1/4
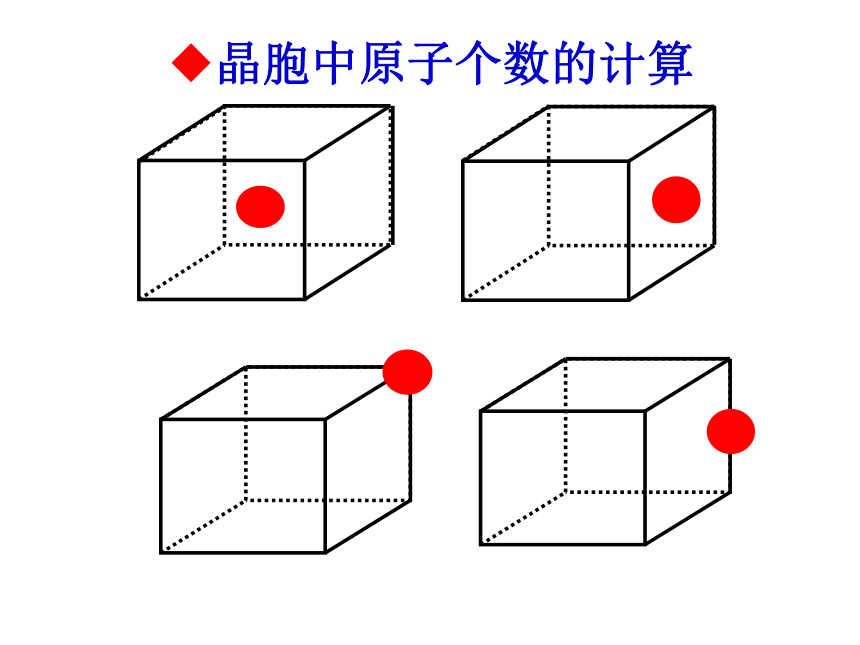
晶胞中原子个数的计算
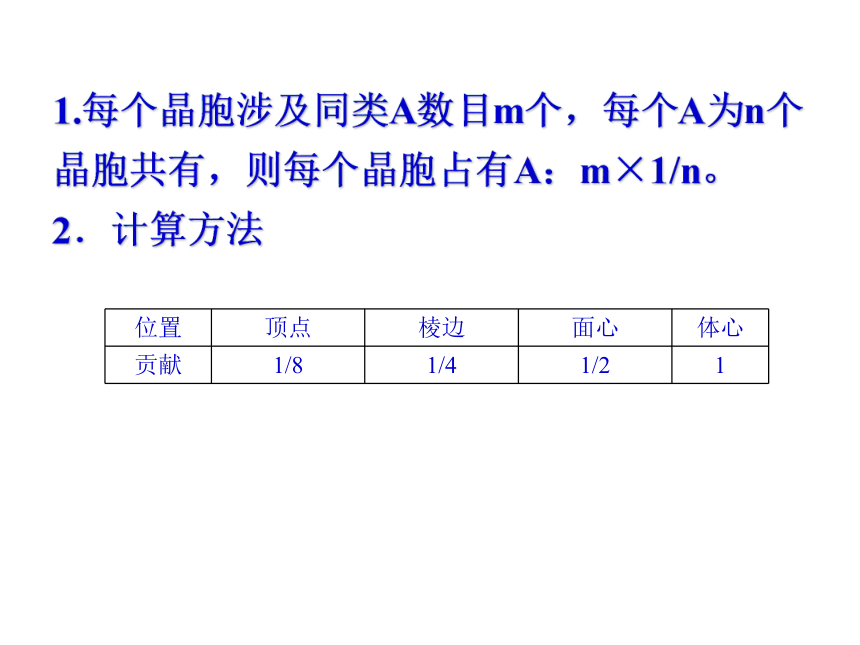
1.每个晶胞涉及同类A数目m个,每个A为n个晶胞共有,则每个晶胞占有A:m×1/n。
2.计算方法
位置 顶点 棱边 面心 体心
贡献 1/8 1/4 1/2 1
【例1】水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165k时形成的,玻璃态的水无固态形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是 ( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C. 玻璃态是水的一种特殊状态
D. 玻璃态水是分子晶体
C
【例2】最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是 。
解析:由于本题团簇分子指的是一个分子的具体结构,并不是晶体中的最小的一个重复单位,不能采用均摊法分析,所以只需数出该结构内两种原子的数目就可以了。答案为:Ti14C13
【例3】钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的结构示意图为下图,它的化学式是 ( )
A.BaTi8O12
B.BaTi4O6
C.BaTi2O4
D.BaTiO3
D
解题关键:
Ba在立方体的中心,完全属于该晶胞; Ti处于立方体的8个顶点,每个Ti为与之相连的8个立方体所共用,即只有1/8属于该晶胞;
O处于立方体的12条棱的中点,每条棱为四个立方体共用,故每个O只有1/4属于该晶胞;
即晶体中: Ba:Ti:O=1:(8×1/8):(12×1/4)=1:1:3
易错剖析:如果以为钛酸钡晶体就是一个个孤立的如题图所示的结构,就会错选C
石墨晶体的层状结构,层内为平面正六边形结构(如图),试回答下列问题:
(1)图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。
碳原子数目与碳碳化学键数目之比为_______。
练习一:
2:3
2
3
学与问(P66)
二氧化碳及其晶胞
P67 习题 第三题
干冰晶体结构示意
结束
回分子晶体
由此可见,每个二氧化碳分子周围有12个二氧化碳分子。
1.晶体与非晶体的严格判别可采用 ( )
A. 有否自范性 B.有否各向异性
C.有否固定熔点 D.有否周期性结构
2.某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未能画出),晶体中A、B、C的中原子个数之比依次为 ( )
A. 1:3:1 B. 2:3:1
C. 2:2:1 D. 1:3:3
【课后巩固练习】
D
A
3. 1987年2月,未经武(Paul Chu)教授等发现钛钡铜氧化合物在90K温度下即具有超导性。若该化合物的结构如右图所示,则该化合物的化学式可能是 ( )
A. YBa2CuO7-x
B. YBa2Cu2O7-x
C. YBa2Cu3O7-x
D. YBa2Cu4O7-x
C
4.白磷分子如图所示:则31 g白磷分子中存在的共价键数目为( )
A.4 NA B.NA
C.1.5 NA D.0.25 NA
C
5.某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是 ( )
A、1∶8 B、1∶4
C、1∶2 D、1∶1
D
6.如右图石墨晶体结构的每一层里平均每个最小的正六边形占有碳原子数目为( )
A、2 B、3 C、4 D、6
A
7. 许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为 ( )
A.Ca4TiO3
B.Ca4TiO6
C.CaTiO3
D.Ca8TiO120
C
8.下列有关晶体的特征及结构的陈述中不正确的是 ( )
A 单晶一般都有各向异性
B 晶体有固定的熔点
C 所有晶体都有一定的规整外形
D 多晶一般不表现各向异性
D
多晶指的是多种晶形共存,单晶指只有一种晶形。 单晶体- 晶体内部的晶格方位完全一致. 多晶体—许多晶粒组成
9. 晶体中最小的重复单元——晶胞,①凡处于立方体顶点的微粒,同时为 个晶胞共有;②凡处于立方体棱上的微粒,同时为
个晶胞共有;③凡处于立方体面上的微粒,同时为 个晶胞共有;④凡处于立方体体心的微粒,同时为 个晶胞共有。
8
4
2
1
10. 现有甲、乙、丙(如下图》三种晶体的晶胞:(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶体中x与y的个数比是__________,乙中a与b的个数比是__________,丙晶胞中有_______个c离子,有____________个d离子。
4 : 3
1 : 1
4
4
10.解析:x:y=4:3 a:b=1:1 4个c 4个d 处于晶胞中心的x或a为该晶胞单独占有,位于立方体顶点的微粒为8个立方体共有,位于立方体棱边的微粒为四个立方体共有,位于立方体面的微粒为两个立方体共有,所以
x:y=l:6×1/8=4:3;
a:b=1:8×1/8=1:1;
丙晶胞中c离子为12×1/4+1=4(个);
d离子为8×1/8 + 6×1/2=4(个)
11.右图是超导化合物————钙钛矿晶体的晶胞结构。请回答:
(1)该化合物的化学式为 。
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有 个
CaTiO3
6
11.解析:这个晶胞对位于顶点上的每个钛原子占有的份额为1/8,所以,它单独占有的钛原子个数为8×1/8=1个;它对位于棱上的每个氧原子占有的份额为1/4,所以,它单独占有的氧原子个数为12×1/4=3个;它全部拥有体内的那一个钙原子,所以,该晶胞中单独占有的钛原子、氧原子和钙原子的个数分别为:1、3、1.钛位于立方体的顶点上,与一个钛离子距离最近的钛离子是与它共棱的,与它共棱的离子都是二个,所以,共6个。
12.右图是石英晶体平面示意图,它实际上是立体的网状结构,
其中硅、氧原子数之比为 。
原硅酸根离子SiO44-的结构可表示为_______
二聚硅酸根离子Si2O76-中,只有硅氧键,它的结构可表示为 。
1:2
干冰晶体结构分析图
CO2 分子
中心
干冰晶体结构分析图
CO2 分子
13. 在干冰晶体中每个CO2分子周围紧邻的 CO2分子有___________个 在晶体中截取一个最小的正方形;使正方形的四个顶点部落到CO2分子的中心,则在这个正方形的平面上有___________个CO2分子。
12
4
14.如图为NaCl晶体结构图,图中直线交点处为NaCl晶体中Na+与Cl-所处的位置(不考虑体积的大小)。
(1)请将其代表Na+的用笔涂黑圆点,以完成 NaCl晶体结构示意图。
(2)确定晶体的晶胞,分析其构成。
(3)从晶胞中分Na+周围与它最近时且距离相等的 Na+共有多少个
14. (1) 含8个小立方体的NaCl晶体示意
图为一个晶胞
(2) 在晶胞中Na+与Cl-个数比为1:1.
(3) 12个
[拓展提高]
1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
顶点数+面数-棱边数=2
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
请回答下列问题:
15.固体C60与金刚石相比较,熔点较高者应是____________,理由是:____________
____________________________________.
16.试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)
__________,并简述其理由:___________
___________________________________。
金刚石属原子晶体,而固体C60不是,故金刚石熔点较高.
金刚石
因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60
可能
17.通过计算,确定C60分子所含单键数。C60分子所含单键数为 。
18. C70分子也已经制得,它的分子结构模型可以与C60同样考虑面推知。通过计算确定C70分子中五边形和六边形的数目。
C60分子形成的化学键数为:1/2(3*60)=90
由欧拉定理计算键数(即棱边数):60+(12+20)-2=90
90-30=60
18.解析:设C70分子中五边形数为x,六边形数为y.依题意可得方程组:
顶点数+面数-棱边数=2
解得: 五边形数 x = 12
六边形数 y = 25
新课标人教版课件系列
《高中化学》
选修3
3.1《晶体的常识》
第二课时
3.1.2《晶胞及晶胞中
微粒个数的确定》
二、晶胞
二、晶胞
定义:晶体中重复出现的最基本的结构单元
体心立方
简单立方
面心立方
三种典型立方晶体结构
1、简单立方:又称简立方,自然界中简单立方晶体比较少见.VI A族元素晶体钋 Po在室温时是简单立方结构.简立方的配位数为 6。
2、体心立方:碱金属 Li、Na、K等是体心立方结构.体心立方的配位数是 8。
3、面心立方:Cu、Ag、Au 等金属晶体的结构是面心立方.面心立方的配位数为 12,
这是简单晶体可能具有的最高配位数,面心立方是自然界最密集的堆积方式之一,称为面心
立方密堆积,简称立方密堆积或立方密积.
晶胞中粒子数的计算方法:
晶体结构类习题最常见的题型就是已知晶胞的结构而求晶体的化学式。解答这类习题首先要明确一个概念:由晶胞构成的晶体,其化学式不一定是表示一个分子中含有多少个原子,而是表示每个晶胞中平均含有各类原子的个数,即各类原子的最简个数比。解答这类习题,通常采用分摊法。
在一个晶胞结构中出现的多个原子,这些原子并不是只为这个晶胞所独立占有,而是为多个晶胞所共有,那么,在一个晶胞结构中出现的每个原子,这个晶体能分摊到多少比例呢。这就是分摊法。分摊法的根本目的就是算出一个晶胞单独占有的各类原子的个数。
分摊法的根本原则是:晶胞任意位置上的一个原子如果是被x个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1/x。
在立体晶胞中,原子可以位于它的顶点,也可以位于它的棱上,还可以在它的面上(不含棱),当然,它的体内也可以有原子;
每个顶点被8个晶胞共有,所以晶胞对自己顶点上的每个原子只占1/8份额;
每条棱被4个晶胞共有,所以晶胞对自己棱上的每个原子只占1/4份额;
每个面被2个晶胞共有,所以晶胞对自己面上(不含棱)的每个原子只占1/2份额;
晶胞体内的原子不与其他晶胞分享,完全属于该晶胞。
体心:1
面心:1/2
顶点:1/8
棱边:1/4
晶胞中原子个数的计算
1.每个晶胞涉及同类A数目m个,每个A为n个晶胞共有,则每个晶胞占有A:m×1/n。
2.计算方法
位置 顶点 棱边 面心 体心
贡献 1/8 1/4 1/2 1
【例1】水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165k时形成的,玻璃态的水无固态形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是 ( )
A.水由液态变为玻璃态,体积缩小
B.水由液态变为玻璃态,体积膨胀
C. 玻璃态是水的一种特殊状态
D. 玻璃态水是分子晶体
C
【例2】最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是 。
解析:由于本题团簇分子指的是一个分子的具体结构,并不是晶体中的最小的一个重复单位,不能采用均摊法分析,所以只需数出该结构内两种原子的数目就可以了。答案为:Ti14C13
【例3】钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的结构示意图为下图,它的化学式是 ( )
A.BaTi8O12
B.BaTi4O6
C.BaTi2O4
D.BaTiO3
D
解题关键:
Ba在立方体的中心,完全属于该晶胞; Ti处于立方体的8个顶点,每个Ti为与之相连的8个立方体所共用,即只有1/8属于该晶胞;
O处于立方体的12条棱的中点,每条棱为四个立方体共用,故每个O只有1/4属于该晶胞;
即晶体中: Ba:Ti:O=1:(8×1/8):(12×1/4)=1:1:3
易错剖析:如果以为钛酸钡晶体就是一个个孤立的如题图所示的结构,就会错选C
石墨晶体的层状结构,层内为平面正六边形结构(如图),试回答下列问题:
(1)图中平均每个正六边形占有C原子数为____个、占有的碳碳键数为____个。
碳原子数目与碳碳化学键数目之比为_______。
练习一:
2:3
2
3
学与问(P66)
二氧化碳及其晶胞
P67 习题 第三题
干冰晶体结构示意
结束
回分子晶体
由此可见,每个二氧化碳分子周围有12个二氧化碳分子。
1.晶体与非晶体的严格判别可采用 ( )
A. 有否自范性 B.有否各向异性
C.有否固定熔点 D.有否周期性结构
2.某物质的晶体中含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子未能画出),晶体中A、B、C的中原子个数之比依次为 ( )
A. 1:3:1 B. 2:3:1
C. 2:2:1 D. 1:3:3
【课后巩固练习】
D
A
3. 1987年2月,未经武(Paul Chu)教授等发现钛钡铜氧化合物在90K温度下即具有超导性。若该化合物的结构如右图所示,则该化合物的化学式可能是 ( )
A. YBa2CuO7-x
B. YBa2Cu2O7-x
C. YBa2Cu3O7-x
D. YBa2Cu4O7-x
C
4.白磷分子如图所示:则31 g白磷分子中存在的共价键数目为( )
A.4 NA B.NA
C.1.5 NA D.0.25 NA
C
5.某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是 ( )
A、1∶8 B、1∶4
C、1∶2 D、1∶1
D
6.如右图石墨晶体结构的每一层里平均每个最小的正六边形占有碳原子数目为( )
A、2 B、3 C、4 D、6
A
7. 许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为 ( )
A.Ca4TiO3
B.Ca4TiO6
C.CaTiO3
D.Ca8TiO120
C
8.下列有关晶体的特征及结构的陈述中不正确的是 ( )
A 单晶一般都有各向异性
B 晶体有固定的熔点
C 所有晶体都有一定的规整外形
D 多晶一般不表现各向异性
D
多晶指的是多种晶形共存,单晶指只有一种晶形。 单晶体- 晶体内部的晶格方位完全一致. 多晶体—许多晶粒组成
9. 晶体中最小的重复单元——晶胞,①凡处于立方体顶点的微粒,同时为 个晶胞共有;②凡处于立方体棱上的微粒,同时为
个晶胞共有;③凡处于立方体面上的微粒,同时为 个晶胞共有;④凡处于立方体体心的微粒,同时为 个晶胞共有。
8
4
2
1
10. 现有甲、乙、丙(如下图》三种晶体的晶胞:(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶体中x与y的个数比是__________,乙中a与b的个数比是__________,丙晶胞中有_______个c离子,有____________个d离子。
4 : 3
1 : 1
4
4
10.解析:x:y=4:3 a:b=1:1 4个c 4个d 处于晶胞中心的x或a为该晶胞单独占有,位于立方体顶点的微粒为8个立方体共有,位于立方体棱边的微粒为四个立方体共有,位于立方体面的微粒为两个立方体共有,所以
x:y=l:6×1/8=4:3;
a:b=1:8×1/8=1:1;
丙晶胞中c离子为12×1/4+1=4(个);
d离子为8×1/8 + 6×1/2=4(个)
11.右图是超导化合物————钙钛矿晶体的晶胞结构。请回答:
(1)该化合物的化学式为 。
(2)在该化合物晶体中,与某个钛离子距离最近且相等的其他钛离子共有 个
CaTiO3
6
11.解析:这个晶胞对位于顶点上的每个钛原子占有的份额为1/8,所以,它单独占有的钛原子个数为8×1/8=1个;它对位于棱上的每个氧原子占有的份额为1/4,所以,它单独占有的氧原子个数为12×1/4=3个;它全部拥有体内的那一个钙原子,所以,该晶胞中单独占有的钛原子、氧原子和钙原子的个数分别为:1、3、1.钛位于立方体的顶点上,与一个钛离子距离最近的钛离子是与它共棱的,与它共棱的离子都是二个,所以,共6个。
12.右图是石英晶体平面示意图,它实际上是立体的网状结构,
其中硅、氧原子数之比为 。
原硅酸根离子SiO44-的结构可表示为_______
二聚硅酸根离子Si2O76-中,只有硅氧键,它的结构可表示为 。
1:2
干冰晶体结构分析图
CO2 分子
中心
干冰晶体结构分析图
CO2 分子
13. 在干冰晶体中每个CO2分子周围紧邻的 CO2分子有___________个 在晶体中截取一个最小的正方形;使正方形的四个顶点部落到CO2分子的中心,则在这个正方形的平面上有___________个CO2分子。
12
4
14.如图为NaCl晶体结构图,图中直线交点处为NaCl晶体中Na+与Cl-所处的位置(不考虑体积的大小)。
(1)请将其代表Na+的用笔涂黑圆点,以完成 NaCl晶体结构示意图。
(2)确定晶体的晶胞,分析其构成。
(3)从晶胞中分Na+周围与它最近时且距离相等的 Na+共有多少个
14. (1) 含8个小立方体的NaCl晶体示意
图为一个晶胞
(2) 在晶胞中Na+与Cl-个数比为1:1.
(3) 12个
[拓展提高]
1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家。C60分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:
顶点数+面数-棱边数=2
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
请回答下列问题:
15.固体C60与金刚石相比较,熔点较高者应是____________,理由是:____________
____________________________________.
16.试估计C60跟F2在一定条件下,能否发生反应生成C60F60(填“可能”或“不可能”)
__________,并简述其理由:___________
___________________________________。
金刚石属原子晶体,而固体C60不是,故金刚石熔点较高.
金刚石
因C60分子含30个双键,与极活泼的F2发生加成反应即可生成C60F60
可能
17.通过计算,确定C60分子所含单键数。C60分子所含单键数为 。
18. C70分子也已经制得,它的分子结构模型可以与C60同样考虑面推知。通过计算确定C70分子中五边形和六边形的数目。
C60分子形成的化学键数为:1/2(3*60)=90
由欧拉定理计算键数(即棱边数):60+(12+20)-2=90
90-30=60
18.解析:设C70分子中五边形数为x,六边形数为y.依题意可得方程组:
顶点数+面数-棱边数=2
解得: 五边形数 x = 12
六边形数 y = 25
