3.3.2《金属晶体的原子堆积模型》PPT课件(新人教版-选修3)
文档属性
| 名称 | 3.3.2《金属晶体的原子堆积模型》PPT课件(新人教版-选修3) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-19 07:18:05 | ||
图片预览




文档简介
(共22张PPT)
新课标人教版课件系列
《高中化学》
选修3
3.3.2《金属晶体的原子
堆积模型》
金属晶体的原子堆积模型
(1)几个概念
紧密堆积:微粒之间的作用力使微粒间尽可能的相互接近,使它们占有最小的空间
配位数:在晶体中与每个微粒紧密相邻的微粒个数
空间利用率:晶体的空间被微粒占满的体积百分数,用它来表示紧密堆积的程度
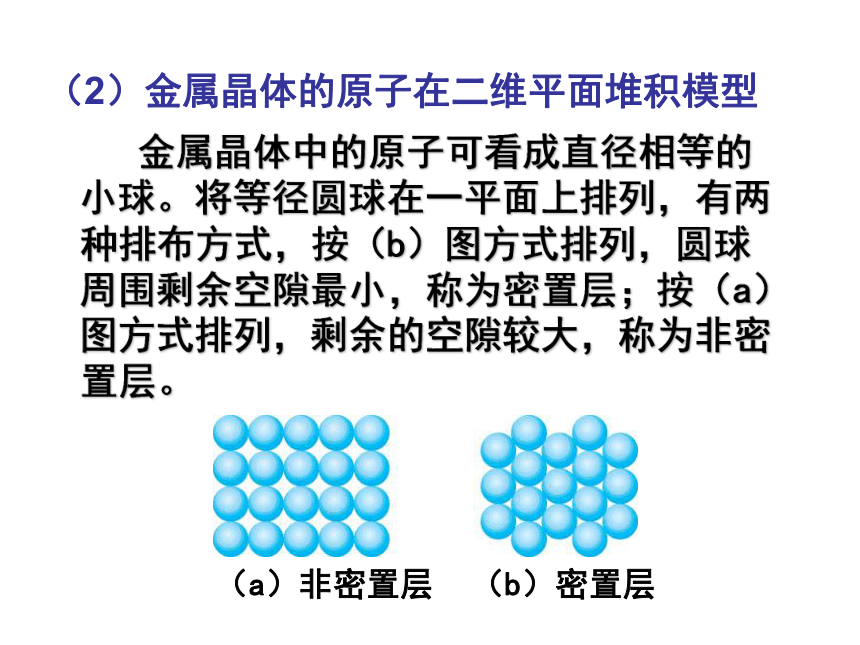
(2)金属晶体的原子在二维平面堆积模型
金属晶体中的原子可看成直径相等的小球。将等径圆球在一平面上排列,有两种排布方式,按(b)图方式排列,圆球周围剩余空隙最小,称为密置层;按(a)图方式排列,剩余的空隙较大,称为非密置层。
(a)非密置层 (b)密置层
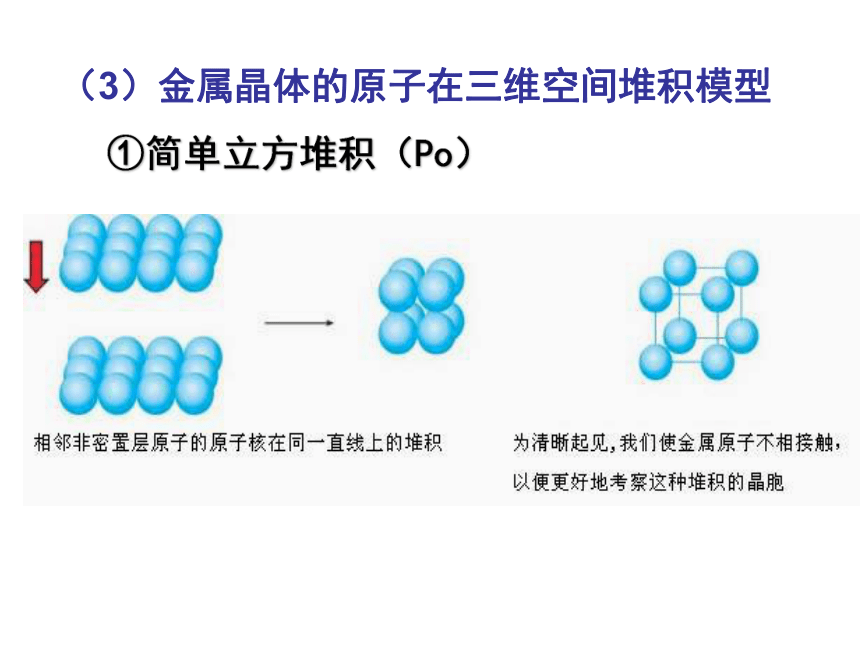
(3)金属晶体的原子在三维空间堆积模型
①简单立方堆积(Po)
简单立方堆积
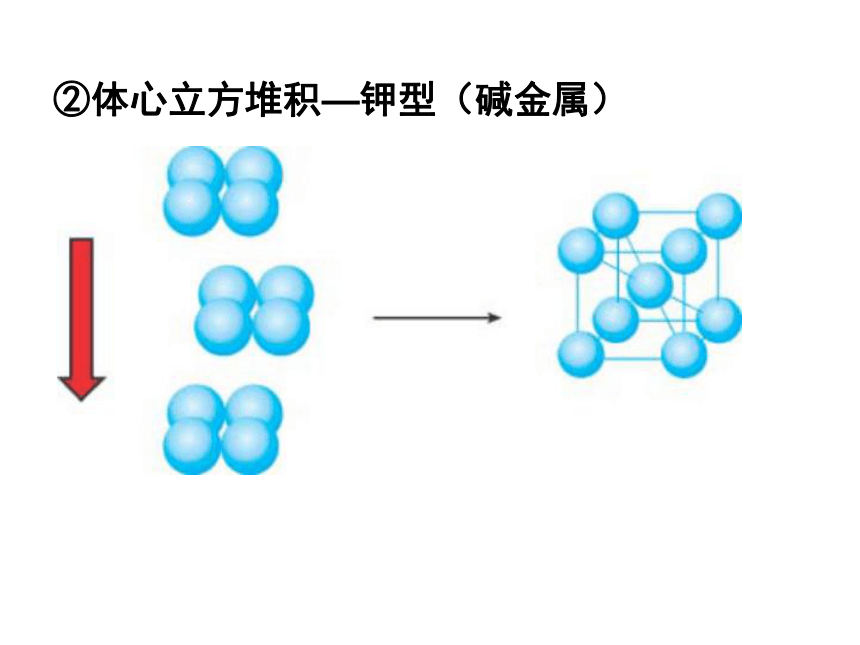
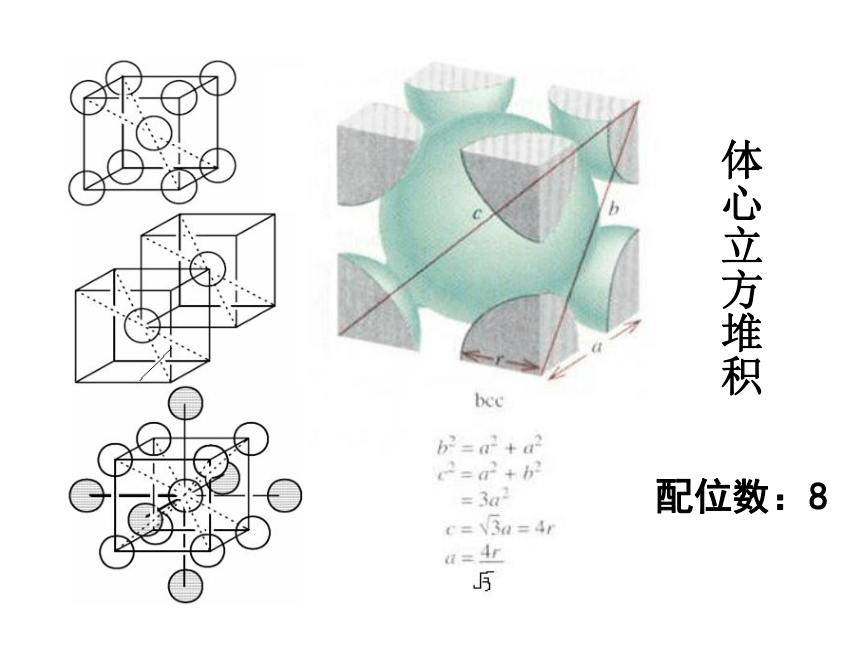
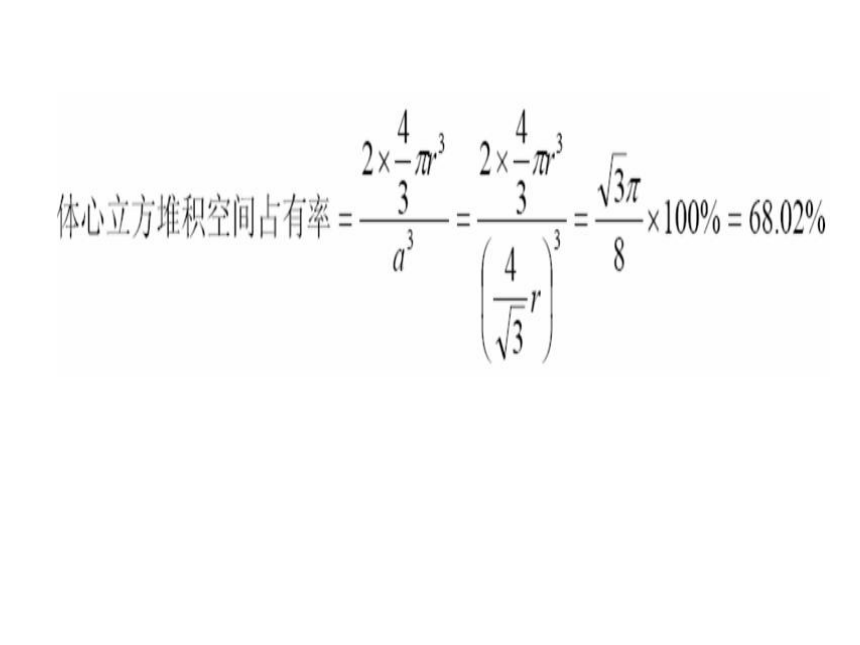
②体心立方堆积—钾型(碱金属)
体心立方堆积
配位数:8
镁型
铜型
③镁型和铜型
1
2
3
4
5
6
第二层 对第一层来讲最紧密的堆积方式是将球对准1,3,5 位。 ( 或对准 2,4,6 位,其情形是一样的 )
1
2
3
4
5
6
A
B
,
关键是第三层,对第一、二层来说,第三层可以有两种最紧密的堆积方式。
第一种是将球对准第一层的球。
1
2
3
4
5
6
于是每两层形成一个周期,即 AB AB 堆积方式,形成六方紧密堆积。
配位数 12 。 ( 同层 6,上下层各 3 ) ,空间利用率为74%
下图是此种六方
紧密堆积的前视图
A
B
A
B
A
1
2
3
4
5
6
3.镁型
第三层的另一种排列方式,是将球对准第一层的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
此种立方紧密堆积的前视图
A
B
C
A
A
B
C
第四层再排 A,于是形成 ABC ABC 三层一个周期。 得到面心立方堆积。
配位数 12 。
( 同层 6, 上下层各 3 )
④面心立方:铜型
B
C
A
镁型
铜型
金属晶体的两种最密堆积方式
堆积模型 采纳这种堆积的典型代表 空间利用率 配位数 晶胞
简单立方 Po (钋) 52% 6
钾型(bcp) K、Na、Fe 68% 8
镁型(hcp) Mg、Zn、Ti 74% 12
铜型(ccp) Cu, Ag, Au 74% 12
1.下列有关金属元素特征的叙述中正确的是
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同
D.金属单质的熔点总是高于分子晶体
能力训练
2. 某些金属晶体(Cu、Ag、Au)的原子按面心立方的形式紧密堆积,即在晶体结构中可以划出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个侧面上,试计算这类金属晶体中原子的空间利用率。
3. 已知金属铜为面心立方晶体,如图所示,铜的相对原子质量为63.54,密度为8.936g/cm3,试求
(1)图中正方形边长 a,
(2)铜的金属半径 r
a
a
r
r
o
r
r
提示:
数出面心立方中的铜的个数:
新课标人教版课件系列
《高中化学》
选修3
3.3.2《金属晶体的原子
堆积模型》
金属晶体的原子堆积模型
(1)几个概念
紧密堆积:微粒之间的作用力使微粒间尽可能的相互接近,使它们占有最小的空间
配位数:在晶体中与每个微粒紧密相邻的微粒个数
空间利用率:晶体的空间被微粒占满的体积百分数,用它来表示紧密堆积的程度
(2)金属晶体的原子在二维平面堆积模型
金属晶体中的原子可看成直径相等的小球。将等径圆球在一平面上排列,有两种排布方式,按(b)图方式排列,圆球周围剩余空隙最小,称为密置层;按(a)图方式排列,剩余的空隙较大,称为非密置层。
(a)非密置层 (b)密置层
(3)金属晶体的原子在三维空间堆积模型
①简单立方堆积(Po)
简单立方堆积
②体心立方堆积—钾型(碱金属)
体心立方堆积
配位数:8
镁型
铜型
③镁型和铜型
1
2
3
4
5
6
第二层 对第一层来讲最紧密的堆积方式是将球对准1,3,5 位。 ( 或对准 2,4,6 位,其情形是一样的 )
1
2
3
4
5
6
A
B
,
关键是第三层,对第一、二层来说,第三层可以有两种最紧密的堆积方式。
第一种是将球对准第一层的球。
1
2
3
4
5
6
于是每两层形成一个周期,即 AB AB 堆积方式,形成六方紧密堆积。
配位数 12 。 ( 同层 6,上下层各 3 ) ,空间利用率为74%
下图是此种六方
紧密堆积的前视图
A
B
A
B
A
1
2
3
4
5
6
3.镁型
第三层的另一种排列方式,是将球对准第一层的 2,4,6 位,不同于 AB 两层的位置,这是 C 层。
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
1
2
3
4
5
6
此种立方紧密堆积的前视图
A
B
C
A
A
B
C
第四层再排 A,于是形成 ABC ABC 三层一个周期。 得到面心立方堆积。
配位数 12 。
( 同层 6, 上下层各 3 )
④面心立方:铜型
B
C
A
镁型
铜型
金属晶体的两种最密堆积方式
堆积模型 采纳这种堆积的典型代表 空间利用率 配位数 晶胞
简单立方 Po (钋) 52% 6
钾型(bcp) K、Na、Fe 68% 8
镁型(hcp) Mg、Zn、Ti 74% 12
铜型(ccp) Cu, Ag, Au 74% 12
1.下列有关金属元素特征的叙述中正确的是
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素在化合物中一定显正价
C.金属元素在不同化合物中的化合价均不同
D.金属单质的熔点总是高于分子晶体
能力训练
2. 某些金属晶体(Cu、Ag、Au)的原子按面心立方的形式紧密堆积,即在晶体结构中可以划出一块正立方体的结构单元,金属原子处于正立方体的八个顶点和六个侧面上,试计算这类金属晶体中原子的空间利用率。
3. 已知金属铜为面心立方晶体,如图所示,铜的相对原子质量为63.54,密度为8.936g/cm3,试求
(1)图中正方形边长 a,
(2)铜的金属半径 r
a
a
r
r
o
r
r
提示:
数出面心立方中的铜的个数:
