3.2.2《原子晶体》PPT课件(新人教版-选修3)
文档属性
| 名称 | 3.2.2《原子晶体》PPT课件(新人教版-选修3) |

|
|
| 格式 | zip | ||
| 文件大小 | 324.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-19 00:00:00 | ||
图片预览






文档简介
(共26张PPT)
新课标人教版课件系列
《高中化学》
选修3
第2课时
《原子晶体》
3.2《分子晶体与原子晶体》
教学目标
知识与能力
1、掌握原子晶体的概念,能够区分原子晶体和分子晶体。
2、了解金刚石等典型原子晶体的结构特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
〖教学难点重点〗
原子晶体的结构与性质的关系
讨论:
CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。
熔点/oC 状态(室温)
CO2 -56.2 气态
SiO2 1723 固态
结论:SiO2不是分子晶体。那它是什么晶体呢?
一、原子晶体
1.定义: 原子间通过共价键相结合而形成空间网状结构的晶体
1.构成以上晶体的粒子是什么
2.粒子间通过什么样的作用力联系在一起
3.以上晶体结构在整体上有什么共同特点
思考
Si
o
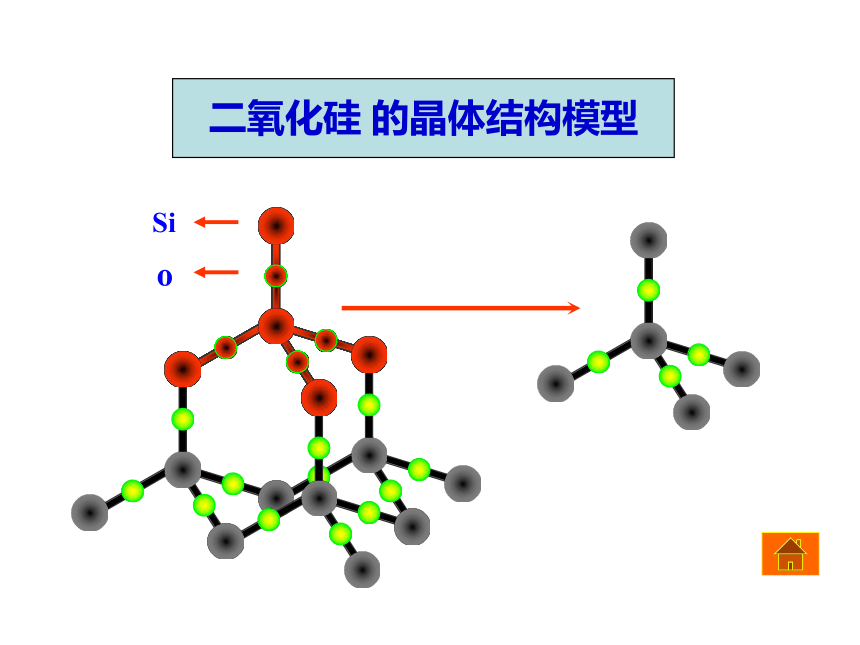
二氧化硅 的晶体结构模型
二氧化硅 的晶体结构模型
1. SiO2晶体中Si、O原子的连接特点。
2. SiO2晶体中存在SiO2小分子吗? SiO2能不能叫做分子式?
3. SiO2晶体中Si-O键的夹角(键角)是多少?每个正四面体占有Si、O原子数是多少?
4 SiO2晶体中,每个硅原子与它周围的4个硅原子所形成的空间结构是什么? SiO2晶体中,最小的硅氧原子环上共有多少个原子?
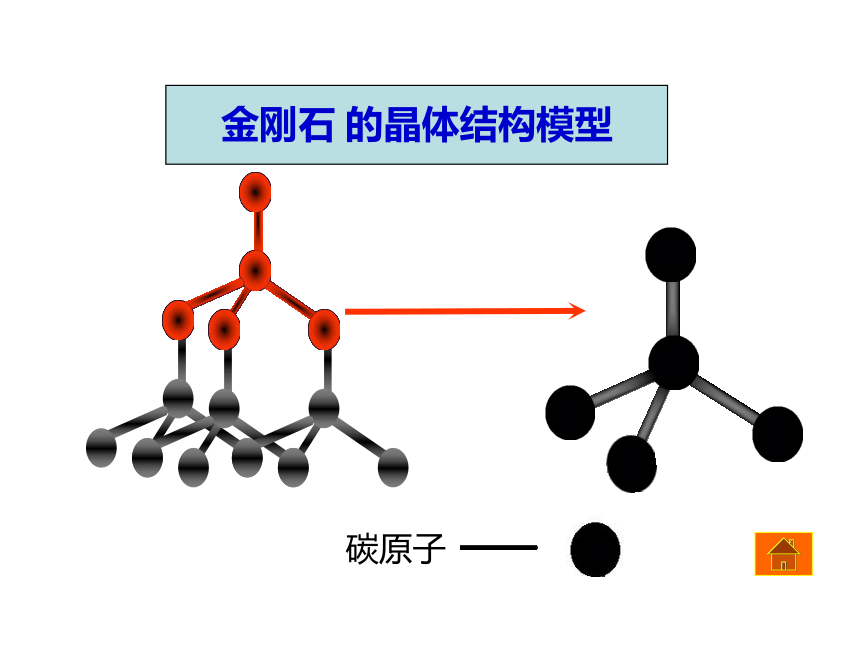
金刚石 的晶体结构模型
碳原子
金刚石 的晶体结构模型
1. 金刚石晶体的结构特点。
2. 金刚石晶体中最小碳环上的碳原子数和环的特点。
3. 金刚石晶体中碳原子与C-C键数之比是多少?
3. 晶体中每个C原子参与了4条C-C键的形成,而在每条键中的贡献只有一半,故C原子与C-C键数之比为:1:(4×1/2)= 1:2
2.最小的碳环由6个碳原子组成且不在同一平面内
晶体硅 的晶体结构模型
硅原子
二、原子晶体的特点
1、熔沸点很高,硬度很大,难溶于一般溶剂,一般不导电。
三、哪些物质属于原子晶体
金刚石、单晶硅、碳化硅、二氧化硅等
2、原子晶体熔、沸点的高低与共价键的键能大小有关,共价键的键能于半径有关,半径越大,键能越小。
比较C 、Si 原子半径,不难发现键能:C—C > C– Si >Si—Si ,所以熔、沸点为金刚石>碳化硅>单晶硅
石墨的晶体结构图
返回
石墨
—混合型晶体
石墨为什么很软?
石墨的熔沸点为什很高?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软,硬度小。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。
原 子 晶 体
1、定义:原子间以共价键相结合而形成的空
间网状结构的晶体。
如:金刚石是以碳碳单键结合而成的正四面体的空间网状结构。
键角:109°28′
键长 :1.55×10-10m
2、性质:熔沸点高,硬度大,难溶于一般溶剂。
熔点: 3550℃ 沸点:4827℃
3、代表晶型:金刚石、晶体硅、二氧化硅
4、原子晶体的构成微粒和作用力:
构成微粒是:原子
作用:共价键
5、原子晶体中不存在分子
如:SiO2中只存在Si原子和O原子,而不存在SiO2分子,只有化学式。
6、原子晶体的熔沸点也是随作共价键的增强而增高
晶体类型的判断
从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体)
分析石墨结构中碳原子数与碳碳键数目比
故正六边形中的碳碳键数为6×1/2=3,
解析:
我们可以先选取一个正六边形
此结构中的碳原子数为6
一个碳原子被三个六元碳环共用,
正六边形中的碳原子数为6×1/3=2。
六边形中的任一条边(即碳碳键)
均被2个正六边形共用,
所以碳原子数与碳碳键数目比为2:3。
5. 已知金刚石中C—C键长为1.54×10-10m,那么金刚石的密度为 g/cm3。(相对原子质量:C 12.0)
6. SiC是原子晶体,其结构类似金刚石,为C、Si 两原子依次相间排列的正四面体型空间网状结构。右图为两个中心重合,各面分别平行的大小两个正方体,其中心为一Si原子,试在小正方体的顶点上画出与Si最近的C的位置,在大正方体的棱上画出与C最近的Si的位置。
Si
C
两大小正方体的边长之比为_______;Si—C—Si的键角为______ (用反三角函数表示);若Si—C键长为a cm,则大正方体边长为_______cm;SiC晶体的密度为______g/cm3。(NA为阿佛加德罗常数,相对原子质量 C.12 Si.28)。
3.金刚石结构中,一个碳原子与 个碳原子成键,
则每个碳原子实际形成的化学键为 个;
a mol金刚石中,碳碳键数为 mol。
4
2
2a
4、已知金刚石的晶胞如图,金刚石中C-C键长为1.55×10-8cm,求金刚石的晶体密度?
开拓思考题
仔细观察左边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些?
(二)、晶体中距离最近的微粒数的计算:
1、在金刚石的网状结构中, 含有由共价键形成的碳原子环, 其中最小的环上有______(填数字)个碳原子,每个碳原子上的任意两个C─C键的夹角都是________ (填角度)
6
109°28'
课堂练习题
下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
常温常压下的分子晶体是:
A.碘 B.水 C. 硫酸铵 D.干冰
晶体中的一个微粒周围有6个微粒,这种晶体是:
A.金刚石 B.石墨 C.干冰 D.氯化钠
新课标人教版课件系列
《高中化学》
选修3
第2课时
《原子晶体》
3.2《分子晶体与原子晶体》
教学目标
知识与能力
1、掌握原子晶体的概念,能够区分原子晶体和分子晶体。
2、了解金刚石等典型原子晶体的结构特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。
〖教学难点重点〗
原子晶体的结构与性质的关系
讨论:
CO2和SiO2的一些物理性质如下表所示,通过比较试判断SiO2晶体是否属于分子晶体。
熔点/oC 状态(室温)
CO2 -56.2 气态
SiO2 1723 固态
结论:SiO2不是分子晶体。那它是什么晶体呢?
一、原子晶体
1.定义: 原子间通过共价键相结合而形成空间网状结构的晶体
1.构成以上晶体的粒子是什么
2.粒子间通过什么样的作用力联系在一起
3.以上晶体结构在整体上有什么共同特点
思考
Si
o
二氧化硅 的晶体结构模型
二氧化硅 的晶体结构模型
1. SiO2晶体中Si、O原子的连接特点。
2. SiO2晶体中存在SiO2小分子吗? SiO2能不能叫做分子式?
3. SiO2晶体中Si-O键的夹角(键角)是多少?每个正四面体占有Si、O原子数是多少?
4 SiO2晶体中,每个硅原子与它周围的4个硅原子所形成的空间结构是什么? SiO2晶体中,最小的硅氧原子环上共有多少个原子?
金刚石 的晶体结构模型
碳原子
金刚石 的晶体结构模型
1. 金刚石晶体的结构特点。
2. 金刚石晶体中最小碳环上的碳原子数和环的特点。
3. 金刚石晶体中碳原子与C-C键数之比是多少?
3. 晶体中每个C原子参与了4条C-C键的形成,而在每条键中的贡献只有一半,故C原子与C-C键数之比为:1:(4×1/2)= 1:2
2.最小的碳环由6个碳原子组成且不在同一平面内
晶体硅 的晶体结构模型
硅原子
二、原子晶体的特点
1、熔沸点很高,硬度很大,难溶于一般溶剂,一般不导电。
三、哪些物质属于原子晶体
金刚石、单晶硅、碳化硅、二氧化硅等
2、原子晶体熔、沸点的高低与共价键的键能大小有关,共价键的键能于半径有关,半径越大,键能越小。
比较C 、Si 原子半径,不难发现键能:C—C > C– Si >Si—Si ,所以熔、沸点为金刚石>碳化硅>单晶硅
石墨的晶体结构图
返回
石墨
—混合型晶体
石墨为什么很软?
石墨的熔沸点为什很高?
石墨为层状结构,各层之间是范德华力结合,容易滑动,所以石墨很软,硬度小。
石墨各层均为平面网状结构,碳原子之间存在很强的共价键,故熔沸点很高。
所以,石墨称为混合型晶体。
原 子 晶 体
1、定义:原子间以共价键相结合而形成的空
间网状结构的晶体。
如:金刚石是以碳碳单键结合而成的正四面体的空间网状结构。
键角:109°28′
键长 :1.55×10-10m
2、性质:熔沸点高,硬度大,难溶于一般溶剂。
熔点: 3550℃ 沸点:4827℃
3、代表晶型:金刚石、晶体硅、二氧化硅
4、原子晶体的构成微粒和作用力:
构成微粒是:原子
作用:共价键
5、原子晶体中不存在分子
如:SiO2中只存在Si原子和O原子,而不存在SiO2分子,只有化学式。
6、原子晶体的熔沸点也是随作共价键的增强而增高
晶体类型的判断
从组成上判断(仅限于中学范围):
有无金属离子?(有:离子晶体)
是否属于“四种原子晶体”?
以上皆否定,则多数是分子晶体。
从性质上判断:
熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)
熔融状态的导电性。(导电:离子晶体)
分析石墨结构中碳原子数与碳碳键数目比
故正六边形中的碳碳键数为6×1/2=3,
解析:
我们可以先选取一个正六边形
此结构中的碳原子数为6
一个碳原子被三个六元碳环共用,
正六边形中的碳原子数为6×1/3=2。
六边形中的任一条边(即碳碳键)
均被2个正六边形共用,
所以碳原子数与碳碳键数目比为2:3。
5. 已知金刚石中C—C键长为1.54×10-10m,那么金刚石的密度为 g/cm3。(相对原子质量:C 12.0)
6. SiC是原子晶体,其结构类似金刚石,为C、Si 两原子依次相间排列的正四面体型空间网状结构。右图为两个中心重合,各面分别平行的大小两个正方体,其中心为一Si原子,试在小正方体的顶点上画出与Si最近的C的位置,在大正方体的棱上画出与C最近的Si的位置。
Si
C
两大小正方体的边长之比为_______;Si—C—Si的键角为______ (用反三角函数表示);若Si—C键长为a cm,则大正方体边长为_______cm;SiC晶体的密度为______g/cm3。(NA为阿佛加德罗常数,相对原子质量 C.12 Si.28)。
3.金刚石结构中,一个碳原子与 个碳原子成键,
则每个碳原子实际形成的化学键为 个;
a mol金刚石中,碳碳键数为 mol。
4
2
2a
4、已知金刚石的晶胞如图,金刚石中C-C键长为1.55×10-8cm,求金刚石的晶体密度?
开拓思考题
仔细观察左边的示意图后,回答下列问题:
金刚石与石墨的熔点均很高,那么二者熔点是否相同?为什么?若不相同,哪种更高一些?
(二)、晶体中距离最近的微粒数的计算:
1、在金刚石的网状结构中, 含有由共价键形成的碳原子环, 其中最小的环上有______(填数字)个碳原子,每个碳原子上的任意两个C─C键的夹角都是________ (填角度)
6
109°28'
课堂练习题
下列不存在化学键的晶体是:
A.硝酸钾 B.干冰 C.石墨 D.固体氩
常温常压下的分子晶体是:
A.碘 B.水 C. 硫酸铵 D.干冰
晶体中的一个微粒周围有6个微粒,这种晶体是:
A.金刚石 B.石墨 C.干冰 D.氯化钠
