3.2.1《分子晶体》PPT课件(新人教版-选修3)
文档属性
| 名称 | 3.2.1《分子晶体》PPT课件(新人教版-选修3) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-19 00:00:00 | ||
图片预览





文档简介
(共21张PPT)
新课标人教版课件系列
《高中化学》
选修3
第1课时
《分子晶体》
3.2《分子晶体与原子晶体》
教学目标
1、使学生了解分子晶体的组成粒子、结构模型和结构特点及其性质的一般特点。
2、使学生了解晶体类型与性质的关系。
3、使学生理解分子间作用力和氢键对物质物理性质的影响。
4、知道一些常见的属于分子晶体的物质类别。
5、使学生主动参与科学探究,体验研究过程,激发他们的学习兴趣。
教学重点难点:
重点掌握分子晶体的结构特点和性质特点
难点是氢键的方向性和氢键对物体物理性质的影响
从三维空间结构认识晶胞的组成结构
教学方法建议:
运用模型和类比方法诱导分析归纳
雪花(H2O)
干冰(CO2)
金刚石(C)
水晶(SiO2)
食盐(NaCl)
KNO3晶体
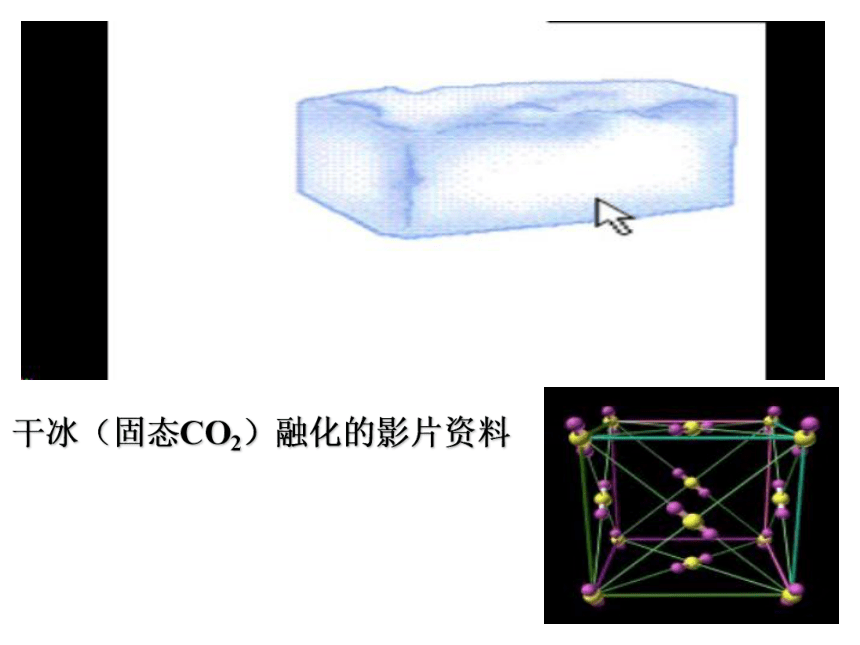
干冰(固态CO2)融化的影片资料
范德瓦尔斯(J.D.van der Waals,1837~1923年)。荷兰科学家,1910年获得诺贝尔物理奖。1837年6月1日,生于莱顿。1873年,他获得莱顿大学的博士学位,在论文中他首次证明了分子体积以及分子间作用力的存在。这种把分子聚集在一起的作用力,叫做分子间作用力。
资料
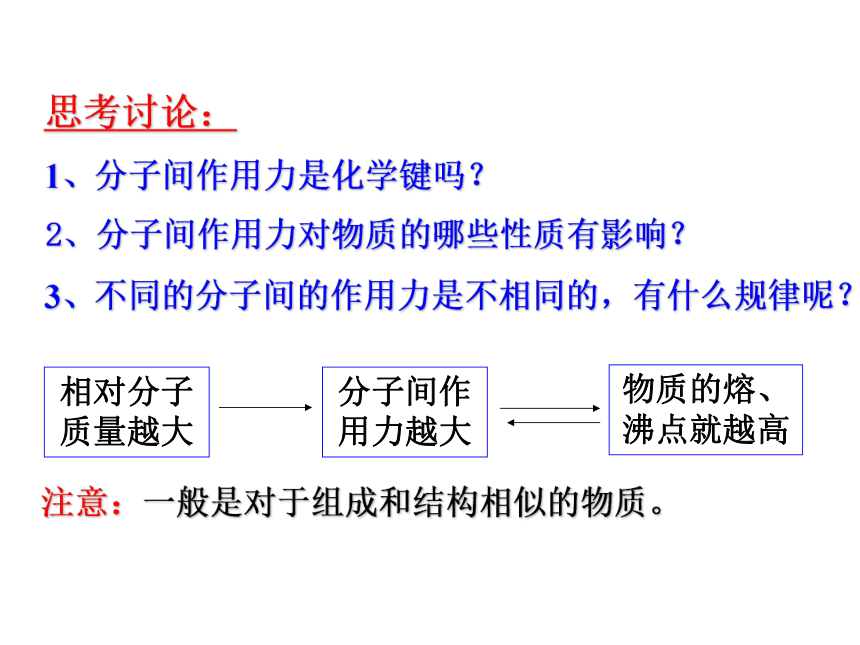
思考讨论:
1、分子间作用力是化学键吗?
3、不同的分子间的作用力是不相同的,有什么规律呢?
2、分子间作用力对物质的哪些性质有影响?
分子间作用力越大
物质的熔、
沸点就越高
相对分子质量越大
注意:一般是对于组成和结构相似的物质。
四卤化碳、卤素单质的熔、沸点与相对分子质量的关系图
一些氢化物的沸点
一些氢化物的沸点
H2O
1、氢键是化学键吗?存在氢键的物质为何熔点、沸点相对较高?
3、如果水分子间无氢键存在,地球上将会是什么面貌?
2、热胀冷缩是一种物理现象,但水结冰时体积却膨胀了,即ρ冰<ρ水,你能解释吗?
思考讨论:
思考:
1、哪些物质能形成分子晶体呢?
实例:多数非金属单质(如卤素,氧气)
稀有气体(如氦,氖,氩)
氢化物(如氨,氯化氢)
多数非金属氧化物(如一氧化碳,二氧化硫)
酸(如硫酸,磷酸)
有机物(如蔗糖,酒精)
思考:
2、结构决定性质,根据分子晶体的结构,总结:
(1)分子晶体的熔沸点如何?
(2)分子晶体在固态、熔融状态下、水溶液中,能否导电?
①熔点和沸点较低
②导电性:固态及熔化时都不导电,溶于水时部分导电
物理性质小结:
3、分子晶体的溶解性如何?
稀有气体:单原子分子
离子晶体
离子键
原子
离子
分子
得 失电子
共价键
共用电子对
分子晶体
分子间作用力
熔、沸点较高
硬度较大
水溶液、熔融能导电
多数能溶与水
熔、沸点较低
固态、熔融不导电
相似相溶
2.下列属于分子晶体的是 ( B )
A、 CaO、NO、CO B、Cl2、H2O2、He
C、CO2、SO2、MgCl2 D、CH4、NH3、NaOH
1. 下列性质符合分子晶体的是( B )
A、熔点是1070 ℃,易溶于水,水溶液能导电。
B、熔点是10.31℃,液态不导电,水溶液能导电。
C、不能溶于水,熔点是1723 ℃ ,沸点是2230 ℃ 。
D、熔点是97.81 ℃,质软、导电,密度是0.97 g/cm3。
3.当干冰熔化或汽化时,发生变化的是( )
A、CO2分子内C—O键
B、CO2分子间作用力
C、CO2分子间作用力和C—O键
D、O—O键发生变化
B
干冰晶体结构模型
晶体类型 离子晶体 分子晶体
结构 构成粒子
作用形式
物理性质 熔、沸点
导电性
溶解性
阴阳离子
分子
离子键
分子间作用力
较高
较低
熔融或水溶液中能
固态或熔融时都不能
多数能溶
相似相溶
比较总结:
新课标人教版课件系列
《高中化学》
选修3
第1课时
《分子晶体》
3.2《分子晶体与原子晶体》
教学目标
1、使学生了解分子晶体的组成粒子、结构模型和结构特点及其性质的一般特点。
2、使学生了解晶体类型与性质的关系。
3、使学生理解分子间作用力和氢键对物质物理性质的影响。
4、知道一些常见的属于分子晶体的物质类别。
5、使学生主动参与科学探究,体验研究过程,激发他们的学习兴趣。
教学重点难点:
重点掌握分子晶体的结构特点和性质特点
难点是氢键的方向性和氢键对物体物理性质的影响
从三维空间结构认识晶胞的组成结构
教学方法建议:
运用模型和类比方法诱导分析归纳
雪花(H2O)
干冰(CO2)
金刚石(C)
水晶(SiO2)
食盐(NaCl)
KNO3晶体
干冰(固态CO2)融化的影片资料
范德瓦尔斯(J.D.van der Waals,1837~1923年)。荷兰科学家,1910年获得诺贝尔物理奖。1837年6月1日,生于莱顿。1873年,他获得莱顿大学的博士学位,在论文中他首次证明了分子体积以及分子间作用力的存在。这种把分子聚集在一起的作用力,叫做分子间作用力。
资料
思考讨论:
1、分子间作用力是化学键吗?
3、不同的分子间的作用力是不相同的,有什么规律呢?
2、分子间作用力对物质的哪些性质有影响?
分子间作用力越大
物质的熔、
沸点就越高
相对分子质量越大
注意:一般是对于组成和结构相似的物质。
四卤化碳、卤素单质的熔、沸点与相对分子质量的关系图
一些氢化物的沸点
一些氢化物的沸点
H2O
1、氢键是化学键吗?存在氢键的物质为何熔点、沸点相对较高?
3、如果水分子间无氢键存在,地球上将会是什么面貌?
2、热胀冷缩是一种物理现象,但水结冰时体积却膨胀了,即ρ冰<ρ水,你能解释吗?
思考讨论:
思考:
1、哪些物质能形成分子晶体呢?
实例:多数非金属单质(如卤素,氧气)
稀有气体(如氦,氖,氩)
氢化物(如氨,氯化氢)
多数非金属氧化物(如一氧化碳,二氧化硫)
酸(如硫酸,磷酸)
有机物(如蔗糖,酒精)
思考:
2、结构决定性质,根据分子晶体的结构,总结:
(1)分子晶体的熔沸点如何?
(2)分子晶体在固态、熔融状态下、水溶液中,能否导电?
①熔点和沸点较低
②导电性:固态及熔化时都不导电,溶于水时部分导电
物理性质小结:
3、分子晶体的溶解性如何?
稀有气体:单原子分子
离子晶体
离子键
原子
离子
分子
得 失电子
共价键
共用电子对
分子晶体
分子间作用力
熔、沸点较高
硬度较大
水溶液、熔融能导电
多数能溶与水
熔、沸点较低
固态、熔融不导电
相似相溶
2.下列属于分子晶体的是 ( B )
A、 CaO、NO、CO B、Cl2、H2O2、He
C、CO2、SO2、MgCl2 D、CH4、NH3、NaOH
1. 下列性质符合分子晶体的是( B )
A、熔点是1070 ℃,易溶于水,水溶液能导电。
B、熔点是10.31℃,液态不导电,水溶液能导电。
C、不能溶于水,熔点是1723 ℃ ,沸点是2230 ℃ 。
D、熔点是97.81 ℃,质软、导电,密度是0.97 g/cm3。
3.当干冰熔化或汽化时,发生变化的是( )
A、CO2分子内C—O键
B、CO2分子间作用力
C、CO2分子间作用力和C—O键
D、O—O键发生变化
B
干冰晶体结构模型
晶体类型 离子晶体 分子晶体
结构 构成粒子
作用形式
物理性质 熔、沸点
导电性
溶解性
阴阳离子
分子
离子键
分子间作用力
较高
较低
熔融或水溶液中能
固态或熔融时都不能
多数能溶
相似相溶
比较总结:
