高一化学《氧化剂和还原剂》复习课件
图片预览



文档简介
(共9张PPT)
氧化剂和还原剂
复习知识点
旧知回顾:氧化剂和还原剂
(一)氧化剂和还原剂
1、氧化剂:
(1)氧化剂是指 (填反应物或生成物)
(2)其特征是化合价 (填升高或降低);其本质是 (填得到或失去)电子
(3)氧化剂具有 (填氧化性或还原性)
2、还原剂:
(1)还原剂是指 (填反应物或生成物)
(2)其特征是化合价 (填升高或降低);其本质是 (填得到或失去)电子
(3)还原剂具有 (填氧化性或还原性)
反应物
降低
得到
反应物
氧化性
升高
失去
还原性
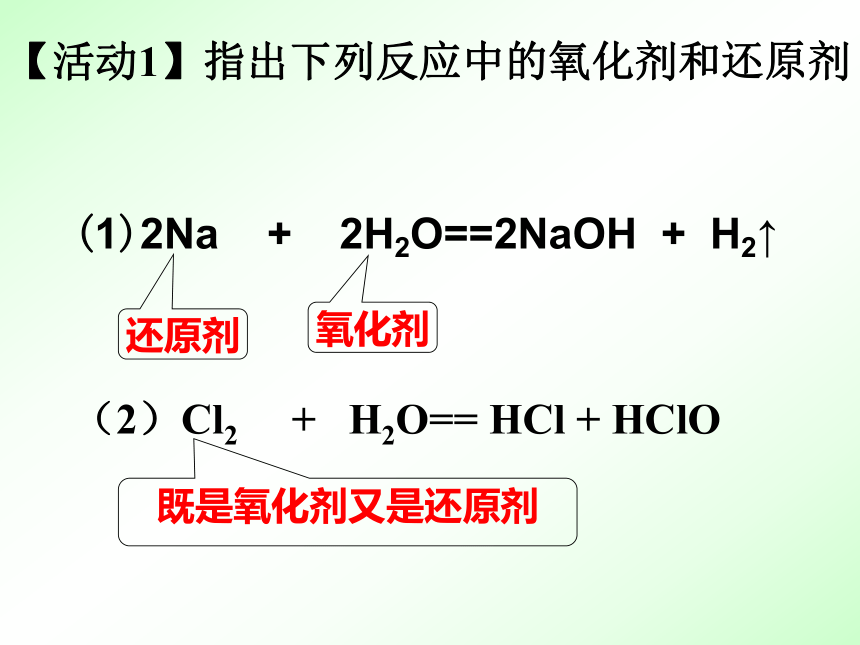
(1)2Na + 2H2O==2NaOH + H2↑
(2)Cl2 + H2O== HCl + HClO
【活动1】指出下列反应中的氧化剂和还原剂
氧化剂
还原剂
既是氧化剂又是还原剂
氧化剂 + 还原剂 还原产物 + 氧化产物
化合价降低 得电子 发生还原反应
化合价升高 失电子 发生氧化反应
氧化还原反应的规律
规律:还(剂)失 升 氧
氧(剂)得 降 还
(二)所含元素化合价与物质氧化性和还原性的关系
最高价时—
最低价时—
中间时—
同种元素
只有氧化性,只做氧化剂
只有还原性,只做还原剂
既有氧化性又有还原性
既可做氧化剂也可做还原剂
〖迁移·应用〗
(三)常见的氧化剂和还原剂
活泼金属单质
某些非金属单质
含有较低价态元素的氧化物和盐
活泼非金属单质
含有较高价态元素的含氧酸
含有较高价态元素的盐
(四)氧化性或还原性的相对强弱
例1根据下列反应判断FeCl3、Cl2、I2氧化性的强弱
①2FeCl2+Cl2=2FeCl3
② 2FeCl3+2HI=2FeCl2+2HCl+I2
氧化性由强到弱的顺序是 ( )
Cl2 > FeCl3
FeCl3 > I2
1.同一反应中氧化性和还原性的比较规律:
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
Cl2 > FeCl3 > I2
2. 根据元素金属性(或金属活动顺序表)或非金属性相对强弱进行判断
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
单质的还原性逐渐减弱,对应阳离子的氧化性逐渐增强
F O Cl Br I S
原子的氧化性逐渐减弱,对应阴离子的还原性逐渐增强
3.依据反应条件判断
温度,催化剂:不同氧化剂(或还原剂)与同种还原剂(或氧化剂)反应,条件要求越高,则其氧化性(或还原性)就越弱。如:
2KMnO4 + 16HCl = 2KCl + 5Cl2 ↑+ 8H2O
MnO2 + 4HCl = MnCl2 + 2H2O + Cl2 ↑
O2 + 4HCl === 2H2O + 2 Cl2 ↑
氧化性:KMnO4 MnO2 O2
> >
▲
催化剂
氧化剂和还原剂
复习知识点
旧知回顾:氧化剂和还原剂
(一)氧化剂和还原剂
1、氧化剂:
(1)氧化剂是指 (填反应物或生成物)
(2)其特征是化合价 (填升高或降低);其本质是 (填得到或失去)电子
(3)氧化剂具有 (填氧化性或还原性)
2、还原剂:
(1)还原剂是指 (填反应物或生成物)
(2)其特征是化合价 (填升高或降低);其本质是 (填得到或失去)电子
(3)还原剂具有 (填氧化性或还原性)
反应物
降低
得到
反应物
氧化性
升高
失去
还原性
(1)2Na + 2H2O==2NaOH + H2↑
(2)Cl2 + H2O== HCl + HClO
【活动1】指出下列反应中的氧化剂和还原剂
氧化剂
还原剂
既是氧化剂又是还原剂
氧化剂 + 还原剂 还原产物 + 氧化产物
化合价降低 得电子 发生还原反应
化合价升高 失电子 发生氧化反应
氧化还原反应的规律
规律:还(剂)失 升 氧
氧(剂)得 降 还
(二)所含元素化合价与物质氧化性和还原性的关系
最高价时—
最低价时—
中间时—
同种元素
只有氧化性,只做氧化剂
只有还原性,只做还原剂
既有氧化性又有还原性
既可做氧化剂也可做还原剂
〖迁移·应用〗
(三)常见的氧化剂和还原剂
活泼金属单质
某些非金属单质
含有较低价态元素的氧化物和盐
活泼非金属单质
含有较高价态元素的含氧酸
含有较高价态元素的盐
(四)氧化性或还原性的相对强弱
例1根据下列反应判断FeCl3、Cl2、I2氧化性的强弱
①2FeCl2+Cl2=2FeCl3
② 2FeCl3+2HI=2FeCl2+2HCl+I2
氧化性由强到弱的顺序是 ( )
Cl2 > FeCl3
FeCl3 > I2
1.同一反应中氧化性和还原性的比较规律:
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
Cl2 > FeCl3 > I2
2. 根据元素金属性(或金属活动顺序表)或非金属性相对强弱进行判断
K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt Au
单质的还原性逐渐减弱,对应阳离子的氧化性逐渐增强
F O Cl Br I S
原子的氧化性逐渐减弱,对应阴离子的还原性逐渐增强
3.依据反应条件判断
温度,催化剂:不同氧化剂(或还原剂)与同种还原剂(或氧化剂)反应,条件要求越高,则其氧化性(或还原性)就越弱。如:
2KMnO4 + 16HCl = 2KCl + 5Cl2 ↑+ 8H2O
MnO2 + 4HCl = MnCl2 + 2H2O + Cl2 ↑
O2 + 4HCl === 2H2O + 2 Cl2 ↑
氧化性:KMnO4 MnO2 O2
> >
▲
催化剂
