高一化学《碳的多样性》课件
图片预览





文档简介
(共22张PPT)
第三章
第一节 碳的多样性
溶洞中的 石花、石笋、钟乳
图中的钻石重约五十克拉价值高达五百万美元在一九三四年芝加哥世界博览会上被评为美国最完美的钻石。
世界上最大的钻石
——库利南一号
美丽的珊瑚
C60的结构
金刚石的结构
碳的同素异形体
石墨的结构
天然石墨
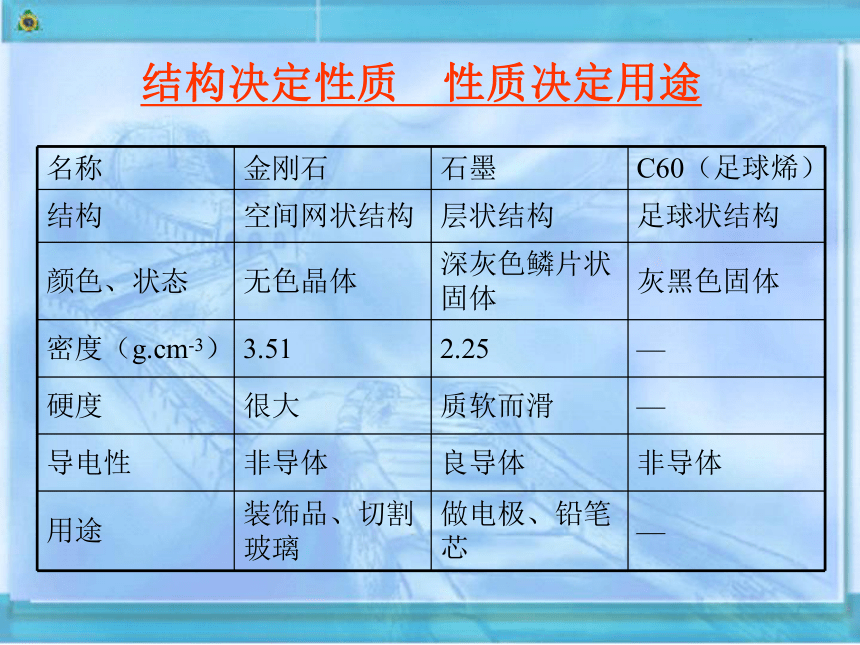
名称 金刚石 石墨 C60(足球烯)
结构 空间网状结构 层状结构 足球状结构
颜色、状态 无色晶体 深灰色鳞片状固体 灰黑色固体
密度(g.cm-3) 3.51 2.25 —
硬度 很大 质软而滑 —
导电性 非导体 良导体 非导体
用途 装饰品、切割玻璃 做电极、铅笔芯 —
结构决定性质 性质决定用途
一、碳单质的化学性质(还原剂)
C+O2===CO2(燃烧)
C+CO2===2CO(生产炼铁等时的还原剂)
2CuO+C===2Cu+CO2↑(还原CuO)
点燃
高温
强热
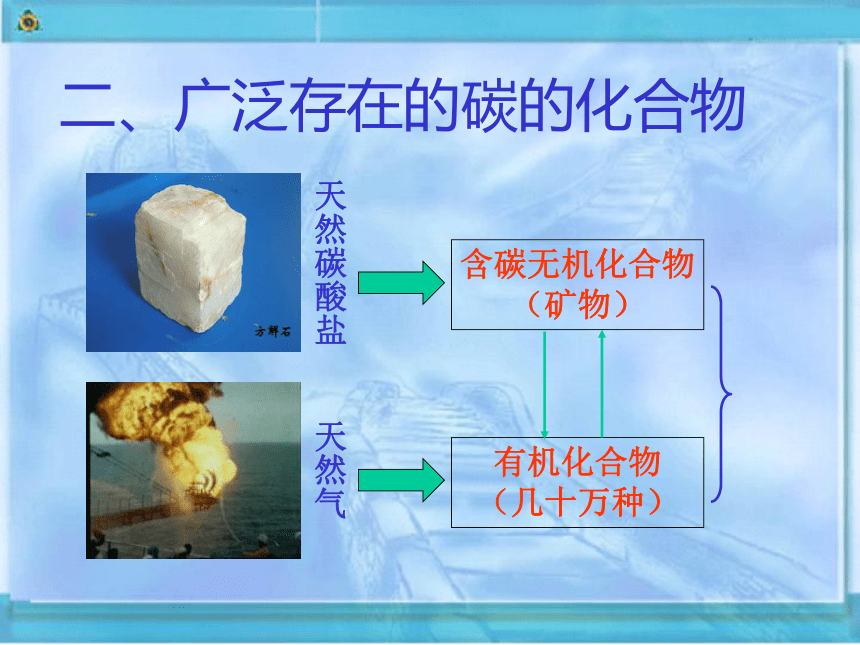
二、广泛存在的碳的化合物
天然气
天然碳酸盐
含碳无机化合物
(矿物)
有机化合物
(几十万种)
1、碳的氧化物(CO、CO2)
CO、CO2都是无色无味的气体,CO不溶于水,CO2微溶于水。CO剧毒,能与人体血液中的血红蛋白结合而使人中毒。
CO具有较强的还原性,是常见的还原剂;CO2不具有还原性,有弱氧化性,具有酸性氧化物的通性。
2、碳酸(H2CO3)
二元弱酸,具有酸的通性,不稳定,易分解
3、碳酸盐
Na2CO3与NaHCO3物理性质比较
名 称 碳酸钠 碳酸氢钠
俗 名
色态
水溶性
白色固体
纯碱(苏打)
小苏打
都易溶于水 但溶解度S碳酸钠>S碳酸氢钠
Na2CO3与NaHCO3的化学性质比较
实验内容 实验现象 结论
与H+反应
与NaOH
与Ca(OH)2
与CaCl 2
加热
产生气泡
CO32-+2H+= CO2↑ + H2O
HCO3-+H+= CO2↑ +H2O
无明显现象
Na2CO3不反应
HCO3-+OH-= CO32- +H2O
产生白色沉淀
CO32-+Ca2+= Ca CO3↓
Ca2+ +HCO3-+OH- =
Ca CO3 ↓ +H2O
Na2CO3产生白色沉淀
NaHCO3无现象
CO32-+Ca2+= Ca CO3↓
NaHCO3不反应
Na2CO3无现象
NaHCO3分解产生CO2
2NaHCO3===Na2CO3+CO2↑+H2O
△
Na2CO3不分解
2NaHCO3===Na2CO3+CO2↑+H2O
△
碳酸氢钠受热分解实验装置:
〖讨 论〗
1、如何鉴别已失去标签的Na2CO3溶液与
NaHCO3溶液 ?
2、如何除去Na2CO3中少量的NaHCO3?
3、如何除去NaHCO3中少量的Na2CO3?
加CaCl2溶液;加热
加适量NaOH溶液;加热
通入中量CO2
三、Na2CO3与NaHCO3的相互转变
⒈ Na2CO3转变成 NaHCO3
_____________________________
⒉ NaHCO3转变成Na2CO3
①______________________________
②_______________________________
Na2CO3+CO2+H2O = 2NaHCO3
2NaHCO3+NaOH = Na2CO3+H2O
2NaHCO3===Na2CO3+CO2↑+H2O
△
碳酸
加热;加碱
碳酸盐
碳酸氢盐
自然界中碳及其化合物间的转化
大气中的二氧化碳
绿色植物
海洋
光合作用
呼吸
动物
呼吸排泄
岩石
风化溶解
光合作用
森林草原
化石燃料
喷发
火山
燃烧
燃烧
动植物遗体演变
溶洞奇观
【活动·探究】
模拟“溶洞的形成”
实验方案及实验记录:
实验内容 实验现象 离子方程式
澄清石灰水
持续通入CO2
开始出现白色沉淀
CO2过量时沉淀溶解
澄清溶液
加热
出现白色沉淀
Ca2+ + 2OH- + CO2 =
Ca CO3↓+ H2O
Ca CO3 +CO2+ H2O =
Ca2+ + 2 H CO3-
Ca2+ + 2 H CO3- ==
Ca CO3 ↓ +CO2+ H2O
△
生产和生活中碳及其化合物间的转化
1、工业炼铁
2、木炭燃烧
C
CO2
CO
碳“三角”
概括·整合
作业:写出下列反应的化学方程式
C
CO2
Na2CO3
NaHCO3
CO
CaCO3
Ca(HCO3)2
注:不能重复
第三章
第一节 碳的多样性
溶洞中的 石花、石笋、钟乳
图中的钻石重约五十克拉价值高达五百万美元在一九三四年芝加哥世界博览会上被评为美国最完美的钻石。
世界上最大的钻石
——库利南一号
美丽的珊瑚
C60的结构
金刚石的结构
碳的同素异形体
石墨的结构
天然石墨
名称 金刚石 石墨 C60(足球烯)
结构 空间网状结构 层状结构 足球状结构
颜色、状态 无色晶体 深灰色鳞片状固体 灰黑色固体
密度(g.cm-3) 3.51 2.25 —
硬度 很大 质软而滑 —
导电性 非导体 良导体 非导体
用途 装饰品、切割玻璃 做电极、铅笔芯 —
结构决定性质 性质决定用途
一、碳单质的化学性质(还原剂)
C+O2===CO2(燃烧)
C+CO2===2CO(生产炼铁等时的还原剂)
2CuO+C===2Cu+CO2↑(还原CuO)
点燃
高温
强热
二、广泛存在的碳的化合物
天然气
天然碳酸盐
含碳无机化合物
(矿物)
有机化合物
(几十万种)
1、碳的氧化物(CO、CO2)
CO、CO2都是无色无味的气体,CO不溶于水,CO2微溶于水。CO剧毒,能与人体血液中的血红蛋白结合而使人中毒。
CO具有较强的还原性,是常见的还原剂;CO2不具有还原性,有弱氧化性,具有酸性氧化物的通性。
2、碳酸(H2CO3)
二元弱酸,具有酸的通性,不稳定,易分解
3、碳酸盐
Na2CO3与NaHCO3物理性质比较
名 称 碳酸钠 碳酸氢钠
俗 名
色态
水溶性
白色固体
纯碱(苏打)
小苏打
都易溶于水 但溶解度S碳酸钠>S碳酸氢钠
Na2CO3与NaHCO3的化学性质比较
实验内容 实验现象 结论
与H+反应
与NaOH
与Ca(OH)2
与CaCl 2
加热
产生气泡
CO32-+2H+= CO2↑ + H2O
HCO3-+H+= CO2↑ +H2O
无明显现象
Na2CO3不反应
HCO3-+OH-= CO32- +H2O
产生白色沉淀
CO32-+Ca2+= Ca CO3↓
Ca2+ +HCO3-+OH- =
Ca CO3 ↓ +H2O
Na2CO3产生白色沉淀
NaHCO3无现象
CO32-+Ca2+= Ca CO3↓
NaHCO3不反应
Na2CO3无现象
NaHCO3分解产生CO2
2NaHCO3===Na2CO3+CO2↑+H2O
△
Na2CO3不分解
2NaHCO3===Na2CO3+CO2↑+H2O
△
碳酸氢钠受热分解实验装置:
〖讨 论〗
1、如何鉴别已失去标签的Na2CO3溶液与
NaHCO3溶液 ?
2、如何除去Na2CO3中少量的NaHCO3?
3、如何除去NaHCO3中少量的Na2CO3?
加CaCl2溶液;加热
加适量NaOH溶液;加热
通入中量CO2
三、Na2CO3与NaHCO3的相互转变
⒈ Na2CO3转变成 NaHCO3
_____________________________
⒉ NaHCO3转变成Na2CO3
①______________________________
②_______________________________
Na2CO3+CO2+H2O = 2NaHCO3
2NaHCO3+NaOH = Na2CO3+H2O
2NaHCO3===Na2CO3+CO2↑+H2O
△
碳酸
加热;加碱
碳酸盐
碳酸氢盐
自然界中碳及其化合物间的转化
大气中的二氧化碳
绿色植物
海洋
光合作用
呼吸
动物
呼吸排泄
岩石
风化溶解
光合作用
森林草原
化石燃料
喷发
火山
燃烧
燃烧
动植物遗体演变
溶洞奇观
【活动·探究】
模拟“溶洞的形成”
实验方案及实验记录:
实验内容 实验现象 离子方程式
澄清石灰水
持续通入CO2
开始出现白色沉淀
CO2过量时沉淀溶解
澄清溶液
加热
出现白色沉淀
Ca2+ + 2OH- + CO2 =
Ca CO3↓+ H2O
Ca CO3 +CO2+ H2O =
Ca2+ + 2 H CO3-
Ca2+ + 2 H CO3- ==
Ca CO3 ↓ +CO2+ H2O
△
生产和生活中碳及其化合物间的转化
1、工业炼铁
2、木炭燃烧
C
CO2
CO
碳“三角”
概括·整合
作业:写出下列反应的化学方程式
C
CO2
Na2CO3
NaHCO3
CO
CaCO3
Ca(HCO3)2
注:不能重复
