高中化学苏教版(2019)选择性必修1专题1 第二单元 第3课时 燃料电池(69张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1专题1 第二单元 第3课时 燃料电池(69张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-03 20:06:00 | ||
图片预览









文档简介
(共69张PPT)
第3课时
燃料电池
1.证据推理和模型认知
能基于原电池装置的认知模型分析陌生的化学电池,设计简单的燃料电池,实现能量转化。
2.科学态度与社会责任
能分析、评价实际生产和生活中的能量转化现象,并能从能源利用率、环境保护等角度综合考虑。
核心素养发展目标
课时对点练
内容索引
一、氢氧燃料电池
二、形形色色的燃料电池
三、制作简单的燃料电池
一、氢氧燃料电池
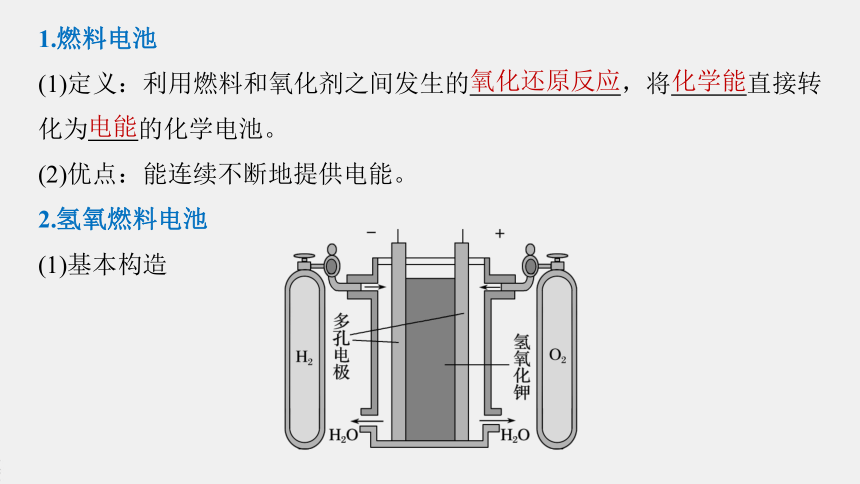
1.燃料电池
(1)定义:利用燃料和氧化剂之间发生的 ,将 直接转化为 的化学电池。
(2)优点:能连续不断地提供电能。
2.氢氧燃料电池
(1)基本构造
氧化还原反应
化学能
电能
(2)工作原理
氢氧燃料电池用多孔金属作电极,不断充入的氢气和氧气,分别在两极发生 反应和 反应。其反应表示如下:
?
酸性电解质(H2SO4)
碱性电解质(KOH)
负极反应
2H2-4e-===4H+
________________________
正极反应
O2+4e-+4H+===2H2O
_______________________
总反应
_________________
氧化
还原
2H2-4e-+4OH-===4H2O
O2+4e-+2H2O===4OH-
2H2+O2===2H2O
(1)燃料电池工作时负极材料一定发生氧化反应( )
(2)氢氧燃料电池是清洁的化学电源( )
(3)在书写燃料电池的电极反应式时,无需考虑电解质溶液的酸碱性( )
(4)氢氧燃料电池中,当转移2
mol电子时消耗2
mol氢气( )
正误判断
×
√
×
×
1.氢氧燃料电池供电时,燃料氢气会燃烧吗?
深度思考
提示 不会。氢氧燃料电池是氢气与氧气分别在两个电极上反应,将化学能直接转化为电能,不会燃烧。
2.以氢氧燃料电池为例,说明燃料电池的特点。
提示 ①连续地将燃料和氧化剂的化学能直接转换成电能。
②电极材料本身不参与氧化还原反应。
③工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排出。
④能量转化率高(>80%),排放废物少。
1.氢氧燃料电池已用于航天飞机,它以铂作电极,以KOH溶液作电解质溶液,下列叙述不正确的是
A.H2在负极发生氧化反应
B.燃料电池的化学能可以全部转化为电能
C.产物为无污染的水,属于环境友好电池
D.供电时的总反应:2H2+O2===2H2O
应用体验
√
解析 由电极反应式可知,通入氢气的一极为电池的负极,发生氧化反应,A项正确;
氢氧燃料电池是将化学能转化为电能的装置,还会伴有热能等能量的释放,能量转化率不会达100%,B项错误;
氢氧燃料电池产物是水,对环境无污染,且能量转化率高,C项正确;
电池总反应与氢气在氧气中燃烧的化学方程式一致,供电时的总反应为2H2+O2===2H2O,D项正确。
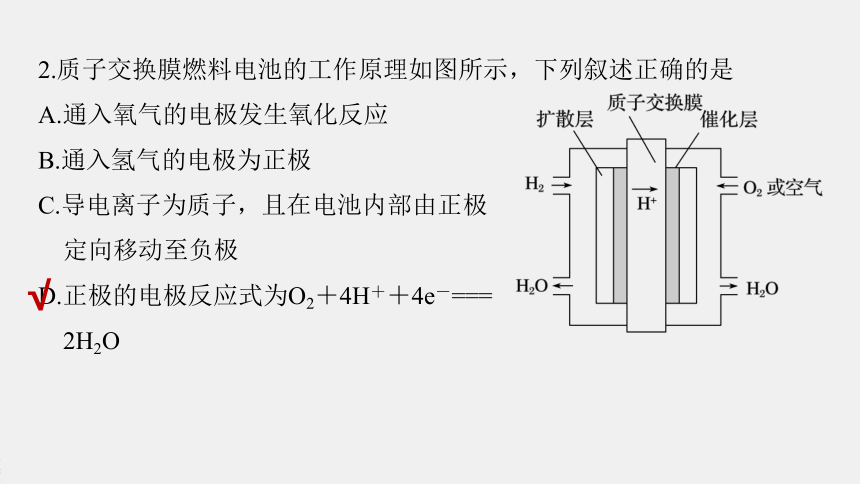
2.质子交换膜燃料电池的工作原理如图所示,下列叙述正确的是
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.导电离子为质子,且在电池内部由正极
定向移动至负极
D.正极的电极反应式为O2+4H++4e-===
2H2O
√
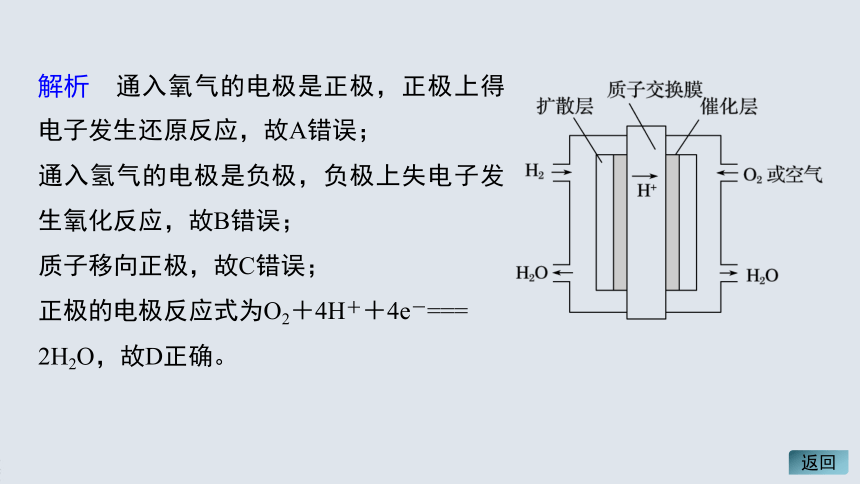
解析 通入氧气的电极是正极,正极上得电子发生还原反应,故A错误;
通入氢气的电极是负极,负极上失电子发生氧化反应,故B错误;
质子移向正极,故C错误;
正极的电极反应式为O2+4H++4e-===
2H2O,故D正确。
返回
二、形形色色的燃料电池
1.能量转换
所有的燃烧均为放热反应,若能量以电的形式向外释放,则形成燃料电池,所以燃料电池的总化学方程式类似燃烧的总化学方程式,条件不同。
理论上来说,所有的燃烧反应均可设计成燃料电池,所以燃料电池的燃料除氢气外,还有烃、肼、甲醇、氨、煤气等气体或液体,且能量转化率超高。
2.燃料电池电极反应式的书写方法
负极为燃料失电子,发生氧化反应;
正极为O2得电子,发生还原反应。
如CH4碱性(KOH溶液)燃料电池负极反应式的书写方法:
第一步 确定生成物
[练一练]
写出下列燃料电池的电极反应式和总反应式。
(1)酸性条件下的甲烷燃料电池
总反应式:_______________________;
正极反应式:_______________________;
负极反应式:_____________________________。
(2)碱性条件下的甲烷燃料电池
总反应式:_______________________________;
正极反应式:_________________________;
负极反应式:_______________________________。
CH4+2O2===CO2+2H2O
2O2+8H++8e-===4H2O
CH4-8e-+2H2O===CO2+8H+
2O2+4H2O+8e-===8OH-
(3)碱性条件下的甲醇(CH3OH)燃料电池
总反应式:____________________________________;
正极反应式:___________________________;
负极反应式:_______________________________________。
3O2+6H2O+12e-===12OH-
(1)甲烷燃料电池中,通入氧气的一极为负极( )
(2)燃料电池中发生的化学反应可以不是氧化还原反应( )
(3)肼(N2H4)、氨不能作为燃料电池的燃料,因为其燃烧会产生污染性气体
( )
(4)应用燃料电池的发电站,具有能量转换率高、废弃物排放少等优点
( )
正误判断
×
×
×
√
1.燃料电池的电池反应式和燃料燃烧的化学方程式一定相同吗?举例说明。
深度思考
提示 不一定。甲烷燃料电池在碱性条件下的电池反应式与燃烧的化学方程式不同,而在酸性条件下的电池反应式与燃烧的化学方程式相同。
2.燃料电池主要有酸性燃料电池、碱性燃料电池、熔融盐燃料电池及固体氧化物燃料电池(传导O2-)四种,正极参加反应的均为氧气,四种情况下正极的电极反应式有什么不同?
提示 ①酸性燃料电池:O2+4H++4e-===2H2O;
②碱性燃料电池:O2+2H2O+4e-===4OH-;
③熔融盐燃料电池:O2+2CO2+4e-===2CO
;
④固体氧化物燃料电池:O2+4e-===2O2-。
1.一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是
应用体验
√
解析 A项,由化合价变化可知,每消耗1
mol
CH4转移6
mol电子,错误;
2.如图为肼燃料电池示意图,请写出正、负极的电极反应式及总反应式。
答案 负极:N2H4-4e-+4OH-===4H2O+N2
正极:O2+4e-+2H2O===4OH-
总反应式:N2H4+O2===N2+2H2O
常见燃料电池
(1)H2、CH4、N2H4、CH3OH、NH3、煤气等均可作为燃料电池的燃料。
(2)电解质可以是酸(如H2SO4)、碱(如KOH)也可以是熔融盐(如Li2CO3-Na2CO3混合物)。
(3)燃料电池电极反应式的书写与电解质溶液有密切关系,酸性溶液中电极反应式不能出现OH-,碱性溶液中电极反应式不能出现H+。
归纳总结
返回
三、制作简单的燃料电池
1.设计思路
将用学生电源电解稀硫酸得到的氢气(H2)和氧气(O2)在两个石墨电极上反应,使化学能转化为电能。
2.装置图
(1)连接时钟时,如何判断燃料电池的正、负极?
深度思考
提示 接通学生电源,两端产生氢气和氧气的体积比为2∶1,由于氢气的体积大,玻璃导管内的液柱先溢出,作燃料电池的负极。
(2)什么现象可以证明处于不同电极的氢气和氧气发生了反应?
提示 时钟的指针发生了偏转。
(3)在制备氢气和氧气时,用蒸馏水代替6
mol·L-1稀硫酸行吗?KOH溶液呢?
提示 不行。蒸馏水导电能力弱,可以加入KOH溶液以增强导电性,故KOH溶液可以代替6
mol·L-1稀硫酸。
1.下列关于氢氧燃料电池说法正确的是
A.正极发生氧化反应,负极发生还原反应
B.若电解质溶液为H2SO4溶液,硫酸根离子移向正极
C.若电解质溶液为KOH溶液,随着反应的进行,溶液的pH不变
D.氢氧燃料电池是一种绿色电池,未来有很大的发展前景
应用体验
√
2.将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是
A.上述燃料电池的负极反应物是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经
过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-
===2CO2↑+3H2O
D.以KOH溶液作为电解质溶液,甲烷燃料电池的正极反应为O2+2H2O
+4e-===4OH-
√
解析 A项,燃料电池中,燃料作负极,负极反应物可以是氢气、甲烷、乙醇等物质,正确;
B项,航天飞行器中氢氧燃料电池的产物是水,经过处理之后可供宇航员使用,正确;
C项,乙醇燃料电池的电解质为KOH时,生成的二氧化碳会和其反应生成碳酸盐,负极反应:C2H5OH-12e-+16OH-===2CO +11H2O,错误;
D项,燃料电池中正极上氧气得电子,在碱性环境下,正极反应式为O2+2H2O+4e-===4OH-,正确。
返回
课
时
对
点
练
题组一 酸性燃料电池
1.以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示。下列说法错误的是
对点训练
A.b电极为负极,发生氧化反应
B.a电极发生的反应为N2+8H++6e-===
2NH
C.A溶液中所含溶质为NH4Cl
D.当反应消耗1
mol
N2时,则消耗的H2为
67.2
L
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
解析 A项,此电池总反应式是N2+3H2+2HCl===2NH4Cl,氢气中的氢元素的化合价升高,根据原电池的工作原理,负极失去电子,化合价升高,因此b极为负极,发生氧化反应,正确;
B项,环境是酸性环境,因此有N2+8H++6e-===2NH
,正确;
C项,根据选项A中总反应式知,分离出的A为NH4Cl,正确;
D项,题目没有说明是否是标准状况,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2.氢氧燃料电池的反应原理如图所示。下列有关氢氧燃料电池的说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.该电池中电极a是负极
B.该电池工作时化学能转化为电能
C.该电池的总反应为2H2+O2===2H2O
D.外电路中电流由电极a通过导线流向电极b
√
解析 通入H2的一极为负极,所以电极a为负极,A项正确;
燃料电池属于原电池,是将化学能转化为电能的装置,B项正确;
该电池中,负极的电极反应式为2H2-4e-===4H+,正极的电极反应式为O2+4H++4e-===2H2O,正、负极电极反应式相加得电池总反应:2H2+O2===2H2O,C项正确;
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
通入氢气的电极为负极,通入氧气的电极为正极,电流从电极b沿导线流向电极a,D项错误。
3.环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.对电极是正极
B.工作电极上发生的电极反应为NO2+2H+-2e-===NO+H2O
C.传感器工作时,H+由工作电极移向对电极
D.对电极的材料可能为活泼金属锌
√
1
2
3
4
5
6
7
8
9
10
11
13
14
15
解析 工作电极是NO2变为NO,化合价降低,是原电池的正极,对电极为负极,故A错误;
工作电极上发生的电极反应为NO2+2H++2e-===NO+H2O,故B错误;
传感器工作时,H+由对电极移向工作电极,故C错误;
对电极为负极,材料可能为活泼金属锌,故D正确。
16
12
题组二 质子交换膜燃料电池
4.如图是甲醇燃料电池的结构示意图,甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2===2CO2+4H2O。下列说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为O2+2H2O+4e-===4OH-
C.负极反应式为CH3OH+H2O-6e-===
CO2
+6H+
D.该电池提供1
mol
e-,消耗氧气0.25
mol
√
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
解析 负极反应式为2CH3OH-12e-+2H2O===2CO2+12H+,正极反应式为3O2+12e-+12H+===6H2O;
根据电子流向,可以判断a处通甲醇,b处通O2;
12
当电池提供
1
mol电子时,消耗O2为1×
mol=0.25
mol。
5.以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.N极为电源负极,联氨从c口通入
B.负极上每消耗1
mol
N2H4,转移6
mol电子
C.正极的电极反应式为O2+2H2O+4e-===
4OH-
D.可将联氨改进为引火性低、稳定性好的N2H4·H2O
√
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
解析 由图中氢离子移动方向可知,电极N为正极,氧气在正极上发生还原反应,电极反应式为O2+4H++4e-===2H2O,则氧气从c口通入,A、C项错误;
联氨在负极上发生氧化反应,电极反应式为N2H4-4e-===N2↑+4H+,每消耗1
mol
N2H4可转移4
mol电子,B项错误;
12
将联氨改进为引火性低、稳定性好的N2H4·H2O,则电池的安全性会更高,D项正确。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
6.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,下列说法不正确的是
16
A.电流由O2所在的铂电极经外电路流向另一电极
B.O2所在的铂电极处发生还原反应
C.该电池的负极反应式为CH3CH2OH+3H2O-12e-
===2CO2↑+12H+
D.微处理器通过检测电流大小而计算出被测气体
中酒精的含量
12
√
1
2
3
4
5
6
7
8
9
10
11
13
14
15
解析 乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上氧气得电子发生还原反应,电流由正极流向负极,即从O2所在的铂电极经外电路流向另一电极,故A、B项正确;
16
12
由装置图可知酒精在负极被氧气氧化生成醋酸:
CH3CH2OH-4e-+H2O===4H++CH3COOH,故C项错误;
微处理器通过检测电流大小可以得出电子转移的物质的量,根据电极反应式可以计算出被测气体中酒精的含量,故D项正确。
题组三 碱性燃料电池
7.将两个铂电极放置在KOH溶液中,然后分别向两极通入CO和O2,即可产生电流,称为燃料电池,下列叙述正确的是
①通入CO的电极为正极;
②正极的电极反应式是O2+2H2O+4e-===4OH-;
③通入CO的电极反应式是2CO+O2-4e-===2CO2;
④负极的电极反应式是CO+4OH--2e-===CO
+2H2O;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动
A.①③⑤
B.②④⑥
C.④⑤⑥
D.①②③
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
√
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
解析 据题意知,发生的反应为2CO+O2===2CO2,反应产生的CO2处于KOH溶液中,又会转化为CO
,④正确,③错误;
O2得e-被还原,在正极反应,①错误,②正确;
阳离子向正极移动,阴离子向负极移动,⑤错误,⑥正确。
12
8.液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.b电极发生氧化反应
B.a电极为该电池的正极
C.放电时,电流从a电极经过负载流向b电极
D.a电极的电极反应式:N2H4+4OH--4e-
===N2↑+4H2O
√
解析 该燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为N2H4+4OH--4e-===N2↑+4H2O,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-===4OH-,电池总反应为N2H4+
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
O2===N2+2H2O,结合离子的移动方向、电流的方向分析解答。该燃料电池中,通入氧化剂空气的b电极为正极,正极上氧气得电子发生还原反应,故A项错误;
该燃料电池中,通入燃料的电极为负极,即a电极为负极,故B项错误;
放电时,电流从b电极经过负载流向a电极,故C项错误;
通入燃料的电极为负极,负极上燃料失电
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
子发生氧化反应,在碱性条件下,电极反应式为N2H4+4OH--4e-===N2↑+4H2O,故D项正确。
题组四 熔融盐(或固体氧化物)燃料电池
9.据报道,美国一个海军航空站安装了一台250
kW的MCFC型燃料电池。该电池可同时供应电和水蒸气,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~700
℃。已知该电池的总反应为2H2+O2===2H2O,负极反应为H2+CO
-2e-===H2O+CO2。下列推断正确的是
A.正极反应为4OH--4e-===O2+2H2O
B.放电时,CO
向负极移动
C.电池供应1
mol水蒸气,转移电子的物质的量为4
mol
D.通入O2的一极为正极,发生氧化反应
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
√
解析 该电池的正极反应为O2+4e-+2CO2===2CO
,A项错误;
原电池工作时,阴离子向负极移动,B项正确;
电池提供1
mol水蒸气时,转移电子的物质的量为2
mol,C项错误;
通入O2的一极为正极,发生还原反应,D项错误。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
10.固体氧化物燃料电池是由美国西屋公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示。其中多孔电极a、b均不参与电极反应。下列判断正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.有O2放电的电极a为电池的负极
B.有H2放电的电极b为电池的正极
C.电极a对应的电极反应式:O2+2H2O+
4e-===4OH-
D.该电池的总反应:2H2+O2
2H2O
√
解析 根据该电池的工作原理图可知,被氧化的是H2,2H2-4e-+2O2-===2H2O,电极b为原电池的负极;被还原的是O2,O2+4e-===2O2-,电极a为原电池的正极;
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
该电池的总反应为2H2+O2
2H2O。
11.以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。下列说法错误的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.以甲烷为燃料,其成本大大低于以氢气为
燃料的传统燃料电池
B.A极为电池正极,发生还原反应
C.B极的电极反应式为CH4+4O2--8e-===
CO2+2H2O
D.该电池的总反应为CH4+2O2 CO2+2H2O
√
解析 由于氢气难以大规模制备,因此以甲烷为燃料,其成本大大低于以氢气为燃料的传统燃料电池,A项正确;
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
由阴离子移动方向可知B极为负极,甲烷被
氧化生成二氧化碳和水,电极反应式为CH4
+4O2--8e-===CO2+2H2O,A极是正极,氧气得电子被还原,电极反应式为O2+4e-===2O2-,B、C项正确;
电池总反应为CH4+2O2===CO2+2H2O,不需要点燃,D项错误。
题组五 金属—空气电池
12.锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,总反应为2Zn+O2+4OH-+2H2O===2Zn(OH) 。下列说法正确的是
A.放电时,电解质溶液中K+向负极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为Zn+4OH--2e-===Zn(OH)
D.放电时,电路中通过2
mol电子,消耗氧气22.4
L(标准状况)
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
√
解析 A错,放电时溶液中的阳离子向正极移动;
B错,充电时的总反应为放电时反应的逆过程:2Zn(OH) ===2Zn+O2↑+4OH-+2H2O,c(OH-)逐渐增大;
C对,放电时负极失电子发生氧化反应,由放电时的总反应可知,负极反应为Zn+4OH--2e-===Zn(OH) ;
D错,由放电时的总反应可知,电路中通过2
mol电子时,消耗0.5
mol
O2,其体积为11.2
L(标准状况)。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
13.近年来AIST正在研制一种高容量、低成本的锂—铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-,下列说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,负极的电极反应式为Cu2O+H2O+2e-
===2Cu+2OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,铜相当于催化剂
√
解析 放电时,锂是负极,发生失电子的氧化反应;
在电池内部Li+(阳离子)透过固体电解质向正极(铜电极)移动;
由题意可知,通空气时铜被腐蚀,表面产生Cu2O,放电时Cu2O又转化成铜,整个反应过程中,铜相当于催化剂。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
1
2
3
4
5
6
7
8
9
10
11
13
14
15
14.环保、安全的铝-空气电池的工作原理如图所示,回答下列问题:
16
12
(1)正极反应为________________________。
O2+2H2O+4e-===4OH-
1
2
3
4
5
6
7
8
9
10
11
13
14
15
(2)电池工作过程中,电解质溶液的pH如何变化?
16
12
(3)NaCl溶液的作用是什么?
答案 总反应方程式为4Al+3O2+6H2O===4Al(OH)3,溶液中的溶质仍为NaCl,故电解质溶液的pH基本不变
答案 NaCl溶液的作用是增强溶液的导电性
1
2
3
4
5
6
7
8
9
10
11
13
14
15
(4)当消耗标况下3.36
L
O2时,消耗铝电极的质量为____
g。
16
12
5.4
解析 根据电子守恒,消耗3.36
L(标况下)O2,即0.15
mol
O2,转移0.6
mol
e-,故消耗0.2
mol
Al,质量为5.4
g。
15.氨气是一种富氢燃料,可以直接用于燃料电池,如图是供氨水式燃料电池工作原理:
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
综合强化
(1)氨气燃料电池的电解质溶液最好选择_____(填“酸性”“碱性”或“中性”)溶液。
碱性
解析 氨气是碱性气体,所以电解液最好选择碱性溶液。
(2)空气在进入电池装置前需要通过过滤器除去的气体是_____。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
CO2
解析 空气中的CO2能和氨水反应,所以滤去的气体是CO2。
(3)氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的总反应式是__________________________,正极的电极反应是_____________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
4NH3
+
3O2===2N2
+
6H2O
3O2+12e-+6H2O===12OH-(或O2
+4e-+2H2O===4OH-)
解析 正极发生还原反应,碱性环境下,电极反应式为O2+4e-+2H2O===4OH-。
16.(1)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如图:
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
①质子的流动方向为_________(填“从A到B”或“从B到A”)。
从A到B
解析 根据图示,A为燃料电池的负极,B为燃料电池的正极,在原电池电解液中,正电荷由负极向正极移动,即从A到B;
②负极的电极反应式为_____________________________。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
解析 负极二氧化硫被氧化为硫酸根离子,电极反应式为SO2-2e-+2H2O===SO
+4H+。
(2)NH3—O2燃料电池的结构如图所示:
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
①a极为电池的____(填“正”或“负”)极。
负
解析 a极通入氨气,是负极,b极通入氧气,是正极;
②当生成1
mol
N2时
,电路中流过电子的物质的量为_______。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
6
mol
解析 氨气中N的化合价由-3变成0,当生成1
mol
N2时,转移电子的物质的量为6
mol。
返回
本课结束
第3课时
燃料电池
1.证据推理和模型认知
能基于原电池装置的认知模型分析陌生的化学电池,设计简单的燃料电池,实现能量转化。
2.科学态度与社会责任
能分析、评价实际生产和生活中的能量转化现象,并能从能源利用率、环境保护等角度综合考虑。
核心素养发展目标
课时对点练
内容索引
一、氢氧燃料电池
二、形形色色的燃料电池
三、制作简单的燃料电池
一、氢氧燃料电池
1.燃料电池
(1)定义:利用燃料和氧化剂之间发生的 ,将 直接转化为 的化学电池。
(2)优点:能连续不断地提供电能。
2.氢氧燃料电池
(1)基本构造
氧化还原反应
化学能
电能
(2)工作原理
氢氧燃料电池用多孔金属作电极,不断充入的氢气和氧气,分别在两极发生 反应和 反应。其反应表示如下:
?
酸性电解质(H2SO4)
碱性电解质(KOH)
负极反应
2H2-4e-===4H+
________________________
正极反应
O2+4e-+4H+===2H2O
_______________________
总反应
_________________
氧化
还原
2H2-4e-+4OH-===4H2O
O2+4e-+2H2O===4OH-
2H2+O2===2H2O
(1)燃料电池工作时负极材料一定发生氧化反应( )
(2)氢氧燃料电池是清洁的化学电源( )
(3)在书写燃料电池的电极反应式时,无需考虑电解质溶液的酸碱性( )
(4)氢氧燃料电池中,当转移2
mol电子时消耗2
mol氢气( )
正误判断
×
√
×
×
1.氢氧燃料电池供电时,燃料氢气会燃烧吗?
深度思考
提示 不会。氢氧燃料电池是氢气与氧气分别在两个电极上反应,将化学能直接转化为电能,不会燃烧。
2.以氢氧燃料电池为例,说明燃料电池的特点。
提示 ①连续地将燃料和氧化剂的化学能直接转换成电能。
②电极材料本身不参与氧化还原反应。
③工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排出。
④能量转化率高(>80%),排放废物少。
1.氢氧燃料电池已用于航天飞机,它以铂作电极,以KOH溶液作电解质溶液,下列叙述不正确的是
A.H2在负极发生氧化反应
B.燃料电池的化学能可以全部转化为电能
C.产物为无污染的水,属于环境友好电池
D.供电时的总反应:2H2+O2===2H2O
应用体验
√
解析 由电极反应式可知,通入氢气的一极为电池的负极,发生氧化反应,A项正确;
氢氧燃料电池是将化学能转化为电能的装置,还会伴有热能等能量的释放,能量转化率不会达100%,B项错误;
氢氧燃料电池产物是水,对环境无污染,且能量转化率高,C项正确;
电池总反应与氢气在氧气中燃烧的化学方程式一致,供电时的总反应为2H2+O2===2H2O,D项正确。
2.质子交换膜燃料电池的工作原理如图所示,下列叙述正确的是
A.通入氧气的电极发生氧化反应
B.通入氢气的电极为正极
C.导电离子为质子,且在电池内部由正极
定向移动至负极
D.正极的电极反应式为O2+4H++4e-===
2H2O
√
解析 通入氧气的电极是正极,正极上得电子发生还原反应,故A错误;
通入氢气的电极是负极,负极上失电子发生氧化反应,故B错误;
质子移向正极,故C错误;
正极的电极反应式为O2+4H++4e-===
2H2O,故D正确。
返回
二、形形色色的燃料电池
1.能量转换
所有的燃烧均为放热反应,若能量以电的形式向外释放,则形成燃料电池,所以燃料电池的总化学方程式类似燃烧的总化学方程式,条件不同。
理论上来说,所有的燃烧反应均可设计成燃料电池,所以燃料电池的燃料除氢气外,还有烃、肼、甲醇、氨、煤气等气体或液体,且能量转化率超高。
2.燃料电池电极反应式的书写方法
负极为燃料失电子,发生氧化反应;
正极为O2得电子,发生还原反应。
如CH4碱性(KOH溶液)燃料电池负极反应式的书写方法:
第一步 确定生成物
[练一练]
写出下列燃料电池的电极反应式和总反应式。
(1)酸性条件下的甲烷燃料电池
总反应式:_______________________;
正极反应式:_______________________;
负极反应式:_____________________________。
(2)碱性条件下的甲烷燃料电池
总反应式:_______________________________;
正极反应式:_________________________;
负极反应式:_______________________________。
CH4+2O2===CO2+2H2O
2O2+8H++8e-===4H2O
CH4-8e-+2H2O===CO2+8H+
2O2+4H2O+8e-===8OH-
(3)碱性条件下的甲醇(CH3OH)燃料电池
总反应式:____________________________________;
正极反应式:___________________________;
负极反应式:_______________________________________。
3O2+6H2O+12e-===12OH-
(1)甲烷燃料电池中,通入氧气的一极为负极( )
(2)燃料电池中发生的化学反应可以不是氧化还原反应( )
(3)肼(N2H4)、氨不能作为燃料电池的燃料,因为其燃烧会产生污染性气体
( )
(4)应用燃料电池的发电站,具有能量转换率高、废弃物排放少等优点
( )
正误判断
×
×
×
√
1.燃料电池的电池反应式和燃料燃烧的化学方程式一定相同吗?举例说明。
深度思考
提示 不一定。甲烷燃料电池在碱性条件下的电池反应式与燃烧的化学方程式不同,而在酸性条件下的电池反应式与燃烧的化学方程式相同。
2.燃料电池主要有酸性燃料电池、碱性燃料电池、熔融盐燃料电池及固体氧化物燃料电池(传导O2-)四种,正极参加反应的均为氧气,四种情况下正极的电极反应式有什么不同?
提示 ①酸性燃料电池:O2+4H++4e-===2H2O;
②碱性燃料电池:O2+2H2O+4e-===4OH-;
③熔融盐燃料电池:O2+2CO2+4e-===2CO
;
④固体氧化物燃料电池:O2+4e-===2O2-。
1.一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是
应用体验
√
解析 A项,由化合价变化可知,每消耗1
mol
CH4转移6
mol电子,错误;
2.如图为肼燃料电池示意图,请写出正、负极的电极反应式及总反应式。
答案 负极:N2H4-4e-+4OH-===4H2O+N2
正极:O2+4e-+2H2O===4OH-
总反应式:N2H4+O2===N2+2H2O
常见燃料电池
(1)H2、CH4、N2H4、CH3OH、NH3、煤气等均可作为燃料电池的燃料。
(2)电解质可以是酸(如H2SO4)、碱(如KOH)也可以是熔融盐(如Li2CO3-Na2CO3混合物)。
(3)燃料电池电极反应式的书写与电解质溶液有密切关系,酸性溶液中电极反应式不能出现OH-,碱性溶液中电极反应式不能出现H+。
归纳总结
返回
三、制作简单的燃料电池
1.设计思路
将用学生电源电解稀硫酸得到的氢气(H2)和氧气(O2)在两个石墨电极上反应,使化学能转化为电能。
2.装置图
(1)连接时钟时,如何判断燃料电池的正、负极?
深度思考
提示 接通学生电源,两端产生氢气和氧气的体积比为2∶1,由于氢气的体积大,玻璃导管内的液柱先溢出,作燃料电池的负极。
(2)什么现象可以证明处于不同电极的氢气和氧气发生了反应?
提示 时钟的指针发生了偏转。
(3)在制备氢气和氧气时,用蒸馏水代替6
mol·L-1稀硫酸行吗?KOH溶液呢?
提示 不行。蒸馏水导电能力弱,可以加入KOH溶液以增强导电性,故KOH溶液可以代替6
mol·L-1稀硫酸。
1.下列关于氢氧燃料电池说法正确的是
A.正极发生氧化反应,负极发生还原反应
B.若电解质溶液为H2SO4溶液,硫酸根离子移向正极
C.若电解质溶液为KOH溶液,随着反应的进行,溶液的pH不变
D.氢氧燃料电池是一种绿色电池,未来有很大的发展前景
应用体验
√
2.将氢气、甲烷、乙醇等物质在氧气中燃烧时的化学能直接转化为电能的装置叫燃料电池。燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。下列有关燃料电池的说法错误的是
A.上述燃料电池的负极反应物是氢气、甲烷、乙醇等物质
B.氢氧燃料电池常用于航天飞行器,原因之一是该电池的产物为水,经
过处理之后可供宇航员使用
C.乙醇燃料电池的电解质常用KOH,该电池的负极反应为C2H5OH-12e-
===2CO2↑+3H2O
D.以KOH溶液作为电解质溶液,甲烷燃料电池的正极反应为O2+2H2O
+4e-===4OH-
√
解析 A项,燃料电池中,燃料作负极,负极反应物可以是氢气、甲烷、乙醇等物质,正确;
B项,航天飞行器中氢氧燃料电池的产物是水,经过处理之后可供宇航员使用,正确;
C项,乙醇燃料电池的电解质为KOH时,生成的二氧化碳会和其反应生成碳酸盐,负极反应:C2H5OH-12e-+16OH-===2CO +11H2O,错误;
D项,燃料电池中正极上氧气得电子,在碱性环境下,正极反应式为O2+2H2O+4e-===4OH-,正确。
返回
课
时
对
点
练
题组一 酸性燃料电池
1.以N2和H2为反应物、溶有A的稀盐酸为电解质溶液,可制成能固氮的新型燃料电池,原理如图所示。下列说法错误的是
对点训练
A.b电极为负极,发生氧化反应
B.a电极发生的反应为N2+8H++6e-===
2NH
C.A溶液中所含溶质为NH4Cl
D.当反应消耗1
mol
N2时,则消耗的H2为
67.2
L
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
解析 A项,此电池总反应式是N2+3H2+2HCl===2NH4Cl,氢气中的氢元素的化合价升高,根据原电池的工作原理,负极失去电子,化合价升高,因此b极为负极,发生氧化反应,正确;
B项,环境是酸性环境,因此有N2+8H++6e-===2NH
,正确;
C项,根据选项A中总反应式知,分离出的A为NH4Cl,正确;
D项,题目没有说明是否是标准状况,错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
2.氢氧燃料电池的反应原理如图所示。下列有关氢氧燃料电池的说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.该电池中电极a是负极
B.该电池工作时化学能转化为电能
C.该电池的总反应为2H2+O2===2H2O
D.外电路中电流由电极a通过导线流向电极b
√
解析 通入H2的一极为负极,所以电极a为负极,A项正确;
燃料电池属于原电池,是将化学能转化为电能的装置,B项正确;
该电池中,负极的电极反应式为2H2-4e-===4H+,正极的电极反应式为O2+4H++4e-===2H2O,正、负极电极反应式相加得电池总反应:2H2+O2===2H2O,C项正确;
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
通入氢气的电极为负极,通入氧气的电极为正极,电流从电极b沿导线流向电极a,D项错误。
3.环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.对电极是正极
B.工作电极上发生的电极反应为NO2+2H+-2e-===NO+H2O
C.传感器工作时,H+由工作电极移向对电极
D.对电极的材料可能为活泼金属锌
√
1
2
3
4
5
6
7
8
9
10
11
13
14
15
解析 工作电极是NO2变为NO,化合价降低,是原电池的正极,对电极为负极,故A错误;
工作电极上发生的电极反应为NO2+2H++2e-===NO+H2O,故B错误;
传感器工作时,H+由对电极移向工作电极,故C错误;
对电极为负极,材料可能为活泼金属锌,故D正确。
16
12
题组二 质子交换膜燃料电池
4.如图是甲醇燃料电池的结构示意图,甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2===2CO2+4H2O。下列说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为O2+2H2O+4e-===4OH-
C.负极反应式为CH3OH+H2O-6e-===
CO2
+6H+
D.该电池提供1
mol
e-,消耗氧气0.25
mol
√
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
解析 负极反应式为2CH3OH-12e-+2H2O===2CO2+12H+,正极反应式为3O2+12e-+12H+===6H2O;
根据电子流向,可以判断a处通甲醇,b处通O2;
12
当电池提供
1
mol电子时,消耗O2为1×
mol=0.25
mol。
5.以引火性高的联氨(N2H4)为燃料的环保电池,工作时产生稳定无污染的物质,原理如图所示。下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.N极为电源负极,联氨从c口通入
B.负极上每消耗1
mol
N2H4,转移6
mol电子
C.正极的电极反应式为O2+2H2O+4e-===
4OH-
D.可将联氨改进为引火性低、稳定性好的N2H4·H2O
√
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
解析 由图中氢离子移动方向可知,电极N为正极,氧气在正极上发生还原反应,电极反应式为O2+4H++4e-===2H2O,则氧气从c口通入,A、C项错误;
联氨在负极上发生氧化反应,电极反应式为N2H4-4e-===N2↑+4H+,每消耗1
mol
N2H4可转移4
mol电子,B项错误;
12
将联氨改进为引火性低、稳定性好的N2H4·H2O,则电池的安全性会更高,D项正确。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
6.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,下列说法不正确的是
16
A.电流由O2所在的铂电极经外电路流向另一电极
B.O2所在的铂电极处发生还原反应
C.该电池的负极反应式为CH3CH2OH+3H2O-12e-
===2CO2↑+12H+
D.微处理器通过检测电流大小而计算出被测气体
中酒精的含量
12
√
1
2
3
4
5
6
7
8
9
10
11
13
14
15
解析 乙醇燃料电池中,负极上乙醇失电子发生氧化反应,正极上氧气得电子发生还原反应,电流由正极流向负极,即从O2所在的铂电极经外电路流向另一电极,故A、B项正确;
16
12
由装置图可知酒精在负极被氧气氧化生成醋酸:
CH3CH2OH-4e-+H2O===4H++CH3COOH,故C项错误;
微处理器通过检测电流大小可以得出电子转移的物质的量,根据电极反应式可以计算出被测气体中酒精的含量,故D项正确。
题组三 碱性燃料电池
7.将两个铂电极放置在KOH溶液中,然后分别向两极通入CO和O2,即可产生电流,称为燃料电池,下列叙述正确的是
①通入CO的电极为正极;
②正极的电极反应式是O2+2H2O+4e-===4OH-;
③通入CO的电极反应式是2CO+O2-4e-===2CO2;
④负极的电极反应式是CO+4OH--2e-===CO
+2H2O;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动
A.①③⑤
B.②④⑥
C.④⑤⑥
D.①②③
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
√
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
解析 据题意知,发生的反应为2CO+O2===2CO2,反应产生的CO2处于KOH溶液中,又会转化为CO
,④正确,③错误;
O2得e-被还原,在正极反应,①错误,②正确;
阳离子向正极移动,阴离子向负极移动,⑤错误,⑥正确。
12
8.液体燃料电池相比于气体燃料电池具有体积小等优点,一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.b电极发生氧化反应
B.a电极为该电池的正极
C.放电时,电流从a电极经过负载流向b电极
D.a电极的电极反应式:N2H4+4OH--4e-
===N2↑+4H2O
√
解析 该燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为N2H4+4OH--4e-===N2↑+4H2O,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-===4OH-,电池总反应为N2H4+
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
O2===N2+2H2O,结合离子的移动方向、电流的方向分析解答。该燃料电池中,通入氧化剂空气的b电极为正极,正极上氧气得电子发生还原反应,故A项错误;
该燃料电池中,通入燃料的电极为负极,即a电极为负极,故B项错误;
放电时,电流从b电极经过负载流向a电极,故C项错误;
通入燃料的电极为负极,负极上燃料失电
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
子发生氧化反应,在碱性条件下,电极反应式为N2H4+4OH--4e-===N2↑+4H2O,故D项正确。
题组四 熔融盐(或固体氧化物)燃料电池
9.据报道,美国一个海军航空站安装了一台250
kW的MCFC型燃料电池。该电池可同时供应电和水蒸气,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~700
℃。已知该电池的总反应为2H2+O2===2H2O,负极反应为H2+CO
-2e-===H2O+CO2。下列推断正确的是
A.正极反应为4OH--4e-===O2+2H2O
B.放电时,CO
向负极移动
C.电池供应1
mol水蒸气,转移电子的物质的量为4
mol
D.通入O2的一极为正极,发生氧化反应
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
√
解析 该电池的正极反应为O2+4e-+2CO2===2CO
,A项错误;
原电池工作时,阴离子向负极移动,B项正确;
电池提供1
mol水蒸气时,转移电子的物质的量为2
mol,C项错误;
通入O2的一极为正极,发生还原反应,D项错误。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
10.固体氧化物燃料电池是由美国西屋公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如图所示。其中多孔电极a、b均不参与电极反应。下列判断正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.有O2放电的电极a为电池的负极
B.有H2放电的电极b为电池的正极
C.电极a对应的电极反应式:O2+2H2O+
4e-===4OH-
D.该电池的总反应:2H2+O2
2H2O
√
解析 根据该电池的工作原理图可知,被氧化的是H2,2H2-4e-+2O2-===2H2O,电极b为原电池的负极;被还原的是O2,O2+4e-===2O2-,电极a为原电池的正极;
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
该电池的总反应为2H2+O2
2H2O。
11.以甲烷为燃料的新型电池得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。下列说法错误的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.以甲烷为燃料,其成本大大低于以氢气为
燃料的传统燃料电池
B.A极为电池正极,发生还原反应
C.B极的电极反应式为CH4+4O2--8e-===
CO2+2H2O
D.该电池的总反应为CH4+2O2 CO2+2H2O
√
解析 由于氢气难以大规模制备,因此以甲烷为燃料,其成本大大低于以氢气为燃料的传统燃料电池,A项正确;
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
由阴离子移动方向可知B极为负极,甲烷被
氧化生成二氧化碳和水,电极反应式为CH4
+4O2--8e-===CO2+2H2O,A极是正极,氧气得电子被还原,电极反应式为O2+4e-===2O2-,B、C项正确;
电池总反应为CH4+2O2===CO2+2H2O,不需要点燃,D项错误。
题组五 金属—空气电池
12.锌—空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,总反应为2Zn+O2+4OH-+2H2O===2Zn(OH) 。下列说法正确的是
A.放电时,电解质溶液中K+向负极移动
B.充电时,电解质溶液中c(OH-)逐渐减小
C.放电时,负极反应为Zn+4OH--2e-===Zn(OH)
D.放电时,电路中通过2
mol电子,消耗氧气22.4
L(标准状况)
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
√
解析 A错,放电时溶液中的阳离子向正极移动;
B错,充电时的总反应为放电时反应的逆过程:2Zn(OH) ===2Zn+O2↑+4OH-+2H2O,c(OH-)逐渐增大;
C对,放电时负极失电子发生氧化反应,由放电时的总反应可知,负极反应为Zn+4OH--2e-===Zn(OH) ;
D错,由放电时的总反应可知,电路中通过2
mol电子时,消耗0.5
mol
O2,其体积为11.2
L(标准状况)。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
13.近年来AIST正在研制一种高容量、低成本的锂—铜空气燃料电池。该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-,下列说法不正确的是
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
A.放电时,Li+透过固体电解质向Cu极移动
B.放电时,负极的电极反应式为Cu2O+H2O+2e-
===2Cu+2OH-
C.通空气时,铜被腐蚀,表面产生Cu2O
D.整个反应过程中,铜相当于催化剂
√
解析 放电时,锂是负极,发生失电子的氧化反应;
在电池内部Li+(阳离子)透过固体电解质向正极(铜电极)移动;
由题意可知,通空气时铜被腐蚀,表面产生Cu2O,放电时Cu2O又转化成铜,整个反应过程中,铜相当于催化剂。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
1
2
3
4
5
6
7
8
9
10
11
13
14
15
14.环保、安全的铝-空气电池的工作原理如图所示,回答下列问题:
16
12
(1)正极反应为________________________。
O2+2H2O+4e-===4OH-
1
2
3
4
5
6
7
8
9
10
11
13
14
15
(2)电池工作过程中,电解质溶液的pH如何变化?
16
12
(3)NaCl溶液的作用是什么?
答案 总反应方程式为4Al+3O2+6H2O===4Al(OH)3,溶液中的溶质仍为NaCl,故电解质溶液的pH基本不变
答案 NaCl溶液的作用是增强溶液的导电性
1
2
3
4
5
6
7
8
9
10
11
13
14
15
(4)当消耗标况下3.36
L
O2时,消耗铝电极的质量为____
g。
16
12
5.4
解析 根据电子守恒,消耗3.36
L(标况下)O2,即0.15
mol
O2,转移0.6
mol
e-,故消耗0.2
mol
Al,质量为5.4
g。
15.氨气是一种富氢燃料,可以直接用于燃料电池,如图是供氨水式燃料电池工作原理:
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
综合强化
(1)氨气燃料电池的电解质溶液最好选择_____(填“酸性”“碱性”或“中性”)溶液。
碱性
解析 氨气是碱性气体,所以电解液最好选择碱性溶液。
(2)空气在进入电池装置前需要通过过滤器除去的气体是_____。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
CO2
解析 空气中的CO2能和氨水反应,所以滤去的气体是CO2。
(3)氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的总反应式是__________________________,正极的电极反应是_____________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
4NH3
+
3O2===2N2
+
6H2O
3O2+12e-+6H2O===12OH-(或O2
+4e-+2H2O===4OH-)
解析 正极发生还原反应,碱性环境下,电极反应式为O2+4e-+2H2O===4OH-。
16.(1)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如图:
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
①质子的流动方向为_________(填“从A到B”或“从B到A”)。
从A到B
解析 根据图示,A为燃料电池的负极,B为燃料电池的正极,在原电池电解液中,正电荷由负极向正极移动,即从A到B;
②负极的电极反应式为_____________________________。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
解析 负极二氧化硫被氧化为硫酸根离子,电极反应式为SO2-2e-+2H2O===SO
+4H+。
(2)NH3—O2燃料电池的结构如图所示:
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
①a极为电池的____(填“正”或“负”)极。
负
解析 a极通入氨气,是负极,b极通入氧气,是正极;
②当生成1
mol
N2时
,电路中流过电子的物质的量为_______。
1
2
3
4
5
6
7
8
9
10
11
13
14
15
16
12
6
mol
解析 氨气中N的化合价由-3变成0,当生成1
mol
N2时,转移电子的物质的量为6
mol。
返回
本课结束
