高中化学苏教版(2019)选择性必修1专题1 第二单元 微专题3 电池电极反应式书写方法汇总(31张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1专题1 第二单元 微专题3 电池电极反应式书写方法汇总(31张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 957.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-03 00:00:00 | ||
图片预览











文档简介
(共37张PPT)
微专题3
电池电极反应式书写方法汇总
1.简单原电池电极反应式的书写
书写简单原电池电极反应式时,可按照负极活泼金属失去电子生成阳离子,发生氧化反应,正极阳离子得到电子生成单质,发生还原反应的规律进行书写。首先判断出电极反应产物,然后结合电极反应物及转移电子数量写出电极反应式,最后结合质量守恒、电荷守恒配平各电极反应式。两电极反应式相加则得到电池总反应。
例1 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源,该电池以金属锂为负极材料,以碳素钢为正极材料,LiOH为电解质,使用时加入水即可放电。
(1)该电池负极的电极反应式为:_________________。
(2)正极的电极反应式:__________________________,电池总反应:
_________________________。
(3)放电时OH-向___极移动,Li+向___极移动(填“正”或“负”)。
2Li-2e-===2Li+
2H2O+2e-===H2↑+2OH-
2Li+2H2O===2LiOH+H2↑
负
正
变式1 可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解质溶液时,正极电极反应式均为O2+
2H2O+4e-===4OH-
B.以NaOH溶液为电解质溶液时,负极电极反应式为Al+3OH--3e-
===Al(OH)3
C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保
持不变
D.电池工作时,电子通过外电路从正极流向负极
√
解析 电池工作时,正极上O2得到电子被还原,电极反应式为O2+2H2O+4e-===4OH-,A项正确;
电解质溶液为NaOH溶液时,在负极上产生的是NaAlO2,而不是Al(OH)3,B项错误;
电池总反应为4Al+3O2+4NaOH===4NaAlO2+2H2O,电池工作过程中消耗NaOH,电解质溶液的pH减小,C项错误;
电池工作时,电子通过外电路由负极流向正极,D项错误。
2.根据总反应写电极反应式
若题中给出总反应,可根据化合价的变化,分析此反应中的氧化反应(负极反应)和还原反应(正极反应),然后写出其中较简单的电极反应式,另一电极反应式可用总反应减去已写出的电极反应式得到。
例2 根据下列原电池的总反应,写出其电极反应式。
(1)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备硫酸铜,若将该反应设计为原电池,其负极的电极反应式是__________________,正极的电极反应式是_______________________。
2Cu-4e-===2Cu2+
O2+4e-+4H+===2H2O
解析 将总反应方程式拆成氧化反应和还原反应两个半反应,还原剂在负极上发生氧化反应:2Cu-4e-===2Cu2+;氧化剂在正极上发生还原反应:O2+4e-+4H+===2H2O。
(2)某原电池总反应为2FeO
+3H2===Fe2O3+4OH-+H2O,在该原电池中:
负极的电极反应式是_________________________;
正极的电极反应式是___________________________________。
3H2-6e-+6OH-===6H2O
解析 将总反应方程式拆成氧化反应和还原反应两个半反应,还原剂在负极上发生氧化反应:3H2-6e-+6OH-===6H2O;氧化剂在正极上发生还原反应:2FeO
+5H2O+6e-===Fe2O3+10OH-。
变式2 一种新型的电池,总反应为3Zn+2FeO
+8H2O===2Fe(OH)3↓+3Zn(OH)2↓+4OH-,其工作原理如图所示。下列说法错误的是
A.Zn电极是负极,发生氧化反应
B.随着反应的进行,溶液的pH增大
C.电子由Zn电极流到石墨电极,再经过溶液
回到Zn电极,形成回路
D.石墨电极上发生的电极反应为FeO +3e-+4H2O===Fe(OH)3↓+5OH-
√
解析 Zn的化合价升高,根据原电池的工作原理可知,锌为负极,发生氧化反应,A项正确;
根据电池总反应方程式中生成OH-可判断出溶液的pH增大,B项正确;
根据原电池的工作原理,电子从Zn电极流出经外电路流向石墨电极,电解质溶液中应是阴、阳离子定向移动,而没有电子通过,C项错误;
正极的电极反应式为FeO
+4H2O+3e-===Fe(OH)3↓+5OH-,D项正确。
3.可充电电池电极反应式的书写
在书写可充电电池电极反应时,要明确可充电电池放电时为原电池,充电时为放电的逆过程。
(1)原电池的负极与充电反应的阳极均发生氧化反应,对应元素化合价升高。
(2)原电池反应的正极与充电反应的阴极均发生还原反应,对应元素化合价降低。
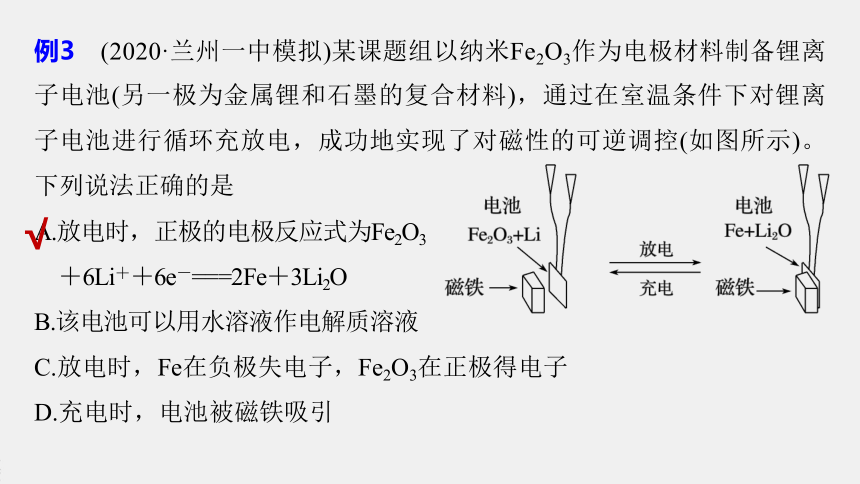
例3 (2020·兰州一中模拟)某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图所示)。下列说法正确的是
A.放电时,正极的电极反应式为Fe2O3
+6Li++6e-===2Fe+3Li2O
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe在负极失电子,Fe2O3在正极得电子
D.充电时,电池被磁铁吸引
√
解析 电池放电的总反应为Fe2O3+6Li===2Fe+3Li2O,单质锂在负极放电,电极反应式为Li-e-===Li+,由总反应和负极的电极反应式可得到正极的电极反应式为Fe2O3+6Li++6e-===2Fe+3Li2O,A项正确;
因为单质锂可以与水反应,所以电解质溶液不能是水溶液,B项错误;
放电时,Li在负极失电子,Fe2O3在正极得电子,C项错误;
从图中可以看到,充电时(向左反应),电池会远离磁铁,即充电时电池中的单质铁转化为氧化铁,不能被磁铁吸引,D项错误。
变式3 镁—锑液态金属电池是新型二次电池,白天利用太阳能给电池充电,夜晚电池可以给外电路供电。该电池利用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。工作原理如图所示,下列有关该二次电池说法正确的是
A.该电池放电时,Cl-向下层方向移动
B.放电时,负极的电极反应式为Mg-
2e-===Mg2+
C.该电池放电时,Mg-Sb(液)层作负极
D.放电时,Mg(液)层的质量增大
√
4.燃料电池电极反应工的书写
(1)燃料电池的正、负极均为惰性电极,均不参与反应。
(2)正极电极反应式的书写
正极发生还原反应,通入的气体一般是氧气,氧气得到电子首先变为氧离子即O2+4e-===2O2-,根据电解质的不同,正极电极反应式的书写分以下几种情况:
①在酸性溶液中,生成的氧离子与氢离子结合生成水,电极反应式为O2+4e-+4H+===2H2O。
②在碱性溶液中,氧离子与氢氧根离子不能结合,只能与水结合生成氢氧根离子,电极反应式为O2+4e-+2H2O===4OH-。
③在熔融碳酸盐中,氧离子能与二氧化碳结合生成碳酸根离子,电极反应式为O2+2CO2+4e-===2CO
。
例4 一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生反应的化学方程式:________________________
______。
2CH3OH+3O2===2CO2+
4H2O
解析 燃料电池的电池反应为燃料的氧化反应,在酸性条件下生成的CO2不与H2SO4反应,故电总池反应为2CH3OH+3O2===2CO2+4H2O。
(2)此电池正极电极的反应式:_________________________,负极的电极反应式:____________________________________。
3O2+12H++12e-===6H2O
2CH3OH+2H2O-12e-===2CO2+12H+
解析 电池的正极为O2得电子,由于是酸性环境,所以会生成H2O,用电池总反应减去正极的电极反应式即可得出负极的电极反应式。
(3)电解液中H+向____极移动,向外电路中释放电子的是____极。
正
负
解析 H+移向正极,在正极生成水。
(4)使用该燃料电池的另一个好处是_____________。
对环境无污染
解析 产物是CO2和H2O,不会对环境造成污染。
变式4 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2===2H2O。下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-
===4OH-
C.每转移0.1
mol电子,消耗1.12
L的H2
D.H+由a极通过固体电解质移向b极
√
解析 由电池总反应及原电池原理可知,充入H2的一极(a极)是负极,充入O2的一极(b极)是正极;电子由负极经外电路流向正极;电池内部阳离子即H+移向正极,b极的电极反应式为O2+4H++4e-===2H2O,故A、B项错误,D项正确;
C项没有指明是否为标准状况,错误。
1.锌—空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时的下列说法正确的是
1
2
3
4
跟踪训练
A.氧气在石墨电极上发生氧化反应
B.该电池的负极反应为Zn+H2O-2e-===ZnO+
2H+
C.该电池放电时OH-向石墨电极移动
D.该电池充电时应将Zn电极与电源负极相连
√
5
6
解析 氧气得电子发生还原反应,A错误;
锌作负极,碱性条件下,负极反应为Zn+2OH--2e-===ZnO+H2O,B错误;
原电池工作时,溶液中的阴离子向负极移动,即OH-向Zn电极移动,C错误;
1
2
3
4
充电时,电池的负极与外接电源的负极相连,D正确。
5
6
2.我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na
2Na2CO3+C。下列说法错误的是
1
2
3
4
A.放电时,ClO
向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-===2CO
+C
D.充电时,阳极反应为Na++e-===Na
√
5
6
解析 根据电池的总反应知,放电时负极反应:4Na-4e-===4Na+
1
2
3
4
充电时,阴极:4Na++4e-===4Na
根据充电和放电时的电极反应式知,充电时释放CO2,放电时吸收CO2。
5
6
1
2
3
4
3.Li—Al/FeS电池是一种正在开发的车载电池,该电池中正极反应为2Li++FeS+2e-===Li2S+Fe。下列有关该电池的说法正确的是
A.Li—Al在电池中作为负极材料,该材料中Li的化合价为+1
B.该电池的电池反应为2Li+FeS===Li2S+Fe
C.负极的电极反应为Al-3e-===Al3+
D.充电时,阴极发生的电极反应为Li2S+Fe-2e-===2Li++FeS
√
5
6
1
2
3
4
解析 根据题给正极的电极反应可知,FeS在电池中作为正极材料,Li—Al在电池中作为负极材料,但该材料中的Li是单质,化合价为0,A项错误;
该电池的负极反应为Li-e-===Li+,电池反应为2Li+FeS===Li2S+Fe,B项正确、C项错误;
充电时,阴极得电子,电极反应为Li++e-===Li,D项错误。
5
6
4.碱性联氨燃料电池具有能量密度较高和无污染等优点,其工作原理如图所示,下列说法不正确的是
1
2
3
4
A.负极反应:N2H4-4e-===4H++N2↑
B.通入氧气的电极为正极
C.电池工作时OH-向负极移动
D.该电池工作一段时间后,电解质溶液
碱性不变(不考虑电解质溶液的体积变化)
√
5
6
解析 由题图所示工作原理可知,该电池的负极为N2H4放电,电极反应:N2H4+4OH--4e-===4H2O+N2↑,A项错误;
氧气得电子被还原,故通入氧气的电极为正极,B项正确;
1
2
3
4
电池工作时OH-向负极移动,C项正确;
该电池的正极反应为O2+2H2O+4e-===4OH-,总反应为N2H4+O2===2H2O+N2,故电解质溶液的碱性不变(不考虑电解质溶液的体积变化),D项正确。
5
6
5.铝作为一种应用广泛的金属,在电化学领域也发挥着举足轻重的作用。回答下列问题:
(1)某同学根据氧化还原反应:2Al(s)+3Cu2+(aq)===2Al3+(aq)+3Cu(s)设计如图所示的原电池:
①电极X的化学式为_____,电极Y的化学式为_____。
Cu
Al
解析 根据已知离子方程式可知Cu作正极,Al作负极。
1
2
3
4
5
6
②盐桥中的阴离子向__________(填化学式)溶液中移动。
Al2(SO4)3
解析 原电池中阴离子向负极移动,即向Al2(SO4)3溶液中移动。
1
2
3
4
5
6
(2)新型电池中的铝电池类型较多。
①Al—空气燃料电池可用作电动汽车的电源,该电池多使用NaOH溶液为电解液。电池工作过程中电解液的pH_____(填“增大”“减小”或“不变”)。
减小
解析 Al—空气燃料电池的总反应为4Al+3O2+NaOH===4NaAlO2+2H2O,故溶液碱性减弱,pH减小。
1
2
3
4
5
6
②如图为Al—AgO电池的原理结构示意图,这种电池可用作水下动力电源。该电池反应方程式为2Al+3AgO+2NaOH===2NaAlO2+3Ag+H2O,当电极上析出1.08
g
Ag时,电路中转移的电子为_____
mol。
0.02
解析 该电池的正极反应为AgO+2e-+H2O===Ag+2OH-。AgO中Ag的化合价为+2,当电极上析出1.08
g
Ag(即0.01
mol)时,电路中转移的电子为0.02
mol。
1
2
3
4
5
6
6.(2021·石家庄一中高二期末)生物电池具有工作时不发热、不损坏电极等优点,不但可以节约大量金属,而且寿命比化学电源长的多,因此越来越受到人们的青睐。某生物电池以葡萄糖(C6H12O6)作原料,在酶的作用下氧化为葡萄糖酸(C6H12O7),其工作原理如图所示。
1
2
3
4
5
6
(1)电极b为_____(填“正极”或“负极”),电极a的电极反应式为________
____________________________。
正极
C6H12O6
+H2O-2e-===C6H12O7+2H+
解析 电极b为正极,电极a为负极,负极上葡萄糖在酶的作用下被氧化为葡萄糖酸(C6H12O7),电极反应式为C6H12O6+H2O-2e-===C6H12O7+2H+。
1
2
3
4
5
6
(2)该生物电池中发生反应的化学方程式为____________________________,当有2
mol
H+通过质子交换膜时,理论上需要标准状况下氧气的体积为_____
L。
2C6H12O6+O2
2C6H12O7
11.2
1
2
3
4
5
6
解析 根据图示,葡萄糖(C6H12O6)在酶的作用下被氧化为葡萄糖酸(C6H12O7),氧气被还原为水,正极的电极反应式为O2+4e-+4H+===2H2O,
当有2
mol
H+通过质子交换膜时,理论上正极消耗0.5
mol氧气,
需要标准状况下氧气的体积为0.5
mol×22.4
L·mol-1=11.2
L。
则该生物电池中发生反应的化学方程式为2C6H12O6+O2
2C6H12O7,
1
2
3
4
5
6
(3)该电池_____(填“能”或“不能”)在高温条件下使用,原因是______
_________________________________。
不能
酶在高
温条件下会发生变性,失去催化活性
解析 酶的主要成分为蛋白质,在高温下,蛋白质会发生变性,失去催化活性,因此该电池不能在高温条件下使用。
1
2
3
4
5
6
本课结束
微专题3
电池电极反应式书写方法汇总
1.简单原电池电极反应式的书写
书写简单原电池电极反应式时,可按照负极活泼金属失去电子生成阳离子,发生氧化反应,正极阳离子得到电子生成单质,发生还原反应的规律进行书写。首先判断出电极反应产物,然后结合电极反应物及转移电子数量写出电极反应式,最后结合质量守恒、电荷守恒配平各电极反应式。两电极反应式相加则得到电池总反应。
例1 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源,该电池以金属锂为负极材料,以碳素钢为正极材料,LiOH为电解质,使用时加入水即可放电。
(1)该电池负极的电极反应式为:_________________。
(2)正极的电极反应式:__________________________,电池总反应:
_________________________。
(3)放电时OH-向___极移动,Li+向___极移动(填“正”或“负”)。
2Li-2e-===2Li+
2H2O+2e-===H2↑+2OH-
2Li+2H2O===2LiOH+H2↑
负
正
变式1 可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解质溶液时,正极电极反应式均为O2+
2H2O+4e-===4OH-
B.以NaOH溶液为电解质溶液时,负极电极反应式为Al+3OH--3e-
===Al(OH)3
C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保
持不变
D.电池工作时,电子通过外电路从正极流向负极
√
解析 电池工作时,正极上O2得到电子被还原,电极反应式为O2+2H2O+4e-===4OH-,A项正确;
电解质溶液为NaOH溶液时,在负极上产生的是NaAlO2,而不是Al(OH)3,B项错误;
电池总反应为4Al+3O2+4NaOH===4NaAlO2+2H2O,电池工作过程中消耗NaOH,电解质溶液的pH减小,C项错误;
电池工作时,电子通过外电路由负极流向正极,D项错误。
2.根据总反应写电极反应式
若题中给出总反应,可根据化合价的变化,分析此反应中的氧化反应(负极反应)和还原反应(正极反应),然后写出其中较简单的电极反应式,另一电极反应式可用总反应减去已写出的电极反应式得到。
例2 根据下列原电池的总反应,写出其电极反应式。
(1)利用反应2Cu+O2+2H2SO4===2CuSO4+2H2O可制备硫酸铜,若将该反应设计为原电池,其负极的电极反应式是__________________,正极的电极反应式是_______________________。
2Cu-4e-===2Cu2+
O2+4e-+4H+===2H2O
解析 将总反应方程式拆成氧化反应和还原反应两个半反应,还原剂在负极上发生氧化反应:2Cu-4e-===2Cu2+;氧化剂在正极上发生还原反应:O2+4e-+4H+===2H2O。
(2)某原电池总反应为2FeO
+3H2===Fe2O3+4OH-+H2O,在该原电池中:
负极的电极反应式是_________________________;
正极的电极反应式是___________________________________。
3H2-6e-+6OH-===6H2O
解析 将总反应方程式拆成氧化反应和还原反应两个半反应,还原剂在负极上发生氧化反应:3H2-6e-+6OH-===6H2O;氧化剂在正极上发生还原反应:2FeO
+5H2O+6e-===Fe2O3+10OH-。
变式2 一种新型的电池,总反应为3Zn+2FeO
+8H2O===2Fe(OH)3↓+3Zn(OH)2↓+4OH-,其工作原理如图所示。下列说法错误的是
A.Zn电极是负极,发生氧化反应
B.随着反应的进行,溶液的pH增大
C.电子由Zn电极流到石墨电极,再经过溶液
回到Zn电极,形成回路
D.石墨电极上发生的电极反应为FeO +3e-+4H2O===Fe(OH)3↓+5OH-
√
解析 Zn的化合价升高,根据原电池的工作原理可知,锌为负极,发生氧化反应,A项正确;
根据电池总反应方程式中生成OH-可判断出溶液的pH增大,B项正确;
根据原电池的工作原理,电子从Zn电极流出经外电路流向石墨电极,电解质溶液中应是阴、阳离子定向移动,而没有电子通过,C项错误;
正极的电极反应式为FeO
+4H2O+3e-===Fe(OH)3↓+5OH-,D项正确。
3.可充电电池电极反应式的书写
在书写可充电电池电极反应时,要明确可充电电池放电时为原电池,充电时为放电的逆过程。
(1)原电池的负极与充电反应的阳极均发生氧化反应,对应元素化合价升高。
(2)原电池反应的正极与充电反应的阴极均发生还原反应,对应元素化合价降低。
例3 (2020·兰州一中模拟)某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图所示)。下列说法正确的是
A.放电时,正极的电极反应式为Fe2O3
+6Li++6e-===2Fe+3Li2O
B.该电池可以用水溶液作电解质溶液
C.放电时,Fe在负极失电子,Fe2O3在正极得电子
D.充电时,电池被磁铁吸引
√
解析 电池放电的总反应为Fe2O3+6Li===2Fe+3Li2O,单质锂在负极放电,电极反应式为Li-e-===Li+,由总反应和负极的电极反应式可得到正极的电极反应式为Fe2O3+6Li++6e-===2Fe+3Li2O,A项正确;
因为单质锂可以与水反应,所以电解质溶液不能是水溶液,B项错误;
放电时,Li在负极失电子,Fe2O3在正极得电子,C项错误;
从图中可以看到,充电时(向左反应),电池会远离磁铁,即充电时电池中的单质铁转化为氧化铁,不能被磁铁吸引,D项错误。
变式3 镁—锑液态金属电池是新型二次电池,白天利用太阳能给电池充电,夜晚电池可以给外电路供电。该电池利用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。工作原理如图所示,下列有关该二次电池说法正确的是
A.该电池放电时,Cl-向下层方向移动
B.放电时,负极的电极反应式为Mg-
2e-===Mg2+
C.该电池放电时,Mg-Sb(液)层作负极
D.放电时,Mg(液)层的质量增大
√
4.燃料电池电极反应工的书写
(1)燃料电池的正、负极均为惰性电极,均不参与反应。
(2)正极电极反应式的书写
正极发生还原反应,通入的气体一般是氧气,氧气得到电子首先变为氧离子即O2+4e-===2O2-,根据电解质的不同,正极电极反应式的书写分以下几种情况:
①在酸性溶液中,生成的氧离子与氢离子结合生成水,电极反应式为O2+4e-+4H+===2H2O。
②在碱性溶液中,氧离子与氢氧根离子不能结合,只能与水结合生成氢氧根离子,电极反应式为O2+4e-+2H2O===4OH-。
③在熔融碳酸盐中,氧离子能与二氧化碳结合生成碳酸根离子,电极反应式为O2+2CO2+4e-===2CO
。
例4 一种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:
(1)这种电池放电时发生反应的化学方程式:________________________
______。
2CH3OH+3O2===2CO2+
4H2O
解析 燃料电池的电池反应为燃料的氧化反应,在酸性条件下生成的CO2不与H2SO4反应,故电总池反应为2CH3OH+3O2===2CO2+4H2O。
(2)此电池正极电极的反应式:_________________________,负极的电极反应式:____________________________________。
3O2+12H++12e-===6H2O
2CH3OH+2H2O-12e-===2CO2+12H+
解析 电池的正极为O2得电子,由于是酸性环境,所以会生成H2O,用电池总反应减去正极的电极反应式即可得出负极的电极反应式。
(3)电解液中H+向____极移动,向外电路中释放电子的是____极。
正
负
解析 H+移向正极,在正极生成水。
(4)使用该燃料电池的另一个好处是_____________。
对环境无污染
解析 产物是CO2和H2O,不会对环境造成污染。
变式4 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为2H2+O2===2H2O。下列有关说法正确的是
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-
===4OH-
C.每转移0.1
mol电子,消耗1.12
L的H2
D.H+由a极通过固体电解质移向b极
√
解析 由电池总反应及原电池原理可知,充入H2的一极(a极)是负极,充入O2的一极(b极)是正极;电子由负极经外电路流向正极;电池内部阳离子即H+移向正极,b极的电极反应式为O2+4H++4e-===2H2O,故A、B项错误,D项正确;
C项没有指明是否为标准状况,错误。
1.锌—空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时的下列说法正确的是
1
2
3
4
跟踪训练
A.氧气在石墨电极上发生氧化反应
B.该电池的负极反应为Zn+H2O-2e-===ZnO+
2H+
C.该电池放电时OH-向石墨电极移动
D.该电池充电时应将Zn电极与电源负极相连
√
5
6
解析 氧气得电子发生还原反应,A错误;
锌作负极,碱性条件下,负极反应为Zn+2OH--2e-===ZnO+H2O,B错误;
原电池工作时,溶液中的阴离子向负极移动,即OH-向Zn电极移动,C错误;
1
2
3
4
充电时,电池的负极与外接电源的负极相连,D正确。
5
6
2.我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na
2Na2CO3+C。下列说法错误的是
1
2
3
4
A.放电时,ClO
向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-===2CO
+C
D.充电时,阳极反应为Na++e-===Na
√
5
6
解析 根据电池的总反应知,放电时负极反应:4Na-4e-===4Na+
1
2
3
4
充电时,阴极:4Na++4e-===4Na
根据充电和放电时的电极反应式知,充电时释放CO2,放电时吸收CO2。
5
6
1
2
3
4
3.Li—Al/FeS电池是一种正在开发的车载电池,该电池中正极反应为2Li++FeS+2e-===Li2S+Fe。下列有关该电池的说法正确的是
A.Li—Al在电池中作为负极材料,该材料中Li的化合价为+1
B.该电池的电池反应为2Li+FeS===Li2S+Fe
C.负极的电极反应为Al-3e-===Al3+
D.充电时,阴极发生的电极反应为Li2S+Fe-2e-===2Li++FeS
√
5
6
1
2
3
4
解析 根据题给正极的电极反应可知,FeS在电池中作为正极材料,Li—Al在电池中作为负极材料,但该材料中的Li是单质,化合价为0,A项错误;
该电池的负极反应为Li-e-===Li+,电池反应为2Li+FeS===Li2S+Fe,B项正确、C项错误;
充电时,阴极得电子,电极反应为Li++e-===Li,D项错误。
5
6
4.碱性联氨燃料电池具有能量密度较高和无污染等优点,其工作原理如图所示,下列说法不正确的是
1
2
3
4
A.负极反应:N2H4-4e-===4H++N2↑
B.通入氧气的电极为正极
C.电池工作时OH-向负极移动
D.该电池工作一段时间后,电解质溶液
碱性不变(不考虑电解质溶液的体积变化)
√
5
6
解析 由题图所示工作原理可知,该电池的负极为N2H4放电,电极反应:N2H4+4OH--4e-===4H2O+N2↑,A项错误;
氧气得电子被还原,故通入氧气的电极为正极,B项正确;
1
2
3
4
电池工作时OH-向负极移动,C项正确;
该电池的正极反应为O2+2H2O+4e-===4OH-,总反应为N2H4+O2===2H2O+N2,故电解质溶液的碱性不变(不考虑电解质溶液的体积变化),D项正确。
5
6
5.铝作为一种应用广泛的金属,在电化学领域也发挥着举足轻重的作用。回答下列问题:
(1)某同学根据氧化还原反应:2Al(s)+3Cu2+(aq)===2Al3+(aq)+3Cu(s)设计如图所示的原电池:
①电极X的化学式为_____,电极Y的化学式为_____。
Cu
Al
解析 根据已知离子方程式可知Cu作正极,Al作负极。
1
2
3
4
5
6
②盐桥中的阴离子向__________(填化学式)溶液中移动。
Al2(SO4)3
解析 原电池中阴离子向负极移动,即向Al2(SO4)3溶液中移动。
1
2
3
4
5
6
(2)新型电池中的铝电池类型较多。
①Al—空气燃料电池可用作电动汽车的电源,该电池多使用NaOH溶液为电解液。电池工作过程中电解液的pH_____(填“增大”“减小”或“不变”)。
减小
解析 Al—空气燃料电池的总反应为4Al+3O2+NaOH===4NaAlO2+2H2O,故溶液碱性减弱,pH减小。
1
2
3
4
5
6
②如图为Al—AgO电池的原理结构示意图,这种电池可用作水下动力电源。该电池反应方程式为2Al+3AgO+2NaOH===2NaAlO2+3Ag+H2O,当电极上析出1.08
g
Ag时,电路中转移的电子为_____
mol。
0.02
解析 该电池的正极反应为AgO+2e-+H2O===Ag+2OH-。AgO中Ag的化合价为+2,当电极上析出1.08
g
Ag(即0.01
mol)时,电路中转移的电子为0.02
mol。
1
2
3
4
5
6
6.(2021·石家庄一中高二期末)生物电池具有工作时不发热、不损坏电极等优点,不但可以节约大量金属,而且寿命比化学电源长的多,因此越来越受到人们的青睐。某生物电池以葡萄糖(C6H12O6)作原料,在酶的作用下氧化为葡萄糖酸(C6H12O7),其工作原理如图所示。
1
2
3
4
5
6
(1)电极b为_____(填“正极”或“负极”),电极a的电极反应式为________
____________________________。
正极
C6H12O6
+H2O-2e-===C6H12O7+2H+
解析 电极b为正极,电极a为负极,负极上葡萄糖在酶的作用下被氧化为葡萄糖酸(C6H12O7),电极反应式为C6H12O6+H2O-2e-===C6H12O7+2H+。
1
2
3
4
5
6
(2)该生物电池中发生反应的化学方程式为____________________________,当有2
mol
H+通过质子交换膜时,理论上需要标准状况下氧气的体积为_____
L。
2C6H12O6+O2
2C6H12O7
11.2
1
2
3
4
5
6
解析 根据图示,葡萄糖(C6H12O6)在酶的作用下被氧化为葡萄糖酸(C6H12O7),氧气被还原为水,正极的电极反应式为O2+4e-+4H+===2H2O,
当有2
mol
H+通过质子交换膜时,理论上正极消耗0.5
mol氧气,
需要标准状况下氧气的体积为0.5
mol×22.4
L·mol-1=11.2
L。
则该生物电池中发生反应的化学方程式为2C6H12O6+O2
2C6H12O7,
1
2
3
4
5
6
(3)该电池_____(填“能”或“不能”)在高温条件下使用,原因是______
_________________________________。
不能
酶在高
温条件下会发生变性,失去催化活性
解析 酶的主要成分为蛋白质,在高温下,蛋白质会发生变性,失去催化活性,因此该电池不能在高温条件下使用。
1
2
3
4
5
6
本课结束
