高中化学苏教版(2019)选择性必修1专题1 第二单元 微专题4 电化学中多池装置及电解的相关计算(31张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1专题1 第二单元 微专题4 电化学中多池装置及电解的相关计算(31张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 783.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-03 20:13:28 | ||
图片预览











文档简介
(共31张PPT)
微专题4
电化学中多池装置及电解的相关计算
一、多池装置
1.判断电池类型
(1)有外接电源时,各电池均为电解池。
(2)无外接电源,如燃料电池、铅酸蓄电池在电池中作电源,其他均为电解池。
(3)无外接电源,有活泼性不同的电极的为原电池,活泼性相同或均为惰性电极的为电解池。
(4)根据电极反应现象判断。
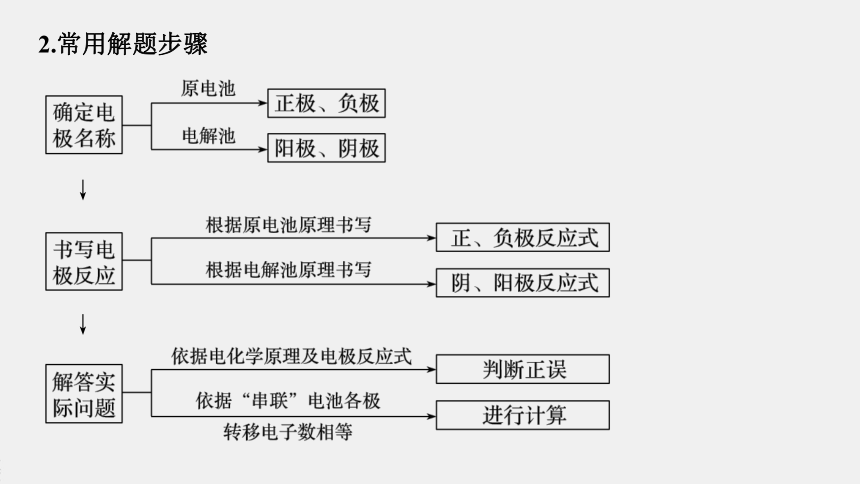
2.常用解题步骤
↓
↓
二、电解的相关计算
1.计算的原则
(1)阳极失去的电子数等于阴极得到的电子数。
(2)串联电路中通过各电解池的电子总数相等。
(3)电源输出的电子总数和电解池中转移的电子总数相等。
2.计算的方法
(1)得失电子守恒法计算:用于串联电路、通过阴、阳两极的电量相同等类型的计算,其依据是电路上转移的电子数相等。
(2)总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
(3)关系式计算:借得失电子守恒关系建立已知量与未知量之间的桥梁,建立计算所需的关系式。如电路中通过4
mol
e-可构建如下关系式:
4e-~2Cl2(Br2、I2)~O2~4H+~4OH-~2H2~2Cu~4Ag~
M
阳极产物
阴极产物
(式中M为金属,n为其离子的化合价数值)
3.计算的步骤
(1)正确书写电极反应式(要注意阳极材料)。
(2)当溶液中有多种离子共存时,要确定放电离子的先后顺序。
(3)最后根据得失电子守恒进行相关的计算。
例1 以惰性电极电解CuSO4溶液,若阳极上生成的气体的物质的量为0.010
mol,则阴极上析出Cu的质量为
A.0.64
g
B.1.28
g
C.2.56
g
D.5.12
g
解析 以惰性电极电解CuSO4溶液,在阳极上氢氧根离子放电生成氧气,阳极电极反应式为4OH--4e-===2H2O+O2↑;在阴极上铜离子得到电子析出金属铜,电极反应式为2Cu2++4e-===2Cu。
根据得失电子守恒得到:O2 ~ 4e- ~ 2Cu
0.010
mol 0.020
mol
所以阴极析出铜的质量m(Cu)=0.020
mol×64
g·mol-1=1.28
g,B项正确。
√
变式1 用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.2
mol
Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中转移电子的物质的量为
A.0.4
mol
B.0.5
mol
C.0.6
mol
D.0.8
mol
√
解析 将Cu(OH)2改写为CuO·H2O,根据CuO·H2O知,阳极上OH-放电生成O2,阴极上Cu2+和H+放电生成Cu和H2,根据氧原子守恒得n(O2)=n[Cu(OH)2]=0.2
mol,则转移电子的物质的量为0.2
mol×4=0.8
mol,故D正确。
例2 (2020·衡水高二检测)把物质的量均为0.1
mol的CuCl2和H2SO4溶于水制成100
mL的混合溶液,用石墨作电极电解混合溶液,并收集两电极所生成的气体,通电一段时间后在两极收集到的气体在相同条件下体积相同,则下列叙述正确的是
A.电路中共转移0.6NA个电子
B.阳极得到的气体中O2的物质的量为0.2
mol
C.阴极质量增加3.2
g
D.电解后剩余溶液中硫酸的浓度为1
mol·L-1
√
解析 用石墨作电极电解CuCl2和H2SO4
阴极反应有:Cu2++2e-===Cu、2H++2e-===H2↑
阳极反应有:2Cl--2e-===Cl2↑、2H2O-4e-===O2↑+4H+
据题给信息,两极收集的气体在相同条件下体积相同,则据放电顺序0.1
mol
CuCl2完全电解,转移电子数为0.2
NA。
设阴极生成氢气为x
mol,则阴极共转移电子为(0.2+2x)
mol,阳极生成氧气为(x-0.1)
mol,
据两极电子得失守恒:0.2+2x=0.2+4(x-0.1),解得x=0.2,故电路中共转移0.6
mol即0.6NA个电子,A正确;
阳极得到的气体中O2为0.1
mol
,B错误;
阴极质量增加0.1
mol×64
g·mol-1=6.4
g,C错误;
由电解过程可知,电解后溶液体积小于100
mL,则H2SO4浓度一定大于1
mol·L-1,故D错误。
变式2 用石墨作电极电解1
000
mL硝酸钾和硝酸铜的混合溶液,当通电一段时间后,两极都收集到112
mL气体(标准状况),假定电解后溶液体积仍为1
000
mL,则电解后溶液的c(H+)为
A.1×10-4
mol·L-1
B.1×10-3
mol·L-1
C.0.01
mol·L-1
D.0.1
mol·L-1
√
解析 阳极生成氧气0.005
mol,阴极生成氢气0.005
mol。
生成n(H+)=(0.005
mol-0.002
5
mol)×4=0.01
mol,c(H+)=0.01
mol·L-1。
例2 如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05
mol·
L-1的氯化铜溶液,B池中加入0.1
mol·L-1的硝酸银溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是
A.2∶2∶4∶1
B.1∶1∶2∶1
C.2∶1∶1∶1
D.2∶1∶2∶1
√
解析 由电解规律可知:a、c为阴极,b、d为阳极。a极上析出铜,b极上析出氯气,c极上析出银,d极上析出氧气。
所以a、b、c、d四个电极上所析出物质的物质的量之比为2∶2∶4∶1。
由得失电子守恒可得出:2e-~Cu~Cl2~2Ag~
O2,
变式3 如图所示,甲烧杯中盛有100
mL
0.50
mol·L-1AgNO3溶液,乙烧杯中盛有100
mL
0.25
mol·L-1CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9
g。回答下列问题:
(1)电源E为____极,F为____极。
负
正
(2)A极的电极反应式为__________________,析出物质______
mol。
(3)B极的电极反应式为_________________________,析出气体____
mL
(标准状况)。
(4)C极的电极反应式为________________,析出物质________
mol。
4Ag++4e-===4Ag
0.025
4OH--4e-===2H2O+O2↑
140
Cu2++2e-===Cu
0.012
5
解析 由电解一段时间后A极比C极重,可知A极上有Ag析出,C极上有Cu析出,
若A极上析出银的物质的量为n(Ag),则C极上析出Cu的物质的量为
n(Ag),
由关系式108
g·mol-1×n(Ag)-64
g·mol-1×n(Ag)
×
=1.9
g,解得n(Ag)=0.025
mol,
由此可知,两电解池内的电解质均是足量的,故两池电极反应式分别为A极:4Ag++4e-===4Ag;
B极:4OH--4e-===2H2O+O2↑;
C极:Cu2++2e-===Cu;
D极:2Cl--2e-===Cl2↑。
A、C两极析出物质的物质的量分别为0.025
mol和0.012
5
mol,B极析出O2的体积(标准状况)为0.006
25
mol×22.4
L·mol-1=0.14
L=140
mL。
1.用石墨电极电解100
mL
H2SO4和CuSO4混合溶液,通电一段时间后,两极均收集到2.24
L气体(标准状况),原混合溶液中Cu2+的物质的量浓度为
A.1
mol·L-1
B.2
mol·L-1
C.3
mol·L-1
D.4
mol·L-1
1
2
3
跟踪训练
√
解析 根据题给信息可知,阴极上首先发生反应Cu2++2e-===Cu,然后发生反应2H++2e-===H2↑;
阳极上发生反应2H2O-4e-===4H++O2↑。
因为在阴极上收集到H2,则说明溶液中Cu2+已完全放电,
根据得失电子守恒计算,阴极上放出0.1
mol
H2需要0.2
mol电子,阳极失去0.4
mol电子放出0.1
mol
O2,
所以阴极上有0.1
mol
Cu2+放电得到0.2
mol电子,
1
2
3
2.如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4NaOH===2Na2CO3+6H2O。
1
2
3
请回答下列问题:
(1)图中甲、乙两池的名称:甲池是_______装置,乙池是_______装置。
原电池
电解池
(2)下列电极的名称:通入CH3OH的电极名称是_____,B(石墨)电极的名称是_____。
(3)写出电极反应式:
①通入O2的电极的电极反应式是________________________;
1
2
3
②A(石墨)电极的电极反应式为_______
___________。
负极
阳极
O2+2H2O+4e-===4OH-
2H++
2e-===H2↑
(4)乙池中反应的化学方程式为____________________________________。
(5)若反应结束后乙池中A(石墨)电极上共收集到气体0.050
mol,则甲池中理论上消耗O2_____
mL(标准状况下)。
1
2
3
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
560
解析 甲池是以CH3OH为燃料的燃料电池,乙池是以石墨为电极电解饱和食盐水的电解装置。根据电子守恒
O2~4e-~2H2
1
mol
2
mol
n(O2)
0.050
mol
n(O2)=0.025
mol V(O2)=0.56
L=560
mL。
1
2
3
1
2
3
3.电解装置如图所示。图中B装置盛有1
L
2
mol·L-1的Na2SO4溶液,A装置中盛有1
L
2
mol·L-1AgNO3溶液,通电后,湿润的淀粉-KI试纸的C端变蓝色。电解一段时间后,试回答:
1
2
3
(1)A装置中发生反应的化学方程式为______________________________
_________。
4AgNO3+2H2O
4Ag+O2↑
+4HNO3
1
2
3
解析 A装置中Fe为阴极:4Ag++4e-===4Ag;
Pt为阳极:4OH--4e-===2H2O+O2↑,
故反应的化学方程式为4AgNO3+2H2O
4Ag+O2↑+4HNO3。
1
2
3
(2)在B装置中观察到的现象是_____________________________________
____________________________________________________________。
接通电源后,铜棒周围开始变为蓝色,石
墨棒上有无色气泡产生,一段时间后,U形管底部出现蓝色絮状沉淀
解析 B装置中Cu为阳极:Cu-2e-===Cu2+,石墨为阴极:2H++2e-===H2↑,阴极H+放电,剩余OH-与阳极生成的Cu2+在U形管底部相遇生成沉淀:Cu2++2OH-===Cu(OH)2↓。
1
2
3
(3)室温下若从电解开始到时间t时,A、B两装置中共收集到0.168
L(标准状况)气体。若电解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A装置溶液中酸的浓度为______________。
0.01
mol·L-1
解析 4HNO3~4e-~O2~2H2
4
mol
22.4
L+22.4
L×2
n(HNO3)
0.168
L
n(HNO3)=0.01
mol,
本课结束
微专题4
电化学中多池装置及电解的相关计算
一、多池装置
1.判断电池类型
(1)有外接电源时,各电池均为电解池。
(2)无外接电源,如燃料电池、铅酸蓄电池在电池中作电源,其他均为电解池。
(3)无外接电源,有活泼性不同的电极的为原电池,活泼性相同或均为惰性电极的为电解池。
(4)根据电极反应现象判断。
2.常用解题步骤
↓
↓
二、电解的相关计算
1.计算的原则
(1)阳极失去的电子数等于阴极得到的电子数。
(2)串联电路中通过各电解池的电子总数相等。
(3)电源输出的电子总数和电解池中转移的电子总数相等。
2.计算的方法
(1)得失电子守恒法计算:用于串联电路、通过阴、阳两极的电量相同等类型的计算,其依据是电路上转移的电子数相等。
(2)总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
(3)关系式计算:借得失电子守恒关系建立已知量与未知量之间的桥梁,建立计算所需的关系式。如电路中通过4
mol
e-可构建如下关系式:
4e-~2Cl2(Br2、I2)~O2~4H+~4OH-~2H2~2Cu~4Ag~
M
阳极产物
阴极产物
(式中M为金属,n为其离子的化合价数值)
3.计算的步骤
(1)正确书写电极反应式(要注意阳极材料)。
(2)当溶液中有多种离子共存时,要确定放电离子的先后顺序。
(3)最后根据得失电子守恒进行相关的计算。
例1 以惰性电极电解CuSO4溶液,若阳极上生成的气体的物质的量为0.010
mol,则阴极上析出Cu的质量为
A.0.64
g
B.1.28
g
C.2.56
g
D.5.12
g
解析 以惰性电极电解CuSO4溶液,在阳极上氢氧根离子放电生成氧气,阳极电极反应式为4OH--4e-===2H2O+O2↑;在阴极上铜离子得到电子析出金属铜,电极反应式为2Cu2++4e-===2Cu。
根据得失电子守恒得到:O2 ~ 4e- ~ 2Cu
0.010
mol 0.020
mol
所以阴极析出铜的质量m(Cu)=0.020
mol×64
g·mol-1=1.28
g,B项正确。
√
变式1 用石墨电极电解CuSO4溶液一段时间后,向所得溶液中加入0.2
mol
Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则电解过程中转移电子的物质的量为
A.0.4
mol
B.0.5
mol
C.0.6
mol
D.0.8
mol
√
解析 将Cu(OH)2改写为CuO·H2O,根据CuO·H2O知,阳极上OH-放电生成O2,阴极上Cu2+和H+放电生成Cu和H2,根据氧原子守恒得n(O2)=n[Cu(OH)2]=0.2
mol,则转移电子的物质的量为0.2
mol×4=0.8
mol,故D正确。
例2 (2020·衡水高二检测)把物质的量均为0.1
mol的CuCl2和H2SO4溶于水制成100
mL的混合溶液,用石墨作电极电解混合溶液,并收集两电极所生成的气体,通电一段时间后在两极收集到的气体在相同条件下体积相同,则下列叙述正确的是
A.电路中共转移0.6NA个电子
B.阳极得到的气体中O2的物质的量为0.2
mol
C.阴极质量增加3.2
g
D.电解后剩余溶液中硫酸的浓度为1
mol·L-1
√
解析 用石墨作电极电解CuCl2和H2SO4
阴极反应有:Cu2++2e-===Cu、2H++2e-===H2↑
阳极反应有:2Cl--2e-===Cl2↑、2H2O-4e-===O2↑+4H+
据题给信息,两极收集的气体在相同条件下体积相同,则据放电顺序0.1
mol
CuCl2完全电解,转移电子数为0.2
NA。
设阴极生成氢气为x
mol,则阴极共转移电子为(0.2+2x)
mol,阳极生成氧气为(x-0.1)
mol,
据两极电子得失守恒:0.2+2x=0.2+4(x-0.1),解得x=0.2,故电路中共转移0.6
mol即0.6NA个电子,A正确;
阳极得到的气体中O2为0.1
mol
,B错误;
阴极质量增加0.1
mol×64
g·mol-1=6.4
g,C错误;
由电解过程可知,电解后溶液体积小于100
mL,则H2SO4浓度一定大于1
mol·L-1,故D错误。
变式2 用石墨作电极电解1
000
mL硝酸钾和硝酸铜的混合溶液,当通电一段时间后,两极都收集到112
mL气体(标准状况),假定电解后溶液体积仍为1
000
mL,则电解后溶液的c(H+)为
A.1×10-4
mol·L-1
B.1×10-3
mol·L-1
C.0.01
mol·L-1
D.0.1
mol·L-1
√
解析 阳极生成氧气0.005
mol,阴极生成氢气0.005
mol。
生成n(H+)=(0.005
mol-0.002
5
mol)×4=0.01
mol,c(H+)=0.01
mol·L-1。
例2 如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05
mol·
L-1的氯化铜溶液,B池中加入0.1
mol·L-1的硝酸银溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是
A.2∶2∶4∶1
B.1∶1∶2∶1
C.2∶1∶1∶1
D.2∶1∶2∶1
√
解析 由电解规律可知:a、c为阴极,b、d为阳极。a极上析出铜,b极上析出氯气,c极上析出银,d极上析出氧气。
所以a、b、c、d四个电极上所析出物质的物质的量之比为2∶2∶4∶1。
由得失电子守恒可得出:2e-~Cu~Cl2~2Ag~
O2,
变式3 如图所示,甲烧杯中盛有100
mL
0.50
mol·L-1AgNO3溶液,乙烧杯中盛有100
mL
0.25
mol·L-1CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.9
g。回答下列问题:
(1)电源E为____极,F为____极。
负
正
(2)A极的电极反应式为__________________,析出物质______
mol。
(3)B极的电极反应式为_________________________,析出气体____
mL
(标准状况)。
(4)C极的电极反应式为________________,析出物质________
mol。
4Ag++4e-===4Ag
0.025
4OH--4e-===2H2O+O2↑
140
Cu2++2e-===Cu
0.012
5
解析 由电解一段时间后A极比C极重,可知A极上有Ag析出,C极上有Cu析出,
若A极上析出银的物质的量为n(Ag),则C极上析出Cu的物质的量为
n(Ag),
由关系式108
g·mol-1×n(Ag)-64
g·mol-1×n(Ag)
×
=1.9
g,解得n(Ag)=0.025
mol,
由此可知,两电解池内的电解质均是足量的,故两池电极反应式分别为A极:4Ag++4e-===4Ag;
B极:4OH--4e-===2H2O+O2↑;
C极:Cu2++2e-===Cu;
D极:2Cl--2e-===Cl2↑。
A、C两极析出物质的物质的量分别为0.025
mol和0.012
5
mol,B极析出O2的体积(标准状况)为0.006
25
mol×22.4
L·mol-1=0.14
L=140
mL。
1.用石墨电极电解100
mL
H2SO4和CuSO4混合溶液,通电一段时间后,两极均收集到2.24
L气体(标准状况),原混合溶液中Cu2+的物质的量浓度为
A.1
mol·L-1
B.2
mol·L-1
C.3
mol·L-1
D.4
mol·L-1
1
2
3
跟踪训练
√
解析 根据题给信息可知,阴极上首先发生反应Cu2++2e-===Cu,然后发生反应2H++2e-===H2↑;
阳极上发生反应2H2O-4e-===4H++O2↑。
因为在阴极上收集到H2,则说明溶液中Cu2+已完全放电,
根据得失电子守恒计算,阴极上放出0.1
mol
H2需要0.2
mol电子,阳极失去0.4
mol电子放出0.1
mol
O2,
所以阴极上有0.1
mol
Cu2+放电得到0.2
mol电子,
1
2
3
2.如图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4NaOH===2Na2CO3+6H2O。
1
2
3
请回答下列问题:
(1)图中甲、乙两池的名称:甲池是_______装置,乙池是_______装置。
原电池
电解池
(2)下列电极的名称:通入CH3OH的电极名称是_____,B(石墨)电极的名称是_____。
(3)写出电极反应式:
①通入O2的电极的电极反应式是________________________;
1
2
3
②A(石墨)电极的电极反应式为_______
___________。
负极
阳极
O2+2H2O+4e-===4OH-
2H++
2e-===H2↑
(4)乙池中反应的化学方程式为____________________________________。
(5)若反应结束后乙池中A(石墨)电极上共收集到气体0.050
mol,则甲池中理论上消耗O2_____
mL(标准状况下)。
1
2
3
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
560
解析 甲池是以CH3OH为燃料的燃料电池,乙池是以石墨为电极电解饱和食盐水的电解装置。根据电子守恒
O2~4e-~2H2
1
mol
2
mol
n(O2)
0.050
mol
n(O2)=0.025
mol V(O2)=0.56
L=560
mL。
1
2
3
1
2
3
3.电解装置如图所示。图中B装置盛有1
L
2
mol·L-1的Na2SO4溶液,A装置中盛有1
L
2
mol·L-1AgNO3溶液,通电后,湿润的淀粉-KI试纸的C端变蓝色。电解一段时间后,试回答:
1
2
3
(1)A装置中发生反应的化学方程式为______________________________
_________。
4AgNO3+2H2O
4Ag+O2↑
+4HNO3
1
2
3
解析 A装置中Fe为阴极:4Ag++4e-===4Ag;
Pt为阳极:4OH--4e-===2H2O+O2↑,
故反应的化学方程式为4AgNO3+2H2O
4Ag+O2↑+4HNO3。
1
2
3
(2)在B装置中观察到的现象是_____________________________________
____________________________________________________________。
接通电源后,铜棒周围开始变为蓝色,石
墨棒上有无色气泡产生,一段时间后,U形管底部出现蓝色絮状沉淀
解析 B装置中Cu为阳极:Cu-2e-===Cu2+,石墨为阴极:2H++2e-===H2↑,阴极H+放电,剩余OH-与阳极生成的Cu2+在U形管底部相遇生成沉淀:Cu2++2OH-===Cu(OH)2↓。
1
2
3
(3)室温下若从电解开始到时间t时,A、B两装置中共收集到0.168
L(标准状况)气体。若电解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A装置溶液中酸的浓度为______________。
0.01
mol·L-1
解析 4HNO3~4e-~O2~2H2
4
mol
22.4
L+22.4
L×2
n(HNO3)
0.168
L
n(HNO3)=0.01
mol,
本课结束
