高中化学苏教版(2019)选择性必修1专题1 专题知识体系构建与核心素养提升(25张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1专题1 专题知识体系构建与核心素养提升(25张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 736.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-03 20:16:39 | ||
图片预览







文档简介
(共25张PPT)
专题知识体系构建与核心素养提升
内容索引
知识体系构建
核心素养提升
知识体系构建
1.化学反应的热效应
化学反应中的热量变化
化学
反应
的热
效应
本质原因:化学反应是旧键断裂和新键形成的过程
焓变:符号为ΔH,单位是kJ·mol-1或J·mol-1
吸热反应:ΔH>0
放热反应:ΔH<0
反应热的测量:一般利用量热计进行测量
反应热的计算:可利用盖斯定律计算无法直接测量
的反应热
热化学
方程式
化学
反应
的热
效应
概念:能够表示反应热的化学方程式
①注明各物质的聚集状态
②化学计量数可以是整数,也可以是分数
③注明温度、压强(25
℃、101
kPa时可以不注明)
④标出ΔH的数值、符号和单位
书写
应用:反应热计算的依据
燃料的燃
烧利用
①标准燃烧热:在101
kPa下,1
mol物质完全燃烧的反
应热
②热值:1
g物质完全燃烧的反应热
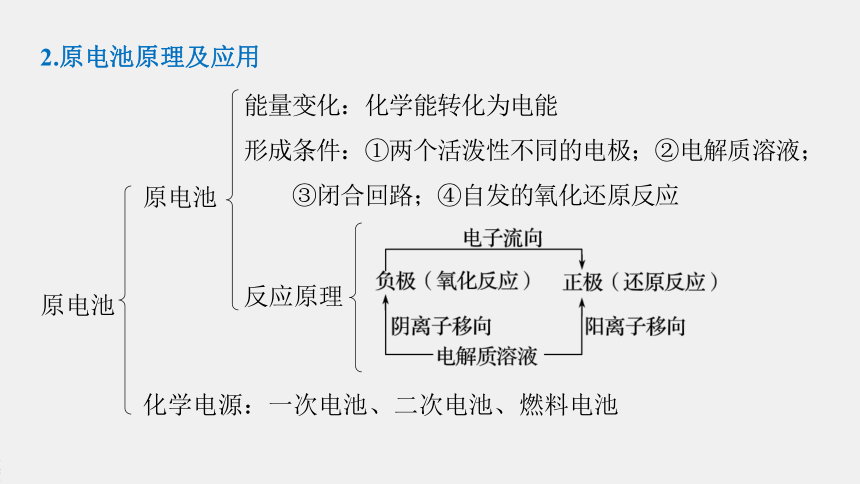
2.原电池原理及应用
原电池
原电池
能量变化:化学能转化为电能
形成条件:①两个活泼性不同的电极;②电解质溶液;
③闭合回路;④自发的氧化还原反应
反应原理
化学电源:一次电池、二次电池、燃料电池
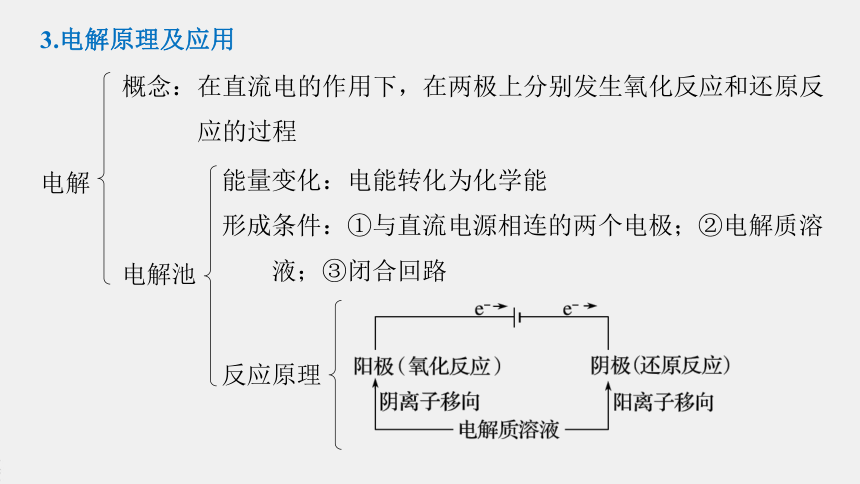
3.电解原理及应用
电解
概念:在直流电的作用下,在两极上分别发生氧化反应和还原反
应的过程
反应原理
电解池
能量变化:电能转化为化学能
形成条件:①与直流电源相连的两个电极;②电解质溶
液;③闭合回路
电解
电镀
应用
氯碱工业:2NaCl+2H2O
2NaOH+H2↑+Cl2↑
概念:应用电解的原理在某些金属或其他材料制品
表面镀上一薄层其他金属或合金的过程
形成条件:①待镀金属制品作阴极;②镀层金属作
阳极;③电镀液中含有镀层金属离子
4.金属的腐蚀与防护
金
属
的
腐
蚀
与
防
护
返回
核心素养提升
研究热化学反应,不仅能从宏观上认识新物质的生成和能量的变化,还要从微观上分析其变化的本质,并能形成能量可以相互转化的变化观念和能量守恒的思想。通过建立相关的思维模型,能正确书写热化学方程式,理解盖斯定律及其应用。认识能源与日常生活、工农业生产及科学技术有着千丝万缕的联系,形成科学合理利用化学反应中能量变化的意识和能源节约的意识。
电化学中涉及的化学反应,不仅有新物质生成,而且还伴有能量之间的转化。要多角度、动态地去分析电化学中的化学反应,既能从宏观上观察认识电化学装置(原电池和电解池)中发生的变化现象,又能从微观的角度(电子的转移、离子的移向等)分析其反应的本质(氧化还原反应)。利用典型的原电池装置和电解池装置,分析其原理,建立相关的思维模型,并能运用模型分析解决问题,如:原电池及其正负极的判定、电解问题的分析方法、电解规律的应用、电解的计算等。
伴随着绿色能源的倡导使用,新型电池技术日新月异,要学会分析认识各种新情境电池(或新型电池)问题的方法。认识电解对社会发展的重大贡献,结合金属的腐蚀与防护和废旧电池的回收利用等问题,既能关注与化学有关的社会问题,认识环境保护的重要性,具有可持续发展意识和绿色化学观念;又能运用所学的化学知识和方法对有关的热点问题作出正确的价值判断。
综上所述,本专题内容的学习对促进“变化观念与平衡思想”“宏观辨识与微观探析”“证据推理与模型认知”“科学探究与创新意识”“科学态度与社会责任”化学核心素养的发展具有重要的价值。
例1 (2020·全国卷Ⅱ,12)电致变色器件可智能调控太阳光透过率,从而实现节能。如图是某电致变色器件的示意图。当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错误的是
典例剖析
A.Ag为阳极
B.Ag+由银电极向变色层迁移
C.W元素的化合价升高
D.总反应为:WO3+xAg===AgxWO3
√
解析 根据题给信息,通电时Ag+注入无色WO3薄膜中,生成AgxWO3,可得Ag为阳极,失去电子发生氧化反应,Ag-e-===Ag+,Ag+通过固体电解质向变色层迁移,总反应为WO3+xAg===AgxWO3,A、B、D正确;
WO3得xe-生成WO
,W元素的化合价降低,C错误。
例2 (2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
√
解析 阴极得电子,A错误;
金属M失电子,其活动性应比铁强,B错误;
M失去的电子流入钢铁设施表面,钢铁设施不易
失去电子而被保护,C正确;
海水中所含电解质的浓度远大于河水中的,因此钢铁设施在海水中被腐蚀的速率快,D错误。
例3 [2020·新高考全国卷Ⅰ(山东),10]微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
A.负极反应为CH3COO-+2H2O-8e-===
2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交
换膜
C.当电路中转移1
mol电子时,模拟海水理论
上除盐58.5
g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
√
解析 由装置示意图可知,负极区CH3COO-发生氧化反应生成CO2和H+,A项正确;
隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,才能使模拟海水中的氯离子移向负极,钠离子移向正极,达到海水淡化的目的,B项错误;
电路中有1
mol
电子通过,则电解质溶液中有1
mol钠离子移向正极,1
mol氯离子移向负极,C项正确;
负极产生CO2:CH3COO-+2H2O-8e-===2CO2↑+7H+,正极产生H2:2H++2e-===H2↑,根据电荷守恒,正、负极产生气体的物质的量之比为2∶1,D项正确。
例4 (2021·长沙雅礼中学高二开学考试)图甲是一种利用微生物将废水中的尿素(H2NCONH2,氮元素显-3价)的化学能直接转化为电能,生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜(图乙),下列说法不正确的是
A.H+透过质子交换膜由左向右移动
B.M电极反应式:H2NCONH2+H2O
-6e-===CO2↑+N2↑+6H+
C.当N电极消耗0.5
mol气体时,则铁电极增重32
g
D.N电极发生还原反应,图乙中铜电极应与Y相连接
√
解析 A项,M是负极,N是正极,H+透过质子交换膜由M极(左)移向N极(右),正确;
B项,H2NCONH2在负极M上失电子
发生氧化反应,生成氮气、二氧化碳和水,电极反应式为H2NCONH2+H2O-6e-===CO2↑+N2↑+6H+,正确;
C项,当N电极消耗0.5
mol氧气时,则转移0.5
mol×4=2.0
mol电子,所以铁电极增重
mol×64
g·mol-1=64
g,错误;
D项,N是正极,发生还原反应,铁上镀铜,则铁为阴极,应与负极(X)相连,铜为阳极,应与正极(Y)相连,正确。
例5 [2020·新高考全国卷Ⅰ(山东),18(1)]探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)
CH3OH(g)+H2O(g)
ΔH1=-49.5
kJ·mol-1
Ⅱ.CO(g)+2H2(g)
CH3OH(g)
ΔH2=-90.4
kJ·mol-1
Ⅲ.CO2(g)+H2(g)
CO(g)+H2O(g) ΔH3
回答下列问题:
ΔH3=______
kJ·mol-1。
40.9
解析 由盖斯定律可知,Ⅲ式=Ⅰ式-Ⅱ式,即ΔH3=-49.5
kJ·mol-1-(-90.4
kJ·mol-1)=40.9
kJ·mol-1。
例6 (2020·浙江7月选考,27)100
mL
0.200
mol·L-1
CuSO4溶液与1.95
g锌粉在量热计中充分反应。测得反应前温度为20.1
℃,反应后最高温度为30.1
℃。
已知:反应前后,溶液的比热容均近似为4.18
J·g-1·℃-1、溶液的密度均近似为1.00
g·cm-3,忽略溶液体积、质量变化和金属吸收的热量。
请计算:
(1)反应放出的热量Q=___________
J。
4.18×103
解析 根据题意,Q=cmΔt=4.18
J·g-1·℃-1×100
g×(30.1-20.1)
℃=4.18×103
J。
(2)反应Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)的ΔH=
______________________________
kJ·mol-1(列式计算)。
解析 1.95
g锌的物质的量为0.03
mol,100
mL
0.200
mol·L-1
CuSO4溶液中铜离子的物质的量为0.02
mol,所以锌过量,据(1)计算ΔH=
=-209
kJ·mol-1。
返回
本课结束
专题知识体系构建与核心素养提升
内容索引
知识体系构建
核心素养提升
知识体系构建
1.化学反应的热效应
化学反应中的热量变化
化学
反应
的热
效应
本质原因:化学反应是旧键断裂和新键形成的过程
焓变:符号为ΔH,单位是kJ·mol-1或J·mol-1
吸热反应:ΔH>0
放热反应:ΔH<0
反应热的测量:一般利用量热计进行测量
反应热的计算:可利用盖斯定律计算无法直接测量
的反应热
热化学
方程式
化学
反应
的热
效应
概念:能够表示反应热的化学方程式
①注明各物质的聚集状态
②化学计量数可以是整数,也可以是分数
③注明温度、压强(25
℃、101
kPa时可以不注明)
④标出ΔH的数值、符号和单位
书写
应用:反应热计算的依据
燃料的燃
烧利用
①标准燃烧热:在101
kPa下,1
mol物质完全燃烧的反
应热
②热值:1
g物质完全燃烧的反应热
2.原电池原理及应用
原电池
原电池
能量变化:化学能转化为电能
形成条件:①两个活泼性不同的电极;②电解质溶液;
③闭合回路;④自发的氧化还原反应
反应原理
化学电源:一次电池、二次电池、燃料电池
3.电解原理及应用
电解
概念:在直流电的作用下,在两极上分别发生氧化反应和还原反
应的过程
反应原理
电解池
能量变化:电能转化为化学能
形成条件:①与直流电源相连的两个电极;②电解质溶
液;③闭合回路
电解
电镀
应用
氯碱工业:2NaCl+2H2O
2NaOH+H2↑+Cl2↑
概念:应用电解的原理在某些金属或其他材料制品
表面镀上一薄层其他金属或合金的过程
形成条件:①待镀金属制品作阴极;②镀层金属作
阳极;③电镀液中含有镀层金属离子
4.金属的腐蚀与防护
金
属
的
腐
蚀
与
防
护
返回
核心素养提升
研究热化学反应,不仅能从宏观上认识新物质的生成和能量的变化,还要从微观上分析其变化的本质,并能形成能量可以相互转化的变化观念和能量守恒的思想。通过建立相关的思维模型,能正确书写热化学方程式,理解盖斯定律及其应用。认识能源与日常生活、工农业生产及科学技术有着千丝万缕的联系,形成科学合理利用化学反应中能量变化的意识和能源节约的意识。
电化学中涉及的化学反应,不仅有新物质生成,而且还伴有能量之间的转化。要多角度、动态地去分析电化学中的化学反应,既能从宏观上观察认识电化学装置(原电池和电解池)中发生的变化现象,又能从微观的角度(电子的转移、离子的移向等)分析其反应的本质(氧化还原反应)。利用典型的原电池装置和电解池装置,分析其原理,建立相关的思维模型,并能运用模型分析解决问题,如:原电池及其正负极的判定、电解问题的分析方法、电解规律的应用、电解的计算等。
伴随着绿色能源的倡导使用,新型电池技术日新月异,要学会分析认识各种新情境电池(或新型电池)问题的方法。认识电解对社会发展的重大贡献,结合金属的腐蚀与防护和废旧电池的回收利用等问题,既能关注与化学有关的社会问题,认识环境保护的重要性,具有可持续发展意识和绿色化学观念;又能运用所学的化学知识和方法对有关的热点问题作出正确的价值判断。
综上所述,本专题内容的学习对促进“变化观念与平衡思想”“宏观辨识与微观探析”“证据推理与模型认知”“科学探究与创新意识”“科学态度与社会责任”化学核心素养的发展具有重要的价值。
例1 (2020·全国卷Ⅱ,12)电致变色器件可智能调控太阳光透过率,从而实现节能。如图是某电致变色器件的示意图。当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错误的是
典例剖析
A.Ag为阳极
B.Ag+由银电极向变色层迁移
C.W元素的化合价升高
D.总反应为:WO3+xAg===AgxWO3
√
解析 根据题给信息,通电时Ag+注入无色WO3薄膜中,生成AgxWO3,可得Ag为阳极,失去电子发生氧化反应,Ag-e-===Ag+,Ag+通过固体电解质向变色层迁移,总反应为WO3+xAg===AgxWO3,A、B、D正确;
WO3得xe-生成WO
,W元素的化合价降低,C错误。
例2 (2020·江苏,11)将金属M连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是
A.阴极的电极反应式为Fe-2e-===Fe2+
B.金属M的活动性比Fe的活动性弱
C.钢铁设施表面因积累大量电子而被保护
D.钢铁设施在河水中的腐蚀速率比在海水中的快
√
解析 阴极得电子,A错误;
金属M失电子,其活动性应比铁强,B错误;
M失去的电子流入钢铁设施表面,钢铁设施不易
失去电子而被保护,C正确;
海水中所含电解质的浓度远大于河水中的,因此钢铁设施在海水中被腐蚀的速率快,D错误。
例3 [2020·新高考全国卷Ⅰ(山东),10]微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是
A.负极反应为CH3COO-+2H2O-8e-===
2CO2↑+7H+
B.隔膜1为阳离子交换膜,隔膜2为阴离子交
换膜
C.当电路中转移1
mol电子时,模拟海水理论
上除盐58.5
g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
√
解析 由装置示意图可知,负极区CH3COO-发生氧化反应生成CO2和H+,A项正确;
隔膜1为阴离子交换膜,隔膜2为阳离子交换膜,才能使模拟海水中的氯离子移向负极,钠离子移向正极,达到海水淡化的目的,B项错误;
电路中有1
mol
电子通过,则电解质溶液中有1
mol钠离子移向正极,1
mol氯离子移向负极,C项正确;
负极产生CO2:CH3COO-+2H2O-8e-===2CO2↑+7H+,正极产生H2:2H++2e-===H2↑,根据电荷守恒,正、负极产生气体的物质的量之比为2∶1,D项正确。
例4 (2021·长沙雅礼中学高二开学考试)图甲是一种利用微生物将废水中的尿素(H2NCONH2,氮元素显-3价)的化学能直接转化为电能,生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜(图乙),下列说法不正确的是
A.H+透过质子交换膜由左向右移动
B.M电极反应式:H2NCONH2+H2O
-6e-===CO2↑+N2↑+6H+
C.当N电极消耗0.5
mol气体时,则铁电极增重32
g
D.N电极发生还原反应,图乙中铜电极应与Y相连接
√
解析 A项,M是负极,N是正极,H+透过质子交换膜由M极(左)移向N极(右),正确;
B项,H2NCONH2在负极M上失电子
发生氧化反应,生成氮气、二氧化碳和水,电极反应式为H2NCONH2+H2O-6e-===CO2↑+N2↑+6H+,正确;
C项,当N电极消耗0.5
mol氧气时,则转移0.5
mol×4=2.0
mol电子,所以铁电极增重
mol×64
g·mol-1=64
g,错误;
D项,N是正极,发生还原反应,铁上镀铜,则铁为阴极,应与负极(X)相连,铜为阳极,应与正极(Y)相连,正确。
例5 [2020·新高考全国卷Ⅰ(山东),18(1)]探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率。以CO2、H2为原料合成CH3OH涉及的主要反应如下:
Ⅰ.CO2(g)+3H2(g)
CH3OH(g)+H2O(g)
ΔH1=-49.5
kJ·mol-1
Ⅱ.CO(g)+2H2(g)
CH3OH(g)
ΔH2=-90.4
kJ·mol-1
Ⅲ.CO2(g)+H2(g)
CO(g)+H2O(g) ΔH3
回答下列问题:
ΔH3=______
kJ·mol-1。
40.9
解析 由盖斯定律可知,Ⅲ式=Ⅰ式-Ⅱ式,即ΔH3=-49.5
kJ·mol-1-(-90.4
kJ·mol-1)=40.9
kJ·mol-1。
例6 (2020·浙江7月选考,27)100
mL
0.200
mol·L-1
CuSO4溶液与1.95
g锌粉在量热计中充分反应。测得反应前温度为20.1
℃,反应后最高温度为30.1
℃。
已知:反应前后,溶液的比热容均近似为4.18
J·g-1·℃-1、溶液的密度均近似为1.00
g·cm-3,忽略溶液体积、质量变化和金属吸收的热量。
请计算:
(1)反应放出的热量Q=___________
J。
4.18×103
解析 根据题意,Q=cmΔt=4.18
J·g-1·℃-1×100
g×(30.1-20.1)
℃=4.18×103
J。
(2)反应Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)的ΔH=
______________________________
kJ·mol-1(列式计算)。
解析 1.95
g锌的物质的量为0.03
mol,100
mL
0.200
mol·L-1
CuSO4溶液中铜离子的物质的量为0.02
mol,所以锌过量,据(1)计算ΔH=
=-209
kJ·mol-1。
返回
本课结束
