高中化学苏教版(2019)选择性必修1专题2 第一单元 微专题5 化学反应速率的计算和比较(14张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1专题2 第一单元 微专题5 化学反应速率的计算和比较(14张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 715.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-03 00:00:00 | ||
图片预览






文档简介
(共14张PPT)
微专题5
化学反应速率的计算和比较
1.化学反应速率的计算
特别提醒 ①如果题目中给出的是物质的量的变化量,在计算化学反应速率时应先除以体积,转化为浓度的变化量。
②对反应物:Δc(转化)=c(起始)-c(某时刻)。
③对生成物:Δc(转化)=c(某时刻)-c(起始)。
(2)运用同一反应中“速率之比等于化学计量数之比”的规律进行计算
对于一个化学反应:mA+nB===pC+qD,
(3)“三段式”法求化学反应速率的解题模式
计算反应速率一般用“三段思维法
”,即从起始
、转化
、某时刻量的情况来考虑,这种方法的优点在于各物质物质的量的浓度及变化非常清晰,一目了然。
mA(g)+nB(g)
pC(g)+qD(g)
c始/(mol·L-1) a b
0 0
c转/(mol·L-1)
mx
nx
px
qx
ct/(mol·L-1)
a-mx
b-nx
px
qx
再利用化学反应速率的定义求算。
2.化学反应速率的比较方法
(1)定性比较
通过明显的实验现象如反应的剧烈程度、产生气泡或沉淀的快慢、固体消失或气体充满所需时间的长短等来定性判断化学反应的快慢。如K与水反应比Na与水反应剧烈,则反应速率:K>Na。
(2)定量比较
对同一化学反应,用不同物质表示化学反应速率时,数值可能不同,因此比较化学反应速率的大小时不能只看数值,还要进行一定的转化,具体有如下两种方法:
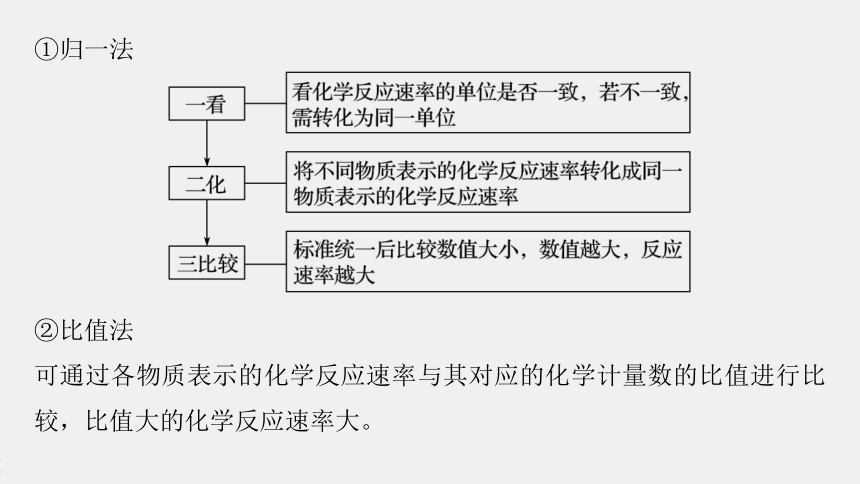
①归一法
②比值法
可通过各物质表示的化学反应速率与其对应的化学计量数的比值进行比较,比值大的化学反应速率大。
1.反应:4A(s)+3B(g)===2C(g)+D(g),经2
min后,B的浓度减少0.6
mol·L-1。对此反应速率的表示正确的是
A.用A表示的反应速率是0.4
mol·L-1·min-1
B.分别用B、C、D表示的反应速率之比是3∶2∶1
C.在2
min时的反应速率,用B表示是0.3
mol·L-1·min-1
D.在2
min内的反应速率,用C表示是-0.2
mol·L-1·min-1
1
2
3
4
跟踪训练
解析 化学反应速率是一段时间内的平均反应速率,不是瞬时反应速率,只能取正值;不能用固体或纯液体表示某一反应的反应速率。
√
2.在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)
2NO2(g),若N2O4的浓度由0.1
mol·L-1降到0.07
mol·L-1需要15
s,那么N2O4的浓度由0.07
mol·L-1降到0.05
mol·L-1所需的反应时间
A.等于5
s
B.等于10
s
C.小于10
s
D.大于10
s
1
2
3
4
√
解析 N2O4的浓度由0.1
mol·L-1降到0.07
mol·L-1需要15
s,
即N2O4的浓度变化为(0.1-0.07)mol·L-1=0.03
mol·L-1,N2O4的浓度由0.07
mol·L-1降到0.05
mol·L-1,
即N2O4的浓度变化为(0.07-0.05)mol·L-1=0.02
mol·L-1,
1
2
3
4
但随着浓度的减小,反应速率逐渐减小,故所需时间大于10
s。
1
2
3
4
3.一定温度下,10
mL
0.40
mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6
min内的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10
min内的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6
min时,c(H2O2)=0.30
mol·L-1
D.反应至6
min时,H2O2分解了50%
√
1
2
3
4
4.反应A(g)+3B(g)
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.15
mol·L-1·min-1
②v(B)=0.01
mol·L-1·s-1
③v(C)=0.40
mol·L-1·min-1
④v(D)=0.45
mol·L-1·min-1
则该反应在不同情况下进行的快慢顺序为______________。
1
2
3
4
④>③=②>①
解析 方法一:将以不同物质表示的反应速率换算为用同一物质同一单位表示的速率,再比较速率数值的大小。
若以物质A为标准,根据用不同物质表示同一反应的速率时,速率之比等于各物质的化学计量数之比,将②③④的反应速率换算为用物质A表示的反应速率,则有:
故反应在不同情况下进行的快慢顺序为④>③=②>①。
1
2
3
4
方法二:首先将反应速率单位统一为mol·L-1·min-1,则②v(B)=0.60
mol·
L-1·min-1,然后根据反应速率与对应物质化学计量数之比的大小进行判断。由化学方程式A(g)+3B(g)
2C(g)+2D(g)得出:
故反应在不同情况下进行的快慢顺序为④>③=②>①。
1
2
3
4
本课结束
微专题5
化学反应速率的计算和比较
1.化学反应速率的计算
特别提醒 ①如果题目中给出的是物质的量的变化量,在计算化学反应速率时应先除以体积,转化为浓度的变化量。
②对反应物:Δc(转化)=c(起始)-c(某时刻)。
③对生成物:Δc(转化)=c(某时刻)-c(起始)。
(2)运用同一反应中“速率之比等于化学计量数之比”的规律进行计算
对于一个化学反应:mA+nB===pC+qD,
(3)“三段式”法求化学反应速率的解题模式
计算反应速率一般用“三段思维法
”,即从起始
、转化
、某时刻量的情况来考虑,这种方法的优点在于各物质物质的量的浓度及变化非常清晰,一目了然。
mA(g)+nB(g)
pC(g)+qD(g)
c始/(mol·L-1) a b
0 0
c转/(mol·L-1)
mx
nx
px
qx
ct/(mol·L-1)
a-mx
b-nx
px
qx
再利用化学反应速率的定义求算。
2.化学反应速率的比较方法
(1)定性比较
通过明显的实验现象如反应的剧烈程度、产生气泡或沉淀的快慢、固体消失或气体充满所需时间的长短等来定性判断化学反应的快慢。如K与水反应比Na与水反应剧烈,则反应速率:K>Na。
(2)定量比较
对同一化学反应,用不同物质表示化学反应速率时,数值可能不同,因此比较化学反应速率的大小时不能只看数值,还要进行一定的转化,具体有如下两种方法:
①归一法
②比值法
可通过各物质表示的化学反应速率与其对应的化学计量数的比值进行比较,比值大的化学反应速率大。
1.反应:4A(s)+3B(g)===2C(g)+D(g),经2
min后,B的浓度减少0.6
mol·L-1。对此反应速率的表示正确的是
A.用A表示的反应速率是0.4
mol·L-1·min-1
B.分别用B、C、D表示的反应速率之比是3∶2∶1
C.在2
min时的反应速率,用B表示是0.3
mol·L-1·min-1
D.在2
min内的反应速率,用C表示是-0.2
mol·L-1·min-1
1
2
3
4
跟踪训练
解析 化学反应速率是一段时间内的平均反应速率,不是瞬时反应速率,只能取正值;不能用固体或纯液体表示某一反应的反应速率。
√
2.在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)
2NO2(g),若N2O4的浓度由0.1
mol·L-1降到0.07
mol·L-1需要15
s,那么N2O4的浓度由0.07
mol·L-1降到0.05
mol·L-1所需的反应时间
A.等于5
s
B.等于10
s
C.小于10
s
D.大于10
s
1
2
3
4
√
解析 N2O4的浓度由0.1
mol·L-1降到0.07
mol·L-1需要15
s,
即N2O4的浓度变化为(0.1-0.07)mol·L-1=0.03
mol·L-1,N2O4的浓度由0.07
mol·L-1降到0.05
mol·L-1,
即N2O4的浓度变化为(0.07-0.05)mol·L-1=0.02
mol·L-1,
1
2
3
4
但随着浓度的减小,反应速率逐渐减小,故所需时间大于10
s。
1
2
3
4
3.一定温度下,10
mL
0.40
mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6
min内的平均反应速率:v(H2O2)≈3.3×10-2mol·L-1·min-1
B.6~10
min内的平均反应速率:v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6
min时,c(H2O2)=0.30
mol·L-1
D.反应至6
min时,H2O2分解了50%
√
1
2
3
4
4.反应A(g)+3B(g)
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.15
mol·L-1·min-1
②v(B)=0.01
mol·L-1·s-1
③v(C)=0.40
mol·L-1·min-1
④v(D)=0.45
mol·L-1·min-1
则该反应在不同情况下进行的快慢顺序为______________。
1
2
3
4
④>③=②>①
解析 方法一:将以不同物质表示的反应速率换算为用同一物质同一单位表示的速率,再比较速率数值的大小。
若以物质A为标准,根据用不同物质表示同一反应的速率时,速率之比等于各物质的化学计量数之比,将②③④的反应速率换算为用物质A表示的反应速率,则有:
故反应在不同情况下进行的快慢顺序为④>③=②>①。
1
2
3
4
方法二:首先将反应速率单位统一为mol·L-1·min-1,则②v(B)=0.60
mol·
L-1·min-1,然后根据反应速率与对应物质化学计量数之比的大小进行判断。由化学方程式A(g)+3B(g)
2C(g)+2D(g)得出:
故反应在不同情况下进行的快慢顺序为④>③=②>①。
1
2
3
4
本课结束
