高中化学苏教版(2019)选择性必修1专题2 第一单元 微专题6 化学反应历程与化学反应速率(15张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1专题2 第一单元 微专题6 化学反应历程与化学反应速率(15张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 761.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-03 20:30:07 | ||
图片预览





文档简介
(共15张PPT)
微专题6
化学反应历程与化学反应速率
1.基元反应、过渡态理论及活化能
(1)基元反应:研究发现,大多数化学反应并不是
经过简单碰撞就能完成,往往要经过多个反应步
骤才能实现。每一步反应都称为基元反应。
(2)过渡态理论:过渡态理论认为,反应物分子并
不只是通过简单碰撞直接形成产物,而是必须经
过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要一定的活化能。这与爬山类似,山的最高点便是过渡态。
2.多步反应的活化能及与速率的关系
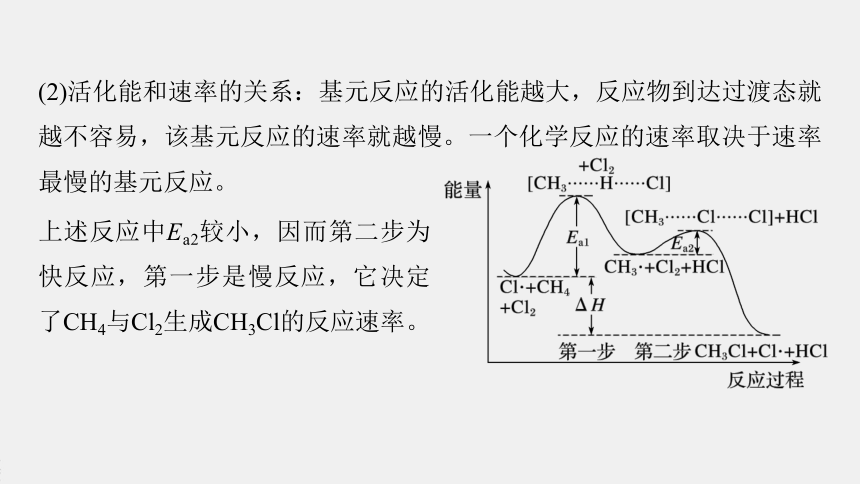
(1)多步反应的活化能:反应物转化为生成物的过程中要经过能量较高的过渡态。过渡态的平均能量与反应物分子的平均能量的差为反应的活化能(如图所示)。
图中表示CH4与Cl2生成CH3Cl的反应过程中各物质的能量变化,Ea1表示第一步反应的活化能,Ea2表示第二步反应的活化能,ΔH是CH4与Cl2生成CH3Cl两步总反应的反应热。
(2)活化能和速率的关系:基元反应的活化能越大,反应物到达过渡态就越不容易,该基元反应的速率就越慢。一个化学反应的速率取决于速率最慢的基元反应。
上述反应中Ea2较小,因而第二步为快反应,第一步是慢反应,它决定了CH4与Cl2生成CH3Cl的反应速率。
3.催化剂对化学反应速率的影响
催化剂是通过降低反应所需的活化能来增大反应速率的。如图所示,没有催化剂参与的反应,活化能(Ea2)较大,则反应速率较小;而有催化剂参与的反应,活化能(Ea1)较小,则反应速率较大。
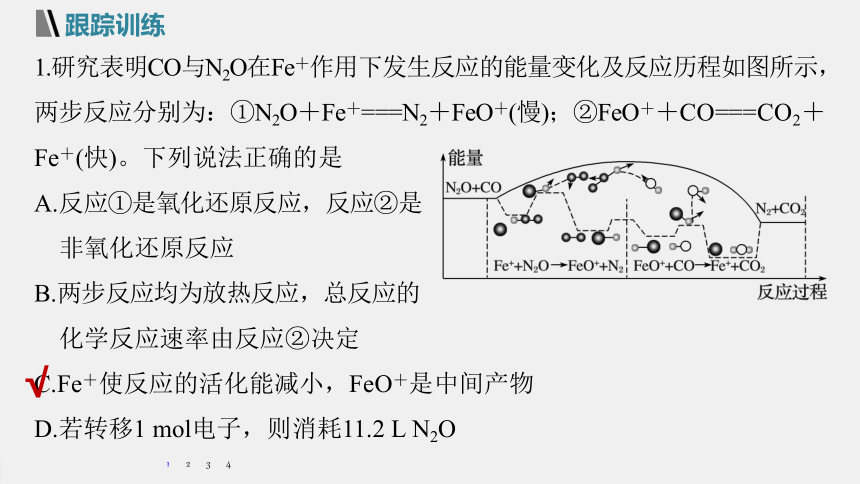
1.研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为:①N2O+Fe+===N2+FeO+(慢);②FeO++CO===CO2+Fe+(快)。下列说法正确的是
1
2
3
4
跟踪训练
A.反应①是氧化还原反应,反应②是
非氧化还原反应
B.两步反应均为放热反应,总反应的
化学反应速率由反应②决定
C.Fe+使反应的活化能减小,FeO+是中间产物
D.若转移1
mol电子,则消耗11.2
L
N2O
√
1
2
3
4
解析 反应②FeO++CO===CO2+Fe+(快),元素化合价发生变化,属于氧化还原反应,故A项错误;
总反应速率由反应慢的一步决定,即由反应①决定,故B项错误;
Fe+作催化剂,使反应的活化能减小,FeO+是中间产物,故C项正确;
气体存在的条件未知,不能确定气体的体积,故D项错误。
2.pH>10时,CO2与OH-的反应历程如下:
①CO2+OH-
HCO
ΔH1(慢反应);
②HCO
+OH-
CO
+H2O ΔH2(瞬间完成)。
下列说法错误的是
A.①的活化能大于②的活化能
B.ΔH1一定大于0,ΔH2一定小于0
C.总反应的焓变为ΔH1+ΔH2
D.总反应的速率由①决定
1
2
3
4
√
解析 反应①的速率较慢,证明反应①需要的活化能大于反应②的活化能,故A正确;
焓变大于零或者小于零与反应快慢无关,只与反应是吸热或放热有关,所以无法判断,故B错误;
根据盖斯定律可知,总反应的焓变为ΔH1+ΔH2,故C正确;
总反应的速率由反应慢的一步决定,所以该反应的总反应速率由①决定,故D正确。
1
2
3
4
1
2
3
4
3.(2021·安徽芜湖单元测试)反应4HBr(g)+O2(g)===2H2O(g)+2Br2(g)的能量与反应历程的关系如图所示:
下列说法错误的是
A.HOOBr和HOBr均是反应的中
间体
B.活化能最大的步骤反应为HBr(g)
+O2(g)===HOOBr(g)
C.三步反应中,第一步反应的速率最慢
D.用E表示键能,该反应的ΔH=2E(Br—Br)+4E(H—O)-4E(H—Br)-
E(O==O)
√
1
2
3
4
解析 由图可得HOOBr和HOBr均是反应的中间体,A项正确;
第一步反应的活化能最大,发生反应4HBr(g)+O2(g)===3HBr(g)+HOOBr(g),简化为HBr(g)+O2(g)===HOOBr(g),B项正确;
第一步反应的活化能最大,反应速率最慢,C项正确;
ΔH=反应物的总键能-生成物的总键能,D项错误。
4.(2021·湖南模拟)活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O2反应过程的能量变化如图所示。下列说法正确的是
1
2
3
4
A.该反应为吸热反应
B.产物的稳定性:P1>P2
C.该过程中最大正反应的活化能
E正=186.19
kJ·mol-1
D.相同条件下,由中间产物Z转
化为产物的速率:v(P1)√
1
2
3
4
解析 根据图像可知,此反应的反应物的总能量大于生成物的总能量,故此反应是放热反应,故A错误;
物质的能量越高越不稳定,根据图像可知,产物P1的能量高于产物P2的能量,故产物的稳定性:P11
2
3
4
最大的正反应的活化能出现在由中间产物Z到过渡态Ⅳ时,即最大正反应的活化能E正=-18.92
kJ·
mol-1-(-205.11
kJ·mol-1)=186.19
kJ·mol-1,故C正确;
相同条件下,反应所需的活化能越小,则反应的速率越快,由于到产物P1所需活化能小,故反应速率快,v(P1)>v(P2),故D错误。
本课结束
微专题6
化学反应历程与化学反应速率
1.基元反应、过渡态理论及活化能
(1)基元反应:研究发现,大多数化学反应并不是
经过简单碰撞就能完成,往往要经过多个反应步
骤才能实现。每一步反应都称为基元反应。
(2)过渡态理论:过渡态理论认为,反应物分子并
不只是通过简单碰撞直接形成产物,而是必须经
过一个形成活化络合物的过渡状态,并且达到这个过渡状态需要一定的活化能。这与爬山类似,山的最高点便是过渡态。
2.多步反应的活化能及与速率的关系
(1)多步反应的活化能:反应物转化为生成物的过程中要经过能量较高的过渡态。过渡态的平均能量与反应物分子的平均能量的差为反应的活化能(如图所示)。
图中表示CH4与Cl2生成CH3Cl的反应过程中各物质的能量变化,Ea1表示第一步反应的活化能,Ea2表示第二步反应的活化能,ΔH是CH4与Cl2生成CH3Cl两步总反应的反应热。
(2)活化能和速率的关系:基元反应的活化能越大,反应物到达过渡态就越不容易,该基元反应的速率就越慢。一个化学反应的速率取决于速率最慢的基元反应。
上述反应中Ea2较小,因而第二步为快反应,第一步是慢反应,它决定了CH4与Cl2生成CH3Cl的反应速率。
3.催化剂对化学反应速率的影响
催化剂是通过降低反应所需的活化能来增大反应速率的。如图所示,没有催化剂参与的反应,活化能(Ea2)较大,则反应速率较小;而有催化剂参与的反应,活化能(Ea1)较小,则反应速率较大。
1.研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分别为:①N2O+Fe+===N2+FeO+(慢);②FeO++CO===CO2+Fe+(快)。下列说法正确的是
1
2
3
4
跟踪训练
A.反应①是氧化还原反应,反应②是
非氧化还原反应
B.两步反应均为放热反应,总反应的
化学反应速率由反应②决定
C.Fe+使反应的活化能减小,FeO+是中间产物
D.若转移1
mol电子,则消耗11.2
L
N2O
√
1
2
3
4
解析 反应②FeO++CO===CO2+Fe+(快),元素化合价发生变化,属于氧化还原反应,故A项错误;
总反应速率由反应慢的一步决定,即由反应①决定,故B项错误;
Fe+作催化剂,使反应的活化能减小,FeO+是中间产物,故C项正确;
气体存在的条件未知,不能确定气体的体积,故D项错误。
2.pH>10时,CO2与OH-的反应历程如下:
①CO2+OH-
HCO
ΔH1(慢反应);
②HCO
+OH-
CO
+H2O ΔH2(瞬间完成)。
下列说法错误的是
A.①的活化能大于②的活化能
B.ΔH1一定大于0,ΔH2一定小于0
C.总反应的焓变为ΔH1+ΔH2
D.总反应的速率由①决定
1
2
3
4
√
解析 反应①的速率较慢,证明反应①需要的活化能大于反应②的活化能,故A正确;
焓变大于零或者小于零与反应快慢无关,只与反应是吸热或放热有关,所以无法判断,故B错误;
根据盖斯定律可知,总反应的焓变为ΔH1+ΔH2,故C正确;
总反应的速率由反应慢的一步决定,所以该反应的总反应速率由①决定,故D正确。
1
2
3
4
1
2
3
4
3.(2021·安徽芜湖单元测试)反应4HBr(g)+O2(g)===2H2O(g)+2Br2(g)的能量与反应历程的关系如图所示:
下列说法错误的是
A.HOOBr和HOBr均是反应的中
间体
B.活化能最大的步骤反应为HBr(g)
+O2(g)===HOOBr(g)
C.三步反应中,第一步反应的速率最慢
D.用E表示键能,该反应的ΔH=2E(Br—Br)+4E(H—O)-4E(H—Br)-
E(O==O)
√
1
2
3
4
解析 由图可得HOOBr和HOBr均是反应的中间体,A项正确;
第一步反应的活化能最大,发生反应4HBr(g)+O2(g)===3HBr(g)+HOOBr(g),简化为HBr(g)+O2(g)===HOOBr(g),B项正确;
第一步反应的活化能最大,反应速率最慢,C项正确;
ΔH=反应物的总键能-生成物的总键能,D项错误。
4.(2021·湖南模拟)活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O2反应过程的能量变化如图所示。下列说法正确的是
1
2
3
4
A.该反应为吸热反应
B.产物的稳定性:P1>P2
C.该过程中最大正反应的活化能
E正=186.19
kJ·mol-1
D.相同条件下,由中间产物Z转
化为产物的速率:v(P1)
1
2
3
4
解析 根据图像可知,此反应的反应物的总能量大于生成物的总能量,故此反应是放热反应,故A错误;
物质的能量越高越不稳定,根据图像可知,产物P1的能量高于产物P2的能量,故产物的稳定性:P1
2
3
4
最大的正反应的活化能出现在由中间产物Z到过渡态Ⅳ时,即最大正反应的活化能E正=-18.92
kJ·
mol-1-(-205.11
kJ·mol-1)=186.19
kJ·mol-1,故C正确;
相同条件下,反应所需的活化能越小,则反应的速率越快,由于到产物P1所需活化能小,故反应速率快,v(P1)>v(P2),故D错误。
本课结束
