高中化学苏教版(2019)选择性必修1专题2 专题知识体系构建与核心素养提升(28张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1专题2 专题知识体系构建与核心素养提升(28张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 772.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-03 20:43:41 | ||
图片预览







文档简介
(共28张PPT)
专题知识体系构建与核心素养提升
内容索引
知识体系构建
核心素养提升
知识体系构建
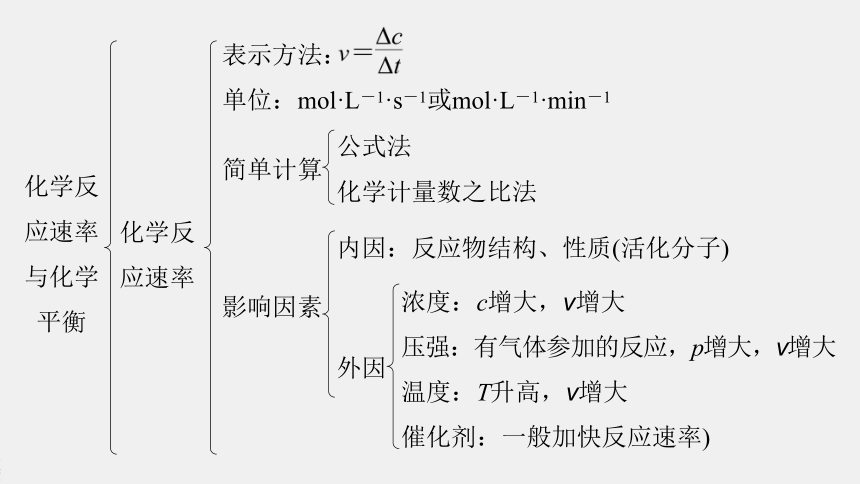
化学反应速率
化学反应速率与化学平衡
表示方法:
单位:mol·L-1·s-1或mol·L-1·min-1
简单计算
公式法
化学计量数之比法
影响因素
内因:反应物结构、性质(活化分子)
外因
浓度:c增大,v增大
压强:有气体参加的反应,p增大,v增大
温度:T升高,v增大
催化剂:一般加快反应速率)
化学反应进行的方向
化学反应速率与化学平衡
焓判据:使体系能量降低的方向,就是反应容易进行的
方向
熵判据:使体系熵增大的方向,就是反应容易进行的方向
ΔG<0,反应自发进行
ΔG>0,反应不能自发进行
ΔG=0,反应达到平衡
复合判据
(ΔG=ΔH-TΔS)
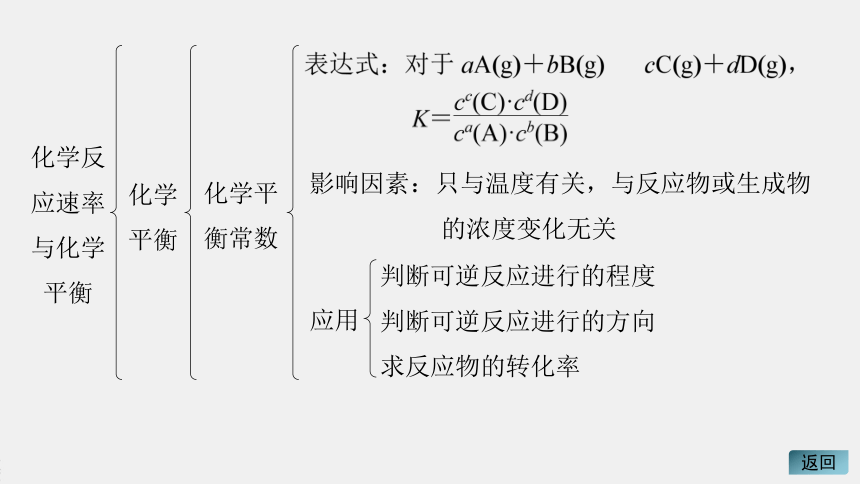
化学平衡
化学反应速率与化学平衡
概念:可逆反应、条件一定,v正=v逆,各组分浓度不变特征:逆、动、等、定、变
原因:外界条件(浓度、压强、温度)改变,v正
=v逆―→v正≠v逆
结果:再次v正=v逆,各成分的含量又不变
方向:依据勒夏特列原理判断
移动因果
化学平衡
化学反应速率与化学平衡
影响因素:只与温度有关,与反应物或生成物
的浓度变化无关
化学平衡常数
应用
判断可逆反应进行的程度
判断可逆反应进行的方向
求反应物的转化率
返回
核心素养提升
本专题充分体现了化学核心素养中的“变化观念与平衡思想”。化学反应在达到平衡前,体系中的相关物质的量一直存在着趋向于达到平衡的变化过程,即使是达到平衡状态后,体系中的物质相互之间仍然存在着各种变化。例如,向密闭容器中通入一定量的SO2(g)和O2(g),在催化剂作用下生成SO3(g),该反应过程中SO2(g)、O2(g)的体积分数逐渐减小,而SO3(g)的体积分数逐渐增大,这体现了化学反应中的“变化观念”;而反应达到平衡后,SO2(g)、O2(g)、SO3(g)的体积分数保持不变,但反应仍在进行,这体现了化学反应中的“平衡思想”。因此,在学习过程中要抓住本质,即应用“变化观念与平衡思想”,从不同视角对纷繁复杂的化学变化进行分类研究,逐步揭示各类化学变化的特征和规律;能用对立统一、联系发展和动态平衡的观点分析化学平衡。
在学习过程中,还应注意通过分析探究外界因素对化学反应速率和化学平衡的影响,理清证据与结论之间的关系,并能根据化学反应速率和化学平衡的知识规律构建模型,建立分析解决各种相关问题的思维框架,促进“证据推理与模型认知”等化学核心素养的发展。
例1 利用传感技术可以探究压强对2NO2(g)
N2O4(g)化学平衡移动的影响。在室温、100
kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是
典例剖析
A.B点处NO2的转化率为3%
B.E点到H点的过程中,NO2的物质的量先
增大后减小
C.E、H两点对应的正反应速率大小为vHD.B、E两点气体的平均相对分子质量大小为MB>ME
√
解析 由图可知B点处压强为97
kPa,设起始二氧化氮为1
mol,转化率为α,由题意建立如下三段式:
2NO2(g)
N2O4(g)
起/mol
1 0
变/mol
α
0.5α
平/mol
1-α
??0.5α
即二氧化氮的转化率为6%,故A错误;
对于有气体参加的反应,压强越大反应速率越大,由图可知,H点压强大于E点,则正反应速率vH>vE,故C错误;
由图可知,B到E的过程为压强减小的过程,减小压强平衡向生成二氧化氮的
方向移动,气体的物质的量增大,由质量守恒定律可知气体质量不变,则混合气体的平均相对分子质量减小,即MB>ME,故D正确。
例2 甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
解析 根据盖斯定律计算:计算反应Ⅱ的反应热ΔH2=ΔH1+ΔH3=85.2
kJ·mol-1-241.8
kJ·mol-1=-156.6
kJ·mol-1。
(1)计算反应Ⅱ的反应热ΔH2=_________________。
-156.6
kJ·mol-1
(2)750
K下,在恒容密闭容器中,发生反应CH3OH(g)
HCHO(g)+H2(g),若起始压强为p0,达到平衡时转化率为α,则平衡时的总压强p平=__________(用含p0和α的式子表示);当p0=101
kPa,测得α=50.0%,计算反应平衡常数Kp=_______kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其他反应)。
p0(1+α)
50.5
解析 若起始压强为p0,达到平衡时转化率为α,
CH3OH(g)
HCHO(g)+H2(g)
起始量/mol
1
0
0
变化量/mol
α ???α ?α
平衡时/mol
1-α ?α ?α
压强之比等于物质的量之比,则p0∶p平=1∶(1+α),p平=p0(1+α);
当p0=101
kPa,测得α=50.0%,
(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH―→·H+·CH2OH
历程ⅱ:·CH2OH―→·H+HCHO
历程ⅲ:·CH2OH―→3·H+CO
历程ⅳ:·H+·H―→H2
右图表示一定条件下温度对碳酸钠催化
脱氢性能的影响,回答下列问题:
①从平衡角度解析550~650
℃甲醇生成甲醛的转化率随温度升高的原因__________________________________________________________________。
甲醇脱氢反应为吸热反应,升高温度,有利于脱氢反应向正反应方向进行
解析 从平衡角度可知,550~650
℃甲醇生成甲醛的转化率随温度升高的原因是:甲醇脱氢反应为吸热反应,升高温度,有利于脱氢反应向正反应方向进行;
②反应历程i的活化能____(填“>”“<”或“=”)CH3OH(g)
HCHO(g)+H2(g)的活化能。
<
③650~750
℃,反应历程ii的速率____(填“>”“<”或“=”)反应历程ⅲ的速率。
解析 由图可知650~750
℃,甲醇的转化率变大,但甲醛的选择性变小,反应历程ii的速率小于反应历程ⅲ的速率。
<
例3 在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0
mol·L-1,在一定条件下发生反应:CO2(g)+CH4(g)
2CO(g)+2H2(g)。测得平衡
时CH4的体积分数与温度及压强的关系如图1所示。回答下列问题:
(1)该反应的ΔH_____(填“<”“>”或“=”)0。
>
解析 由图1可知,压强不变时,升高温度,CH4的体积分数减小,平衡右移,说明正反应为吸热反应,则ΔH>0。
(2)压强p1、p2、p3由大到小的顺序为____________;压强为p2时,b点处v正_____(填“<”“>”或“=”)v逆。
p3>p2>p1
>
解析 经三条等压线作一条垂线,会有三个交点,如图,交点分别为m、n、p;
由p点→n点→m点,甲烷的体积分数依次增大,根据反应体系特征,说明体系压强逐渐增大,则p1<p2<p3。
b点→a点需要使CH4的体积分数减小,才能建立平衡,故反应正向进行,v正>v逆。
(3)a点时CH4的转化率为________。
80%
(4)为探究速率与浓度的关系,根据相关实验数据,粗略地绘制出了两条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO),如图2。
①与曲线v正~c(CH4)相对应的是图中曲线________(填“甲”或“乙”)。
②降低温度,反应重新达到平衡时,v正、v逆相应的平衡点分别为________(填字母)。
乙
B、F
解析 由于反应开始只加入了反应物,结合平衡建立的过程可知,甲曲线为v逆~c(CO),乙曲线为v正~c(CH4),降温后平衡逆向移动,正、逆反应速率都要减小,而c(CH4)要增大,c(CO)要减小,综合考虑,只有B、F符合题意。
返回
本课结束
专题知识体系构建与核心素养提升
内容索引
知识体系构建
核心素养提升
知识体系构建
化学反应速率
化学反应速率与化学平衡
表示方法:
单位:mol·L-1·s-1或mol·L-1·min-1
简单计算
公式法
化学计量数之比法
影响因素
内因:反应物结构、性质(活化分子)
外因
浓度:c增大,v增大
压强:有气体参加的反应,p增大,v增大
温度:T升高,v增大
催化剂:一般加快反应速率)
化学反应进行的方向
化学反应速率与化学平衡
焓判据:使体系能量降低的方向,就是反应容易进行的
方向
熵判据:使体系熵增大的方向,就是反应容易进行的方向
ΔG<0,反应自发进行
ΔG>0,反应不能自发进行
ΔG=0,反应达到平衡
复合判据
(ΔG=ΔH-TΔS)
化学平衡
化学反应速率与化学平衡
概念:可逆反应、条件一定,v正=v逆,各组分浓度不变特征:逆、动、等、定、变
原因:外界条件(浓度、压强、温度)改变,v正
=v逆―→v正≠v逆
结果:再次v正=v逆,各成分的含量又不变
方向:依据勒夏特列原理判断
移动因果
化学平衡
化学反应速率与化学平衡
影响因素:只与温度有关,与反应物或生成物
的浓度变化无关
化学平衡常数
应用
判断可逆反应进行的程度
判断可逆反应进行的方向
求反应物的转化率
返回
核心素养提升
本专题充分体现了化学核心素养中的“变化观念与平衡思想”。化学反应在达到平衡前,体系中的相关物质的量一直存在着趋向于达到平衡的变化过程,即使是达到平衡状态后,体系中的物质相互之间仍然存在着各种变化。例如,向密闭容器中通入一定量的SO2(g)和O2(g),在催化剂作用下生成SO3(g),该反应过程中SO2(g)、O2(g)的体积分数逐渐减小,而SO3(g)的体积分数逐渐增大,这体现了化学反应中的“变化观念”;而反应达到平衡后,SO2(g)、O2(g)、SO3(g)的体积分数保持不变,但反应仍在进行,这体现了化学反应中的“平衡思想”。因此,在学习过程中要抓住本质,即应用“变化观念与平衡思想”,从不同视角对纷繁复杂的化学变化进行分类研究,逐步揭示各类化学变化的特征和规律;能用对立统一、联系发展和动态平衡的观点分析化学平衡。
在学习过程中,还应注意通过分析探究外界因素对化学反应速率和化学平衡的影响,理清证据与结论之间的关系,并能根据化学反应速率和化学平衡的知识规律构建模型,建立分析解决各种相关问题的思维框架,促进“证据推理与模型认知”等化学核心素养的发展。
例1 利用传感技术可以探究压强对2NO2(g)
N2O4(g)化学平衡移动的影响。在室温、100
kPa条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞并保持活塞位置不变,测定针筒内气体压强变化如图所示。下列说法正确的是
典例剖析
A.B点处NO2的转化率为3%
B.E点到H点的过程中,NO2的物质的量先
增大后减小
C.E、H两点对应的正反应速率大小为vH
√
解析 由图可知B点处压强为97
kPa,设起始二氧化氮为1
mol,转化率为α,由题意建立如下三段式:
2NO2(g)
N2O4(g)
起/mol
1 0
变/mol
α
0.5α
平/mol
1-α
??0.5α
即二氧化氮的转化率为6%,故A错误;
对于有气体参加的反应,压强越大反应速率越大,由图可知,H点压强大于E点,则正反应速率vH>vE,故C错误;
由图可知,B到E的过程为压强减小的过程,减小压强平衡向生成二氧化氮的
方向移动,气体的物质的量增大,由质量守恒定律可知气体质量不变,则混合气体的平均相对分子质量减小,即MB>ME,故D正确。
例2 甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
解析 根据盖斯定律计算:计算反应Ⅱ的反应热ΔH2=ΔH1+ΔH3=85.2
kJ·mol-1-241.8
kJ·mol-1=-156.6
kJ·mol-1。
(1)计算反应Ⅱ的反应热ΔH2=_________________。
-156.6
kJ·mol-1
(2)750
K下,在恒容密闭容器中,发生反应CH3OH(g)
HCHO(g)+H2(g),若起始压强为p0,达到平衡时转化率为α,则平衡时的总压强p平=__________(用含p0和α的式子表示);当p0=101
kPa,测得α=50.0%,计算反应平衡常数Kp=_______kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其他反应)。
p0(1+α)
50.5
解析 若起始压强为p0,达到平衡时转化率为α,
CH3OH(g)
HCHO(g)+H2(g)
起始量/mol
1
0
0
变化量/mol
α ???α ?α
平衡时/mol
1-α ?α ?α
压强之比等于物质的量之比,则p0∶p平=1∶(1+α),p平=p0(1+α);
当p0=101
kPa,测得α=50.0%,
(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH―→·H+·CH2OH
历程ⅱ:·CH2OH―→·H+HCHO
历程ⅲ:·CH2OH―→3·H+CO
历程ⅳ:·H+·H―→H2
右图表示一定条件下温度对碳酸钠催化
脱氢性能的影响,回答下列问题:
①从平衡角度解析550~650
℃甲醇生成甲醛的转化率随温度升高的原因__________________________________________________________________。
甲醇脱氢反应为吸热反应,升高温度,有利于脱氢反应向正反应方向进行
解析 从平衡角度可知,550~650
℃甲醇生成甲醛的转化率随温度升高的原因是:甲醇脱氢反应为吸热反应,升高温度,有利于脱氢反应向正反应方向进行;
②反应历程i的活化能____(填“>”“<”或“=”)CH3OH(g)
HCHO(g)+H2(g)的活化能。
<
③650~750
℃,反应历程ii的速率____(填“>”“<”或“=”)反应历程ⅲ的速率。
解析 由图可知650~750
℃,甲醇的转化率变大,但甲醛的选择性变小,反应历程ii的速率小于反应历程ⅲ的速率。
<
例3 在恒容密闭容器中通入CH4与CO2,使其物质的量浓度均为1.0
mol·L-1,在一定条件下发生反应:CO2(g)+CH4(g)
2CO(g)+2H2(g)。测得平衡
时CH4的体积分数与温度及压强的关系如图1所示。回答下列问题:
(1)该反应的ΔH_____(填“<”“>”或“=”)0。
>
解析 由图1可知,压强不变时,升高温度,CH4的体积分数减小,平衡右移,说明正反应为吸热反应,则ΔH>0。
(2)压强p1、p2、p3由大到小的顺序为____________;压强为p2时,b点处v正_____(填“<”“>”或“=”)v逆。
p3>p2>p1
>
解析 经三条等压线作一条垂线,会有三个交点,如图,交点分别为m、n、p;
由p点→n点→m点,甲烷的体积分数依次增大,根据反应体系特征,说明体系压强逐渐增大,则p1<p2<p3。
b点→a点需要使CH4的体积分数减小,才能建立平衡,故反应正向进行,v正>v逆。
(3)a点时CH4的转化率为________。
80%
(4)为探究速率与浓度的关系,根据相关实验数据,粗略地绘制出了两条速率—浓度关系曲线:v正~c(CH4)和v逆~c(CO),如图2。
①与曲线v正~c(CH4)相对应的是图中曲线________(填“甲”或“乙”)。
②降低温度,反应重新达到平衡时,v正、v逆相应的平衡点分别为________(填字母)。
乙
B、F
解析 由于反应开始只加入了反应物,结合平衡建立的过程可知,甲曲线为v逆~c(CO),乙曲线为v正~c(CH4),降温后平衡逆向移动,正、逆反应速率都要减小,而c(CH4)要增大,c(CO)要减小,综合考虑,只有B、F符合题意。
返回
本课结束
