2021-2022学年高一化学鲁科版(2019)必修第一册3.3.2 氨的转化与生成 课件 (30张ppt)
文档属性
| 名称 | 2021-2022学年高一化学鲁科版(2019)必修第一册3.3.2 氨的转化与生成 课件 (30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 58.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-04 21:46:50 | ||
图片预览










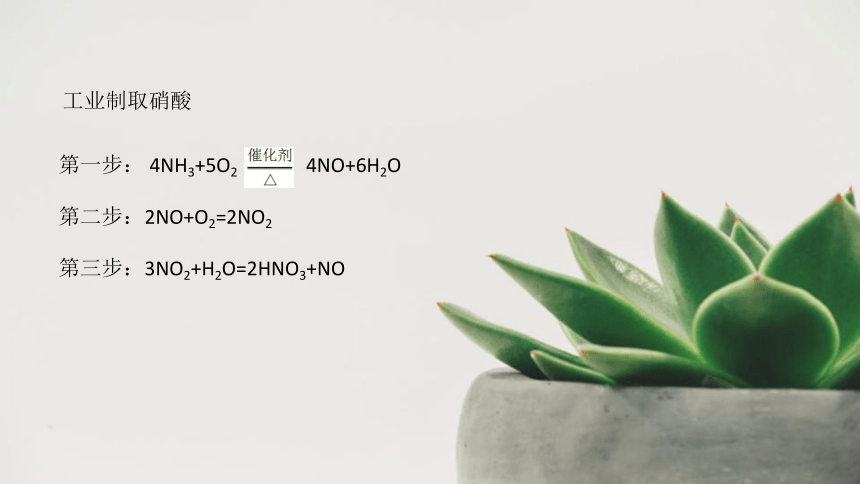

文档简介
(共30张PPT)
第三章
物质的性质与转化
第三节
氮的循环
第2课时
氨的转化与生成
1.如何吸收弥漫在空气中的大量氨气?
2.被围困在污染区的群众怎样做才能避免吸入氨气?
洒水
疏散到地势较低处
观看视频后思考:
二、氨的转化与生成
1.氨气(NH3)
(1)物理性质:
无色、易液化(液氨常用作致冷剂),有刺激性气味的气体;在标准状况下,密度为0.771
g
·
L-1,比空气小;极易溶于水且能快速溶解,常温、常压下1体积水能溶解约700体积氨气。
任务一:实现从氨气到其他含氮化合物的转化
预期转化
设计思路
选取试剂
实验现象
得出结论
NH3
NH3·H2O
(2)氨气的化学性质
氨气的转化与生成
氨气的应用非常广泛,氨气的转化与生成也就成为人们关注的课题。那么,以氨气为原料,如何将其转化为在农业生产中有着广泛应用的氨水、氯化铵和硝酸?另外,哪些含有氮元素的物质能够转化为氨气?
根据上述问题设计完整的实验方案,实施部分实验,实现氨气的转化与生成。
活动·探究
实验现象
烧杯中的水进入烧瓶形成喷泉,烧瓶内液体呈现红色。
实验操作
打开止水夹,挤压滴管的胶头,使少量水进入圆底烧瓶。
实验原理
少量水溶解大量气体,使烧瓶内外在短时间内迅速产生较大的压强差,利用大气压将烧杯中的液体压入烧瓶内
喷泉实验
1.装置气密性好
2.烧瓶要干燥
3.气体要充满烧瓶
实验成功的关键
①与H2O反应:
NH3+H2O
NH3·H2O
NH4++OH-
(一水合氨)
氨水的成分:
NH3、H2O、NH3·H2O
;NH4+、OH-、H+
一水合氨是弱碱,能使酚酞试液变红
使湿润的红色石蕊试纸变蓝
氨气的检验:
预期转化
设计思路
选取试剂
实验现象
得出结论
NH3
NH4Cl
②与酸的反应
NH3+HCl
====
NH4Cl
2NH3+H2SO4
====
(NH4)2SO4
NH3+HNO3
====
NH4NO3
大量白烟
预期转化
设计思路
选取试剂
实验现象
得出结论
NH3
NO
NO2
HNO3
③
NH3的催化氧化
4NH3+5O2
====
4NO+6H2O
催化剂
注意:
①反应条件:催化剂、加热
②是工业制硝酸中的关键一步,也叫氨的催化氧化
③说明氨有一定的还原性,可被O2、Cl2、CuO等氧化
工业制取硝酸
第一步:
4NH3+5O2
4NO+6H2O
第二步:2NO+O2=2NO2
第三步:3NO2+H2O=2HNO3+NO
2.氨气的生成
(1)铵盐的分解
①加热NH4Cl
NH4Cl
===
NH3+
HCl
△
②加热NH4HCO3
NH4HCO3
===
NH3↑+CO2
↑
+
H2O
△
(2)铵盐与碱反应
NH4+
+OH-===
NH3↑
+
H2O
△
氨的实验室制法
2NH4Cl+Ca(OH)2====
CaCl2+2NH3↑+2H2O
△
1.原理:
2.气体发生装置:
固+固,加热型
防止空气
对流
3.干燥装置:
用碱石灰干燥
4.收集装置:
向下排空气法
5.尾气处理:
用水或浓硫酸吸收多余的氨气
6.验满:
a:使湿润的红色石蕊试纸变蓝(唯一的一种碱性气体)
b:蘸有浓HCl的玻璃棒接近试管口产生白烟
铵根离子检验
化学原理:铵盐与浓碱反应生成氨气。
检验方法:取少量溶液于小试管中,滴加浓氢氧化钠溶液,加热,若产生的气体能使湿润的红色石蕊试纸变蓝,就可以判断该物质是铵盐。
氨的用途
制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料
致冷剂
3.氨的用途
4.氮肥
(1)化学氮肥
(2)氮肥能够促进作物生长,并提高作物中蛋白质的含量。
铵态氮肥→主要成分NH4+
硝态氮肥→主要成分NO3-
有机态氮肥→尿素
课堂小结
1.下列关于氨气的叙述,错误的是( )
A.氨气极易溶解于水
B.氨气可以使湿润的蓝色石蕊试纸变红色
C.氨气具有还原性
D.可以用玻璃棒蘸取浓盐酸检验氨气的存在
B
课堂练习
2.下列方法适合实验室制取氨气的是( )
A.N2和H2催化加热制取氨气
B.加热NH4Cl制取氨气
C.向碱石灰固体上滴加浓氨水
D.将NH4Cl溶液和NaOH溶液混合
C
3.下列离子方程式书写正确的是( )
A.实验室用氯化铵和熟石灰制氨:NH4++OH-==NH3↑+H2O
B.NaOH溶液与NH4Cl溶液混合加热:NH4+
+OH-==NH3·H2O
C.氨水中加盐酸:NH3·H2O+H+===NH4++H2O
D.氨水中加入氯化铁溶液:Fe2++2NH3·H2O===2NH4++Fe(OH)2↓
C
4.某同学仿照“喷泉”实验的原理,在实验室做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可以看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CH4、SO2、NO气体中的两种,则下列判断中正确的是( )
A.X是NH3,Y是HCl
B.X是Cl2,Y是NH3
C.X是SO2,Y是O2
D.X是NO,Y是O2
A
5.为了检验某固体物质中是否含有NH,你认为下列试纸或试剂一定用不到的是( )
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A.①⑤
B.④⑤
C.①③
D.①④⑤
B
6.某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列方法制备氨气,其中合理的是________(填序号,下同)。
A.将氯化铵固体加热分解
B.将浓氨水滴入氢氧化钠固体中
C.将氢氧化钠固体加入浓氨水中
D.将氯化铵稀溶液滴入氢氧化钠固体中
(2)根据上述正确的原理,该同学欲用下列常见的实验室制气装置制取氨气,适宜的装置是________。
B
C
(3)气体的性质是气体收集方法选择的主要依据,下列性质与收集方法无关的是________。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(4)下图是甲同学设计收集氨气的几种装置,其中可行的是________,集气的原理是_________________________________________________________
___________________________________________________________。
d
②
④
利用氨气密度小于空气,采用短管进氨气,长管出空气,即可收集氨气
第三章
物质的性质与转化
第三节
氮的循环
第2课时
氨的转化与生成
1.如何吸收弥漫在空气中的大量氨气?
2.被围困在污染区的群众怎样做才能避免吸入氨气?
洒水
疏散到地势较低处
观看视频后思考:
二、氨的转化与生成
1.氨气(NH3)
(1)物理性质:
无色、易液化(液氨常用作致冷剂),有刺激性气味的气体;在标准状况下,密度为0.771
g
·
L-1,比空气小;极易溶于水且能快速溶解,常温、常压下1体积水能溶解约700体积氨气。
任务一:实现从氨气到其他含氮化合物的转化
预期转化
设计思路
选取试剂
实验现象
得出结论
NH3
NH3·H2O
(2)氨气的化学性质
氨气的转化与生成
氨气的应用非常广泛,氨气的转化与生成也就成为人们关注的课题。那么,以氨气为原料,如何将其转化为在农业生产中有着广泛应用的氨水、氯化铵和硝酸?另外,哪些含有氮元素的物质能够转化为氨气?
根据上述问题设计完整的实验方案,实施部分实验,实现氨气的转化与生成。
活动·探究
实验现象
烧杯中的水进入烧瓶形成喷泉,烧瓶内液体呈现红色。
实验操作
打开止水夹,挤压滴管的胶头,使少量水进入圆底烧瓶。
实验原理
少量水溶解大量气体,使烧瓶内外在短时间内迅速产生较大的压强差,利用大气压将烧杯中的液体压入烧瓶内
喷泉实验
1.装置气密性好
2.烧瓶要干燥
3.气体要充满烧瓶
实验成功的关键
①与H2O反应:
NH3+H2O
NH3·H2O
NH4++OH-
(一水合氨)
氨水的成分:
NH3、H2O、NH3·H2O
;NH4+、OH-、H+
一水合氨是弱碱,能使酚酞试液变红
使湿润的红色石蕊试纸变蓝
氨气的检验:
预期转化
设计思路
选取试剂
实验现象
得出结论
NH3
NH4Cl
②与酸的反应
NH3+HCl
====
NH4Cl
2NH3+H2SO4
====
(NH4)2SO4
NH3+HNO3
====
NH4NO3
大量白烟
预期转化
设计思路
选取试剂
实验现象
得出结论
NH3
NO
NO2
HNO3
③
NH3的催化氧化
4NH3+5O2
====
4NO+6H2O
催化剂
注意:
①反应条件:催化剂、加热
②是工业制硝酸中的关键一步,也叫氨的催化氧化
③说明氨有一定的还原性,可被O2、Cl2、CuO等氧化
工业制取硝酸
第一步:
4NH3+5O2
4NO+6H2O
第二步:2NO+O2=2NO2
第三步:3NO2+H2O=2HNO3+NO
2.氨气的生成
(1)铵盐的分解
①加热NH4Cl
NH4Cl
===
NH3+
HCl
△
②加热NH4HCO3
NH4HCO3
===
NH3↑+CO2
↑
+
H2O
△
(2)铵盐与碱反应
NH4+
+OH-===
NH3↑
+
H2O
△
氨的实验室制法
2NH4Cl+Ca(OH)2====
CaCl2+2NH3↑+2H2O
△
1.原理:
2.气体发生装置:
固+固,加热型
防止空气
对流
3.干燥装置:
用碱石灰干燥
4.收集装置:
向下排空气法
5.尾气处理:
用水或浓硫酸吸收多余的氨气
6.验满:
a:使湿润的红色石蕊试纸变蓝(唯一的一种碱性气体)
b:蘸有浓HCl的玻璃棒接近试管口产生白烟
铵根离子检验
化学原理:铵盐与浓碱反应生成氨气。
检验方法:取少量溶液于小试管中,滴加浓氢氧化钠溶液,加热,若产生的气体能使湿润的红色石蕊试纸变蓝,就可以判断该物质是铵盐。
氨的用途
制氮肥
铵盐
制硝酸
纯碱
有机合成
工业原料
致冷剂
3.氨的用途
4.氮肥
(1)化学氮肥
(2)氮肥能够促进作物生长,并提高作物中蛋白质的含量。
铵态氮肥→主要成分NH4+
硝态氮肥→主要成分NO3-
有机态氮肥→尿素
课堂小结
1.下列关于氨气的叙述,错误的是( )
A.氨气极易溶解于水
B.氨气可以使湿润的蓝色石蕊试纸变红色
C.氨气具有还原性
D.可以用玻璃棒蘸取浓盐酸检验氨气的存在
B
课堂练习
2.下列方法适合实验室制取氨气的是( )
A.N2和H2催化加热制取氨气
B.加热NH4Cl制取氨气
C.向碱石灰固体上滴加浓氨水
D.将NH4Cl溶液和NaOH溶液混合
C
3.下列离子方程式书写正确的是( )
A.实验室用氯化铵和熟石灰制氨:NH4++OH-==NH3↑+H2O
B.NaOH溶液与NH4Cl溶液混合加热:NH4+
+OH-==NH3·H2O
C.氨水中加盐酸:NH3·H2O+H+===NH4++H2O
D.氨水中加入氯化铁溶液:Fe2++2NH3·H2O===2NH4++Fe(OH)2↓
C
4.某同学仿照“喷泉”实验的原理,在实验室做了一个“喷烟”实验,如图所示。他在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的NaOH溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可以看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是HCl、NH3、Cl2、O2、CH4、SO2、NO气体中的两种,则下列判断中正确的是( )
A.X是NH3,Y是HCl
B.X是Cl2,Y是NH3
C.X是SO2,Y是O2
D.X是NO,Y是O2
A
5.为了检验某固体物质中是否含有NH,你认为下列试纸或试剂一定用不到的是( )
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
A.①⑤
B.④⑤
C.①③
D.①④⑤
B
6.某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列方法制备氨气,其中合理的是________(填序号,下同)。
A.将氯化铵固体加热分解
B.将浓氨水滴入氢氧化钠固体中
C.将氢氧化钠固体加入浓氨水中
D.将氯化铵稀溶液滴入氢氧化钠固体中
(2)根据上述正确的原理,该同学欲用下列常见的实验室制气装置制取氨气,适宜的装置是________。
B
C
(3)气体的性质是气体收集方法选择的主要依据,下列性质与收集方法无关的是________。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(4)下图是甲同学设计收集氨气的几种装置,其中可行的是________,集气的原理是_________________________________________________________
___________________________________________________________。
d
②
④
利用氨气密度小于空气,采用短管进氨气,长管出空气,即可收集氨气
