高中化学苏教版(2019)选择性必修1 专题1化学反应与能量变化 第一单元 化学反应的热效应 阶段重点突破练(一)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1 专题1化学反应与能量变化 第一单元 化学反应的热效应 阶段重点突破练(一) |

|
|
| 格式 | docx | ||
| 文件大小 | 253.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-04 00:00:00 | ||
图片预览




文档简介
第一单元化学反应的热效应
阶段重点突破练(一)
一、反应热、焓变概念的理解
1.(2020·甘肃西北师大附中高二月考)氯原子对O3的分解有催化作用:
反应O3+Cl===ClO+O2的焓变为ΔH1,
反应ClO+O===Cl+O2的焓变为ΔH2,
大气臭氧层的分解反应是O3+O===2O2,其焓变为ΔH,该反应的能量变化如图:
下列叙述正确的是( )
A.反应O3+O===2O2的ΔH=E1-E3
B.O3+O===2O2是吸热反应
C.ΔH=ΔH1+ΔH2
D.ΔH=E3-E2>0
2.(2020·成都月考)已知:H2(g)+F2(g)===2HF(g) ΔH=-270
kJ·mol-1,下列说法正确的是( )
A.在相同条件下,1
mol
H2(g)与1
mol
F2(g)的能量总和大于2
mol
HF(g)的能量
B.1
mol
H2(g)与1
mol
F2(g)反应生成2
mol
HF(l)放出的热量小于270
kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用如图来表示
3.已知:
①1
mol晶体硅中含有2
mol
Si—Si键,1
mol
SiO2晶体中含有4
mol
Si—O键。
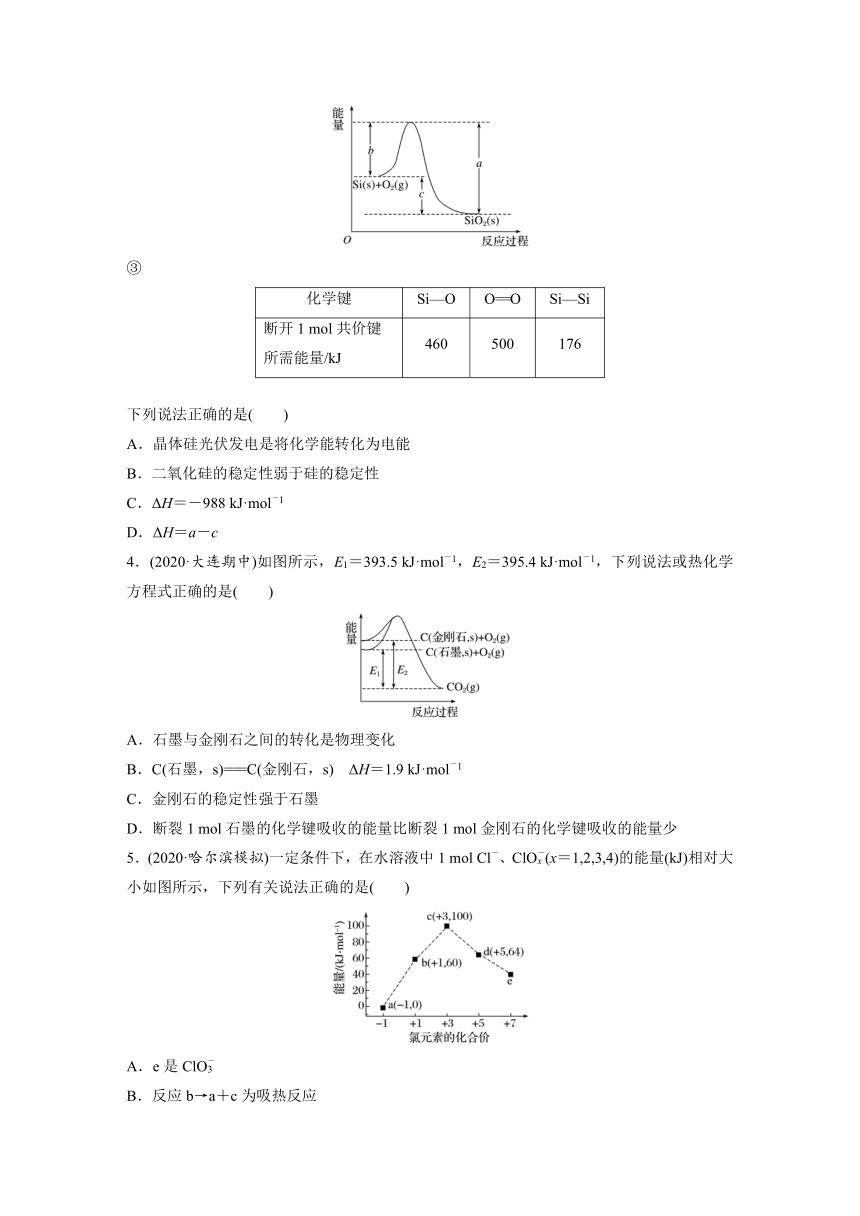
②Si(s)+O2(g)===SiO2(s) ΔH,其反应过程与能量变化如图所示。
③
化学键
Si—O
O==O
Si—Si
断开1
mol共价键
所需能量/kJ
460
500
176
下列说法正确的是( )
A.晶体硅光伏发电是将化学能转化为电能
B.二氧化硅的稳定性弱于硅的稳定性
C.ΔH=-988
kJ·mol-1
D.ΔH=a-c
4.(2020·大连期中)如图所示,E1=393.5
kJ·mol-1,E2=395.4
kJ·mol-1,下列说法或热化学方程式正确的是( )
A.石墨与金刚石之间的转化是物理变化
B.C(石墨,s)===C(金刚石,s) ΔH=1.9
kJ·mol-1
C.金刚石的稳定性强于石墨
D.断裂1
mol石墨的化学键吸收的能量比断裂1
mol金刚石的化学键吸收的能量少
5.(2020·哈尔滨模拟)一定条件下,在水溶液中1
mol
Cl-、ClO(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是( )
A.e是ClO
B.反应b→a+c为吸热反应
C.a、b、c、d中c最稳定
D.反应b→d+a的热化学方程式为3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=-116
kJ·mol-1
二、根据已知信息书写热化学方程式及正误判断
6.下列热化学方程式正确的是(ΔH的绝对值均正确)( )
A.Hg+O2===HgO ΔH=-90.7
kJ·mol-1(反应热)
B.P(s)+Cl2(g)===PCl3(g)
ΔH=-306
kJ·mol-1(反应热)
C.CH3OH(l)+O2(g)===CO2(g)+2H2O(g)
ΔH=-725.76
kJ·mol-1(标准燃烧热)
D.NaOH(aq)+HNO3(aq)===NaNO3(aq)+H2O(l)
ΔH=57.3
kJ·mol-1(中和反应的反应热)
7.(2020·威海高二检测)下列关于热化学反应的描述正确的是( )
A.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3
kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热为ΔH=2×(-57.3)
kJ·mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9
kJ·mol-1,则CH3OH(g)的标准燃烧热为-192.9
kJ·mol-1
C.已知2H2O(g)===2H2(g)+O2(g) ΔH=484
kJ·mol-1,则H2(g)的标准燃烧热是-242
kJ·mol-1
D.葡萄糖的标准燃烧热是-2
800
kJ·mol-1,则C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1
400
kJ·mol-1
三、运用盖斯定律计算焓变及ΔH大小比较
8.已知:a.C2H2(g)+H2(g)===C2H4(g) ΔH<0;b.2CH4(g)===C2H4(g)+2H2(g) ΔH>0。以下三个热化学方程式:
①C(s)+2H2(g)===CH4(g) ΔH1
②C(s)+H2(g)===C2H2(g) ΔH2
③C(s)+H2(g)===C2H4(g) ΔH3
则ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A.ΔH2>ΔH3>ΔH1
B.ΔH3>ΔH2>ΔH1
C.ΔH3>ΔH1>ΔH2
D.ΔH1>ΔH2>ΔH3
9.下列关于反应热的描述正确的是( )
A.HCl和NaOH中和反应的反应热ΔH=-57.3
kJ·mol-1,则H2SO4和Ca(OH)2中和反应的反应热ΔH=2×(-57.3)
kJ·mol-1
B.CO(g)的标准燃烧热是-283.0
kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=(2×283.0)
kJ·mol-1
C.反应热有正负之分,标准燃烧热ΔH全部是正值
D.1
mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的标准燃烧热
10.已知热化学方程式:
①H2(g)+O2(g)===H2O(g) ΔH=a
kJ·mol-1
②H2(g)+O2(g)===H2O(l) ΔH=b
kJ·mol-1
③C(s)+O2(g)===CO(g) ΔH=c
kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=d
kJ·mol-1
关于上面热化学方程式的判断不正确的是( )
A.a、b、c、d都小于0
B.a+c>b+d
C.CO的标准燃烧热为(d-c)kJ·mol-1
D.燃烧10
g
H2最多放出的热量为|5a|
kJ
11.(2020·江苏联考)根据如图所示的物质转化关系,下列说法错误的是( )
A.相同质量的N2H4(g)和N2H4(l),前者具有的能量较高
B.相同质量的NO2(g)和N2O4(g),破坏两种物质中所有的化学键,后者所需的能量高
C.ΔH5=ΔH1+ΔH2+ΔH3+ΔH4
D.N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,则ΔH>ΔH4
12.(2020·重庆南开中学高二期中)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)===2Al2O3(s) ΔH1
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是( )
A.ΔH1>ΔH2
B.ΔH1<ΔH2
C.ΔH1=ΔH2
D.无法计算
四、大题综合练
13.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
化学键
P—P
P—O
O==O
P==O
键能/
(kJ·mol-1)
172
335
498
X
已知白磷的标准燃烧热为-2
378.0
kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:Ⅰ.C(石墨,s)+O2(g)===CO2(g)
ΔH1=-393.5
kJ·mol-1
Ⅱ.2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6
kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2
599.2
kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1
mol
C2H2(g)的焓变为________________。
②已知3.6
g碳在6.4
g的氧气中燃烧,至反应物耗尽,并放出x
kJ热量,已知单质碳的标准燃烧热为-y
kJ·mol-1,则1
mol
C与O2反应生成CO的反应热ΔH为________________。
14.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(1)氢能被称为绿色能源的原因是__________________(任答一点)。
(2)在101
kPa下,1
g氢气完全燃烧生成液态水时放出142.9
kJ的热量,请回答下列问题:
①该反应的反应物总能量________(填“大于”“小于”或“等于”)生成物总能量。
②氢气的标准燃烧热为________________。
③该反应的热化学方程式为_____________________________________________________
_____________________________________________________________________________。
④若1
mol氢气完全燃烧生成1
mol气态水放出241
kJ的热量,已知H—O键能为463
kJ·mol-1,O==O键能为498
kJ·mol-1,计算H—H键能为________kJ·mol-1。
(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5
kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s)
ΔH2=-64.4
kJ·mol-1;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=________
kJ·mol-1。
答案与解析
一、反应热、焓变概念的理解
1.(2020·甘肃西北师大附中高二月考)氯原子对O3的分解有催化作用:
反应O3+Cl===ClO+O2的焓变为ΔH1,
反应ClO+O===Cl+O2的焓变为ΔH2,
大气臭氧层的分解反应是O3+O===2O2,其焓变为ΔH,该反应的能量变化如图:
下列叙述正确的是( )
A.反应O3+O===2O2的ΔH=E1-E3
B.O3+O===2O2是吸热反应
C.ΔH=ΔH1+ΔH2
D.ΔH=E3-E2>0
答案 C
解析 反应热等于生成物的总能量减去反应物的总能量,则反应O3+O===2O2的ΔH=E3-E2,A项错误;由图像可以看出,反应物O3+O的总能量大于2O2的总能量,为放热反应,B项错误;已知:①O3+Cl===ClO+O2 ΔH1;②ClO+O===Cl+O2 ΔH2,利用盖斯定律,①+②可得O3+O===2O2 ΔH=ΔH1+ΔH2,故C正确。
2.(2020·成都月考)已知:H2(g)+F2(g)===2HF(g) ΔH=-270
kJ·mol-1,下列说法正确的是( )
A.在相同条件下,1
mol
H2(g)与1
mol
F2(g)的能量总和大于2
mol
HF(g)的能量
B.1
mol
H2(g)与1
mol
F2(g)反应生成2
mol
HF(l)放出的热量小于270
kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用如图来表示
答案 A
解析 该反应为放热反应,在相同条件下,1
mol
H2(g)与1
mol
F2(g)的能量总和大于2
mol
HF(g)的能量,A项正确;1
mol
H2(g)与1
mol
F2(g)反应生成2
mol
HF(l)放出的热量大于270
kJ,B项错误;该反应的逆反应是吸热反应,C项错误;该反应为放热反应,反应物总能量应比生成物总能量高,D项错误。
3.已知:
①1
mol晶体硅中含有2
mol
Si—Si键,1
mol
SiO2晶体中含有4
mol
Si—O键。
②Si(s)+O2(g)===SiO2(s) ΔH,其反应过程与能量变化如图所示。
③
化学键
Si—O
O==O
Si—Si
断开1
mol共价键
所需能量/kJ
460
500
176
下列说法正确的是( )
A.晶体硅光伏发电是将化学能转化为电能
B.二氧化硅的稳定性弱于硅的稳定性
C.ΔH=-988
kJ·mol-1
D.ΔH=a-c
答案 C
解析 晶体硅光伏发电是将太阳能转化为电能,A错误;根据化学键的键能判断,1
mol二氧化硅中的化学键断裂需要的能量为4×460
kJ=1
840
kJ,1
mol晶体硅中的化学键断裂需要的能量为2×176
kJ=352
kJ,故二氧化硅的稳定性强于硅的稳定性,B错误;ΔH=(176×2+500-460×4)
kJ·mol-1=-988
kJ·mol-1,C正确;根据图中信息可知,ΔH=-c,D错误。
4.(2020·大连期中)如图所示,E1=393.5
kJ·mol-1,E2=395.4
kJ·mol-1,下列说法或热化学方程式正确的是( )
A.石墨与金刚石之间的转化是物理变化
B.C(石墨,s)===C(金刚石,s) ΔH=1.9
kJ·mol-1
C.金刚石的稳定性强于石墨
D.断裂1
mol石墨的化学键吸收的能量比断裂1
mol金刚石的化学键吸收的能量少
答案 B
解析 石墨与金刚石是两种不同的单质,二者之间的转化是化学变化,A项错误;由图可知,1
mol金刚石的能量比1
mol
石墨高395.4
kJ-393.5
kJ=1.9
kJ,故有C(石墨,s)===C(金刚石,s) ΔH=1.9
kJ·mol-1,B项正确;金刚石的能量高于石墨的能量,物质的能量越高越不稳定,C项错误;C(石墨,s)===C(金刚石,s) ΔH=1.9
kJ·mol-1,1
mol石墨的总键能比1
mol金刚石的总键能大1.9
kJ,D项错误。
5.(2020·哈尔滨模拟)一定条件下,在水溶液中1
mol
Cl-、ClO(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是( )
A.e是ClO
B.反应b→a+c为吸热反应
C.a、b、c、d中c最稳定
D.反应b→d+a的热化学方程式为3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=-116
kJ·mol-1
答案 D
解析 e中Cl元素化合价为+7,而ClO中Cl元素化合价为+5,A项错误;a、b、c、d中a的能量最低,所以a最稳定,C项错误;b→d+a为3ClO-(aq)===ClO(aq)+2Cl-(aq),反应热=(64
kJ·mol-1+2×0
kJ·mol-1)-3×60
kJ·mol-1=-116
kJ·mol-1,所以该反应的热化学方程式为3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=-116
kJ·mol-1,D项正确。
二、根据已知信息书写热化学方程式及正误判断
6.下列热化学方程式正确的是(ΔH的绝对值均正确)( )
A.Hg+O2===HgO ΔH=-90.7
kJ·mol-1(反应热)
B.P(s)+Cl2(g)===PCl3(g)
ΔH=-306
kJ·mol-1(反应热)
C.CH3OH(l)+O2(g)===CO2(g)+2H2O(g)
ΔH=-725.76
kJ·mol-1(标准燃烧热)
D.NaOH(aq)+HNO3(aq)===NaNO3(aq)+H2O(l)
ΔH=57.3
kJ·mol-1(中和反应的反应热)
答案 B
解析 热化学方程式中需要注明各物质的聚集状态,A项错误;标准燃烧热是指在101
kPa时,1
mol纯物质完全燃烧的反应热,CH3OH完全燃烧应生成二氧化碳气体和液态水,C项错误;中和反应是放热反应,ΔH应小于0,D项错误。
7.(2020·威海高二检测)下列关于热化学反应的描述正确的是( )
A.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3
kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热为ΔH=2×(-57.3)
kJ·mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9
kJ·mol-1,则CH3OH(g)的标准燃烧热为-192.9
kJ·mol-1
C.已知2H2O(g)===2H2(g)+O2(g) ΔH=484
kJ·mol-1,则H2(g)的标准燃烧热是-242
kJ·mol-1
D.葡萄糖的标准燃烧热是-2
800
kJ·mol-1,则C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1
400
kJ·mol-1
答案 D
解析 A项,H2SO4与Ba(OH)2反应除有H+与OH-反应放热外,生成BaSO4沉淀亦放热,故ΔH<2×(-57.3)
kJ·mol-1;B项,甲醇未完全燃烧,H元素应生成H2O(l);C项,可表示为H2(g)+O2(g)===H2O(g) ΔH=-242
kJ·mol-1,水为气态,不是H2的标准燃烧热;D项,标准燃烧热是指1
mol葡萄糖完全燃烧的反应热,热化学方程式中C6H12O6(s)的化学计量数为,则ΔH=-1
400
kJ·mol-1。
三、运用盖斯定律计算焓变及ΔH大小比较
8.已知:a.C2H2(g)+H2(g)===C2H4(g) ΔH<0;b.2CH4(g)===C2H4(g)+2H2(g) ΔH>0。以下三个热化学方程式:
①C(s)+2H2(g)===CH4(g) ΔH1
②C(s)+H2(g)===C2H2(g) ΔH2
③C(s)+H2(g)===C2H4(g) ΔH3
则ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A.ΔH2>ΔH3>ΔH1
B.ΔH3>ΔH2>ΔH1
C.ΔH3>ΔH1>ΔH2
D.ΔH1>ΔH2>ΔH3
答案 A
解析 利用盖斯定律,(②-③)×2得出:C2H4(g)===C2H2(g)+H2(g) ΔH=2(ΔH2-ΔH3),根据反应a的逆过程为吸热反应,得ΔH2-ΔH3>0,ΔH2>ΔH3;(③-①)×2
得出:2CH4(g)===C2H4(g)+2H2(g) ΔH=2(ΔH3-ΔH1),根据反应b,可知ΔH3-ΔH1>0,ΔH3>ΔH1,故A项正确。
9.下列关于反应热的描述正确的是( )
A.HCl和NaOH中和反应的反应热ΔH=-57.3
kJ·mol-1,则H2SO4和Ca(OH)2中和反应的反应热ΔH=2×(-57.3)
kJ·mol-1
B.CO(g)的标准燃烧热是-283.0
kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=(2×283.0)
kJ·mol-1
C.反应热有正负之分,标准燃烧热ΔH全部是正值
D.1
mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的标准燃烧热
答案 B
10.已知热化学方程式:
①H2(g)+O2(g)===H2O(g) ΔH=a
kJ·mol-1
②H2(g)+O2(g)===H2O(l) ΔH=b
kJ·mol-1
③C(s)+O2(g)===CO(g) ΔH=c
kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=d
kJ·mol-1
关于上面热化学方程式的判断不正确的是( )
A.a、b、c、d都小于0
B.a+c>b+d
C.CO的标准燃烧热为(d-c)kJ·mol-1
D.燃烧10
g
H2最多放出的热量为|5a|
kJ
答案 D
解析 所有燃烧均为放热反应,A正确;气态水比液态水具有的能量高,a>b,完全燃烧能放出更多的能量,c>d,故a+c>b+d,B正确;由④-③可得CO(g)+O2(g)===CO2(g) ΔH=(d-c)
kJ·mol-1,C正确;生成液态水时放出的能量最多,燃烧10
g
H2最多放出的热量为|5b|
kJ,D错误。
11.(2020·江苏联考)根据如图所示的物质转化关系,下列说法错误的是( )
A.相同质量的N2H4(g)和N2H4(l),前者具有的能量较高
B.相同质量的NO2(g)和N2O4(g),破坏两种物质中所有的化学键,后者所需的能量高
C.ΔH5=ΔH1+ΔH2+ΔH3+ΔH4
D.N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,则ΔH>ΔH4
答案 D
解析 N2H4(l)变为N2H4(g)需要吸收热量,故相同质量的N2H4(g)和N2H4(l),N2H4(g)的能量高于N2H4(l),A项正确;NO2(g)===N2O4(g) ΔH3<0,所以破坏1
mol
NO2所含的化学键需要吸收的能量比破坏0.5
mol
N2O4所含的化学键需要吸收的能量低,B项正确;由盖斯定律可知,ΔH5=ΔH1+ΔH2+ΔH3+ΔH4,C项正确;N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,ΔH=ΔH3+ΔH4,因ΔH3<0,故ΔH<ΔH4,D错误。
12.(2020·重庆南开中学高二期中)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)===2Al2O3(s) ΔH1
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是( )
A.ΔH1>ΔH2
B.ΔH1<ΔH2
C.ΔH1=ΔH2
D.无法计算
答案 B
解析 将已知两个热化学方程式依次编号为①②,由盖斯定律可知,①-②可得4Al(s)+2Fe2O3(s)===2Al2O3(s)+4Fe(s) ΔH=ΔH1-ΔH2,铝热反应为放热反应,即ΔH1-ΔH2<0,所以ΔH1<ΔH2,故选B。
四、大题综合练
13.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
化学键
P—P
P—O
O==O
P==O
键能/
(kJ·mol-1)
172
335
498
X
已知白磷的标准燃烧热为-2
378.0
kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:Ⅰ.C(石墨,s)+O2(g)===CO2(g)
ΔH1=-393.5
kJ·mol-1
Ⅱ.2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6
kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2
599.2
kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1
mol
C2H2(g)的焓变为________________。
②已知3.6
g碳在6.4
g的氧气中燃烧,至反应物耗尽,并放出x
kJ热量,已知单质碳的标准燃烧热为-y
kJ·mol-1,则1
mol
C与O2反应生成CO的反应热ΔH为________________。
答案 (1)470
(2)①226.8
kJ·mol-1
②-(5x-0.5y)
kJ·mol-1
解析
(1)由反应P4(s)+5O2(g)===P4O10(s),可知ΔH=6E(P—P)+5E(O==O)-[4E(P==O)+12E(P—O)]可求得P==O的键能。(2)①关键是理解信息,由盖斯定律可知,一个反应的焓变仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关。将Ⅰ×2+Ⅱ×-Ⅲ×,得ΔH=ΔH1×2+ΔH2×-ΔH3×。
14.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(1)氢能被称为绿色能源的原因是__________________(任答一点)。
(2)在101
kPa下,1
g氢气完全燃烧生成液态水时放出142.9
kJ的热量,请回答下列问题:
①该反应的反应物总能量________(填“大于”“小于”或“等于”)生成物总能量。
②氢气的标准燃烧热为________________。
③该反应的热化学方程式为_____________________________________________________
_____________________________________________________________________________。
④若1
mol氢气完全燃烧生成1
mol气态水放出241
kJ的热量,已知H—O键能为463
kJ·mol-1,O==O键能为498
kJ·mol-1,计算H—H键能为________kJ·mol-1。
(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5
kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s)
ΔH2=-64.4
kJ·mol-1;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=________
kJ·mol-1。
答案 (1)无污染(答案合理均可)
(2)①大于 ②-285.8
kJ·mol-1 ③2H2(g)+O2(g)===2H2O(l) ΔH=-571.6
kJ·mol-1 ④436
(3)84.6
解析 (1)氢气燃烧生成水,无污染,为清洁能源等。
(2)①氢气的燃烧为放热反应,则生成物的总能量小于反应物总能量;
②2
g氢气为1
mol,完全燃烧生成液态水放出285.8
kJ的热量,可知H2的标准燃烧热为-285.8
kJ·
mol-1;
③H2的标准燃烧热为-285.8
kJ·mol-1,则热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6
kJ·mol-1;
④2
mol氢气燃烧的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=-482
kJ·mol-1;设1
mol
H—H键完全断裂时吸收热量为x,2x+498
kJ-4×463
kJ=-482
kJ,解得x=436
kJ。
(3)①Mg(s)+H2(g)===MgH2(s)
ΔH1=-74.5
kJ·mol-1;
②Mg2Ni(s)+2H2(g)===Mg2NiH4(s)
ΔH2=-64.4
kJ·mol-1;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3;
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3=-64.4
kJ·
mol-1-2×(-74.5
kJ·mol-1)=84.6
kJ·mol-1。
阶段重点突破练(一)
一、反应热、焓变概念的理解
1.(2020·甘肃西北师大附中高二月考)氯原子对O3的分解有催化作用:
反应O3+Cl===ClO+O2的焓变为ΔH1,
反应ClO+O===Cl+O2的焓变为ΔH2,
大气臭氧层的分解反应是O3+O===2O2,其焓变为ΔH,该反应的能量变化如图:
下列叙述正确的是( )
A.反应O3+O===2O2的ΔH=E1-E3
B.O3+O===2O2是吸热反应
C.ΔH=ΔH1+ΔH2
D.ΔH=E3-E2>0
2.(2020·成都月考)已知:H2(g)+F2(g)===2HF(g) ΔH=-270
kJ·mol-1,下列说法正确的是( )
A.在相同条件下,1
mol
H2(g)与1
mol
F2(g)的能量总和大于2
mol
HF(g)的能量
B.1
mol
H2(g)与1
mol
F2(g)反应生成2
mol
HF(l)放出的热量小于270
kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用如图来表示
3.已知:
①1
mol晶体硅中含有2
mol
Si—Si键,1
mol
SiO2晶体中含有4
mol
Si—O键。
②Si(s)+O2(g)===SiO2(s) ΔH,其反应过程与能量变化如图所示。
③
化学键
Si—O
O==O
Si—Si
断开1
mol共价键
所需能量/kJ
460
500
176
下列说法正确的是( )
A.晶体硅光伏发电是将化学能转化为电能
B.二氧化硅的稳定性弱于硅的稳定性
C.ΔH=-988
kJ·mol-1
D.ΔH=a-c
4.(2020·大连期中)如图所示,E1=393.5
kJ·mol-1,E2=395.4
kJ·mol-1,下列说法或热化学方程式正确的是( )
A.石墨与金刚石之间的转化是物理变化
B.C(石墨,s)===C(金刚石,s) ΔH=1.9
kJ·mol-1
C.金刚石的稳定性强于石墨
D.断裂1
mol石墨的化学键吸收的能量比断裂1
mol金刚石的化学键吸收的能量少
5.(2020·哈尔滨模拟)一定条件下,在水溶液中1
mol
Cl-、ClO(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是( )
A.e是ClO
B.反应b→a+c为吸热反应
C.a、b、c、d中c最稳定
D.反应b→d+a的热化学方程式为3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=-116
kJ·mol-1
二、根据已知信息书写热化学方程式及正误判断
6.下列热化学方程式正确的是(ΔH的绝对值均正确)( )
A.Hg+O2===HgO ΔH=-90.7
kJ·mol-1(反应热)
B.P(s)+Cl2(g)===PCl3(g)
ΔH=-306
kJ·mol-1(反应热)
C.CH3OH(l)+O2(g)===CO2(g)+2H2O(g)
ΔH=-725.76
kJ·mol-1(标准燃烧热)
D.NaOH(aq)+HNO3(aq)===NaNO3(aq)+H2O(l)
ΔH=57.3
kJ·mol-1(中和反应的反应热)
7.(2020·威海高二检测)下列关于热化学反应的描述正确的是( )
A.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3
kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热为ΔH=2×(-57.3)
kJ·mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9
kJ·mol-1,则CH3OH(g)的标准燃烧热为-192.9
kJ·mol-1
C.已知2H2O(g)===2H2(g)+O2(g) ΔH=484
kJ·mol-1,则H2(g)的标准燃烧热是-242
kJ·mol-1
D.葡萄糖的标准燃烧热是-2
800
kJ·mol-1,则C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1
400
kJ·mol-1
三、运用盖斯定律计算焓变及ΔH大小比较
8.已知:a.C2H2(g)+H2(g)===C2H4(g) ΔH<0;b.2CH4(g)===C2H4(g)+2H2(g) ΔH>0。以下三个热化学方程式:
①C(s)+2H2(g)===CH4(g) ΔH1
②C(s)+H2(g)===C2H2(g) ΔH2
③C(s)+H2(g)===C2H4(g) ΔH3
则ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A.ΔH2>ΔH3>ΔH1
B.ΔH3>ΔH2>ΔH1
C.ΔH3>ΔH1>ΔH2
D.ΔH1>ΔH2>ΔH3
9.下列关于反应热的描述正确的是( )
A.HCl和NaOH中和反应的反应热ΔH=-57.3
kJ·mol-1,则H2SO4和Ca(OH)2中和反应的反应热ΔH=2×(-57.3)
kJ·mol-1
B.CO(g)的标准燃烧热是-283.0
kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=(2×283.0)
kJ·mol-1
C.反应热有正负之分,标准燃烧热ΔH全部是正值
D.1
mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的标准燃烧热
10.已知热化学方程式:
①H2(g)+O2(g)===H2O(g) ΔH=a
kJ·mol-1
②H2(g)+O2(g)===H2O(l) ΔH=b
kJ·mol-1
③C(s)+O2(g)===CO(g) ΔH=c
kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=d
kJ·mol-1
关于上面热化学方程式的判断不正确的是( )
A.a、b、c、d都小于0
B.a+c>b+d
C.CO的标准燃烧热为(d-c)kJ·mol-1
D.燃烧10
g
H2最多放出的热量为|5a|
kJ
11.(2020·江苏联考)根据如图所示的物质转化关系,下列说法错误的是( )
A.相同质量的N2H4(g)和N2H4(l),前者具有的能量较高
B.相同质量的NO2(g)和N2O4(g),破坏两种物质中所有的化学键,后者所需的能量高
C.ΔH5=ΔH1+ΔH2+ΔH3+ΔH4
D.N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,则ΔH>ΔH4
12.(2020·重庆南开中学高二期中)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)===2Al2O3(s) ΔH1
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是( )
A.ΔH1>ΔH2
B.ΔH1<ΔH2
C.ΔH1=ΔH2
D.无法计算
四、大题综合练
13.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
化学键
P—P
P—O
O==O
P==O
键能/
(kJ·mol-1)
172
335
498
X
已知白磷的标准燃烧热为-2
378.0
kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:Ⅰ.C(石墨,s)+O2(g)===CO2(g)
ΔH1=-393.5
kJ·mol-1
Ⅱ.2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6
kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2
599.2
kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1
mol
C2H2(g)的焓变为________________。
②已知3.6
g碳在6.4
g的氧气中燃烧,至反应物耗尽,并放出x
kJ热量,已知单质碳的标准燃烧热为-y
kJ·mol-1,则1
mol
C与O2反应生成CO的反应热ΔH为________________。
14.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(1)氢能被称为绿色能源的原因是__________________(任答一点)。
(2)在101
kPa下,1
g氢气完全燃烧生成液态水时放出142.9
kJ的热量,请回答下列问题:
①该反应的反应物总能量________(填“大于”“小于”或“等于”)生成物总能量。
②氢气的标准燃烧热为________________。
③该反应的热化学方程式为_____________________________________________________
_____________________________________________________________________________。
④若1
mol氢气完全燃烧生成1
mol气态水放出241
kJ的热量,已知H—O键能为463
kJ·mol-1,O==O键能为498
kJ·mol-1,计算H—H键能为________kJ·mol-1。
(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5
kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s)
ΔH2=-64.4
kJ·mol-1;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=________
kJ·mol-1。
答案与解析
一、反应热、焓变概念的理解
1.(2020·甘肃西北师大附中高二月考)氯原子对O3的分解有催化作用:
反应O3+Cl===ClO+O2的焓变为ΔH1,
反应ClO+O===Cl+O2的焓变为ΔH2,
大气臭氧层的分解反应是O3+O===2O2,其焓变为ΔH,该反应的能量变化如图:
下列叙述正确的是( )
A.反应O3+O===2O2的ΔH=E1-E3
B.O3+O===2O2是吸热反应
C.ΔH=ΔH1+ΔH2
D.ΔH=E3-E2>0
答案 C
解析 反应热等于生成物的总能量减去反应物的总能量,则反应O3+O===2O2的ΔH=E3-E2,A项错误;由图像可以看出,反应物O3+O的总能量大于2O2的总能量,为放热反应,B项错误;已知:①O3+Cl===ClO+O2 ΔH1;②ClO+O===Cl+O2 ΔH2,利用盖斯定律,①+②可得O3+O===2O2 ΔH=ΔH1+ΔH2,故C正确。
2.(2020·成都月考)已知:H2(g)+F2(g)===2HF(g) ΔH=-270
kJ·mol-1,下列说法正确的是( )
A.在相同条件下,1
mol
H2(g)与1
mol
F2(g)的能量总和大于2
mol
HF(g)的能量
B.1
mol
H2(g)与1
mol
F2(g)反应生成2
mol
HF(l)放出的热量小于270
kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用如图来表示
答案 A
解析 该反应为放热反应,在相同条件下,1
mol
H2(g)与1
mol
F2(g)的能量总和大于2
mol
HF(g)的能量,A项正确;1
mol
H2(g)与1
mol
F2(g)反应生成2
mol
HF(l)放出的热量大于270
kJ,B项错误;该反应的逆反应是吸热反应,C项错误;该反应为放热反应,反应物总能量应比生成物总能量高,D项错误。
3.已知:
①1
mol晶体硅中含有2
mol
Si—Si键,1
mol
SiO2晶体中含有4
mol
Si—O键。
②Si(s)+O2(g)===SiO2(s) ΔH,其反应过程与能量变化如图所示。
③
化学键
Si—O
O==O
Si—Si
断开1
mol共价键
所需能量/kJ
460
500
176
下列说法正确的是( )
A.晶体硅光伏发电是将化学能转化为电能
B.二氧化硅的稳定性弱于硅的稳定性
C.ΔH=-988
kJ·mol-1
D.ΔH=a-c
答案 C
解析 晶体硅光伏发电是将太阳能转化为电能,A错误;根据化学键的键能判断,1
mol二氧化硅中的化学键断裂需要的能量为4×460
kJ=1
840
kJ,1
mol晶体硅中的化学键断裂需要的能量为2×176
kJ=352
kJ,故二氧化硅的稳定性强于硅的稳定性,B错误;ΔH=(176×2+500-460×4)
kJ·mol-1=-988
kJ·mol-1,C正确;根据图中信息可知,ΔH=-c,D错误。
4.(2020·大连期中)如图所示,E1=393.5
kJ·mol-1,E2=395.4
kJ·mol-1,下列说法或热化学方程式正确的是( )
A.石墨与金刚石之间的转化是物理变化
B.C(石墨,s)===C(金刚石,s) ΔH=1.9
kJ·mol-1
C.金刚石的稳定性强于石墨
D.断裂1
mol石墨的化学键吸收的能量比断裂1
mol金刚石的化学键吸收的能量少
答案 B
解析 石墨与金刚石是两种不同的单质,二者之间的转化是化学变化,A项错误;由图可知,1
mol金刚石的能量比1
mol
石墨高395.4
kJ-393.5
kJ=1.9
kJ,故有C(石墨,s)===C(金刚石,s) ΔH=1.9
kJ·mol-1,B项正确;金刚石的能量高于石墨的能量,物质的能量越高越不稳定,C项错误;C(石墨,s)===C(金刚石,s) ΔH=1.9
kJ·mol-1,1
mol石墨的总键能比1
mol金刚石的总键能大1.9
kJ,D项错误。
5.(2020·哈尔滨模拟)一定条件下,在水溶液中1
mol
Cl-、ClO(x=1,2,3,4)的能量(kJ)相对大小如图所示,下列有关说法正确的是( )
A.e是ClO
B.反应b→a+c为吸热反应
C.a、b、c、d中c最稳定
D.反应b→d+a的热化学方程式为3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=-116
kJ·mol-1
答案 D
解析 e中Cl元素化合价为+7,而ClO中Cl元素化合价为+5,A项错误;a、b、c、d中a的能量最低,所以a最稳定,C项错误;b→d+a为3ClO-(aq)===ClO(aq)+2Cl-(aq),反应热=(64
kJ·mol-1+2×0
kJ·mol-1)-3×60
kJ·mol-1=-116
kJ·mol-1,所以该反应的热化学方程式为3ClO-(aq)===ClO(aq)+2Cl-(aq) ΔH=-116
kJ·mol-1,D项正确。
二、根据已知信息书写热化学方程式及正误判断
6.下列热化学方程式正确的是(ΔH的绝对值均正确)( )
A.Hg+O2===HgO ΔH=-90.7
kJ·mol-1(反应热)
B.P(s)+Cl2(g)===PCl3(g)
ΔH=-306
kJ·mol-1(反应热)
C.CH3OH(l)+O2(g)===CO2(g)+2H2O(g)
ΔH=-725.76
kJ·mol-1(标准燃烧热)
D.NaOH(aq)+HNO3(aq)===NaNO3(aq)+H2O(l)
ΔH=57.3
kJ·mol-1(中和反应的反应热)
答案 B
解析 热化学方程式中需要注明各物质的聚集状态,A项错误;标准燃烧热是指在101
kPa时,1
mol纯物质完全燃烧的反应热,CH3OH完全燃烧应生成二氧化碳气体和液态水,C项错误;中和反应是放热反应,ΔH应小于0,D项错误。
7.(2020·威海高二检测)下列关于热化学反应的描述正确的是( )
A.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3
kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热为ΔH=2×(-57.3)
kJ·mol-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9
kJ·mol-1,则CH3OH(g)的标准燃烧热为-192.9
kJ·mol-1
C.已知2H2O(g)===2H2(g)+O2(g) ΔH=484
kJ·mol-1,则H2(g)的标准燃烧热是-242
kJ·mol-1
D.葡萄糖的标准燃烧热是-2
800
kJ·mol-1,则C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1
400
kJ·mol-1
答案 D
解析 A项,H2SO4与Ba(OH)2反应除有H+与OH-反应放热外,生成BaSO4沉淀亦放热,故ΔH<2×(-57.3)
kJ·mol-1;B项,甲醇未完全燃烧,H元素应生成H2O(l);C项,可表示为H2(g)+O2(g)===H2O(g) ΔH=-242
kJ·mol-1,水为气态,不是H2的标准燃烧热;D项,标准燃烧热是指1
mol葡萄糖完全燃烧的反应热,热化学方程式中C6H12O6(s)的化学计量数为,则ΔH=-1
400
kJ·mol-1。
三、运用盖斯定律计算焓变及ΔH大小比较
8.已知:a.C2H2(g)+H2(g)===C2H4(g) ΔH<0;b.2CH4(g)===C2H4(g)+2H2(g) ΔH>0。以下三个热化学方程式:
①C(s)+2H2(g)===CH4(g) ΔH1
②C(s)+H2(g)===C2H2(g) ΔH2
③C(s)+H2(g)===C2H4(g) ΔH3
则ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A.ΔH2>ΔH3>ΔH1
B.ΔH3>ΔH2>ΔH1
C.ΔH3>ΔH1>ΔH2
D.ΔH1>ΔH2>ΔH3
答案 A
解析 利用盖斯定律,(②-③)×2得出:C2H4(g)===C2H2(g)+H2(g) ΔH=2(ΔH2-ΔH3),根据反应a的逆过程为吸热反应,得ΔH2-ΔH3>0,ΔH2>ΔH3;(③-①)×2
得出:2CH4(g)===C2H4(g)+2H2(g) ΔH=2(ΔH3-ΔH1),根据反应b,可知ΔH3-ΔH1>0,ΔH3>ΔH1,故A项正确。
9.下列关于反应热的描述正确的是( )
A.HCl和NaOH中和反应的反应热ΔH=-57.3
kJ·mol-1,则H2SO4和Ca(OH)2中和反应的反应热ΔH=2×(-57.3)
kJ·mol-1
B.CO(g)的标准燃烧热是-283.0
kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=(2×283.0)
kJ·mol-1
C.反应热有正负之分,标准燃烧热ΔH全部是正值
D.1
mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的标准燃烧热
答案 B
10.已知热化学方程式:
①H2(g)+O2(g)===H2O(g) ΔH=a
kJ·mol-1
②H2(g)+O2(g)===H2O(l) ΔH=b
kJ·mol-1
③C(s)+O2(g)===CO(g) ΔH=c
kJ·mol-1
④C(s)+O2(g)===CO2(g) ΔH=d
kJ·mol-1
关于上面热化学方程式的判断不正确的是( )
A.a、b、c、d都小于0
B.a+c>b+d
C.CO的标准燃烧热为(d-c)kJ·mol-1
D.燃烧10
g
H2最多放出的热量为|5a|
kJ
答案 D
解析 所有燃烧均为放热反应,A正确;气态水比液态水具有的能量高,a>b,完全燃烧能放出更多的能量,c>d,故a+c>b+d,B正确;由④-③可得CO(g)+O2(g)===CO2(g) ΔH=(d-c)
kJ·mol-1,C正确;生成液态水时放出的能量最多,燃烧10
g
H2最多放出的热量为|5b|
kJ,D错误。
11.(2020·江苏联考)根据如图所示的物质转化关系,下列说法错误的是( )
A.相同质量的N2H4(g)和N2H4(l),前者具有的能量较高
B.相同质量的NO2(g)和N2O4(g),破坏两种物质中所有的化学键,后者所需的能量高
C.ΔH5=ΔH1+ΔH2+ΔH3+ΔH4
D.N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,则ΔH>ΔH4
答案 D
解析 N2H4(l)变为N2H4(g)需要吸收热量,故相同质量的N2H4(g)和N2H4(l),N2H4(g)的能量高于N2H4(l),A项正确;NO2(g)===N2O4(g) ΔH3<0,所以破坏1
mol
NO2所含的化学键需要吸收的能量比破坏0.5
mol
N2O4所含的化学键需要吸收的能量低,B项正确;由盖斯定律可知,ΔH5=ΔH1+ΔH2+ΔH3+ΔH4,C项正确;N2H4(l)+NO2(g)===N2(g)+2H2O(l) ΔH,ΔH=ΔH3+ΔH4,因ΔH3<0,故ΔH<ΔH4,D错误。
12.(2020·重庆南开中学高二期中)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)===2Al2O3(s) ΔH1
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是( )
A.ΔH1>ΔH2
B.ΔH1<ΔH2
C.ΔH1=ΔH2
D.无法计算
答案 B
解析 将已知两个热化学方程式依次编号为①②,由盖斯定律可知,①-②可得4Al(s)+2Fe2O3(s)===2Al2O3(s)+4Fe(s) ΔH=ΔH1-ΔH2,铝热反应为放热反应,即ΔH1-ΔH2<0,所以ΔH1<ΔH2,故选B。
四、大题综合练
13.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(1)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
化学键
P—P
P—O
O==O
P==O
键能/
(kJ·mol-1)
172
335
498
X
已知白磷的标准燃烧热为-2
378.0
kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=________。
(2)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
①已知:Ⅰ.C(石墨,s)+O2(g)===CO2(g)
ΔH1=-393.5
kJ·mol-1
Ⅱ.2H2(g)+O2(g)===2H2O(l)
ΔH2=-571.6
kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)
ΔH3=-2
599.2
kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1
mol
C2H2(g)的焓变为________________。
②已知3.6
g碳在6.4
g的氧气中燃烧,至反应物耗尽,并放出x
kJ热量,已知单质碳的标准燃烧热为-y
kJ·mol-1,则1
mol
C与O2反应生成CO的反应热ΔH为________________。
答案 (1)470
(2)①226.8
kJ·mol-1
②-(5x-0.5y)
kJ·mol-1
解析
(1)由反应P4(s)+5O2(g)===P4O10(s),可知ΔH=6E(P—P)+5E(O==O)-[4E(P==O)+12E(P—O)]可求得P==O的键能。(2)①关键是理解信息,由盖斯定律可知,一个反应的焓变仅与反应的起始状态和反应的最终状态有关,而与反应的途径无关。将Ⅰ×2+Ⅱ×-Ⅲ×,得ΔH=ΔH1×2+ΔH2×-ΔH3×。
14.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。
(1)氢能被称为绿色能源的原因是__________________(任答一点)。
(2)在101
kPa下,1
g氢气完全燃烧生成液态水时放出142.9
kJ的热量,请回答下列问题:
①该反应的反应物总能量________(填“大于”“小于”或“等于”)生成物总能量。
②氢气的标准燃烧热为________________。
③该反应的热化学方程式为_____________________________________________________
_____________________________________________________________________________。
④若1
mol氢气完全燃烧生成1
mol气态水放出241
kJ的热量,已知H—O键能为463
kJ·mol-1,O==O键能为498
kJ·mol-1,计算H—H键能为________kJ·mol-1。
(3)氢能的储存是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知:
Mg(s)+H2(g)===MgH2(s) ΔH1=-74.5
kJ·mol-1;
Mg2Ni(s)+2H2(g)===Mg2NiH4(s)
ΔH2=-64.4
kJ·mol-1;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3。
则ΔH3=________
kJ·mol-1。
答案 (1)无污染(答案合理均可)
(2)①大于 ②-285.8
kJ·mol-1 ③2H2(g)+O2(g)===2H2O(l) ΔH=-571.6
kJ·mol-1 ④436
(3)84.6
解析 (1)氢气燃烧生成水,无污染,为清洁能源等。
(2)①氢气的燃烧为放热反应,则生成物的总能量小于反应物总能量;
②2
g氢气为1
mol,完全燃烧生成液态水放出285.8
kJ的热量,可知H2的标准燃烧热为-285.8
kJ·
mol-1;
③H2的标准燃烧热为-285.8
kJ·mol-1,则热化学方程式为2H2(g)+O2(g)===2H2O(l) ΔH=-571.6
kJ·mol-1;
④2
mol氢气燃烧的热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=-482
kJ·mol-1;设1
mol
H—H键完全断裂时吸收热量为x,2x+498
kJ-4×463
kJ=-482
kJ,解得x=436
kJ。
(3)①Mg(s)+H2(g)===MgH2(s)
ΔH1=-74.5
kJ·mol-1;
②Mg2Ni(s)+2H2(g)===Mg2NiH4(s)
ΔH2=-64.4
kJ·mol-1;
Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3;
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)===2Mg(s)+Mg2NiH4(s) ΔH3=-64.4
kJ·
mol-1-2×(-74.5
kJ·mol-1)=84.6
kJ·mol-1。
