高中化学苏教版(2019)选择性必修1 专题1 第二单元 化学能与电能的转化 阶段重点突破练(二)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1 专题1 第二单元 化学能与电能的转化 阶段重点突破练(二) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-04 22:50:23 | ||
图片预览




文档简介
阶段重点突破练(二)
一、常见化学电源的工作原理
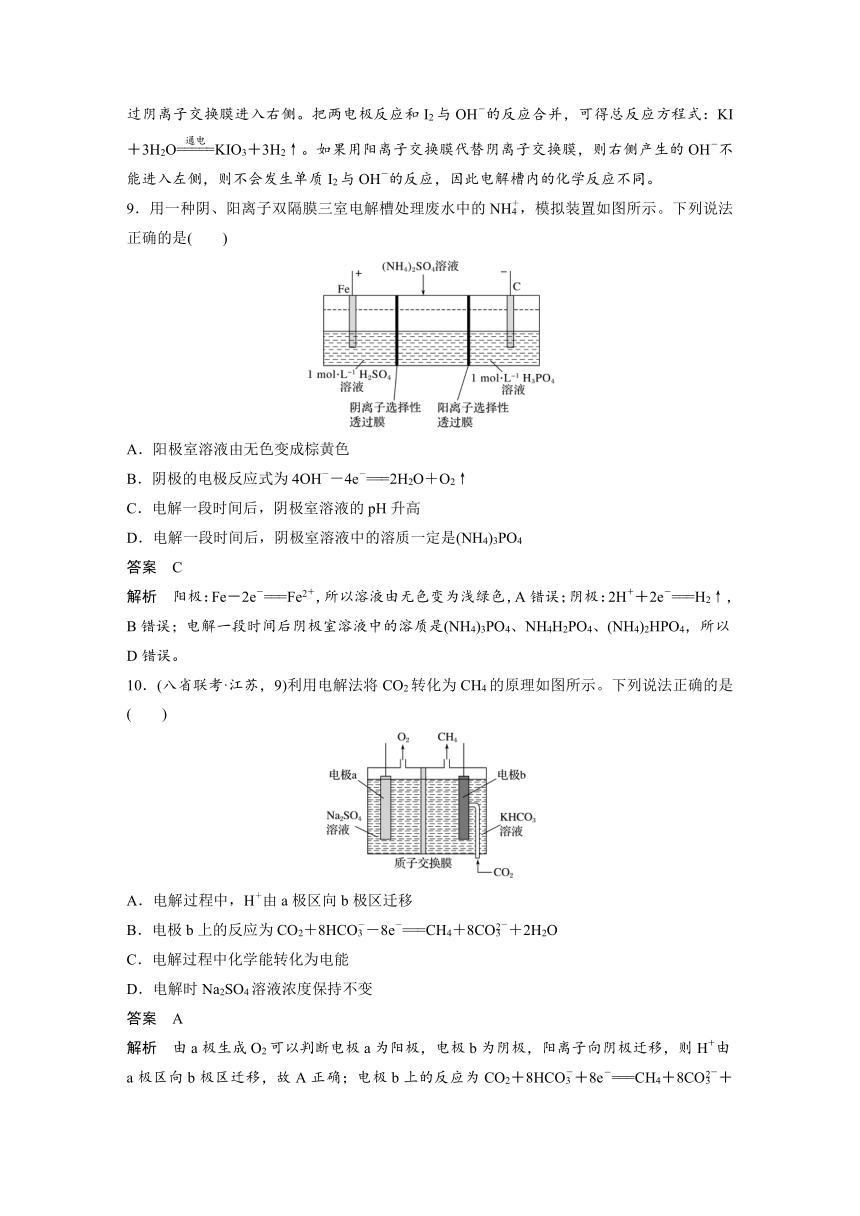
1.下列关于化学能转化为电能的四种装置的说法正确的是( )
A.电池Ⅰ中锌是正极
B.电池Ⅱ是一次性电池
C.电池Ⅲ工作时,氢气发生还原反应
D.电池Ⅳ工作时,电子由锌通过导线流向碳棒
答案 D
解析 电池Ⅰ中锌是负极,铜是正极,A错误;电池Ⅱ为铅蓄电池,属于二次电池,B错误;电池Ⅲ为氢氧燃料电池,H2在负极失去电子发生氧化反应,C错误;电池Ⅳ为锌锰干电池,锌筒为负极,碳棒为正极,电子由负极经导线流向正极,D正确。
2.(2020·河北武邑中学高二月考)如图为氢氧燃料电池原理示意图,下列叙述不正确的是( )
A.a极是负极
B.b极的电极反应式为4OH--4e-===2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
答案 B
解析 氢氧燃料电池中,通入氢气的电极a为原电池的负极,A正确;氢氧燃料电池中,通入氧气的电极为原电池的正极,则b极上O2得电子发生还原反应,电极反应式为O2+4e-+2H2O===4OH-,B错误;氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,C正确。
二、新型化学电源的工作原理
3.热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl?KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。下列有关说法正确的是( )
A.正极反应式:Ca+2Cl--2e-===CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1
mol电子,理论上生成20.7
g
Pb
D.常温下,在正、负极间接上电流计,指针不偏转
答案 D
解析 正极发生还原反应,故为PbSO4+2e-===Pb+SO,A项错误;放电过程为原电池,故阳离子向正极移动,B项错误;每转移0.1
mol电子,生成0.05
mol
Pb为10.35
g,C项错误;常温下,电解质不能熔化,不能形成原电池,故指针不偏转,D项正确。
4.(2020·辽宁锦州模拟)肼(N2H4)暴露在空气中容易爆炸,但是以其为燃料的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是( )
A.电池工作时,正极附近的pH减小
B.当消耗1
mol
O2时,有2
mol
Na+由甲槽向乙槽迁移
C.负极反应式为4OH-+N2H4-4e-===N2↑+4H2O
D.若去掉阳离子交换膜,电池也能正常工作
答案 C
解析 电池工作时,O2在正极发生还原反应:O2+2H2O+4e-===4OH-,由于生成OH-,溶液的pH增大,A错误;当消耗1
mol
O2时,电路中转移4
mol电子,生成4
mol
OH-,为保持溶液呈电中性,应有4
mol
Na+由甲槽向乙槽迁移,B错误;N2H4在负极上失电子发生氧化反应,则负极反应式为4OH-+N2H4-4e-===N2↑+4H2O,C正确;若去掉阳离子交换膜,肼会与水中溶解的氧气直接接触,发生爆炸,无法正常工作,D错误。
5.直接煤—空气燃料电池原理如图所示,下列说法错误的是( )
A.随着反应的进行,氧化物电解质的量不断减少
B.负极的电极反应式为C+2CO-4e-===3CO2↑
C.电极X为负极,O2-向X极迁移
D.直接煤—空气燃料电池的能量效率比煤燃烧发电的能量效率高
答案 A
解析 随着反应的进行,氧化物电解质的量不会减少,故A错误;由原理图分析可知,其负极反应式为C+2CO-4e-===3CO2↑,故B正确;原电池内部的阴离子向负极移动,所以C正确;直接煤—空气燃料电池是把化学能直接转化为电能,而煤燃烧发电是把化学能转化为热能,再转化为电能,所以D正确。
6.碳呼吸电池的工作原理如图所示,已知草酸铝[Al2(C2O4)3]难溶于水。下列有关说法正确的是( )
A.该装置将电能转变为化学能
B.正极的电极反应为C2O-2e-===2CO2
C.每生成1
mol
Al2(C2O4)3,有6
mol电子流过负载
D.草酸盐溶液中的阳离子移向Al电极
答案 C
解析 根据题意,此装置为原电池,是化学能转化成电能的装置,故A错误;根据原电池工作原理,正极反应由CO2参与,电极反应式为2CO2+2e-===C2O,故B错误;生成Al2(C2O4)3,以Al进行计算,转移电子的物质的量为1×2×3
mol=6
mol,故C正确;根据原电池的工作原理,阳离子向正极移动,Al电极为负极,因此草酸盐溶液中阳离子向通入含CO2空气一极移动,故D错误。
三、电解原理及其应用
7.21世纪是钛的世纪。在800~1
000
℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是( )
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e-===Ti+2O2-
D.每生成0.1
mol
Ti,转移0.2
mol电子
答案 C
解析 由O2-的移动方向可知,b为电源正极,A错误;石墨电极作阳极,发生氧化反应,B错误;每生成0.1
mol
Ti,转移0.4
mol电子,D错误。
8.电解装置如图所示,电解槽内装有KI?淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。(已知:3I2+6OH-===IO+5I-
+3H2O)
下列说法不正确的是( )
A.右侧发生的电极反应式:2H++2e-===H2↑
B.电解结束时,右侧溶液中含有IO
C.电解槽内发生反应的总化学方程式:KI+3H2OKIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变
答案 D
解析 电解时左侧溶液变蓝,说明反应中I-→I2,则电极反应为2I--2e-===I2,该极为阳极。右侧电极为阴极,发生还原反应,则应该是H+放电生成H2,电极反应为2H++2e-===H2↑,电解过程中阴离子OH-可通过阴离子交换膜向阳极移动,因此OH-可从右侧进入左侧,导致单质I2与OH-反应:3I2+6OH-===IO+5I-+3H2O,因此左侧溶液中生成IO,IO也可透过阴离子交换膜进入右侧。把两电极反应和I2与OH-的反应合并,可得总反应方程式:KI+3H2OKIO3+3H2↑。如果用阳离子交换膜代替阴离子交换膜,则右侧产生的OH-不能进入左侧,则不会发生单质I2与OH-的反应,因此电解槽内的化学反应不同。
9.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH,模拟装置如图所示。下列说法正确的是( )
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为4OH--4e-===2H2O+O2↑
C.电解一段时间后,阴极室溶液的pH升高
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
答案 C
解析 阳极:Fe-2e-===Fe2+,所以溶液由无色变为浅绿色,A错误;阴极:2H++2e-===H2↑,B错误;电解一段时间后阴极室溶液中的溶质是(NH4)3PO4、NH4H2PO4、(NH4)2HPO4,所以D错误。
10.(八省联考·江苏,9)利用电解法将CO2转化为CH4的原理如图所示。下列说法正确的是( )
A.电解过程中,H+由a极区向b极区迁移
B.电极b上的反应为CO2+8HCO-8e-===CH4+8CO+2H2O
C.电解过程中化学能转化为电能
D.电解时Na2SO4溶液浓度保持不变
答案 A
解析 由a极生成O2可以判断电极a为阳极,电极b为阴极,阳离子向阴极迁移,则H+由a极区向b极区迁移,故A正确;电极b上的反应为CO2+8HCO+8e-===CH4+8CO+2H2O,故B错误;电解过程中电能转化为化学能,故C错误;电解时OH-比SO更容易失去电子,所以电解Na2SO4溶液的实质是电解水,溶液中的水被消耗,Na2SO4溶液的浓度增大,故D错误。
四、新型二次电池的分析
11.用吸附了氢气的纳米碳管等材料制作的二次电池原理如图所示,下列说法正确的是( )
A.充电时,阴极的电极反应为Ni(OH)2+OH--e-===NiO(OH)+H2O
B.放电时,负极的电极反应为H2-2e-+2OH-===2H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
答案 B
解析 放电时相当于原电池,负极失去电子,氢气在负极放电,B项正确;放电时OH-等阴离子向负极移动,结合图示电子流向可确定碳电极为负极,即OH-向碳电极移动,C项错误;充电时相当于电解池,阴极发生还原反应,A项错误;充电时电池的碳电极与外电源的负极相连,D项错误。
12.(2020·全国卷Ⅰ,12)科学家近年发明了一种新型Zn—CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为Zn-2e-+4OH-===Zn(OH)
B.放电时,1
mol
CO2转化为HCOOH,转移的电子数为2
mol
C.充电时,电池总反应为2Zn(OH)===2Zn+O2↑+4OH-+2H2O
D.充电时,正极溶液中OH-浓度升高
答案 D
解析 由装置示意图可知,放电时负极反应为Zn-2e-+4OH-===Zn(OH),A项正确;放电时CO2转化为HCOOH,C元素化合价降低2,则1
mol
CO2转化为HCOOH时,转移电子数为2
mol,B项正确;由装置示意图可知充电时阳极产生O2,阴极产生Zn,C项正确;充电时阳极上发生反应为2H2O-4e-===4H++O2↑,OH-浓度降低,D项错误。
13.全钒电池以惰性材料作电极,在电解质溶液中发生的总反应为VO2+(蓝色)+H2O+V3+(紫色)VO(黄色)+V2+(绿色)+2H+,下列说法正确的是( )
A.当电池放电时,VO被氧化
B.放电时,负极反应式为VO+2H++e-===VO2++H2O
C.充电时,阳极附近溶液由绿色逐渐变为紫色
D.放电过程中,正极附近溶液的pH变大
答案 D
解析 当电池放电时,VO―→VO2+,V元素的化合价由+5变为+4,VO被还原,故A错误;放电时,负极失电子,负极反应式为V2+-e-===V3+,故B错误;充电时,阳极发生氧化反应,由VO2+―→VO,阳极附近溶液由蓝色逐渐变为黄色,故C错误;放电过程中,正极反应式为VO+2H++e-===VO2++H2O,正极附近溶液的pH变大,故D正确。
14.(2021·河北月考)钠硫电池作为一种新型化学电源,具有体积小、容量大、寿命长、效率高等重要优点。其结构与工作原理如图所示,下列说法错误的是( )
A.放电过程中,A极为电源负极
B.放电过程中,电池总反应为2Na+xS===Na2Sx
C.充电过程中,Na+由A极移动到B极
D.充电过程中,外电路中流过0.01
mol电子,负极材料增重0.23
g
答案 C
解析 A项,由图中放电电流可知,放电时A极为电源负极,正确;B项,放电过程中,钠作负极失电子,变成钠离子,移向正极,在正极生成Na2Sx,电池总反应为2Na+xS===Na2Sx,正确;C项,充电过程中,Na+移向阴极,即由B极移动到A极,错误;D项,充电过程中,外电路中流过0.01
mol电子,有0.01
mol钠离子转化为钠单质,所以负极材料增重0.23
g,正确。
五、大题综合练
15.如图是一个电化学的示意图,回答下列问题:
(1)甲池是________装置,乙装置中电极A为______极。
(2)甲装置中通入甲烷的电极反应式为__________________________________________
________________________________________________________________________,
乙装置中电极B(Ag)的电极反应式为___________________________________________
________________________________________________________________________,
丙装置中电极D区的生成物是________(填化学式)。
(3)工作一段时间后,当丙池中生成112
mL(标准状况)气体时,均匀搅拌丙池,所得溶液的c(OH-)
=________
mol·L-1(已知:氯化钠溶液足量,电解后溶液体积为500
mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(填化学式)。
答案 (1)原电池 阳 (2)CH4+10OH--8e-===CO+7H2O Ag++e-===Ag H2和NaOH
(3)0.01 HCl
解析 (1)由图可知,甲装置为燃料电池,是原电池,通入燃料的电极为负极,通入氧气的电极为正极,与电池正极相连的电极A为阳极。
(2)甲装置中由于电解质为KOH,负极反应为CH4+10OH--8e-===CO+7H2O,正极反应为O2+2H2O+4e-===4OH-,乙、丙装置为电解池,电极B反应式为Ag++e-===Ag,电极D发生反应为2H++2e-===H2↑,由于电极D消耗了H+,破坏了水的电离平衡,最终在D极区产生NaOH溶液和H2,故电极D区产物为H2和NaOH。
(3)在丙装置中,总反应为2Cl-+2H2O===Cl2↑+H2↑+2OH-,n(气体)==0.005
mol,
所以c(OH-)==0.01
mol·L-1,所以若要使丙池恢复电解前的状态,应向丙池中通入0.005
mol
HCl气体。
16.燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
①电极A为生物燃料电池的________(填“正”或“负”)极。
②正极反应式为_______________________________________________________________。
③放电过程中,H+由________极区向________极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1
mol氧气,理论上生成标准状况下二氧化碳的体积是________。
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇?氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。
请回答:
①a极电极反应式为___________________________________________________________;
②工作时,O2-由电极________(填“a”或“b”,下同)向电极________移动;
③电子由电极________通过传感器流向电极________。
答案 (1)①正 ②O2+4H++4e-===2H2O
③负 正 ④22.4
L
(2)①CO+O2--2e-===CO2 ②b a ③a b
解析 (1)由图可知电极A为燃料电池的正极,电极反应为6O2+24H++24e-===12H2O;电极B为燃料电池的负极,电极反应为C6H12O6+6H2O-24e-===6CO2+24H+。放电过程中,H+由负极区向正极区移动。葡萄糖燃料电池的总反应为C6H12O6+6O2===6CO2+6H2O,即1
mol
O2~1
mol
CO2,每消耗1
mol
O2,理论上生成标准状况下CO2气体22.4
L。
(2)由元素价态变化可知,电极a为负极,电极反应式为2CO+2O2--4e-===2CO2,电极b为正极,电极反应式为O2+4e-===2O2-,总反应为2CO+O2===2CO2。工作时电子由电极a通过传感器流向电极b,O2-由电极b向电极a移动。
17.高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。
(1)该电池放电时正极反应式为__________________________________________________。
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________________________________
(填“左”或“右”,下同)移动;若用阳离子交换膜代替盐桥,则钾离子向________移动。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有________________________________________________________________________。
答案 (1)FeO+4H2O+3e-===Fe(OH)3+5OH- (2)右 左 (3)使用时间长、工作电压稳定
解析 (1)放电时高铁酸钾在正极反应,发生还原反应,电极反应式为FeO+4H2O+3e-===Fe(OH)3+5OH-。(2)电池工作时,阴离子移向负极,阳离子移向正极,所以盐桥中氯离子向右移动;若用阳离子交换膜代替盐桥,则钾离子向左移动。
一、常见化学电源的工作原理
1.下列关于化学能转化为电能的四种装置的说法正确的是( )
A.电池Ⅰ中锌是正极
B.电池Ⅱ是一次性电池
C.电池Ⅲ工作时,氢气发生还原反应
D.电池Ⅳ工作时,电子由锌通过导线流向碳棒
答案 D
解析 电池Ⅰ中锌是负极,铜是正极,A错误;电池Ⅱ为铅蓄电池,属于二次电池,B错误;电池Ⅲ为氢氧燃料电池,H2在负极失去电子发生氧化反应,C错误;电池Ⅳ为锌锰干电池,锌筒为负极,碳棒为正极,电子由负极经导线流向正极,D正确。
2.(2020·河北武邑中学高二月考)如图为氢氧燃料电池原理示意图,下列叙述不正确的是( )
A.a极是负极
B.b极的电极反应式为4OH--4e-===2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
答案 B
解析 氢氧燃料电池中,通入氢气的电极a为原电池的负极,A正确;氢氧燃料电池中,通入氧气的电极为原电池的正极,则b极上O2得电子发生还原反应,电极反应式为O2+4e-+2H2O===4OH-,B错误;氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,C正确。
二、新型化学电源的工作原理
3.热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl?KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。下列有关说法正确的是( )
A.正极反应式:Ca+2Cl--2e-===CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1
mol电子,理论上生成20.7
g
Pb
D.常温下,在正、负极间接上电流计,指针不偏转
答案 D
解析 正极发生还原反应,故为PbSO4+2e-===Pb+SO,A项错误;放电过程为原电池,故阳离子向正极移动,B项错误;每转移0.1
mol电子,生成0.05
mol
Pb为10.35
g,C项错误;常温下,电解质不能熔化,不能形成原电池,故指针不偏转,D项正确。
4.(2020·辽宁锦州模拟)肼(N2H4)暴露在空气中容易爆炸,但是以其为燃料的燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染等特点,其工作原理如图所示,下列叙述正确的是( )
A.电池工作时,正极附近的pH减小
B.当消耗1
mol
O2时,有2
mol
Na+由甲槽向乙槽迁移
C.负极反应式为4OH-+N2H4-4e-===N2↑+4H2O
D.若去掉阳离子交换膜,电池也能正常工作
答案 C
解析 电池工作时,O2在正极发生还原反应:O2+2H2O+4e-===4OH-,由于生成OH-,溶液的pH增大,A错误;当消耗1
mol
O2时,电路中转移4
mol电子,生成4
mol
OH-,为保持溶液呈电中性,应有4
mol
Na+由甲槽向乙槽迁移,B错误;N2H4在负极上失电子发生氧化反应,则负极反应式为4OH-+N2H4-4e-===N2↑+4H2O,C正确;若去掉阳离子交换膜,肼会与水中溶解的氧气直接接触,发生爆炸,无法正常工作,D错误。
5.直接煤—空气燃料电池原理如图所示,下列说法错误的是( )
A.随着反应的进行,氧化物电解质的量不断减少
B.负极的电极反应式为C+2CO-4e-===3CO2↑
C.电极X为负极,O2-向X极迁移
D.直接煤—空气燃料电池的能量效率比煤燃烧发电的能量效率高
答案 A
解析 随着反应的进行,氧化物电解质的量不会减少,故A错误;由原理图分析可知,其负极反应式为C+2CO-4e-===3CO2↑,故B正确;原电池内部的阴离子向负极移动,所以C正确;直接煤—空气燃料电池是把化学能直接转化为电能,而煤燃烧发电是把化学能转化为热能,再转化为电能,所以D正确。
6.碳呼吸电池的工作原理如图所示,已知草酸铝[Al2(C2O4)3]难溶于水。下列有关说法正确的是( )
A.该装置将电能转变为化学能
B.正极的电极反应为C2O-2e-===2CO2
C.每生成1
mol
Al2(C2O4)3,有6
mol电子流过负载
D.草酸盐溶液中的阳离子移向Al电极
答案 C
解析 根据题意,此装置为原电池,是化学能转化成电能的装置,故A错误;根据原电池工作原理,正极反应由CO2参与,电极反应式为2CO2+2e-===C2O,故B错误;生成Al2(C2O4)3,以Al进行计算,转移电子的物质的量为1×2×3
mol=6
mol,故C正确;根据原电池的工作原理,阳离子向正极移动,Al电极为负极,因此草酸盐溶液中阳离子向通入含CO2空气一极移动,故D错误。
三、电解原理及其应用
7.21世纪是钛的世纪。在800~1
000
℃时电解TiO2可制得钛,装置如图所示。下列叙述正确的是( )
A.a为电源的正极
B.石墨电极上发生还原反应
C.阴极发生的反应为TiO2+4e-===Ti+2O2-
D.每生成0.1
mol
Ti,转移0.2
mol电子
答案 C
解析 由O2-的移动方向可知,b为电源正极,A错误;石墨电极作阳极,发生氧化反应,B错误;每生成0.1
mol
Ti,转移0.4
mol电子,D错误。
8.电解装置如图所示,电解槽内装有KI?淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。(已知:3I2+6OH-===IO+5I-
+3H2O)
下列说法不正确的是( )
A.右侧发生的电极反应式:2H++2e-===H2↑
B.电解结束时,右侧溶液中含有IO
C.电解槽内发生反应的总化学方程式:KI+3H2OKIO3+3H2↑
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变
答案 D
解析 电解时左侧溶液变蓝,说明反应中I-→I2,则电极反应为2I--2e-===I2,该极为阳极。右侧电极为阴极,发生还原反应,则应该是H+放电生成H2,电极反应为2H++2e-===H2↑,电解过程中阴离子OH-可通过阴离子交换膜向阳极移动,因此OH-可从右侧进入左侧,导致单质I2与OH-反应:3I2+6OH-===IO+5I-+3H2O,因此左侧溶液中生成IO,IO也可透过阴离子交换膜进入右侧。把两电极反应和I2与OH-的反应合并,可得总反应方程式:KI+3H2OKIO3+3H2↑。如果用阳离子交换膜代替阴离子交换膜,则右侧产生的OH-不能进入左侧,则不会发生单质I2与OH-的反应,因此电解槽内的化学反应不同。
9.用一种阴、阳离子双隔膜三室电解槽处理废水中的NH,模拟装置如图所示。下列说法正确的是( )
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为4OH--4e-===2H2O+O2↑
C.电解一段时间后,阴极室溶液的pH升高
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
答案 C
解析 阳极:Fe-2e-===Fe2+,所以溶液由无色变为浅绿色,A错误;阴极:2H++2e-===H2↑,B错误;电解一段时间后阴极室溶液中的溶质是(NH4)3PO4、NH4H2PO4、(NH4)2HPO4,所以D错误。
10.(八省联考·江苏,9)利用电解法将CO2转化为CH4的原理如图所示。下列说法正确的是( )
A.电解过程中,H+由a极区向b极区迁移
B.电极b上的反应为CO2+8HCO-8e-===CH4+8CO+2H2O
C.电解过程中化学能转化为电能
D.电解时Na2SO4溶液浓度保持不变
答案 A
解析 由a极生成O2可以判断电极a为阳极,电极b为阴极,阳离子向阴极迁移,则H+由a极区向b极区迁移,故A正确;电极b上的反应为CO2+8HCO+8e-===CH4+8CO+2H2O,故B错误;电解过程中电能转化为化学能,故C错误;电解时OH-比SO更容易失去电子,所以电解Na2SO4溶液的实质是电解水,溶液中的水被消耗,Na2SO4溶液的浓度增大,故D错误。
四、新型二次电池的分析
11.用吸附了氢气的纳米碳管等材料制作的二次电池原理如图所示,下列说法正确的是( )
A.充电时,阴极的电极反应为Ni(OH)2+OH--e-===NiO(OH)+H2O
B.放电时,负极的电极反应为H2-2e-+2OH-===2H2O
C.放电时,OH-移向镍电极
D.充电时,将电池的碳电极与外电源的正极相连
答案 B
解析 放电时相当于原电池,负极失去电子,氢气在负极放电,B项正确;放电时OH-等阴离子向负极移动,结合图示电子流向可确定碳电极为负极,即OH-向碳电极移动,C项错误;充电时相当于电解池,阴极发生还原反应,A项错误;充电时电池的碳电极与外电源的负极相连,D项错误。
12.(2020·全国卷Ⅰ,12)科学家近年发明了一种新型Zn—CO2水介质电池。电池示意图如下,电极为金属锌和选择性催化材料,放电时,温室气体CO2被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。
下列说法错误的是( )
A.放电时,负极反应为Zn-2e-+4OH-===Zn(OH)
B.放电时,1
mol
CO2转化为HCOOH,转移的电子数为2
mol
C.充电时,电池总反应为2Zn(OH)===2Zn+O2↑+4OH-+2H2O
D.充电时,正极溶液中OH-浓度升高
答案 D
解析 由装置示意图可知,放电时负极反应为Zn-2e-+4OH-===Zn(OH),A项正确;放电时CO2转化为HCOOH,C元素化合价降低2,则1
mol
CO2转化为HCOOH时,转移电子数为2
mol,B项正确;由装置示意图可知充电时阳极产生O2,阴极产生Zn,C项正确;充电时阳极上发生反应为2H2O-4e-===4H++O2↑,OH-浓度降低,D项错误。
13.全钒电池以惰性材料作电极,在电解质溶液中发生的总反应为VO2+(蓝色)+H2O+V3+(紫色)VO(黄色)+V2+(绿色)+2H+,下列说法正确的是( )
A.当电池放电时,VO被氧化
B.放电时,负极反应式为VO+2H++e-===VO2++H2O
C.充电时,阳极附近溶液由绿色逐渐变为紫色
D.放电过程中,正极附近溶液的pH变大
答案 D
解析 当电池放电时,VO―→VO2+,V元素的化合价由+5变为+4,VO被还原,故A错误;放电时,负极失电子,负极反应式为V2+-e-===V3+,故B错误;充电时,阳极发生氧化反应,由VO2+―→VO,阳极附近溶液由蓝色逐渐变为黄色,故C错误;放电过程中,正极反应式为VO+2H++e-===VO2++H2O,正极附近溶液的pH变大,故D正确。
14.(2021·河北月考)钠硫电池作为一种新型化学电源,具有体积小、容量大、寿命长、效率高等重要优点。其结构与工作原理如图所示,下列说法错误的是( )
A.放电过程中,A极为电源负极
B.放电过程中,电池总反应为2Na+xS===Na2Sx
C.充电过程中,Na+由A极移动到B极
D.充电过程中,外电路中流过0.01
mol电子,负极材料增重0.23
g
答案 C
解析 A项,由图中放电电流可知,放电时A极为电源负极,正确;B项,放电过程中,钠作负极失电子,变成钠离子,移向正极,在正极生成Na2Sx,电池总反应为2Na+xS===Na2Sx,正确;C项,充电过程中,Na+移向阴极,即由B极移动到A极,错误;D项,充电过程中,外电路中流过0.01
mol电子,有0.01
mol钠离子转化为钠单质,所以负极材料增重0.23
g,正确。
五、大题综合练
15.如图是一个电化学的示意图,回答下列问题:
(1)甲池是________装置,乙装置中电极A为______极。
(2)甲装置中通入甲烷的电极反应式为__________________________________________
________________________________________________________________________,
乙装置中电极B(Ag)的电极反应式为___________________________________________
________________________________________________________________________,
丙装置中电极D区的生成物是________(填化学式)。
(3)工作一段时间后,当丙池中生成112
mL(标准状况)气体时,均匀搅拌丙池,所得溶液的c(OH-)
=________
mol·L-1(已知:氯化钠溶液足量,电解后溶液体积为500
mL)。若要使丙池恢复电解前的状态,应向丙池中通入________(填化学式)。
答案 (1)原电池 阳 (2)CH4+10OH--8e-===CO+7H2O Ag++e-===Ag H2和NaOH
(3)0.01 HCl
解析 (1)由图可知,甲装置为燃料电池,是原电池,通入燃料的电极为负极,通入氧气的电极为正极,与电池正极相连的电极A为阳极。
(2)甲装置中由于电解质为KOH,负极反应为CH4+10OH--8e-===CO+7H2O,正极反应为O2+2H2O+4e-===4OH-,乙、丙装置为电解池,电极B反应式为Ag++e-===Ag,电极D发生反应为2H++2e-===H2↑,由于电极D消耗了H+,破坏了水的电离平衡,最终在D极区产生NaOH溶液和H2,故电极D区产物为H2和NaOH。
(3)在丙装置中,总反应为2Cl-+2H2O===Cl2↑+H2↑+2OH-,n(气体)==0.005
mol,
所以c(OH-)==0.01
mol·L-1,所以若要使丙池恢复电解前的状态,应向丙池中通入0.005
mol
HCl气体。
16.燃料电池是利用燃料与氧气反应从而将化学能转化为电能的装置。
(1)以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
①电极A为生物燃料电池的________(填“正”或“负”)极。
②正极反应式为_______________________________________________________________。
③放电过程中,H+由________极区向________极区迁移(填“正”或“负”)。
④在电池反应中,每消耗1
mol氧气,理论上生成标准状况下二氧化碳的体积是________。
(2)一氧化碳无色无味有毒,世界各国每年均有不少人因一氧化碳中毒而失去生命。一种一氧化碳分析仪的工作原理如图所示,该装置中电解质为氧化钇?氧化钠,其中O2-可以在固体介质NASICON中自由移动。传感器中通过的电流越大,尾气中一氧化碳的含量越高。
请回答:
①a极电极反应式为___________________________________________________________;
②工作时,O2-由电极________(填“a”或“b”,下同)向电极________移动;
③电子由电极________通过传感器流向电极________。
答案 (1)①正 ②O2+4H++4e-===2H2O
③负 正 ④22.4
L
(2)①CO+O2--2e-===CO2 ②b a ③a b
解析 (1)由图可知电极A为燃料电池的正极,电极反应为6O2+24H++24e-===12H2O;电极B为燃料电池的负极,电极反应为C6H12O6+6H2O-24e-===6CO2+24H+。放电过程中,H+由负极区向正极区移动。葡萄糖燃料电池的总反应为C6H12O6+6O2===6CO2+6H2O,即1
mol
O2~1
mol
CO2,每消耗1
mol
O2,理论上生成标准状况下CO2气体22.4
L。
(2)由元素价态变化可知,电极a为负极,电极反应式为2CO+2O2--4e-===2CO2,电极b为正极,电极反应式为O2+4e-===2O2-,总反应为2CO+O2===2CO2。工作时电子由电极a通过传感器流向电极b,O2-由电极b向电极a移动。
17.高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。
(1)该电池放电时正极反应式为__________________________________________________。
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________________________________
(填“左”或“右”,下同)移动;若用阳离子交换膜代替盐桥,则钾离子向________移动。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有________________________________________________________________________。
答案 (1)FeO+4H2O+3e-===Fe(OH)3+5OH- (2)右 左 (3)使用时间长、工作电压稳定
解析 (1)放电时高铁酸钾在正极反应,发生还原反应,电极反应式为FeO+4H2O+3e-===Fe(OH)3+5OH-。(2)电池工作时,阴离子移向负极,阳离子移向正极,所以盐桥中氯离子向右移动;若用阳离子交换膜代替盐桥,则钾离子向左移动。
