黑龙江省大庆市名校2022届高三上学期开学考试化学试题(Word版含答案)
文档属性
| 名称 | 黑龙江省大庆市名校2022届高三上学期开学考试化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-05 07:20:42 | ||
图片预览



文档简介
大庆市名校2021-2022学年度
高三上学期
开学考试
化学
可能用到的相对原子质量:H
1
Li
7
C
12
N
14
O
16
F
19
Na
23
Mg
24
Al
27
Si
28
S
32
Cl
35.5
K
39
Ca
40
Fe
56
Cu
64
(
I卷
选择题
共44分
)
一、选择题(1-10题,每题2分;11-18题,每题24分)
1.2021年东京奥运会在这个暑假召开。有一种有机物,因其酷似奥林匹克旗中的五环,科学家称之为奥林匹克烃。有关奥林匹克烃的说法正确的是
A.该烃的一氯代物只有六种
B.该烃分子中只含非极性键
C.该烃完全燃烧生成H2O的物质的量小于CO2的物质的量
D.该烃属于苯的同系物
2.2020年11月“嫦娥五号”成功着陆月球,展示了以芳纶为主制成的五星红旗,用SiC增强铝基材料钻杆“挖土”,实现了中国首次月球无人采样返回。研究表明月球表面的“土壤”主要含有氧、硅、铝、铁、镁、钙和钠等元素。下列有关说法正确的是
A.月球表面的“土壤”所含金属元素镁和铝均可以通过电解其熔融氯化物进行冶炼
B.制作五星红旗用的芳纶为合成纤维,灼烧具有烧焦羽毛的气味
C.SiC又称金刚砂,属于有机合成高分子材料
D.“嫦娥五号”使用的锂离子电池组工作时是将化学能转变成电能
3.下列关于新冠病毒说法错误的是
A.含有病毒的飞沫分散在空气中形成的分散系为气溶胶
B.N95口罩所使用的聚丙烯材料属于天然纤维
C.用于盛装新冠疫苗的中硼硅玻璃管属于硅酸盐材质,既耐低温,又耐强酸
D.用电解食盐水制取的次氯酸钠喷洒房间能杀死新冠肺炎病毒
4.检验黑木耳中的铁离子的步骤为:灼烧黑木耳→加酸溶解→过滤→取滤液检验,所选择的装置(夹持装置已略去)及操作正确的是
A.灼烧木耳
B.加酸后搅拌溶解
C.过滤得滤液
D.检验滤液中铁离子
5.部分含碳物质的分类与相应碳元素的化合价关系如图所示。下列说法错误的是
A.a中可能含有非极性键
B.b存在多种同素异形体
C.c不属于酸性氧化物
D.d转化为e可通过化合反应实现
6.锗(位于第4周期ⅣA族)和铝在周期表中处于对角线位置,二者的单质及化合物的性质对应相似。下列关于锗及其化合物的推断正确的是( )
A.锗不能与强碱反应
B.氢氧化锗具有两性
C.氧化锗易溶于水
D.氧化锗的化学式为Ge2O3
7.已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,中性溶液中,、、、能大量共存
B.向含有的溶液中通入充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-
D.向溶液中滴加少量氯水,再加入,振荡,静置,有机层呈橙色
8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.在水中加入0.1molCl2,充分反应后转移的电子数为
B.标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA
C.1
mol
MnO2与1
L
4mol/L盐酸反应生成的Cl2分子数为2NA
D.60gSiO2晶体中含有[SiO4]四面体结构单元的数目约为NA
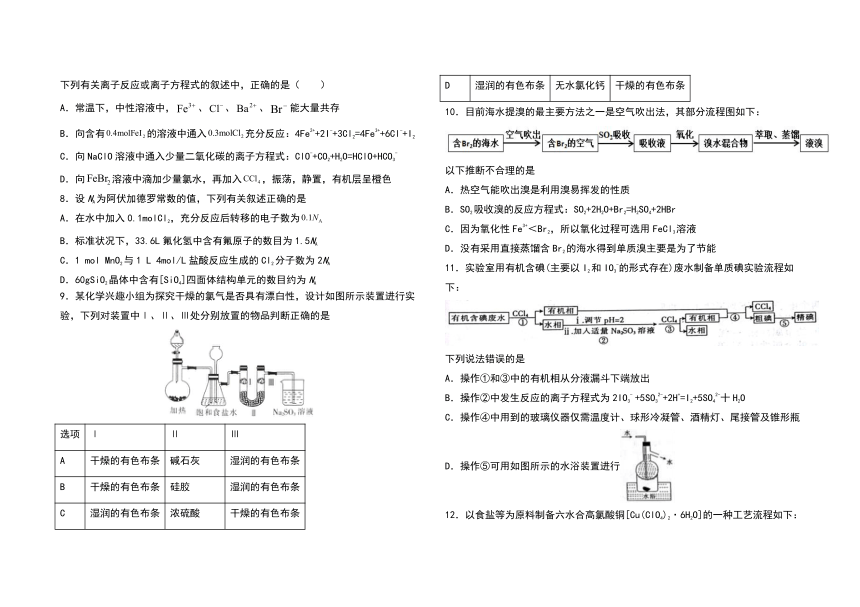
9.某化学兴趣小组为探究干燥的氯气是否具有漂白性,设计如图所示装置进行实验,下列对装置中Ⅰ、Ⅱ、Ⅲ处分别放置的物品判断正确的是
选项
Ⅰ
Ⅱ
Ⅲ
A
干燥的有色布条
碱石灰
湿润的有色布条
B
干燥的有色布条
硅胶
湿润的有色布条
C
湿润的有色布条
浓硫酸
干燥的有色布条
D
湿润的有色布条
无水氯化钙
干燥的有色布条
10.目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:
以下推断不合理的是
A.热空气能吹出溴是利用溴易挥发的性质
B.SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C.因为氧化性Fe3+<Br2,所以氧化过程可选用FeCl3溶液
D.没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
11.实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘实验流程如下:
下列说法错误的是
A.操作①和③中的有机相从分液漏斗下端放出
B.操作②中发生反应的离子方程式为2IO3-
+5SO32-+2H+=I2+5SO42-十H2O
C.操作④中用到的玻璃仪器仅需温度计、球形冷凝管、酒精灯、尾接管及锥形瓶
D.操作⑤可用如图所示的水浴装置进行
12.以食盐等为原料制备六水合高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如下:
下列说法不正确的是
A.“电解Ⅰ”时阳极不可用不锈钢材质B.“歧化反应”的产物之一为NaClO4
C.“操作a”是过滤
D.“反应Ⅱ”的离子方程式为Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
13.25
℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是(
)
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25
℃时,该反应的平衡常数K=2.2
14.氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25
℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l) H=-67.7
kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) H=-57.3
kJ·mol-1
25℃时,在20
mL
0.1
mol·L-1氢氟酸中加入V
mL
0.1
mol·L-1
NaOH溶液,,测得混合溶液的pH变化曲线如下图所示,下列说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:
HF(aq)
F-(aq)+H+(aq) H=+10.4
kJ·mol-1
B.在①点时pH=6,溶液中:c(F-)-c(Na+)
=
9.9×10-7mol/L
C.在②点时,溶液中:c(F-)
<
c(Na+)
D.在③点时V=20mL,溶液中:c(F—)
<
c(Na+)=0.1mol/L
15.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质可用作计算机芯片。下列叙述正确的是
A.原子半径由大到小的顺序:W、Z、Y、X
B.简单气态氢化物的稳定性由强到弱的顺序:Y、W、X
C.半导体器件的研制开始于W元素
D.元素Z可以形成离子化合物也可以形成共价化合物
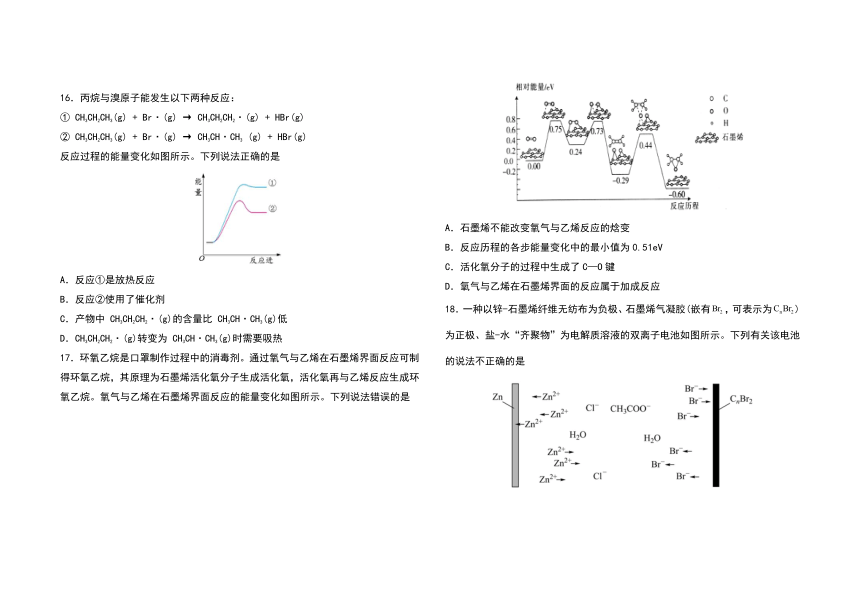
16.丙烷与溴原子能发生以下两种反应:
①
CH3CH2CH3(g)
+
Br·(g)
→
CH3CH2CH2·(g)
+
HBr(g)
②
CH3CH2CH3(g)
+
Br·(g)
→
CH3CH·CH3
(g)
+
HBr(g)
反应过程的能量变化如图所示。下列说法正确的是
A.反应①是放热反应
B.反应②使用了催化剂
C.产物中
CH3CH2CH2·(g)的含量比
CH3CH·CH3(g)低
D.CH3CH2CH2·(g)转变为
CH3CH·CH3(g)时需要吸热
17.环氧乙烷是口罩制作过程中的消毒剂。通过氧气与乙烯在石墨烯界面反应可制得环氧乙烷,其原理为石墨烯活化氧分子生成活化氧,活化氧再与乙烯反应生成环氧乙烷。氧气与乙烯在石墨烯界面反应的能量变化如图所示。下列说法错误的是
A.石墨烯不能改变氧气与乙烯反应的焓变
B.反应历程的各步能量变化中的最小值为0.51eV
C.活化氧分子的过程中生成了C—O键
D.氧气与乙烯在石墨烯界面的反应属于加成反应
18.一种以锌-石墨烯纤维无纺布为负极、石墨烯气凝胶(嵌有,可表示为)为正极、盐-水“齐聚物”为电解质溶液的双离子电池如图所示。下列有关该电池的说法不正确的是
A.放电时,石墨烯气凝胶电极上的电极反应式为
B.多孔石墨烯可增大电极与电解质溶液的接触面积,也有利于扩散至电极表面
C.电池总反应为
D.充电时,被还原,在石墨烯纤维无纺布电极侧沉积,被氧化后在阴极嵌入
(第II卷
非选择题
共56分)
二、填空题
19.(16分)以粗硅(含铁、铝等杂质)为原料,工业上有以下两种制备高纯硅的工艺。已知:SiCl4沸点57.7℃,遇水强烈水解;SiHCl3沸点31.5℃,且能与H2O强烈反应,并在空气中易自燃。
(1)写出制备粗硅的化学反应方程式为___________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4和HCl,操作①采用的方法为___________。SiCl4和SiHCl3遇水都会剧烈反应,都会生成、HCl。但SiHCl3会多生成一种物质X,写出X物质的名称
__________。
(3)实验室用如下装置制备SiCl4(反应温度在400℃~500℃)。
①装置F的作用是______________________________________。
实验开始应先点燃_______
(填“A”或“D”)装置的酒精灯一段时间后再点燃另一酒精灯。
②写出A装置中的化学反应方程式_______________________。
(4)SiHCl3与过量H2制备纯硅的装置如下(热源及夹持装置已略去)。
装置B中的试剂是_________(填名称),装置C中的烧瓶加热的目的是________。实验中先让稀硫酸与锌粒反应一段时间后,再加热C、D装置的理由是___________,装置D中发生反应的化学方程式为___________。
20.(13分)氟及其化合物在生产生活中被广泛使用。
(1)LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下
已知:HCl的沸点是-85.0
℃,HF的沸点是19.5
℃。
①第①步反应中无水HF的作用是
、
。反应设备不能用玻璃材质的原因是_______________________(用化学方程式表示)。
②该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:_______________________________________________。
③第④步分离采用的方法是______;第⑤步分离尾气中HF、HCl采用的方法是____。
(2)工业上制备氟气通常采用电解氧化法,如图是电解熔融的氟氢化钾(KHF2)的实验装置:
①
已知阴极的电极反应式为2HF2-+2e-═H2+4F-,则电解的总反应为
__________
②
出口1处的物质是
__________(填化学式)。
(3)牙齿表面有一层釉质,其组成为羟基磷灰石Ca5(PO4)3OH(Ksp=6.8×10-21),容易受到酸的侵蚀,研究表明氟磷灰石Ca5(PO4)3F(Ksp=1.0×10-37)更能抵抗酸的腐蚀。请用平衡移动原理解释为什么人们常使用含氟牙膏防治蛀牙____________。
21.(14分)氯气是一种重要的化工原料。
(1)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,例如,工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4。已知:
TiO2(s)+2Cl2(g)=
TiCl4(g)+
O2(g)
ΔH1=+175.4
kJ·mol-1
;KI=3.4×10-29
2C(s)+O2(g)=2CO(g)
ΔH2=-220.9
kJ·mol-1
;KII=1.2×1048
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:__________________。
结合数据说明氯化过程中加碳的理由____________________________________
。
(2)Cl2合成有机物时会产生副产物HCl。4HCl+O22Cl2+2H2O,可实现氯的循环利用。
①若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是 ?
a.v?(HCl)=2?v(Cl2) b.4v正(HCl)=?v逆(O2)
c.又加入1mol?O2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
②下图是该反应两种投料比[n?(HCl):n?(O2)分别为4:1和2:1
]下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是 ?。
a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)?Cl2(aq)
K1=c(Cl2)/p
Cl
2(aq)
+
H2O(l)?H+
(aq)+Cl-
(aq)
+
HClO(aq)
K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)?Cl2(aq)的焓变ΔH1______0。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=______。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=______。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5
mol·L-1,反应30
min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是______。
A.适当提高反应温度
B.改变催化剂
C.适当降低反应温度
D.改变反应物浓度
22.(13分)溴水中存在化学平衡:Br2+H2O
HBr+HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质(如图所示)。
回答下列问题:
(1)写出B中所含官能团名称__________,指出③的反应类型________,写出I的结构简式________。
(2)写出反应①的化学方程式___________________________________。
写出反应②的化学方程式___________________________________。
(3)以C2H5Br为原料,其它无机试剂任选,写出制备乙酸乙酯的合成路线图,注明试剂和条件。
大庆市名校2021-2022学年度
高三上学期开学考试
化学答案
一、选择题(1-10题,每题2分;11-18题,每题3分)
1.【答案】C2.【答案】D3.【答案】B4.【答案】B5.【答案】A6.【答案】B
7.【答案】C8.【答案】D9.【答案】D10.【答案】C
11.【答案】C12.【答案】B13.【答案】D14.【答案】B15.【答案】D16.【答案】C
17.【答案】B18.【答案】D
19.(16分)
(2分)
分馏(或蒸馏)
(1分)
氢气(1分)
吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶
(1分)
A
(2分)
(2分)
浓硫酸
(1分)
使进入烧瓶的液态SiHCl3变为气体(2分)让H2排尽装置中的空气,防止SiHCl3水解和自燃
(2分)
(2分)
20.(13分)【答案】溶剂(1分)
反应物
(1分)
SiO2+4HF=SiF4↑+2H2O
(2分)
PF
5+4H2O=H3PO4+5HF(2分)
过滤(1分)
冷凝
(1分)
2KHF2
H2↑+F2↑+2KF
(2分)
F2
(1分)
牙齿表面的羟基磷灰石在水中存在平衡:
Ca5(PO4)3OH(s)
5Ca2+
(aq)
+3PO43-(aq)
+OH-(aq),容易因为酸使上述平衡向右移动而被腐蚀;当加入氟化物时发生反应生成溶解度更小的氟磷灰石:
5Ca2+
(aq)
+3PO43-(aq)
+
F-
(aq)=
Ca5(PO4)
3F(s),实现了羟基磷灰石转化为更耐腐蚀的氟磷灰石,因此使用氟化物能防止蛀牙
(2分)
21.(14分)【答案】(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)
△H=-45.5
kJ/mol
(2分)
反应I
+
II得:
TiO2(s)+2Cl2(g)
+
2C(s)
=TiCl4(g)+
2CO(g),K=KIKII=4.1×1019远大于K1,反应II使TiO2氯化为TiCl4得以实现;ΔH=ΔHI+ΔHII=
-45.5kJ·mol-1,反应II
可为反应I提供所需的能量(2分)
(2)①ac (2分) ②ad (2分)(3)①<
(1分)
②
(1分)
③
K1p
+
(2分)
(4)
AB
(2分)
22.(13分)【答案】溴原子(1分)、羟基
(1分)
取代反应
(1分)
(2分)
(2分)
(2分)
(4分)
e
c
高三上学期
开学考试
化学
可能用到的相对原子质量:H
1
Li
7
C
12
N
14
O
16
F
19
Na
23
Mg
24
Al
27
Si
28
S
32
Cl
35.5
K
39
Ca
40
Fe
56
Cu
64
(
I卷
选择题
共44分
)
一、选择题(1-10题,每题2分;11-18题,每题24分)
1.2021年东京奥运会在这个暑假召开。有一种有机物,因其酷似奥林匹克旗中的五环,科学家称之为奥林匹克烃。有关奥林匹克烃的说法正确的是
A.该烃的一氯代物只有六种
B.该烃分子中只含非极性键
C.该烃完全燃烧生成H2O的物质的量小于CO2的物质的量
D.该烃属于苯的同系物
2.2020年11月“嫦娥五号”成功着陆月球,展示了以芳纶为主制成的五星红旗,用SiC增强铝基材料钻杆“挖土”,实现了中国首次月球无人采样返回。研究表明月球表面的“土壤”主要含有氧、硅、铝、铁、镁、钙和钠等元素。下列有关说法正确的是
A.月球表面的“土壤”所含金属元素镁和铝均可以通过电解其熔融氯化物进行冶炼
B.制作五星红旗用的芳纶为合成纤维,灼烧具有烧焦羽毛的气味
C.SiC又称金刚砂,属于有机合成高分子材料
D.“嫦娥五号”使用的锂离子电池组工作时是将化学能转变成电能
3.下列关于新冠病毒说法错误的是
A.含有病毒的飞沫分散在空气中形成的分散系为气溶胶
B.N95口罩所使用的聚丙烯材料属于天然纤维
C.用于盛装新冠疫苗的中硼硅玻璃管属于硅酸盐材质,既耐低温,又耐强酸
D.用电解食盐水制取的次氯酸钠喷洒房间能杀死新冠肺炎病毒
4.检验黑木耳中的铁离子的步骤为:灼烧黑木耳→加酸溶解→过滤→取滤液检验,所选择的装置(夹持装置已略去)及操作正确的是
A.灼烧木耳
B.加酸后搅拌溶解
C.过滤得滤液
D.检验滤液中铁离子
5.部分含碳物质的分类与相应碳元素的化合价关系如图所示。下列说法错误的是
A.a中可能含有非极性键
B.b存在多种同素异形体
C.c不属于酸性氧化物
D.d转化为e可通过化合反应实现
6.锗(位于第4周期ⅣA族)和铝在周期表中处于对角线位置,二者的单质及化合物的性质对应相似。下列关于锗及其化合物的推断正确的是( )
A.锗不能与强碱反应
B.氢氧化锗具有两性
C.氧化锗易溶于水
D.氧化锗的化学式为Ge2O3
7.已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.常温下,中性溶液中,、、、能大量共存
B.向含有的溶液中通入充分反应:4Fe2++2I-+3Cl2=4Fe3++6Cl-+I2
C.向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-
D.向溶液中滴加少量氯水,再加入,振荡,静置,有机层呈橙色
8.设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.在水中加入0.1molCl2,充分反应后转移的电子数为
B.标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA
C.1
mol
MnO2与1
L
4mol/L盐酸反应生成的Cl2分子数为2NA
D.60gSiO2晶体中含有[SiO4]四面体结构单元的数目约为NA
9.某化学兴趣小组为探究干燥的氯气是否具有漂白性,设计如图所示装置进行实验,下列对装置中Ⅰ、Ⅱ、Ⅲ处分别放置的物品判断正确的是
选项
Ⅰ
Ⅱ
Ⅲ
A
干燥的有色布条
碱石灰
湿润的有色布条
B
干燥的有色布条
硅胶
湿润的有色布条
C
湿润的有色布条
浓硫酸
干燥的有色布条
D
湿润的有色布条
无水氯化钙
干燥的有色布条
10.目前海水提溴的最主要方法之一是空气吹出法,其部分流程图如下:
以下推断不合理的是
A.热空气能吹出溴是利用溴易挥发的性质
B.SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C.因为氧化性Fe3+<Br2,所以氧化过程可选用FeCl3溶液
D.没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能
11.实验室用有机含碘(主要以I2和IO3-的形式存在)废水制备单质碘实验流程如下:
下列说法错误的是
A.操作①和③中的有机相从分液漏斗下端放出
B.操作②中发生反应的离子方程式为2IO3-
+5SO32-+2H+=I2+5SO42-十H2O
C.操作④中用到的玻璃仪器仅需温度计、球形冷凝管、酒精灯、尾接管及锥形瓶
D.操作⑤可用如图所示的水浴装置进行
12.以食盐等为原料制备六水合高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如下:
下列说法不正确的是
A.“电解Ⅰ”时阳极不可用不锈钢材质B.“歧化反应”的产物之一为NaClO4
C.“操作a”是过滤
D.“反应Ⅱ”的离子方程式为Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
13.25
℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是(
)
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D.25
℃时,该反应的平衡常数K=2.2
14.氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25
℃时:
①HF(aq)+OH-(aq)===F-(aq)+H2O(l) H=-67.7
kJ·mol-1
②H+(aq)+OH-(aq)===H2O(l) H=-57.3
kJ·mol-1
25℃时,在20
mL
0.1
mol·L-1氢氟酸中加入V
mL
0.1
mol·L-1
NaOH溶液,,测得混合溶液的pH变化曲线如下图所示,下列说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:
HF(aq)
F-(aq)+H+(aq) H=+10.4
kJ·mol-1
B.在①点时pH=6,溶液中:c(F-)-c(Na+)
=
9.9×10-7mol/L
C.在②点时,溶液中:c(F-)
<
c(Na+)
D.在③点时V=20mL,溶液中:c(F—)
<
c(Na+)=0.1mol/L
15.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有6个电子,Y是至今发现的非金属性最强的元素,Z在周期表中处于周期序数等于族序数的位置,W的单质可用作计算机芯片。下列叙述正确的是
A.原子半径由大到小的顺序:W、Z、Y、X
B.简单气态氢化物的稳定性由强到弱的顺序:Y、W、X
C.半导体器件的研制开始于W元素
D.元素Z可以形成离子化合物也可以形成共价化合物
16.丙烷与溴原子能发生以下两种反应:
①
CH3CH2CH3(g)
+
Br·(g)
→
CH3CH2CH2·(g)
+
HBr(g)
②
CH3CH2CH3(g)
+
Br·(g)
→
CH3CH·CH3
(g)
+
HBr(g)
反应过程的能量变化如图所示。下列说法正确的是
A.反应①是放热反应
B.反应②使用了催化剂
C.产物中
CH3CH2CH2·(g)的含量比
CH3CH·CH3(g)低
D.CH3CH2CH2·(g)转变为
CH3CH·CH3(g)时需要吸热
17.环氧乙烷是口罩制作过程中的消毒剂。通过氧气与乙烯在石墨烯界面反应可制得环氧乙烷,其原理为石墨烯活化氧分子生成活化氧,活化氧再与乙烯反应生成环氧乙烷。氧气与乙烯在石墨烯界面反应的能量变化如图所示。下列说法错误的是
A.石墨烯不能改变氧气与乙烯反应的焓变
B.反应历程的各步能量变化中的最小值为0.51eV
C.活化氧分子的过程中生成了C—O键
D.氧气与乙烯在石墨烯界面的反应属于加成反应
18.一种以锌-石墨烯纤维无纺布为负极、石墨烯气凝胶(嵌有,可表示为)为正极、盐-水“齐聚物”为电解质溶液的双离子电池如图所示。下列有关该电池的说法不正确的是
A.放电时,石墨烯气凝胶电极上的电极反应式为
B.多孔石墨烯可增大电极与电解质溶液的接触面积,也有利于扩散至电极表面
C.电池总反应为
D.充电时,被还原,在石墨烯纤维无纺布电极侧沉积,被氧化后在阴极嵌入
(第II卷
非选择题
共56分)
二、填空题
19.(16分)以粗硅(含铁、铝等杂质)为原料,工业上有以下两种制备高纯硅的工艺。已知:SiCl4沸点57.7℃,遇水强烈水解;SiHCl3沸点31.5℃,且能与H2O强烈反应,并在空气中易自燃。
(1)写出制备粗硅的化学反应方程式为___________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3中含有少量SiCl4和HCl,操作①采用的方法为___________。SiCl4和SiHCl3遇水都会剧烈反应,都会生成、HCl。但SiHCl3会多生成一种物质X,写出X物质的名称
__________。
(3)实验室用如下装置制备SiCl4(反应温度在400℃~500℃)。
①装置F的作用是______________________________________。
实验开始应先点燃_______
(填“A”或“D”)装置的酒精灯一段时间后再点燃另一酒精灯。
②写出A装置中的化学反应方程式_______________________。
(4)SiHCl3与过量H2制备纯硅的装置如下(热源及夹持装置已略去)。
装置B中的试剂是_________(填名称),装置C中的烧瓶加热的目的是________。实验中先让稀硫酸与锌粒反应一段时间后,再加热C、D装置的理由是___________,装置D中发生反应的化学方程式为___________。
20.(13分)氟及其化合物在生产生活中被广泛使用。
(1)LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下
已知:HCl的沸点是-85.0
℃,HF的沸点是19.5
℃。
①第①步反应中无水HF的作用是
、
。反应设备不能用玻璃材质的原因是_______________________(用化学方程式表示)。
②该流程需在无水条件下进行,第③步反应中PF5极易水解,其产物为两种酸,写出PF5水解的化学方程式:_______________________________________________。
③第④步分离采用的方法是______;第⑤步分离尾气中HF、HCl采用的方法是____。
(2)工业上制备氟气通常采用电解氧化法,如图是电解熔融的氟氢化钾(KHF2)的实验装置:
①
已知阴极的电极反应式为2HF2-+2e-═H2+4F-,则电解的总反应为
__________
②
出口1处的物质是
__________(填化学式)。
(3)牙齿表面有一层釉质,其组成为羟基磷灰石Ca5(PO4)3OH(Ksp=6.8×10-21),容易受到酸的侵蚀,研究表明氟磷灰石Ca5(PO4)3F(Ksp=1.0×10-37)更能抵抗酸的腐蚀。请用平衡移动原理解释为什么人们常使用含氟牙膏防治蛀牙____________。
21.(14分)氯气是一种重要的化工原料。
(1)由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,例如,工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为TiO2)为原料生产TiCl4。已知:
TiO2(s)+2Cl2(g)=
TiCl4(g)+
O2(g)
ΔH1=+175.4
kJ·mol-1
;KI=3.4×10-29
2C(s)+O2(g)=2CO(g)
ΔH2=-220.9
kJ·mol-1
;KII=1.2×1048
沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:__________________。
结合数据说明氯化过程中加碳的理由____________________________________
。
(2)Cl2合成有机物时会产生副产物HCl。4HCl+O22Cl2+2H2O,可实现氯的循环利用。
①若该反应在体积不变的密闭容器中发生,当反应达平衡时,下列叙述正确的是 ?
a.v?(HCl)=2?v(Cl2) b.4v正(HCl)=?v逆(O2)
c.又加入1mol?O2,达新平衡时,HCl的转化率增大
d.分离出H2O,达新平衡时,v正(HCl)增大
②下图是该反应两种投料比[n?(HCl):n?(O2)分别为4:1和2:1
]下,反应温度对HCl平衡转化率影响的曲线。下列叙述正确的是 ?。
a.该反应的正反应是放热反应
b.其他条件不变,升高温度,平衡常数K值增大
c.若平衡常数K值变大,达新平衡前v逆始终减小
d.若平衡常数K值变大,则平衡向正反应方向移动
(3)在一定温度下,氯气溶于水的过程及其平衡常数为:
Cl2(g)?Cl2(aq)
K1=c(Cl2)/p
Cl
2(aq)
+
H2O(l)?H+
(aq)+Cl-
(aq)
+
HClO(aq)
K2
其中p为Cl2(g)的平衡压强,c(Cl2)为Cl2在水溶液中的平衡浓度。
①Cl2(g)?Cl2(aq)的焓变ΔH1______0。(填”>”、“=”或“<”)
②平衡常数K2的表达式为K2=______。
③氯气在水中的溶解度(以物质的量浓度表示)为c,则c=______。(用平衡压强p和上述平衡常数表示,忽略HClO的电离)
(4)在一定温度下,以I2为催化剂,氯苯和Cl2在CS2中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为0.5
mol·L-1,反应30
min测得氯苯15%转化为邻二氯苯,25%转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是______。
A.适当提高反应温度
B.改变催化剂
C.适当降低反应温度
D.改变反应物浓度
22.(13分)溴水中存在化学平衡:Br2+H2O
HBr+HBrO,乙烯通入溴水中,生成A、B和C2H5Br三种物质(如图所示)。
回答下列问题:
(1)写出B中所含官能团名称__________,指出③的反应类型________,写出I的结构简式________。
(2)写出反应①的化学方程式___________________________________。
写出反应②的化学方程式___________________________________。
(3)以C2H5Br为原料,其它无机试剂任选,写出制备乙酸乙酯的合成路线图,注明试剂和条件。
大庆市名校2021-2022学年度
高三上学期开学考试
化学答案
一、选择题(1-10题,每题2分;11-18题,每题3分)
1.【答案】C2.【答案】D3.【答案】B4.【答案】B5.【答案】A6.【答案】B
7.【答案】C8.【答案】D9.【答案】D10.【答案】C
11.【答案】C12.【答案】B13.【答案】D14.【答案】B15.【答案】D16.【答案】C
17.【答案】B18.【答案】D
19.(16分)
(2分)
分馏(或蒸馏)
(1分)
氢气(1分)
吸收尾气Cl2,并防止空气中的水蒸气进入广口瓶
(1分)
A
(2分)
(2分)
浓硫酸
(1分)
使进入烧瓶的液态SiHCl3变为气体(2分)让H2排尽装置中的空气,防止SiHCl3水解和自燃
(2分)
(2分)
20.(13分)【答案】溶剂(1分)
反应物
(1分)
SiO2+4HF=SiF4↑+2H2O
(2分)
PF
5+4H2O=H3PO4+5HF(2分)
过滤(1分)
冷凝
(1分)
2KHF2
H2↑+F2↑+2KF
(2分)
F2
(1分)
牙齿表面的羟基磷灰石在水中存在平衡:
Ca5(PO4)3OH(s)
5Ca2+
(aq)
+3PO43-(aq)
+OH-(aq),容易因为酸使上述平衡向右移动而被腐蚀;当加入氟化物时发生反应生成溶解度更小的氟磷灰石:
5Ca2+
(aq)
+3PO43-(aq)
+
F-
(aq)=
Ca5(PO4)
3F(s),实现了羟基磷灰石转化为更耐腐蚀的氟磷灰石,因此使用氟化物能防止蛀牙
(2分)
21.(14分)【答案】(1)TiO2(s)+2Cl2(g)+2C(s)=TiCl4(g)+2CO(g)
△H=-45.5
kJ/mol
(2分)
反应I
+
II得:
TiO2(s)+2Cl2(g)
+
2C(s)
=TiCl4(g)+
2CO(g),K=KIKII=4.1×1019远大于K1,反应II使TiO2氯化为TiCl4得以实现;ΔH=ΔHI+ΔHII=
-45.5kJ·mol-1,反应II
可为反应I提供所需的能量(2分)
(2)①ac (2分) ②ad (2分)(3)①<
(1分)
②
(1分)
③
K1p
+
(2分)
(4)
AB
(2分)
22.(13分)【答案】溴原子(1分)、羟基
(1分)
取代反应
(1分)
(2分)
(2分)
(2分)
(4分)
e
c
同课章节目录
