高中化学苏教版(2019)选择性必修1 专题3 第三单元 微专题12 水解常数及应用(15张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1 专题3 第三单元 微专题12 水解常数及应用(15张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 814.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-05 00:00:00 | ||
图片预览






文档简介
(共15张PPT)
微专题12
水解常数及应用
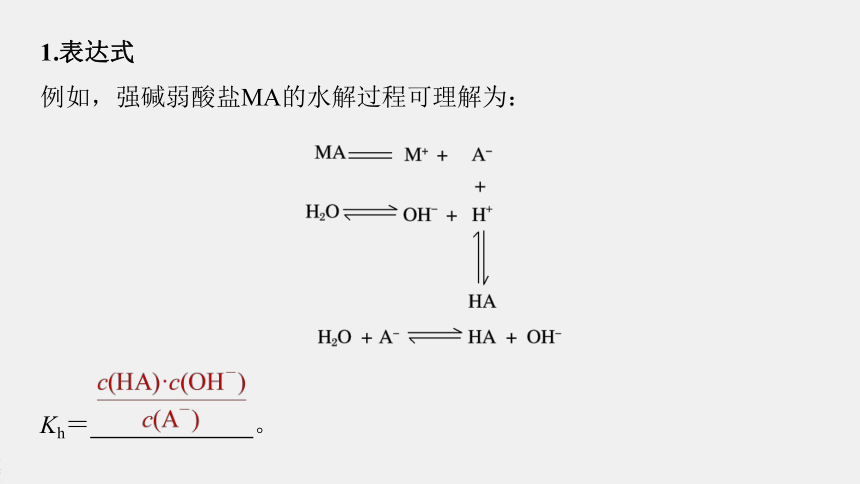
1.表达式
例如,强碱弱酸盐MA的水解过程可理解为:
Kh=
。
2.与对应弱酸电离常数的关系
Ka=
,
所以,
=Kw或Kh=
。
3.水解常数的意义
Kh定量的表示水解反应趋势的大小,Kh越大,水解趋势
。
4.外因对水解常数的影响
Kh是化学平衡常数的一种,只与温度有关,与盐溶液的浓度无关,一般温度升高,Kh
。
Kh·Ka
越大
增大
1.多元弱酸根离子如
的水解平衡常数与逐级电离平衡常数的关系?
深度思考
2.NaHCO3溶液中,水解程度和电离程度的相对大小如何比较?
提示 NaHCO3溶液中,水解程度和电离程度的相对大小可以用水解常数(Kh)与电离常数(Ka2)的相对大小进行比较。
1.已知25
℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5,该温度下
1
mol·L-1的NH4Cl溶液中c(H+)=___________
mol·L-1。(已知
≈2.36)
跟踪训练
2.36×10-5
c(H+)≈c(NH3·H2O)
≈2.36×10-5
mol·L-1。
1
2
3
4
5
2.(2020·台州期末)下列数据不一定随温度升高而增大的是
A.活化分子百分数
B.盐类水解平衡常数
C.弱酸或弱碱的电离平衡常数
D.化学平衡常数
√
解析 B项,盐类水解是吸热过程,升高温度,促进水解,水解平衡常数增大,正确;
C项,弱电解质的电离是吸热过程,升高温度促进弱电解质电离,电离平衡常数增大,正确;
D项,对于放热的化学反应,升高温度K减小,错误。
1
2
3
4
5
3.常温下,有浓度均为0.1
mol·L-1的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
已知该温度下3种酸的电离平衡常数如下:
HCN
H2CO3
CH3COOH
Ka=5.0×10-10
Ka1=4×10-7
Ka2=5.0×10-11
Ka=1.7×10-5
(1)这4种溶液pH由大到小的顺序是________________(填序号)。
②>①>④>③
1
2
3
4
5
解析 这4种溶液②NaOH溶液碱性最强,其余三种溶液因Ka(CH3COOH)
>Ka1(H2CO3)>Ka(HCN),弱酸的酸性越强,其钠盐的水解程度越弱,则水解程度:CH3COONaNaHCO3>
CH3COONa,则pH由大到小的顺序是②>①>④>③。
1
2
3
4
5
(2)④的水解平衡常数Kh=___________。
2.5×10-8
1
2
3
4
5
(3)此温度下,某HCN和NaCN的混合溶液的pH=11,则
为_____。
0.02
1
2
3
4
5
4.由数据分析,室温下,NaHSO3溶液呈酸性的原因。(已知H2SO3:Ka1=1.4×10-2,Ka2=6.0×10-8)
≈7.14×10-13
1
2
3
4
5
5.(2020·郑州模拟)磷酸是三元弱酸,常温下三步电离常数分别是Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,回答下列问题:
(1)常温下,同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序是____________(填序号)。
(2)常温下,NaH2PO4的水溶液pH____(填“>”“<”或“=”)7。
③<②<①
<
解析 NaH2PO4的水解常数
1
2
3
4
5
(3)常温下,Na2HPO4的水溶液呈____(填“酸”“碱”或“中”)性,用Ka
与Kh的相对大小说明理由:_____________________________________
____________________________________________________________________________________________________。
碱
其电离程度,因而Na2HPO4的水溶液呈碱性
1
2
3
4
5
本课结束
微专题12
水解常数及应用
1.表达式
例如,强碱弱酸盐MA的水解过程可理解为:
Kh=
。
2.与对应弱酸电离常数的关系
Ka=
,
所以,
=Kw或Kh=
。
3.水解常数的意义
Kh定量的表示水解反应趋势的大小,Kh越大,水解趋势
。
4.外因对水解常数的影响
Kh是化学平衡常数的一种,只与温度有关,与盐溶液的浓度无关,一般温度升高,Kh
。
Kh·Ka
越大
增大
1.多元弱酸根离子如
的水解平衡常数与逐级电离平衡常数的关系?
深度思考
2.NaHCO3溶液中,水解程度和电离程度的相对大小如何比较?
提示 NaHCO3溶液中,水解程度和电离程度的相对大小可以用水解常数(Kh)与电离常数(Ka2)的相对大小进行比较。
1.已知25
℃时,NH3·H2O的电离平衡常数Kb=1.8×10-5,该温度下
1
mol·L-1的NH4Cl溶液中c(H+)=___________
mol·L-1。(已知
≈2.36)
跟踪训练
2.36×10-5
c(H+)≈c(NH3·H2O)
≈2.36×10-5
mol·L-1。
1
2
3
4
5
2.(2020·台州期末)下列数据不一定随温度升高而增大的是
A.活化分子百分数
B.盐类水解平衡常数
C.弱酸或弱碱的电离平衡常数
D.化学平衡常数
√
解析 B项,盐类水解是吸热过程,升高温度,促进水解,水解平衡常数增大,正确;
C项,弱电解质的电离是吸热过程,升高温度促进弱电解质电离,电离平衡常数增大,正确;
D项,对于放热的化学反应,升高温度K减小,错误。
1
2
3
4
5
3.常温下,有浓度均为0.1
mol·L-1的下列4种溶液:
①NaCN溶液 ②NaOH溶液 ③CH3COONa溶液 ④NaHCO3溶液
已知该温度下3种酸的电离平衡常数如下:
HCN
H2CO3
CH3COOH
Ka=5.0×10-10
Ka1=4×10-7
Ka2=5.0×10-11
Ka=1.7×10-5
(1)这4种溶液pH由大到小的顺序是________________(填序号)。
②>①>④>③
1
2
3
4
5
解析 这4种溶液②NaOH溶液碱性最强,其余三种溶液因Ka(CH3COOH)
>Ka1(H2CO3)>Ka(HCN),弱酸的酸性越强,其钠盐的水解程度越弱,则水解程度:CH3COONa
CH3COONa,则pH由大到小的顺序是②>①>④>③。
1
2
3
4
5
(2)④的水解平衡常数Kh=___________。
2.5×10-8
1
2
3
4
5
(3)此温度下,某HCN和NaCN的混合溶液的pH=11,则
为_____。
0.02
1
2
3
4
5
4.由数据分析,室温下,NaHSO3溶液呈酸性的原因。(已知H2SO3:Ka1=1.4×10-2,Ka2=6.0×10-8)
≈7.14×10-13
1
2
3
4
5
5.(2020·郑州模拟)磷酸是三元弱酸,常温下三步电离常数分别是Ka1=7.1×10-3,Ka2=6.2×10-8,Ka3=4.5×10-13,回答下列问题:
(1)常温下,同浓度①Na3PO4、②Na2HPO4、③NaH2PO4的pH由小到大的顺序是____________(填序号)。
(2)常温下,NaH2PO4的水溶液pH____(填“>”“<”或“=”)7。
③<②<①
<
解析 NaH2PO4的水解常数
1
2
3
4
5
(3)常温下,Na2HPO4的水溶液呈____(填“酸”“碱”或“中”)性,用Ka
与Kh的相对大小说明理由:_____________________________________
____________________________________________________________________________________________________。
碱
其电离程度,因而Na2HPO4的水溶液呈碱性
1
2
3
4
5
本课结束
