4.2 电解池 课时同步训练 2021-2022学年高二化学人教版(2019)选择性必修1word版含解析
文档属性
| 名称 | 4.2 电解池 课时同步训练 2021-2022学年高二化学人教版(2019)选择性必修1word版含解析 |  | |
| 格式 | docx | ||
| 文件大小 | 799.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-05 18:56:04 | ||
图片预览

文档简介
4.2课时
电解池
一、选择题(本大题共14小题,每小题所给的4个选项,只有一个答案符合题目要求。)
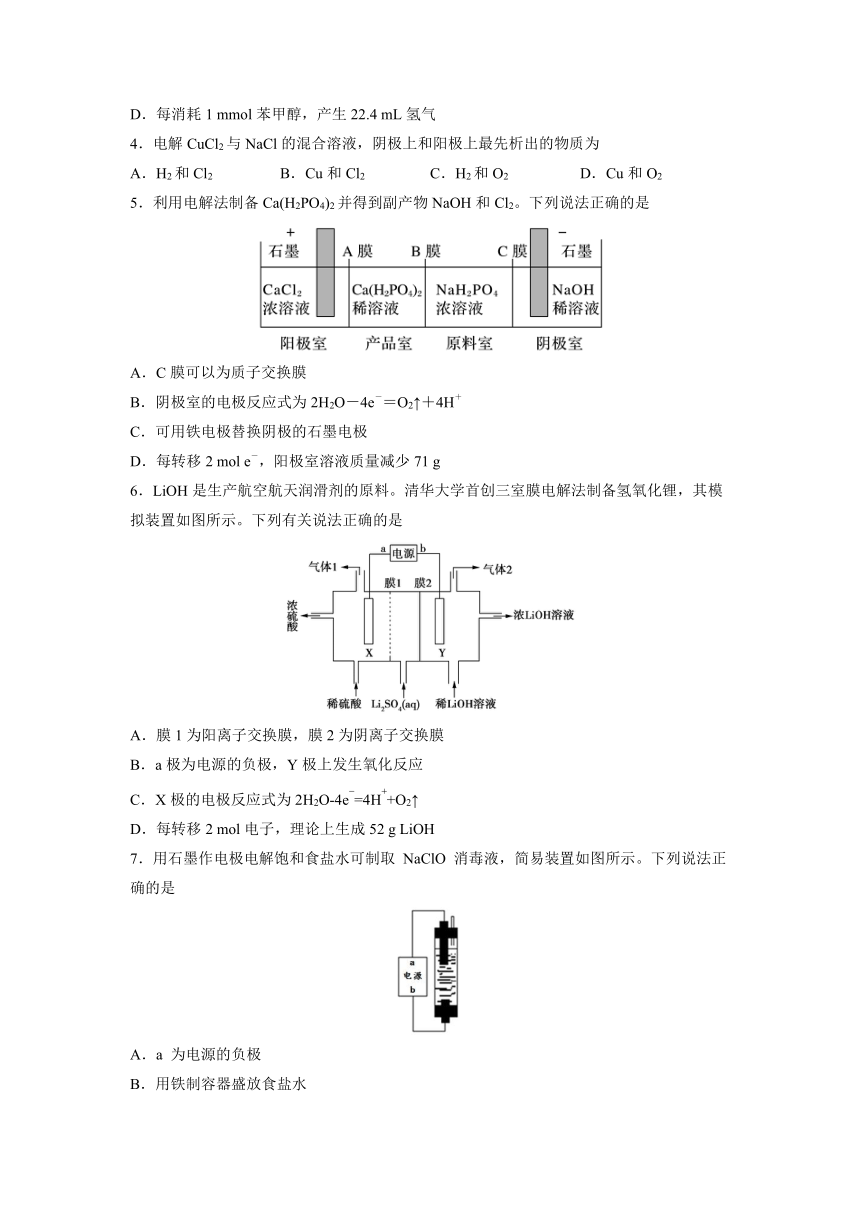
1.如图所示装置中,属于电解池的是
A.
B.
C.
D.
2.如图为课本中电解饱和食盐水的实验装置。据此,下列叙述不正确的是
A.装置中,a管导出的气体为氢气
B.b管导出的气体为氯气
C.以食盐水为基础原料制取氯气等产品的工业被称为氯碱工业
D.在石墨棒电极区城滴入酚酞试液,溶液会变红
3.在N-羟基邻苯二甲酰亚胺(NHPI)介质中,可实现醇向醛的转化,原理如图。下列说法错误的是
A.理论上NHPI的总量在反应前后不变
B.海绵Ni电极作阳极
C.总反应为+
H2↑
D.每消耗1
mmol苯甲醇,产生22.4
mL氢气
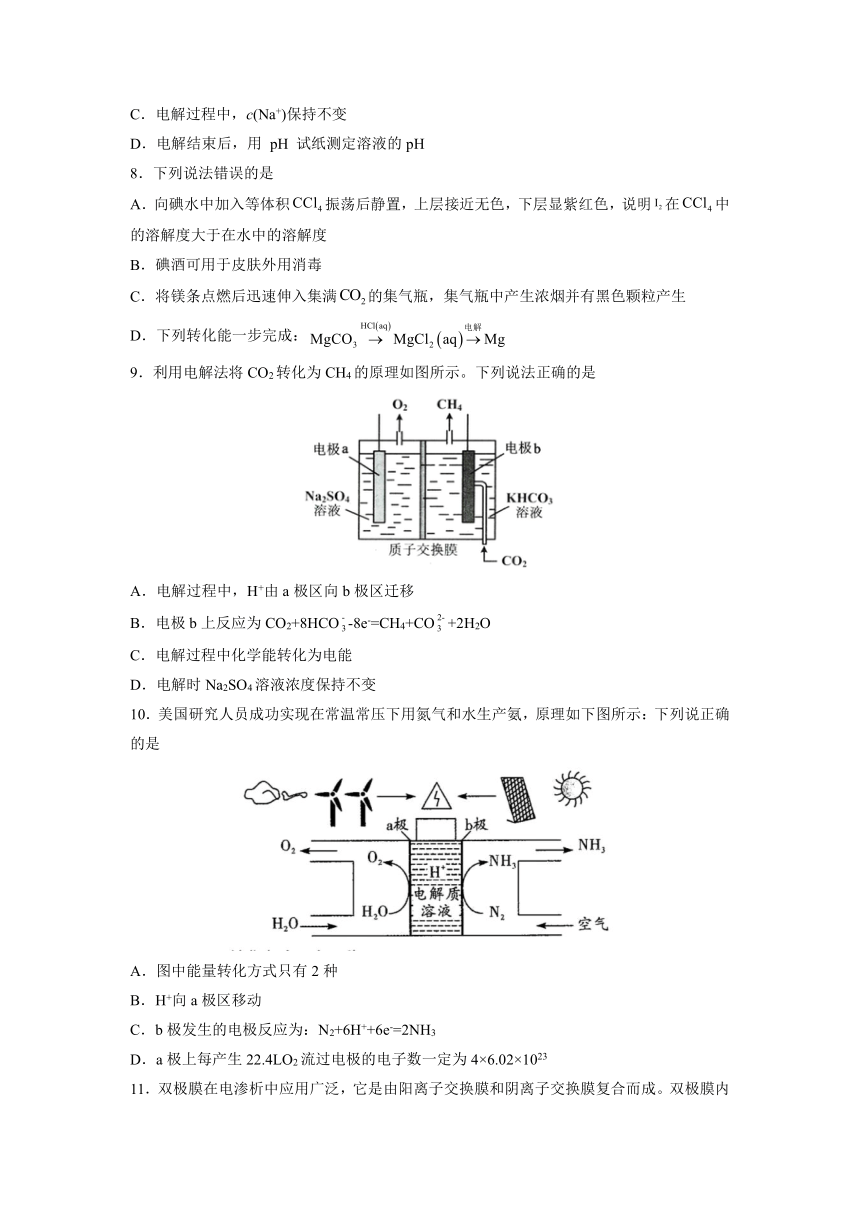
4.电解CuCl2与NaCl的混合溶液,阴极上和阳极上最先析出的物质为
A.H2和Cl2
B.Cu和Cl2
C.H2和O2
D.Cu和O2
5.利用电解法制备Ca(H2PO4)2并得到副产物NaOH和Cl2。下列说法正确的是
A.C膜可以为质子交换膜
B.阴极室的电极反应式为2H2O-4e-=O2↑+4H+
C.可用铁电极替换阴极的石墨电极
D.每转移2
mol
e-,阳极室溶液质量减少71
g
6.LiOH是生产航空航天润滑剂的原料。清华大学首创三室膜电解法制备氢氧化锂,其模拟装置如图所示。下列有关说法正确的是
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.a极为电源的负极,Y极上发生氧化反应
C.X极的电极反应式为2H2O-4e=4H+O2↑
D.每转移2
mol电子,理论上生成52
g
LiOH
7.用石墨作电极电解饱和食盐水可制取
NaClO
消毒液,简易装置如图所示。下列说法正确的是
A.a
为电源的负极
B.用铁制容器盛放食盐水
C.电解过程中,c(Na+)保持不变
D.电解结束后,用
pH
试纸测定溶液的pH
8.下列说法错误的是
A.向碘水中加入等体积振荡后静置,上层接近无色,下层显紫红色,说明在中的溶解度大于在水中的溶解度
B.碘酒可用于皮肤外用消毒
C.将镁条点燃后迅速伸入集满的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生
D.下列转化能一步完成:
9.利用电解法将CO2转化为CH4的原理如图所示。下列说法正确的是
A.电解过程中,H+由a极区向b极区迁移
B.电极b上反应为CO2+8HCO-8e-=CH4+CO+2H2O
C.电解过程中化学能转化为电能
D.电解时Na2SO4溶液浓度保持不变
10.美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:下列说正确的是
A.图中能量转化方式只有2种
B.H+向a极区移动
C.b极发生的电极反应为:N2+6H++6e-=2NH3
D.a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
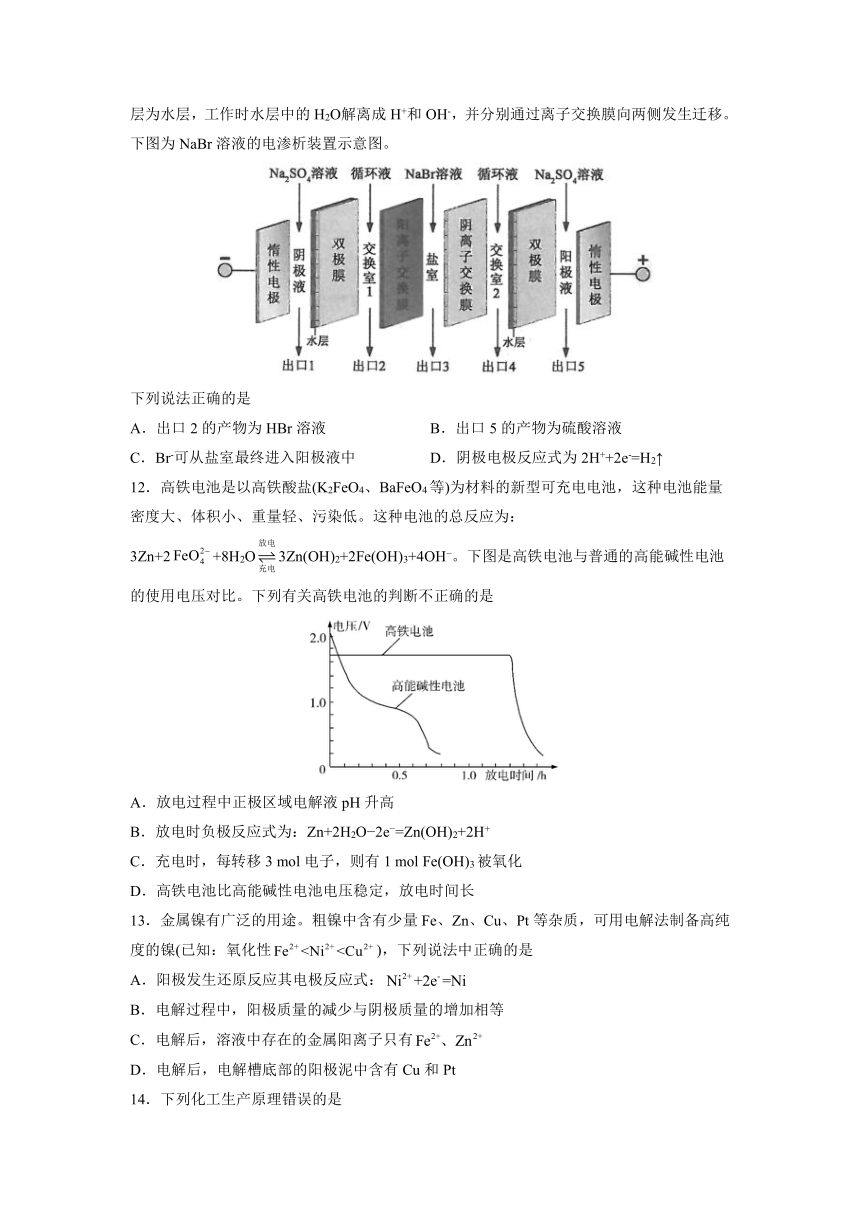
11.双极膜在电渗析中应用广泛,它是由阳离子交换膜和阴离子交换膜复合而成。双极膜内层为水层,工作时水层中的H2О解离成H+和OH-,并分别通过离子交换膜向两侧发生迁移。下图为NaBr溶液的电渗析装置示意图。
下列说法正确的是
A.出口2的产物为HBr溶液
B.出口5的产物为硫酸溶液
C.Br-可从盐室最终进入阳极液中
D.阴极电极反应式为2H++2e-=H2↑
12.高铁电池是以高铁酸盐(K2FeO4、BaFeO4等)为材料的新型可充电电池,这种电池能量密度大、体积小、重量轻、污染低。这种电池的总反应为:3Zn+2+8H2O3Zn(OH)2+2Fe(OH)3+4OH?。下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断不正确的是
A.放电过程中正极区域电解液pH升高
B.放电时负极反应式为:Zn+2H2O?2e?=Zn(OH)2+2H+
C.充电时,每转移3
mol电子,则有1
mol
Fe(OH)3被氧化
D.高铁电池比高能碱性电池电压稳定,放电时间长
13.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍(已知:氧化性),下列说法中正确的是
A.阳极发生还原反应其电极反应式:
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有
D.电解后,电解槽底部的阳极泥中含有Cu和Pt
14.下列化工生产原理错误的是
①可以用电解熔融氯化钠的方法来制取金属钠;②将钠加入氯化镁饱和溶液中制取镁;③用电解法冶炼铝时,原料可选用氯化铝;④湿法炼制是用锌和硫酸制溶液反应置换出铜
A.仅②③
B.仅①③
C.仅①②
D.仅②③④
二、非选择题(本大题共5小题)
15.A、B、C为三种强电解质,它们在水中电离出的离子如表所示:
阳离子
、、
阴离子
、
如图所示的装置中,甲、乙、丙三只烧杯中分别盛有足量的A、B、C三种溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液的与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的______(填“正”或“负”)极,b电极上发生的电极反应为_____________。
(2)写出乙中的总反应方程式:_______________。
(3)如果电解过程中B溶液中的金属离子全部被还原析出,此时电解能否继续进行,为什么?___________。
(4)经过一段时间后,要使C溶液恢复到原来的状态,需要进行的操作是_______________。
16.如图所示为在直流电源的作用下电解CuSO4溶液的装置,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,将B电足量极取出,洗干净并干燥后称量,其质量增加了3.2g,则:
(1)a电极为电源的___极。
(2)写出电极反应式:A极___,B极__。
(3)若要使反应后的溶液恢复到原来状态,则应该加入__,加入__g。
17.工业上常用电解熔融氯化钠的方法制取金属钠,试回答下列问题:
(1)金属钠在__极上产生。
(2)写出产生Cl2的电极反应式:__。
(3)该反应__(填“是”或“不是”)离子反应,如果是,请写出该反应的离子方程式__(如不是,则此空不填)。
(4)为什么不采用电解食盐水的方法来制取钠?___。
18.请按要求书写电极产物或电极反应式。
(1)写出用惰性电极电解下列溶液时的阳极产物:
①KOH溶液______________;
②溶液____________;
③溶液____________。
(2)写出用惰性电极电解下列溶液时的阴极产物:
①NaCl溶液______________;
②溶液______________;
③溶液_______________。
(3)写出用Cu电极电解溶液的电极反应:阴极_______________;阳极_______________;总反应_____________。
19.25℃时,用石墨电极电解2.0
L溶液。5min后,在一个石墨电极上有6.4gCu生成。试回答下列问题:
(1)发生氧化反应的是_____极,电极反应为__________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为___________。
(3)若将溶液恢复到与电解前一样,则需加入______mol的__________。
(4)若用等质量的两块铜片代替石墨作电极,当析出6.4gCu时,两铜片的质量相差_______g,电解液的pH_______(填“变小”“变大”或“不变”)。
参考答案
1.C
【解析】A.电解池是把电能转化为化学能的装置,A没有电源,属于原电池,故A错误;B.B装置也没有电源,故B错误;
C.C为电解氯化铜溶液的装置图,故C正确;
D.没有形成闭合回路,不能构成电池,故D错误;
故选:C。
2.D
【解析】A.铁棒一端为阴极,产生的气体为氢气,则a管导出的气体为氢气,故A正确;
B.石墨电极为阳极,生成的气体为氯气,则b管导出的气体为氯气,故B正确;
C.以食盐水为基础原料制取氯气的同时会产生氢氧化钠等产品,故工业被称为氯碱工业,故C正确;
D.在铁棒一端的溶液中有NaOH生成,滴入酚酞试液,溶液变红,故D错误;
故选D。
3.D
【解析】A.根据上述分析可知,NHPI在阳极区参与反应,又在阴极区为生成物,因此理论上NHPI的总量在反应前后不发生改变,A正确;
B.由上述分析,Ni2+在海绵Ni电极失去电子得到Ni3+,发生氧化反应,则海绵Ni为阳极,B正确;
C.阳极反应式为:Ni2+-e-=Ni3+,阳极区同时还发生反应:Ni3++NHPI→Ni2++PINO,阴极反应式为:2H++2e-=H2,阴极区同时还发生反应:+PINO→,因此总反应为+
H2↑,C正确;
D.未指明标准状况,不能用Vm=22.4L/mol进行计算,D错误;
答案选D。
4.B
【解析】电解时,溶液中Cu2+、H+、Na+移向阴极,Cu2+先放电得到Cu;Cl-、OH-移向阳极,Cl-先放电得到Cl2,阴极上和阳极上最先析出的物质分别为Cu和Cl2;
故选:B。
5.C
【解析】A.根据装置图各室的物质成分可知,产品Ca(H2PO4)2中的Ca2+来源于阳极室,H2PO来源于原料室,为了保持原料室中溶液为电中性,原料室中Na+移向阴极室,故C膜只能是阳离子交换膜,A项错误;
B.阴极发生还原反应,阴极室中为碱性溶液,不会产生H+。阴极室的电极反应式为2H2O+2e-=H2↑+2OH-,B项错误;
C.阴极发生还原反应,阴极电极不参与反应,故可用铁电极替换阴极的石墨电极,C项正确;
D.阳极电极反应式为:2Cl--2e-=Cl2↑,每转移2
mol
e-,生成1molCl2,同时有1molCa2+移向产品室,因此阳极室溶液质量减少111g,D项错误;
答案选C。
6.C
【解析】A.由两个区域生成的物质知,X极区域生成硫酸,硫酸锂溶液中向X极迁移,膜1为阴离子交换膜;Li向Y极迁移,膜2为阳离子交换膜,A错误;
B.气体1为O2,X极为阳极,所以a极为正极,b极为负极,则Y极为阴极,发生还原反应,B错误;
C.X极上水电离产生的OH-失去电子发生氧化反应产生O2,最终是附近溶液中c(H+)增大,电极反应式为:2H2O-4e=4H+O2↑,C正确;
D.Y极为阴极,电极反应式为2H2O+2e=2OH+H2↑,可见:每反应转移2
mol电子,理论上有2
mol
Li向Y极迁移形成2
mol
LiOH,其质量是48
g,D错误;
故合理选项是C。
7.A
【解析】A.电解饱和食盐水,阳极上发生氯离子失去电子生成氯气的反应,阴极上发生水得电子生成氢气和氢氧根离子的反应,为使氯气和氢氧根离子反应生成次氯酸根与氯离子,必须使氯气在装置下部产生,故下面为阳极,b电源为正极,a为电源负极,故A正确;
B.铁在中性食盐水中易发生吸氧腐蚀,铁失去电子变成亚铁离子,故不能用铁制容器盛放食盐水,故B错误;
C.电解过程中,阴极水作为反应物被消耗,溶液体积减小,钠离子物质的量不变,所以c(Na+)减小,故C错误;
D.由于次氯酸钠具有漂白性,会漂白pH
试纸,所以不能用pH
试纸测定溶液的pH,故D错误;
故答案为A。
8.D
【解析】A.碘易溶于,微溶于水,A正确;
B.碘酒可杀菌消毒,故可用于皮肤外用消毒,B正确;
C.Mg可以在中燃烧,化学方程式为,黑色颗粒为C,C正确;
D.电解溶液时,氢离子的氧化性大于镁离子,不能得到Mg,D错误;
故选D。
9.A
【解析】A.由a极生成O2可以判断出a极为阳极,b为阴极,阳离子向阴极流动。则H+由a极区向b极区迁移正确,故A正确;
B.
电极方程式配平发生错误,电极b上反应应为CO2+8HCO+8e-=CH4+8CO+2H2O,故B错误;
C.通过电解法可知此电池为电解池,所以电解过程中是电能转化为化学能,故C错误;
D.电解时OH-比更容易失去电子,所以电解Na2SO4溶液的实质是电解水,溶液中的水发生消耗,所以Na2SO4溶液的浓度是增大的,故D错误;
故选A。
10.C
【解析】A.图中装置为电解池装置,其能量转化方式为电能转化为化学能;该电源由太阳能和风能转化而来,故有3种能量转化方式,故A错误;
B.电解池中阳离子向阴极移动,故向b极移动,故B错误;
C.b极为阴极,氮气得电子,与生成氨气,其电极反应式为,故C正确;
D.氧气为气体,非标况下不能确定数值,故D错误;
故选C。
11.D
【解析】A.
电解时,
溶液中的阳离子向阴极移动,阴离子向阳极移动,溶液中的Na+向阴极移动,与双极膜提供的氢氧根离子结合,出口2的产物为NaOH溶液,A错误;
B.
电解时,
溶液中的阳离子向阴极移动,阴离子向阳极移动,溶液中的Br-向阳极移动,与双极膜提供的氢离子结合,故出口4的产物为HBr溶液,钠离子不能通过双极膜,故出口5不是硫酸,B错误;
C.
结合选项B,Br-不会从盐室最终进入阳极液中,C错误;
D.
电解池阴极处,发生的反应是物质得到电子被还原,发生还原反应,水解离成H+和OH?,则在阴极处发生的反应为2H++2e-=H2↑,D正确;
答案选D。
12.B
【解析】A.放电时的正极反应式为+4H2O+3e?=Fe(OH)3+5OH?,故正极区域电解液碱性增强,故A正确;
B.Zn(OH)2与H+不可能共存,且用总电极反应式减去正极反应式可得负极正确的反应式,故B错误;
C.1
mol
Fe(OH)3被氧化为时,转移3
mol电子,故C正确;
D.由图像中的两个曲线对比可知高铁电池比高能碱性电池电压稳定,放电时间长,故D正确;
故选B。
13.D
【解析】A.阳极发生氧化反应其电极反应式:等,阴极上得电子发生还原反应,电极反应式为Ni2++2e-═Ni,
A项错误;
B.电解过程中,阳极上铁、锌和镍失电子发生氧化反应,阴极上只有镍得电子析出,阴阳极上转移电子相等,但因为这几种金属的摩尔质量不等,所以阳极质量的减少与阴极质量的增加不相等,
B项错误;
C.电解后,部分镍离子不析出,溶液中存在的金属阳离子有Fe2+和Zn2+和Ni2+,C项错误;
D.因为氧化性,铂为惰性电极,所以阳极中铂和铜不会被氧化生成金属阳离子,则铜和铂在电解槽底部形成阳极泥,D项正确;
答案选D。
14.D
【解析】①钠是活泼金属,可以用电解熔融氯化钠的方法来制取金属钠,正确;②将钠加入氯化镁溶液中,钠先和水反应生成NaOH,氯化镁会和NaOH发生复分解反应,所以得不到镁单质,应采用电解熔融氯化镁的方法冶炼镁,错误;③氯化铝是分子晶体,熔融状态下氯化铝不导电,故不能用电解氯化铝的方法得到铝,错误;④湿法炼铜是用铁和硫酸铜溶液反应置换出铜,错误。综上所述,D项符合题意。
故选D。
15.负
能,因为B溶液中的铜全部析出后,电解质溶液已变为溶液,反应变为电解水的反应
向丙烧杯中加入适量的水
【解析】(1)根据前面分析得到M为负极,甲中的电解质溶液为KOH或NaOH溶液,相当于电解H2O,阳极b的电极反应为;故答案为:负;。
(2)乙中的电解质溶液是溶液,电解时的总反应方程式为;故答案为:。
(3)B溶液中的铜全部析出后,电解质变为,电解反应仍能继续进行;故答案为:能,因为B溶液中的铜全部析出后,电解质溶液已变为溶液,反应变为电解水的反应。
(4)丙中的电解质溶液是或溶液,电解时被电解的是H2O,所以要使C溶液恢复到原来的状态,应向丙烧杯中加入适量的水;故答案为:向丙烧杯中加入适量的水。
16.正
2H2O-4e-=O2↑+4H+
Cu2++2e-=Cu
CuO
4.0
【解析】(1)
a为电源正极,故答案为:正;
(2)
依据分析可知A为阳极,溶液中氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑,B为阴极,溶液中铜离子得到电子生成铜,电极反应为:
Cu2++2e-=Cu,故答案为:4OH--4e-=2H2O+O2↑,
Cu2++2e-=Cu;
(3)将B电极取出洗干净并干燥后称量其质量增加了3.2g,则析出铜的物质的量=,如果想使反应溶液恢复到原来状态,可以加入CuO恢复溶液浓度,依据元素守恒得到加入氧化铜质量=0.05mol×80g/mol=4.0g,故答案为:CuO,4.0。
17.阴
2Cl--2e-Cl2↑
是
2Na++2Cl-2Na+Cl2↑
NaCl溶液中含有H+,H+的氧化性强于Na+,因此Na+不会参与反应生成Na
【解析】(1)由分析可知,金属钠在阴极上产生,故答案为:阴;
(2)由分析可知,产生Cl2的电极反应式为,故答案为:;
(3)氯化钠在熔融状态下能够电离出自由移动的和,所以该反应是离子反应。
离子方程式为2Na++2Cl-2Na+Cl2↑,故答案为:是;2Na++2Cl-2Na+Cl2↑;
(4)由金属活动性顺序表知,的氧化性强于,在溶液中存在,因此不会参与反应,故答案为:NaCl溶液中含有H+,H+的氧化性强于Na+,因此Na+不会参与反应生成Na。
18.O2
Cl2
O2
H2
H2
Cu
【解析】(1)①氢氧化钾为强碱,电解氢氧化钾溶液时,氢氧根离子在阳极上失去电子发生氧化反应生成氧气,故答案为:O2;
②氯化锌为活泼金属的无氧酸盐,电解氯化锌溶液时,氯离子在阳极上失去电子发生氧化反应生成氯气,故答案为:Cl2;
③硫酸钠是活泼金属的含氧酸盐,电解硫酸钠溶液时,水电离出的氢氧根离子在阳极上失去电子发生氧化反应生成氧气,故答案为:O2;
(2)①氯化钠为活泼金属的无氧酸盐,电解氯化钠溶液时,水电离出的氢离子在阴极上得到电子发生还原反应生成氢气,故答案为:H2;
②硫酸为含氧酸,电解硫酸溶液时,氢离子在阴极上得到电子发生还原反应生成氢气,故答案为:H2;
③硫酸铜为不活泼金属的含氧酸盐,电解硫酸铜溶液时,铜离子在阴极上得到电子发生还原反应生成铜,故答案为:Cu;
(3)用Cu电极电解溶液时,活性电极铜做阳极,铜失去电子发生氧化反应生成铜离子,电极反应式为,阴极上银离子得到电子发生还原反应生成银,电极反应式为,电解的总反应为,故答案为:;;。
19.阳
1
0.1
CuO
12.8
不变
【解析】(1)电解硫酸铜溶液时,水电离出的氢氧根离子在阳极失去电子发生氧化反应生成氧气,电极反应式为,故答案为:阳;;
(2)电解硫酸铜溶液时,反应生成铜、氧气和硫酸,电解的化学方程式为,由电解方程式可知电解后溶液中,则溶液的,故答案为:1;
(3)电解后生成的0.1mol
Cu和0.05mol
脱离该体系,相当于0.1mo
lCuO,因此若将溶液复原,则应加入0.1mol
CuO,故答案为:CuO;
(4)若用等质量的两块铜片代替石墨作电极,该装置为电镀池,阳极上铜失去电子发生氧化反应生成铁离子,阴极上铜离子得到电子发生还原反应生成铜,由得失电子数目守恒可知,若阴极上析出6.4g铜,阳极溶解6.4g铜,则电解后两铜片质量差为,由于溶液中铜离子浓度不变,电解液的pH不变,故答案为:12.8g;不变。
电解池
一、选择题(本大题共14小题,每小题所给的4个选项,只有一个答案符合题目要求。)
1.如图所示装置中,属于电解池的是
A.
B.
C.
D.
2.如图为课本中电解饱和食盐水的实验装置。据此,下列叙述不正确的是
A.装置中,a管导出的气体为氢气
B.b管导出的气体为氯气
C.以食盐水为基础原料制取氯气等产品的工业被称为氯碱工业
D.在石墨棒电极区城滴入酚酞试液,溶液会变红
3.在N-羟基邻苯二甲酰亚胺(NHPI)介质中,可实现醇向醛的转化,原理如图。下列说法错误的是
A.理论上NHPI的总量在反应前后不变
B.海绵Ni电极作阳极
C.总反应为+
H2↑
D.每消耗1
mmol苯甲醇,产生22.4
mL氢气
4.电解CuCl2与NaCl的混合溶液,阴极上和阳极上最先析出的物质为
A.H2和Cl2
B.Cu和Cl2
C.H2和O2
D.Cu和O2
5.利用电解法制备Ca(H2PO4)2并得到副产物NaOH和Cl2。下列说法正确的是
A.C膜可以为质子交换膜
B.阴极室的电极反应式为2H2O-4e-=O2↑+4H+
C.可用铁电极替换阴极的石墨电极
D.每转移2
mol
e-,阳极室溶液质量减少71
g
6.LiOH是生产航空航天润滑剂的原料。清华大学首创三室膜电解法制备氢氧化锂,其模拟装置如图所示。下列有关说法正确的是
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.a极为电源的负极,Y极上发生氧化反应
C.X极的电极反应式为2H2O-4e=4H+O2↑
D.每转移2
mol电子,理论上生成52
g
LiOH
7.用石墨作电极电解饱和食盐水可制取
NaClO
消毒液,简易装置如图所示。下列说法正确的是
A.a
为电源的负极
B.用铁制容器盛放食盐水
C.电解过程中,c(Na+)保持不变
D.电解结束后,用
pH
试纸测定溶液的pH
8.下列说法错误的是
A.向碘水中加入等体积振荡后静置,上层接近无色,下层显紫红色,说明在中的溶解度大于在水中的溶解度
B.碘酒可用于皮肤外用消毒
C.将镁条点燃后迅速伸入集满的集气瓶,集气瓶中产生浓烟并有黑色颗粒产生
D.下列转化能一步完成:
9.利用电解法将CO2转化为CH4的原理如图所示。下列说法正确的是
A.电解过程中,H+由a极区向b极区迁移
B.电极b上反应为CO2+8HCO-8e-=CH4+CO+2H2O
C.电解过程中化学能转化为电能
D.电解时Na2SO4溶液浓度保持不变
10.美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:下列说正确的是
A.图中能量转化方式只有2种
B.H+向a极区移动
C.b极发生的电极反应为:N2+6H++6e-=2NH3
D.a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
11.双极膜在电渗析中应用广泛,它是由阳离子交换膜和阴离子交换膜复合而成。双极膜内层为水层,工作时水层中的H2О解离成H+和OH-,并分别通过离子交换膜向两侧发生迁移。下图为NaBr溶液的电渗析装置示意图。
下列说法正确的是
A.出口2的产物为HBr溶液
B.出口5的产物为硫酸溶液
C.Br-可从盐室最终进入阳极液中
D.阴极电极反应式为2H++2e-=H2↑
12.高铁电池是以高铁酸盐(K2FeO4、BaFeO4等)为材料的新型可充电电池,这种电池能量密度大、体积小、重量轻、污染低。这种电池的总反应为:3Zn+2+8H2O3Zn(OH)2+2Fe(OH)3+4OH?。下图是高铁电池与普通的高能碱性电池的使用电压对比。下列有关高铁电池的判断不正确的是
A.放电过程中正极区域电解液pH升高
B.放电时负极反应式为:Zn+2H2O?2e?=Zn(OH)2+2H+
C.充电时,每转移3
mol电子,则有1
mol
Fe(OH)3被氧化
D.高铁电池比高能碱性电池电压稳定,放电时间长
13.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍(已知:氧化性),下列说法中正确的是
A.阳极发生还原反应其电极反应式:
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有
D.电解后,电解槽底部的阳极泥中含有Cu和Pt
14.下列化工生产原理错误的是
①可以用电解熔融氯化钠的方法来制取金属钠;②将钠加入氯化镁饱和溶液中制取镁;③用电解法冶炼铝时,原料可选用氯化铝;④湿法炼制是用锌和硫酸制溶液反应置换出铜
A.仅②③
B.仅①③
C.仅①②
D.仅②③④
二、非选择题(本大题共5小题)
15.A、B、C为三种强电解质,它们在水中电离出的离子如表所示:
阳离子
、、
阴离子
、
如图所示的装置中,甲、乙、丙三只烧杯中分别盛有足量的A、B、C三种溶液,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液的与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的______(填“正”或“负”)极,b电极上发生的电极反应为_____________。
(2)写出乙中的总反应方程式:_______________。
(3)如果电解过程中B溶液中的金属离子全部被还原析出,此时电解能否继续进行,为什么?___________。
(4)经过一段时间后,要使C溶液恢复到原来的状态,需要进行的操作是_______________。
16.如图所示为在直流电源的作用下电解CuSO4溶液的装置,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,将B电足量极取出,洗干净并干燥后称量,其质量增加了3.2g,则:
(1)a电极为电源的___极。
(2)写出电极反应式:A极___,B极__。
(3)若要使反应后的溶液恢复到原来状态,则应该加入__,加入__g。
17.工业上常用电解熔融氯化钠的方法制取金属钠,试回答下列问题:
(1)金属钠在__极上产生。
(2)写出产生Cl2的电极反应式:__。
(3)该反应__(填“是”或“不是”)离子反应,如果是,请写出该反应的离子方程式__(如不是,则此空不填)。
(4)为什么不采用电解食盐水的方法来制取钠?___。
18.请按要求书写电极产物或电极反应式。
(1)写出用惰性电极电解下列溶液时的阳极产物:
①KOH溶液______________;
②溶液____________;
③溶液____________。
(2)写出用惰性电极电解下列溶液时的阴极产物:
①NaCl溶液______________;
②溶液______________;
③溶液_______________。
(3)写出用Cu电极电解溶液的电极反应:阴极_______________;阳极_______________;总反应_____________。
19.25℃时,用石墨电极电解2.0
L溶液。5min后,在一个石墨电极上有6.4gCu生成。试回答下列问题:
(1)发生氧化反应的是_____极,电极反应为__________。
(2)若电解后溶液的体积不变,则电解后溶液的pH为___________。
(3)若将溶液恢复到与电解前一样,则需加入______mol的__________。
(4)若用等质量的两块铜片代替石墨作电极,当析出6.4gCu时,两铜片的质量相差_______g,电解液的pH_______(填“变小”“变大”或“不变”)。
参考答案
1.C
【解析】A.电解池是把电能转化为化学能的装置,A没有电源,属于原电池,故A错误;B.B装置也没有电源,故B错误;
C.C为电解氯化铜溶液的装置图,故C正确;
D.没有形成闭合回路,不能构成电池,故D错误;
故选:C。
2.D
【解析】A.铁棒一端为阴极,产生的气体为氢气,则a管导出的气体为氢气,故A正确;
B.石墨电极为阳极,生成的气体为氯气,则b管导出的气体为氯气,故B正确;
C.以食盐水为基础原料制取氯气的同时会产生氢氧化钠等产品,故工业被称为氯碱工业,故C正确;
D.在铁棒一端的溶液中有NaOH生成,滴入酚酞试液,溶液变红,故D错误;
故选D。
3.D
【解析】A.根据上述分析可知,NHPI在阳极区参与反应,又在阴极区为生成物,因此理论上NHPI的总量在反应前后不发生改变,A正确;
B.由上述分析,Ni2+在海绵Ni电极失去电子得到Ni3+,发生氧化反应,则海绵Ni为阳极,B正确;
C.阳极反应式为:Ni2+-e-=Ni3+,阳极区同时还发生反应:Ni3++NHPI→Ni2++PINO,阴极反应式为:2H++2e-=H2,阴极区同时还发生反应:+PINO→,因此总反应为+
H2↑,C正确;
D.未指明标准状况,不能用Vm=22.4L/mol进行计算,D错误;
答案选D。
4.B
【解析】电解时,溶液中Cu2+、H+、Na+移向阴极,Cu2+先放电得到Cu;Cl-、OH-移向阳极,Cl-先放电得到Cl2,阴极上和阳极上最先析出的物质分别为Cu和Cl2;
故选:B。
5.C
【解析】A.根据装置图各室的物质成分可知,产品Ca(H2PO4)2中的Ca2+来源于阳极室,H2PO来源于原料室,为了保持原料室中溶液为电中性,原料室中Na+移向阴极室,故C膜只能是阳离子交换膜,A项错误;
B.阴极发生还原反应,阴极室中为碱性溶液,不会产生H+。阴极室的电极反应式为2H2O+2e-=H2↑+2OH-,B项错误;
C.阴极发生还原反应,阴极电极不参与反应,故可用铁电极替换阴极的石墨电极,C项正确;
D.阳极电极反应式为:2Cl--2e-=Cl2↑,每转移2
mol
e-,生成1molCl2,同时有1molCa2+移向产品室,因此阳极室溶液质量减少111g,D项错误;
答案选C。
6.C
【解析】A.由两个区域生成的物质知,X极区域生成硫酸,硫酸锂溶液中向X极迁移,膜1为阴离子交换膜;Li向Y极迁移,膜2为阳离子交换膜,A错误;
B.气体1为O2,X极为阳极,所以a极为正极,b极为负极,则Y极为阴极,发生还原反应,B错误;
C.X极上水电离产生的OH-失去电子发生氧化反应产生O2,最终是附近溶液中c(H+)增大,电极反应式为:2H2O-4e=4H+O2↑,C正确;
D.Y极为阴极,电极反应式为2H2O+2e=2OH+H2↑,可见:每反应转移2
mol电子,理论上有2
mol
Li向Y极迁移形成2
mol
LiOH,其质量是48
g,D错误;
故合理选项是C。
7.A
【解析】A.电解饱和食盐水,阳极上发生氯离子失去电子生成氯气的反应,阴极上发生水得电子生成氢气和氢氧根离子的反应,为使氯气和氢氧根离子反应生成次氯酸根与氯离子,必须使氯气在装置下部产生,故下面为阳极,b电源为正极,a为电源负极,故A正确;
B.铁在中性食盐水中易发生吸氧腐蚀,铁失去电子变成亚铁离子,故不能用铁制容器盛放食盐水,故B错误;
C.电解过程中,阴极水作为反应物被消耗,溶液体积减小,钠离子物质的量不变,所以c(Na+)减小,故C错误;
D.由于次氯酸钠具有漂白性,会漂白pH
试纸,所以不能用pH
试纸测定溶液的pH,故D错误;
故答案为A。
8.D
【解析】A.碘易溶于,微溶于水,A正确;
B.碘酒可杀菌消毒,故可用于皮肤外用消毒,B正确;
C.Mg可以在中燃烧,化学方程式为,黑色颗粒为C,C正确;
D.电解溶液时,氢离子的氧化性大于镁离子,不能得到Mg,D错误;
故选D。
9.A
【解析】A.由a极生成O2可以判断出a极为阳极,b为阴极,阳离子向阴极流动。则H+由a极区向b极区迁移正确,故A正确;
B.
电极方程式配平发生错误,电极b上反应应为CO2+8HCO+8e-=CH4+8CO+2H2O,故B错误;
C.通过电解法可知此电池为电解池,所以电解过程中是电能转化为化学能,故C错误;
D.电解时OH-比更容易失去电子,所以电解Na2SO4溶液的实质是电解水,溶液中的水发生消耗,所以Na2SO4溶液的浓度是增大的,故D错误;
故选A。
10.C
【解析】A.图中装置为电解池装置,其能量转化方式为电能转化为化学能;该电源由太阳能和风能转化而来,故有3种能量转化方式,故A错误;
B.电解池中阳离子向阴极移动,故向b极移动,故B错误;
C.b极为阴极,氮气得电子,与生成氨气,其电极反应式为,故C正确;
D.氧气为气体,非标况下不能确定数值,故D错误;
故选C。
11.D
【解析】A.
电解时,
溶液中的阳离子向阴极移动,阴离子向阳极移动,溶液中的Na+向阴极移动,与双极膜提供的氢氧根离子结合,出口2的产物为NaOH溶液,A错误;
B.
电解时,
溶液中的阳离子向阴极移动,阴离子向阳极移动,溶液中的Br-向阳极移动,与双极膜提供的氢离子结合,故出口4的产物为HBr溶液,钠离子不能通过双极膜,故出口5不是硫酸,B错误;
C.
结合选项B,Br-不会从盐室最终进入阳极液中,C错误;
D.
电解池阴极处,发生的反应是物质得到电子被还原,发生还原反应,水解离成H+和OH?,则在阴极处发生的反应为2H++2e-=H2↑,D正确;
答案选D。
12.B
【解析】A.放电时的正极反应式为+4H2O+3e?=Fe(OH)3+5OH?,故正极区域电解液碱性增强,故A正确;
B.Zn(OH)2与H+不可能共存,且用总电极反应式减去正极反应式可得负极正确的反应式,故B错误;
C.1
mol
Fe(OH)3被氧化为时,转移3
mol电子,故C正确;
D.由图像中的两个曲线对比可知高铁电池比高能碱性电池电压稳定,放电时间长,故D正确;
故选B。
13.D
【解析】A.阳极发生氧化反应其电极反应式:等,阴极上得电子发生还原反应,电极反应式为Ni2++2e-═Ni,
A项错误;
B.电解过程中,阳极上铁、锌和镍失电子发生氧化反应,阴极上只有镍得电子析出,阴阳极上转移电子相等,但因为这几种金属的摩尔质量不等,所以阳极质量的减少与阴极质量的增加不相等,
B项错误;
C.电解后,部分镍离子不析出,溶液中存在的金属阳离子有Fe2+和Zn2+和Ni2+,C项错误;
D.因为氧化性,铂为惰性电极,所以阳极中铂和铜不会被氧化生成金属阳离子,则铜和铂在电解槽底部形成阳极泥,D项正确;
答案选D。
14.D
【解析】①钠是活泼金属,可以用电解熔融氯化钠的方法来制取金属钠,正确;②将钠加入氯化镁溶液中,钠先和水反应生成NaOH,氯化镁会和NaOH发生复分解反应,所以得不到镁单质,应采用电解熔融氯化镁的方法冶炼镁,错误;③氯化铝是分子晶体,熔融状态下氯化铝不导电,故不能用电解氯化铝的方法得到铝,错误;④湿法炼铜是用铁和硫酸铜溶液反应置换出铜,错误。综上所述,D项符合题意。
故选D。
15.负
能,因为B溶液中的铜全部析出后,电解质溶液已变为溶液,反应变为电解水的反应
向丙烧杯中加入适量的水
【解析】(1)根据前面分析得到M为负极,甲中的电解质溶液为KOH或NaOH溶液,相当于电解H2O,阳极b的电极反应为;故答案为:负;。
(2)乙中的电解质溶液是溶液,电解时的总反应方程式为;故答案为:。
(3)B溶液中的铜全部析出后,电解质变为,电解反应仍能继续进行;故答案为:能,因为B溶液中的铜全部析出后,电解质溶液已变为溶液,反应变为电解水的反应。
(4)丙中的电解质溶液是或溶液,电解时被电解的是H2O,所以要使C溶液恢复到原来的状态,应向丙烧杯中加入适量的水;故答案为:向丙烧杯中加入适量的水。
16.正
2H2O-4e-=O2↑+4H+
Cu2++2e-=Cu
CuO
4.0
【解析】(1)
a为电源正极,故答案为:正;
(2)
依据分析可知A为阳极,溶液中氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑,B为阴极,溶液中铜离子得到电子生成铜,电极反应为:
Cu2++2e-=Cu,故答案为:4OH--4e-=2H2O+O2↑,
Cu2++2e-=Cu;
(3)将B电极取出洗干净并干燥后称量其质量增加了3.2g,则析出铜的物质的量=,如果想使反应溶液恢复到原来状态,可以加入CuO恢复溶液浓度,依据元素守恒得到加入氧化铜质量=0.05mol×80g/mol=4.0g,故答案为:CuO,4.0。
17.阴
2Cl--2e-Cl2↑
是
2Na++2Cl-2Na+Cl2↑
NaCl溶液中含有H+,H+的氧化性强于Na+,因此Na+不会参与反应生成Na
【解析】(1)由分析可知,金属钠在阴极上产生,故答案为:阴;
(2)由分析可知,产生Cl2的电极反应式为,故答案为:;
(3)氯化钠在熔融状态下能够电离出自由移动的和,所以该反应是离子反应。
离子方程式为2Na++2Cl-2Na+Cl2↑,故答案为:是;2Na++2Cl-2Na+Cl2↑;
(4)由金属活动性顺序表知,的氧化性强于,在溶液中存在,因此不会参与反应,故答案为:NaCl溶液中含有H+,H+的氧化性强于Na+,因此Na+不会参与反应生成Na。
18.O2
Cl2
O2
H2
H2
Cu
【解析】(1)①氢氧化钾为强碱,电解氢氧化钾溶液时,氢氧根离子在阳极上失去电子发生氧化反应生成氧气,故答案为:O2;
②氯化锌为活泼金属的无氧酸盐,电解氯化锌溶液时,氯离子在阳极上失去电子发生氧化反应生成氯气,故答案为:Cl2;
③硫酸钠是活泼金属的含氧酸盐,电解硫酸钠溶液时,水电离出的氢氧根离子在阳极上失去电子发生氧化反应生成氧气,故答案为:O2;
(2)①氯化钠为活泼金属的无氧酸盐,电解氯化钠溶液时,水电离出的氢离子在阴极上得到电子发生还原反应生成氢气,故答案为:H2;
②硫酸为含氧酸,电解硫酸溶液时,氢离子在阴极上得到电子发生还原反应生成氢气,故答案为:H2;
③硫酸铜为不活泼金属的含氧酸盐,电解硫酸铜溶液时,铜离子在阴极上得到电子发生还原反应生成铜,故答案为:Cu;
(3)用Cu电极电解溶液时,活性电极铜做阳极,铜失去电子发生氧化反应生成铜离子,电极反应式为,阴极上银离子得到电子发生还原反应生成银,电极反应式为,电解的总反应为,故答案为:;;。
19.阳
1
0.1
CuO
12.8
不变
【解析】(1)电解硫酸铜溶液时,水电离出的氢氧根离子在阳极失去电子发生氧化反应生成氧气,电极反应式为,故答案为:阳;;
(2)电解硫酸铜溶液时,反应生成铜、氧气和硫酸,电解的化学方程式为,由电解方程式可知电解后溶液中,则溶液的,故答案为:1;
(3)电解后生成的0.1mol
Cu和0.05mol
脱离该体系,相当于0.1mo
lCuO,因此若将溶液复原,则应加入0.1mol
CuO,故答案为:CuO;
(4)若用等质量的两块铜片代替石墨作电极,该装置为电镀池,阳极上铜失去电子发生氧化反应生成铁离子,阴极上铜离子得到电子发生还原反应生成铜,由得失电子数目守恒可知,若阴极上析出6.4g铜,阳极溶解6.4g铜,则电解后两铜片质量差为,由于溶液中铜离子浓度不变,电解液的pH不变,故答案为:12.8g;不变。
