高中化学苏教版(2019)选择性必修1 专题3 第四单元 第1课时 沉淀溶解平衡与溶度积(60张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1 专题3 第四单元 第1课时 沉淀溶解平衡与溶度积(60张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-05 18:51:33 | ||
图片预览









文档简介
(共60张PPT)
第1课时
沉淀溶解平衡与溶度积
1.变化观念与平衡思想
知道难溶电解质的沉淀溶解平衡及其影响因素,能多角度、动态地分析难溶电解质的溶解平衡。
2.证据推理与模型认知
知道溶度积的意义,建立根据溶度积判断反应进行方向的思维模型。
核心素养发展目标
课时对点练
内容索引
一、沉淀溶解平衡原理
二、溶度积常数
一、沉淀溶解平衡原理
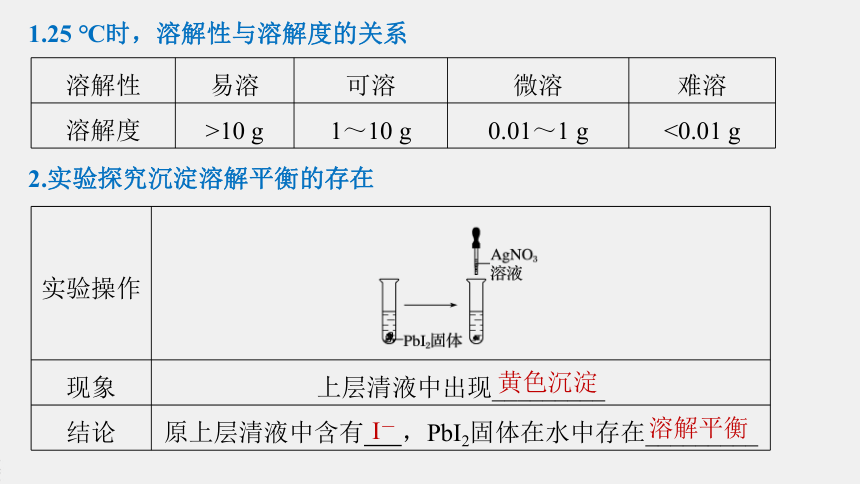
1.25
℃时,溶解性与溶解度的关系
溶解性
易溶
可溶
微溶
难溶
溶解度
>10
g
1~10
g
0.01~1
g
<0.01
g
2.实验探究沉淀溶解平衡的存在
实验操作
?
现象
上层清液中出现_________
结论
原上层清液中含有
,PbI2固体在水中存在_________
黄色沉淀
I-
溶解平衡
3.以AgCl为例分析沉淀溶解平衡建立的过程
(1)AgCl在溶液中存在两个过程:一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl表面进入水中,即存在
过程;另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl表面析出,即存在
过程。在一定温度下,当AgCl溶解和沉淀的速率相等时,体系中形成AgCl
。
总结:在一定温度下,当沉淀溶解和生成的速率
时,即建立了动态平衡,叫做沉淀溶解平衡。
溶解
沉淀
饱和溶液
相等
(2)沉淀溶解平衡的特征
相等
保持不变
(3)沉淀溶解平衡的表达式:AmBn(s)
mAn++nBm-
在沉淀后用“s”标明状态,溶液中用“离子符号”,并用“
”连接。
如:PbI2沉淀溶解平衡可表示为
。
4.外界条件对沉淀溶解平衡的影响
(1)温度:升高温度,多数沉淀溶解平衡向溶解方向移动;少数沉淀溶解平衡向
方向移动,如Ca(OH)2的沉淀溶解平衡。
(2)浓度:加水稀释,沉淀溶解平衡向
方向移动。
(3)同离子:加入与难溶电解质构成中相同的离子,平衡向_________方向移动。
(4)其他:加入可与难溶电解质溶解所得的离子反应的物质,沉淀溶解平衡向
方向移动。
特别提醒 影响难溶电解质沉淀溶解平衡的决定性因素为难溶电解质本身的性质。
生成沉淀
溶解
生成沉淀
溶解
1.(1)因为BaSO4难溶,所以将BaSO4加入水中,溶液中无Ba2+和
( )
(2)难溶电解质的沉淀溶解平衡是动态平衡,即溶解和沉淀同时进行着,只是v(溶解)=v(沉淀)( )
(3)Ca(OH)2溶解放热,所以升温,Ca(OH)2(s)
Ca2++2OH-溶解平衡逆向移动( )
(4)含等物质的量的AgNO3与NaCl的溶液混合后,恰好完全反应生成AgCl沉淀,溶液中不存在Ag+和Cl-( )
(5)当溶液中某离子浓度小于1×10-5
mol·L-1时,可视为该离子沉淀完全
( )
应用体验
×
√
√
×
√
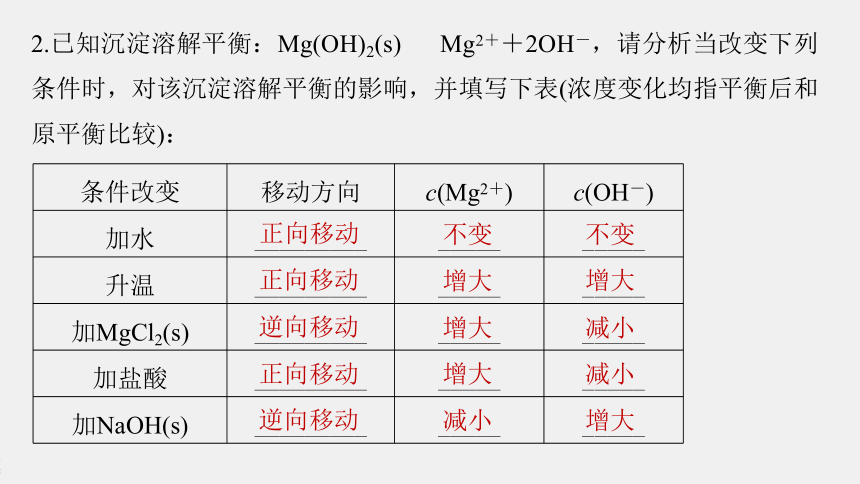
2.已知沉淀溶解平衡:Mg(OH)2(s)
Mg2++2OH-,请分析当改变下列条件时,对该沉淀溶解平衡的影响,并填写下表(浓度变化均指平衡后和原平衡比较):
条件改变
移动方向
c(Mg2+)
c(OH-)
加水
_________
_____
_____
升温
_________
_____
_____
加MgCl2(s)
_________
_____
_____
加盐酸
_________
_____
_____
加NaOH(s)
_________
_____
_____
正向移动
正向移动
逆向移动
正向移动
逆向移动
不变
增大
增大
增大
减小
不变
增大
减小
减小
增大
3.将AgCl分别投入下列溶液中:
①40
mL
0.03
mol·L-1的HCl溶液 ②50
mL
0.03
mol·L-1的AgNO3溶液 ③30
mL
0.02
mol·L-1的CaCl2溶液 ④10
mL蒸馏水。AgCl的溶解度由大到小的顺序是_______________。
④>①=②>③
解析 AgCl(s)在溶液中存在如下沉淀溶解平衡:AgCl(s)
Ag++Cl-,①中c(Cl-)=0.03
mol·L-1,抑制了AgCl(s)的溶解,使得AgCl(s)的溶解度减小,②中c(Ag+)=0.03
mol·L-1,也抑制了AgCl(s)的溶解,且抑制程度与①相同,③中的c(Cl-)=0.04
mol·L-1,抑制溶解,且抑制程度大于①和②,AgCl(s)的溶解度更小。所以AgCl的溶解度由大到小的顺序是④>①=②>③。
返回
二、溶度积常数
1.概念:难溶电解质的沉淀溶解平衡也存在
,称为
,简称溶度积,符号为
。
2.表达式
AmBn(s)
mAn++nBm-
Ksp=_______________
AgCl(s)
Ag++Cl-
Ksp=c(Ag+)·c(Cl-)
Fe(OH)3(s)
Fe3++3OH-
Ksp=c(Fe3+)·c3(OH-)
平衡常数
溶度积常数
Ksp
cm(An+)·cn(Bm-)
3.意义
Ksp的大小反映难溶电解质在水中的溶解能力。
(1)相同类型的难溶电解质,溶度积小的电解质,其溶解能力
。
(2)不同类型的难溶电解质,溶度积小的电解质,其溶解能力_______
比溶度积大的溶解能力小。
小
不一定
4.应用——溶度积规则
通过比较溶度积与溶液中的离子浓度幂之积的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成。以沉淀溶解平衡BaSO4(s)
Ba2++
为例:
(1)c(Ba2+)·c(
)>Ksp,溶液过饱和,有
析出,直至溶液饱和,达到新的平衡。
(2)c(Ba2+)·c(
)=Ksp,溶液饱和,沉淀与溶解处于
。
(3)c(Ba2+)·c(
)析出,若加入过量难溶电解质,难溶电解质溶解直至溶液饱和。
沉淀
平衡状态
沉淀
5.影响因素
溶度积Ksp值的大小只与难溶电解质本身的性质和温度有关,与浓度无关。
(1)溶度积是沉淀溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
( )
(2)溶度积受离子浓度大小的影响( )
(3)Ksp小的难溶电解质的溶解度一定小于Ksp大的难溶电解质的溶解度
( )
(4)改变外界条件使溶解平衡正向移动,Ksp一定增大( )
正误判断
×
×
×
×
易错警示
同种类型的难溶电解质,Ksp可用于溶解度的直接比较,如AgCl、AgBr、AgI都是AB型,Ag2S是A2B型,不同类型不能直接比较溶解度大小。
将10
mL
0.002
mol·L-1的CaCl2溶液与等体积、等浓度的Na2C2O4溶液相混合,已知CaC2O4的Ksp=2.32×10-9。判断是否有CaC2O4沉淀生成。
深度思考
提示 根据溶度积规则:
c(Ca2+)·c(
)=0.001
×0.001=10-6>Ksp(CaC2O4),所以有沉淀生成。
应用体验
1.已知常温下,Ksp[Cu(OH)2]=2.0×10-20,某CuSO4溶液中c(Cu2+)=0.02
mol·L-1,现向溶液中加入碱来调节pH,当Cu2+开始沉淀时,pH应调节为多少?通过计算证明。
提示 常温下,如果要生成Cu(OH)2沉淀,则c(Cu2+)·c2(OH-)>Ksp[Cu(OH)2],即0.02×c2(OH-)>2.0×10-20,有c(OH-)>1.0×10-9
mol·L-1,所以c(H+)<1.0×10-5
mol·L-1,故应调节pH大于5。
2.已知25
℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(1)25
℃时,氯化银的饱和溶液中,c(Cl-)=____________________,向其中加入NaCl固体,溶解平衡_________,溶度积常数_____。
1.3×10-5
mol·L-1
逆向移动
不变
解析 氯化银的饱和溶液中无其他离子影响,
(2)25
℃时,若向50
mL
0.018
mol·L-1的AgNO3溶液中加入50
mL
0.020
mol·L-1
的盐酸,混合后溶液中的c(Ag+)=_________________,pH=____。
1.8×10-7
mol·L-1
2
解析 n(AgNO3)=50×10-3
L×0.018
mol·L-1=9×10-4
mol,n(HCl)=50×10-3
L×0.020
mol·L-1=1×10-3
mol,两溶液混合,AgNO3+HCl
===AgCl↓+HNO3,HCl过量:1×10-3
mol-9×10-4
mol=1×10-4
mol,
故反应后的c(Cl-)=
=1×10-3
mol·L-1,H+未被消耗,
c(H+)=
=1×10-2
mol·L-1。c(Ag+)·c(Cl-)=1.8×10-10,
即c(Ag+)·(1×10-3)=1.8×10-10,解得c(Ag+)=1.8×10-7
mol·L-1;pH=-lg
(1×10-2)=2。
(3)25
℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序为_______________,由此可得出_______更难溶。
Ag2CrO4>AgCl
AgCl
解析 在Ag2CrO4的沉淀溶解平衡中
2x
x
(4)将等体积的4×10-3
mol·L-1的AgNO3溶液和4×10-3
mol·L-1的K2CrO4溶液混合____(填“有”或“没有”)Ag2CrO4沉淀产生。
有
(1)Ksp只与难溶电解质的性质、温度有关,而与沉淀的量和溶液中离子的浓度无关。
(2)对于同类型物质(如AB型、A2B型、AB2型等),可直接用溶度积比较难溶电解质的溶解能力,Ksp越大,难溶电解质在水中的溶解能力越强。
(3)对于不同类型的物质,Ksp不能直接作为比较依据,而应通过计算将Ksp转化为饱和溶液中溶质的物质的量浓度来确定溶解能力的大小。
归纳总结
返回
课
时
对
点
练
题组一 沉淀溶解平衡的含义
1.下列关于沉淀溶解平衡的说法正确的是
A.只有难溶电解质才存在沉淀溶解平衡过程
B.沉淀溶解平衡过程是可逆的
C.在平衡状态时,v(溶解)=v(沉淀)=0
D.达到沉淀溶解平衡的溶液不一定是饱和溶液
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 无论是难溶电解质还是易溶电解质,都存在沉淀溶解平衡过程,A项错误;
沉淀溶解达到平衡状态时,v(溶解)=v(沉淀)≠0,C项错误;
沉淀溶解过程达到平衡时,溶液也达到饱和状态,D项错误。
17
2.(2020·郑州期中)下列有关AgCl的沉淀溶解平衡说法正确的是
A.AgCl沉淀生成和溶解达平衡后不再进行
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl的溶解度增大
D.向AgCl沉淀溶解平衡体系中加入NaCl固体,AgCl固体的质量不变
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 难溶物达到沉淀溶解平衡时沉淀的生成和溶解都不停止,但溶解速率和生成速率相等,A错误;
没有绝对不溶的物质,B错误;
温度越高,AgCl的溶解度越大,C正确;
向AgCl沉淀溶解平衡体系中加入NaCl固体,使沉淀溶解平衡逆向移动,AgCl固体的质量增大,D错误。
17
题组二 沉淀溶解平衡的影响因素
3.25
℃时,在含有大量PbI2的饱和溶液中存在着平衡:PbI2(s)
Pb2++2I-,加入KI溶液,下列说法正确的是
A.溶液中Pb2+和I-浓度都增大
B.溶度积常数Ksp增大
C.沉淀溶解平衡正向移动
D.溶液中Pb2+的浓度减小
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
解析 加入KI溶液时,溶液中c(I-)增大,使PbI2的沉淀溶解平衡逆向移动,因此溶液中c(Pb2+)减小,但由于溶液中温度未发生改变,故PbI2的溶度积常数Ksp不发生变化。
17
4.将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。下列溶液中Ba2+的浓度最小的是
A.10
mL
0.2
mol·L-1
Na2CO3溶液
B.40
mL
水
C.50
mL
0.01
mol·L-1
BaCl2溶液
D.100
mL
0.01
mol·L-1盐酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
16
17
5.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)
Ca2++2OH-。下列说法正确的是
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 恒温下加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH不变,A错误;
加热,Ca(OH)2的溶解度减小,溶液的pH降低,B错误;
加入Na2CO3溶液,沉淀溶解平衡正向移动,Ca(OH)2固体转化为CaCO3固体,固体质量增加,C正确;
加入NaOH固体,沉淀溶解平衡逆向移动,Ca(OH)2固体质量增加,D错误。
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 溶度积及应用
6.(2020·济南期中)下列说法正确的是
A.难溶电解质在水中达到沉淀溶解平衡时,沉淀和溶解立即停止
B.Ksp越小,难溶电解质在水中的溶解能力一定越小
C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的溶解能力
相同
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 难溶电解质在水中达到沉淀溶解平衡,沉淀溶解平衡是动态平衡,沉淀和溶解的速率相同,故A项错误;
Ksp可用来判断相同类型的化合物在水中的溶解度大小,但如果化合物的类型不同,就不能直接进行判断,故B项错误;
沉淀溶解平衡存在溶度积常数,Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关,故C项正确;
相同温度下,AgCl在水中的溶解能力大于在NaCl溶液中的溶解能力,因为在NaCl溶液中氯离子对氯化银的溶解起到抑制作用,故D项错误。
17
7.已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4
mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于
A.2.8×10-2
mol·L-1
B.1.4×10-5
mol·L-1
C.2.8×10-5
mol·L-1
D.5.6×10-5
mol·L-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
8.在2
L含有物质的量均为0.1
mol的Ca2+、Mg2+的某溶液中,加入一定量的NaOH固体使溶液的pH=11,有沉淀生成,过滤。
已知:Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。当离子浓度小于10-5
mol·L-1认为已经除净,下列说法正确的是
A.此沉淀是Mg(OH)2、Ca(OH)2的混合物
B.此沉淀只有Mg(OH)2
C.过滤后滤液中存在Ca2+、Mg2+
D.向原溶液中加入8.8
g
NaOH固体,不可以使Ca2+部分转化为沉淀
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 加入NaOH固体调至pH=11,此时滤液中c(OH-)=1×10-3
mol·L-1,则c(Ca2+)·c2(OH-)=0.05×(10-3)2=5×10-8Ksp[Mg(OH)2],有Mg(OH)2沉淀生成;在滤液中由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.61×10-12,c(Mg2+)=5.61×10-6
<10-5,滤液中不存在Mg2+;若改为加入8.8
g
NaOH固体,则n(NaOH)=0.22
mol,与0.1
mol
Mg2+反应消耗OH-
0.2
mol,剩余0.02
mol
OH-,c(Ca2+)·c2(OH-)=0.05×0.012=5×10-6>Ksp[Ca(OH)2],所以有Ca(OH)2沉淀析出。
17
题组四 Ksp曲线图像
9.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 A项,温度不变,加入Na2SO4会导致溶解平衡逆向移动,但两离子浓度的乘积仍不变,仍在曲线上,不会由a点变到b点;
C项,d点还没有形成饱和溶液,因此无BaSO4沉淀生成;
D项,a点与c点的Ksp相等。
17
10.(2020·齐齐哈尔期末)常温下,用AgNO3溶液分别滴定浓度均为0.1
mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑
的水解),下列叙述正确的是
A.n点表示AgCl的不饱和溶液
B.Ksp(Ag2C2O4)的数量级为10-11
C.向c(Cl-)=c(
)混合液中滴入AgNO3
溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4(s)+2Cl-
2AgCl(s)+
的平衡常数K=10-9.04
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 A项,n点时c(Ag+)比溶解平衡曲线上的c(Ag+)大,表示AgCl的过饱和溶液,错误;
B项,Ksp(Ag2C2O4)=(10-4)2×10-2.46=1×10-10.46=10-0.46×10-10≈0.347×10-10≈3.47×10-11,故它的数量级为10-11,正确;
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
11.下列有关溶度积常数Ksp的说法正确的是
A.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小
B.溶度积常数Ksp只受温度影响,温度升高Ksp减小
C.难溶电解质的溶度积Ksp越小,则它的溶解度越小
D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
综合强化
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 温度不变,溶度积常数不变,故A项不正确、D项正确;
大多数难溶物的Ksp随温度的升高而增大,但也有少数物质相反,如Ca(OH)2,故B不正确;
只有相同类型的难溶电解质,才满足Ksp越小溶解度越小的规律,C项错误。
17
12.(2020·济南高二检测)一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是
①20
mL
0.01
mol·L-1
KCl溶液 ②30
mL
0.02
mol·L-1
CaCl2溶液 ③40
mL
0.03
mol·L-1
HCl溶液
④10
mL
蒸馏水 ⑤50
mL
0.05
mol·L-1
AgNO3溶液
A.①>②>③>④>⑤
B.④>①>③>②>⑤
C.⑤>④>②>①>③
D.④>③>⑤>②>①
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 AgCl(s)
Ag++Cl-,c(Cl-)或c(Ag+)越大,对AgCl的溶解抑制作用越大,AgCl的溶解度就越小。注意AgCl的溶解度大小只与溶液中Ag+或Cl-的浓度有关,而与溶液体积无关。①c(Cl-)=0.01
mol·L-1,②c(Cl-)=0.04
mol·L-1,③c(Cl-)=0.03
mol·L-1,④c(Cl-)=0
mol·L-1,⑤c(Ag+)=0.05
mol·L-1;Ag+或Cl-浓度由小到大的顺序为④<①<③<②<⑤,故AgCl的溶解度由大到小的顺序为④>①>③>②>⑤。
17
13.(2020·河北廊坊质检)常温下,Ksp(PbI2)=7.1×10-9。取适量黄色PbI2粉末溶于水中,充分搅拌后得到浊液,过滤。在滤液中加入少量KI,测得c(I-)=1.0×10-2
mol·L-1。下列说法正确的是
A.Ksp(PbI2)减小
B.溶液中c(I-)减小
C.产生黄色沉淀
D.溶液中c(Pb2+)=7.1×10-7
mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
14.已知:pAg=-lg
c(Ag+),Ksp(AgCl)=1×10-12。如图是向10
mL
AgNO3溶液中逐滴加入0.1
mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是
A.原AgNO3溶液的物质的量浓度为0.1
mol·L-1
B.图中x点的坐标为(100,6)
C.图中x点表示溶液中Ag+被恰好完全沉淀(浓度为0)
D.若把0.1
mol·L-1
NaCl溶液换成0.1
mol·L-1
NaI溶液,
则图像在终点后变为虚线部分
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 加入NaCl之前,pAg=0,所以c(AgNO3)=1
mol·L-1,A错误;
由于x点c(Ag+)=10-6
mol·L-1,所以Ag+视为沉淀完全(但浓度不为0),则加入的NaCl的物质的量n(NaCl)=n(AgNO3)=0.01
L×1
mol·L-1=0.01
mol,所以V(NaCl)=
=100
mL,B正确、C错误;
若把NaCl换成NaI,由于Ksp(AgI)更小,所以c(Ag+)更小,pAg更大,与图像不符,D错误。
17
15.室温下用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为_____,加碱调节至pH为____时,铁离子刚好沉淀完全(离子浓度小于1×10-5
mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为____时,锌开始沉淀(假定Zn2+浓度为0.1
mol·L-1)。若上述过程不加H2O2后果是___________
_________,原因是__________________________。
已知:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp的近似值
10-17
10-17
10-39
Fe3+
2.7
6
Zn2+和Fe2+
不能分离
Fe(OH)2和Zn(OH)2的Ksp相近
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由于Zn(OH)2和
Fe(OH)2的Ksp相近,若不加双氧水,沉淀Zn2+的同时Fe2+也会沉淀,从而使Zn2+和Fe2+不能分离。
17
16.根据题目提供的溶度积数据进行计算并回答下列问题:
(1)在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(
)=10-3
mol·L-1,则Ca2+是否沉淀完全?_____(填“是”或“否”)。[已知c(Ca2+)≤10-5
mol·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(2)25
℃时,Mg(OH)2饱和溶液_____(填“能”或“不能”)使石蕊溶液变蓝色。(已知Ksp[Mg(OH)2]=4.0×10-12,lg
5=0.7)
能
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(3)大量的碘富集在海藻中,用水浸取后浓缩,该浓缩液中主要含有I-、Cl-等离子。取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始
沉淀时,溶液中
为___________。[已知Ksp(AgCl)=1.8×10-10,
Ksp(AgI)=8.5×10-17]
4.7×10-7
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
17.(1)工业废水中常含有一定量的
,它们会对人类及生态系统产生很大损害,必须进行处理。Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
Cr3++3OH-,常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降低为10-5
mol·L-1,溶液的pH应调至_____。
5
解析 Ksp=c(Cr3+)·c3(OH-)=10-32,
pH=-lg
c(H+)=-lg
10-5=5。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(2)常温下,在0.10
mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___________
mol·L-1
(Ksp[Cu(OH)2]=2.2×10-20)。若在0.10
mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中H+的浓度是______
mol·L-1。
2.2×10-8
0.20
解析 pH=8时c(OH-)=10-6
mol·L-1,由氢氧化铜的溶度积常数可知:Ksp=2.2×10-20=10-12×c(Cu2+),得c(Cu2+)=2.2×10-8
mol·L-1。使Cu2+完全沉淀为CuS,已知c(Cu2+)=0.10
mol·L-1,根据反应关系式:Cu2+~2H+得c(H+)=0.20
mol·L-1。
返回
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
本课结束
第1课时
沉淀溶解平衡与溶度积
1.变化观念与平衡思想
知道难溶电解质的沉淀溶解平衡及其影响因素,能多角度、动态地分析难溶电解质的溶解平衡。
2.证据推理与模型认知
知道溶度积的意义,建立根据溶度积判断反应进行方向的思维模型。
核心素养发展目标
课时对点练
内容索引
一、沉淀溶解平衡原理
二、溶度积常数
一、沉淀溶解平衡原理
1.25
℃时,溶解性与溶解度的关系
溶解性
易溶
可溶
微溶
难溶
溶解度
>10
g
1~10
g
0.01~1
g
<0.01
g
2.实验探究沉淀溶解平衡的存在
实验操作
?
现象
上层清液中出现_________
结论
原上层清液中含有
,PbI2固体在水中存在_________
黄色沉淀
I-
溶解平衡
3.以AgCl为例分析沉淀溶解平衡建立的过程
(1)AgCl在溶液中存在两个过程:一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl表面进入水中,即存在
过程;另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl表面析出,即存在
过程。在一定温度下,当AgCl溶解和沉淀的速率相等时,体系中形成AgCl
。
总结:在一定温度下,当沉淀溶解和生成的速率
时,即建立了动态平衡,叫做沉淀溶解平衡。
溶解
沉淀
饱和溶液
相等
(2)沉淀溶解平衡的特征
相等
保持不变
(3)沉淀溶解平衡的表达式:AmBn(s)
mAn++nBm-
在沉淀后用“s”标明状态,溶液中用“离子符号”,并用“
”连接。
如:PbI2沉淀溶解平衡可表示为
。
4.外界条件对沉淀溶解平衡的影响
(1)温度:升高温度,多数沉淀溶解平衡向溶解方向移动;少数沉淀溶解平衡向
方向移动,如Ca(OH)2的沉淀溶解平衡。
(2)浓度:加水稀释,沉淀溶解平衡向
方向移动。
(3)同离子:加入与难溶电解质构成中相同的离子,平衡向_________方向移动。
(4)其他:加入可与难溶电解质溶解所得的离子反应的物质,沉淀溶解平衡向
方向移动。
特别提醒 影响难溶电解质沉淀溶解平衡的决定性因素为难溶电解质本身的性质。
生成沉淀
溶解
生成沉淀
溶解
1.(1)因为BaSO4难溶,所以将BaSO4加入水中,溶液中无Ba2+和
( )
(2)难溶电解质的沉淀溶解平衡是动态平衡,即溶解和沉淀同时进行着,只是v(溶解)=v(沉淀)( )
(3)Ca(OH)2溶解放热,所以升温,Ca(OH)2(s)
Ca2++2OH-溶解平衡逆向移动( )
(4)含等物质的量的AgNO3与NaCl的溶液混合后,恰好完全反应生成AgCl沉淀,溶液中不存在Ag+和Cl-( )
(5)当溶液中某离子浓度小于1×10-5
mol·L-1时,可视为该离子沉淀完全
( )
应用体验
×
√
√
×
√
2.已知沉淀溶解平衡:Mg(OH)2(s)
Mg2++2OH-,请分析当改变下列条件时,对该沉淀溶解平衡的影响,并填写下表(浓度变化均指平衡后和原平衡比较):
条件改变
移动方向
c(Mg2+)
c(OH-)
加水
_________
_____
_____
升温
_________
_____
_____
加MgCl2(s)
_________
_____
_____
加盐酸
_________
_____
_____
加NaOH(s)
_________
_____
_____
正向移动
正向移动
逆向移动
正向移动
逆向移动
不变
增大
增大
增大
减小
不变
增大
减小
减小
增大
3.将AgCl分别投入下列溶液中:
①40
mL
0.03
mol·L-1的HCl溶液 ②50
mL
0.03
mol·L-1的AgNO3溶液 ③30
mL
0.02
mol·L-1的CaCl2溶液 ④10
mL蒸馏水。AgCl的溶解度由大到小的顺序是_______________。
④>①=②>③
解析 AgCl(s)在溶液中存在如下沉淀溶解平衡:AgCl(s)
Ag++Cl-,①中c(Cl-)=0.03
mol·L-1,抑制了AgCl(s)的溶解,使得AgCl(s)的溶解度减小,②中c(Ag+)=0.03
mol·L-1,也抑制了AgCl(s)的溶解,且抑制程度与①相同,③中的c(Cl-)=0.04
mol·L-1,抑制溶解,且抑制程度大于①和②,AgCl(s)的溶解度更小。所以AgCl的溶解度由大到小的顺序是④>①=②>③。
返回
二、溶度积常数
1.概念:难溶电解质的沉淀溶解平衡也存在
,称为
,简称溶度积,符号为
。
2.表达式
AmBn(s)
mAn++nBm-
Ksp=_______________
AgCl(s)
Ag++Cl-
Ksp=c(Ag+)·c(Cl-)
Fe(OH)3(s)
Fe3++3OH-
Ksp=c(Fe3+)·c3(OH-)
平衡常数
溶度积常数
Ksp
cm(An+)·cn(Bm-)
3.意义
Ksp的大小反映难溶电解质在水中的溶解能力。
(1)相同类型的难溶电解质,溶度积小的电解质,其溶解能力
。
(2)不同类型的难溶电解质,溶度积小的电解质,其溶解能力_______
比溶度积大的溶解能力小。
小
不一定
4.应用——溶度积规则
通过比较溶度积与溶液中的离子浓度幂之积的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成。以沉淀溶解平衡BaSO4(s)
Ba2++
为例:
(1)c(Ba2+)·c(
)>Ksp,溶液过饱和,有
析出,直至溶液饱和,达到新的平衡。
(2)c(Ba2+)·c(
)=Ksp,溶液饱和,沉淀与溶解处于
。
(3)c(Ba2+)·c(
)
沉淀
平衡状态
沉淀
5.影响因素
溶度积Ksp值的大小只与难溶电解质本身的性质和温度有关,与浓度无关。
(1)溶度积是沉淀溶解平衡时难溶电解质在溶液中的各离子浓度的乘积
( )
(2)溶度积受离子浓度大小的影响( )
(3)Ksp小的难溶电解质的溶解度一定小于Ksp大的难溶电解质的溶解度
( )
(4)改变外界条件使溶解平衡正向移动,Ksp一定增大( )
正误判断
×
×
×
×
易错警示
同种类型的难溶电解质,Ksp可用于溶解度的直接比较,如AgCl、AgBr、AgI都是AB型,Ag2S是A2B型,不同类型不能直接比较溶解度大小。
将10
mL
0.002
mol·L-1的CaCl2溶液与等体积、等浓度的Na2C2O4溶液相混合,已知CaC2O4的Ksp=2.32×10-9。判断是否有CaC2O4沉淀生成。
深度思考
提示 根据溶度积规则:
c(Ca2+)·c(
)=0.001
×0.001=10-6>Ksp(CaC2O4),所以有沉淀生成。
应用体验
1.已知常温下,Ksp[Cu(OH)2]=2.0×10-20,某CuSO4溶液中c(Cu2+)=0.02
mol·L-1,现向溶液中加入碱来调节pH,当Cu2+开始沉淀时,pH应调节为多少?通过计算证明。
提示 常温下,如果要生成Cu(OH)2沉淀,则c(Cu2+)·c2(OH-)>Ksp[Cu(OH)2],即0.02×c2(OH-)>2.0×10-20,有c(OH-)>1.0×10-9
mol·L-1,所以c(H+)<1.0×10-5
mol·L-1,故应调节pH大于5。
2.已知25
℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。
(1)25
℃时,氯化银的饱和溶液中,c(Cl-)=____________________,向其中加入NaCl固体,溶解平衡_________,溶度积常数_____。
1.3×10-5
mol·L-1
逆向移动
不变
解析 氯化银的饱和溶液中无其他离子影响,
(2)25
℃时,若向50
mL
0.018
mol·L-1的AgNO3溶液中加入50
mL
0.020
mol·L-1
的盐酸,混合后溶液中的c(Ag+)=_________________,pH=____。
1.8×10-7
mol·L-1
2
解析 n(AgNO3)=50×10-3
L×0.018
mol·L-1=9×10-4
mol,n(HCl)=50×10-3
L×0.020
mol·L-1=1×10-3
mol,两溶液混合,AgNO3+HCl
===AgCl↓+HNO3,HCl过量:1×10-3
mol-9×10-4
mol=1×10-4
mol,
故反应后的c(Cl-)=
=1×10-3
mol·L-1,H+未被消耗,
c(H+)=
=1×10-2
mol·L-1。c(Ag+)·c(Cl-)=1.8×10-10,
即c(Ag+)·(1×10-3)=1.8×10-10,解得c(Ag+)=1.8×10-7
mol·L-1;pH=-lg
(1×10-2)=2。
(3)25
℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序为_______________,由此可得出_______更难溶。
Ag2CrO4>AgCl
AgCl
解析 在Ag2CrO4的沉淀溶解平衡中
2x
x
(4)将等体积的4×10-3
mol·L-1的AgNO3溶液和4×10-3
mol·L-1的K2CrO4溶液混合____(填“有”或“没有”)Ag2CrO4沉淀产生。
有
(1)Ksp只与难溶电解质的性质、温度有关,而与沉淀的量和溶液中离子的浓度无关。
(2)对于同类型物质(如AB型、A2B型、AB2型等),可直接用溶度积比较难溶电解质的溶解能力,Ksp越大,难溶电解质在水中的溶解能力越强。
(3)对于不同类型的物质,Ksp不能直接作为比较依据,而应通过计算将Ksp转化为饱和溶液中溶质的物质的量浓度来确定溶解能力的大小。
归纳总结
返回
课
时
对
点
练
题组一 沉淀溶解平衡的含义
1.下列关于沉淀溶解平衡的说法正确的是
A.只有难溶电解质才存在沉淀溶解平衡过程
B.沉淀溶解平衡过程是可逆的
C.在平衡状态时,v(溶解)=v(沉淀)=0
D.达到沉淀溶解平衡的溶液不一定是饱和溶液
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 无论是难溶电解质还是易溶电解质,都存在沉淀溶解平衡过程,A项错误;
沉淀溶解达到平衡状态时,v(溶解)=v(沉淀)≠0,C项错误;
沉淀溶解过程达到平衡时,溶液也达到饱和状态,D项错误。
17
2.(2020·郑州期中)下列有关AgCl的沉淀溶解平衡说法正确的是
A.AgCl沉淀生成和溶解达平衡后不再进行
B.AgCl难溶于水,溶液中没有Ag+和Cl-
C.升高温度,AgCl的溶解度增大
D.向AgCl沉淀溶解平衡体系中加入NaCl固体,AgCl固体的质量不变
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 难溶物达到沉淀溶解平衡时沉淀的生成和溶解都不停止,但溶解速率和生成速率相等,A错误;
没有绝对不溶的物质,B错误;
温度越高,AgCl的溶解度越大,C正确;
向AgCl沉淀溶解平衡体系中加入NaCl固体,使沉淀溶解平衡逆向移动,AgCl固体的质量增大,D错误。
17
题组二 沉淀溶解平衡的影响因素
3.25
℃时,在含有大量PbI2的饱和溶液中存在着平衡:PbI2(s)
Pb2++2I-,加入KI溶液,下列说法正确的是
A.溶液中Pb2+和I-浓度都增大
B.溶度积常数Ksp增大
C.沉淀溶解平衡正向移动
D.溶液中Pb2+的浓度减小
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
解析 加入KI溶液时,溶液中c(I-)增大,使PbI2的沉淀溶解平衡逆向移动,因此溶液中c(Pb2+)减小,但由于溶液中温度未发生改变,故PbI2的溶度积常数Ksp不发生变化。
17
4.将足量的BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。下列溶液中Ba2+的浓度最小的是
A.10
mL
0.2
mol·L-1
Na2CO3溶液
B.40
mL
水
C.50
mL
0.01
mol·L-1
BaCl2溶液
D.100
mL
0.01
mol·L-1盐酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
16
17
5.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)
Ca2++2OH-。下列说法正确的是
A.恒温下向溶液中加入CaO,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 恒温下加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH不变,A错误;
加热,Ca(OH)2的溶解度减小,溶液的pH降低,B错误;
加入Na2CO3溶液,沉淀溶解平衡正向移动,Ca(OH)2固体转化为CaCO3固体,固体质量增加,C正确;
加入NaOH固体,沉淀溶解平衡逆向移动,Ca(OH)2固体质量增加,D错误。
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
题组三 溶度积及应用
6.(2020·济南期中)下列说法正确的是
A.难溶电解质在水中达到沉淀溶解平衡时,沉淀和溶解立即停止
B.Ksp越小,难溶电解质在水中的溶解能力一定越小
C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的溶解能力
相同
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 难溶电解质在水中达到沉淀溶解平衡,沉淀溶解平衡是动态平衡,沉淀和溶解的速率相同,故A项错误;
Ksp可用来判断相同类型的化合物在水中的溶解度大小,但如果化合物的类型不同,就不能直接进行判断,故B项错误;
沉淀溶解平衡存在溶度积常数,Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关,故C项正确;
相同温度下,AgCl在水中的溶解能力大于在NaCl溶液中的溶解能力,因为在NaCl溶液中氯离子对氯化银的溶解起到抑制作用,故D项错误。
17
7.已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4
mol·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于
A.2.8×10-2
mol·L-1
B.1.4×10-5
mol·L-1
C.2.8×10-5
mol·L-1
D.5.6×10-5
mol·L-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
8.在2
L含有物质的量均为0.1
mol的Ca2+、Mg2+的某溶液中,加入一定量的NaOH固体使溶液的pH=11,有沉淀生成,过滤。
已知:Ksp[Ca(OH)2]=4.68×10-6;Ksp[Mg(OH)2]=5.61×10-12。当离子浓度小于10-5
mol·L-1认为已经除净,下列说法正确的是
A.此沉淀是Mg(OH)2、Ca(OH)2的混合物
B.此沉淀只有Mg(OH)2
C.过滤后滤液中存在Ca2+、Mg2+
D.向原溶液中加入8.8
g
NaOH固体,不可以使Ca2+部分转化为沉淀
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 加入NaOH固体调至pH=11,此时滤液中c(OH-)=1×10-3
mol·L-1,则c(Ca2+)·c2(OH-)=0.05×(10-3)2=5×10-8
<10-5,滤液中不存在Mg2+;若改为加入8.8
g
NaOH固体,则n(NaOH)=0.22
mol,与0.1
mol
Mg2+反应消耗OH-
0.2
mol,剩余0.02
mol
OH-,c(Ca2+)·c2(OH-)=0.05×0.012=5×10-6>Ksp[Ca(OH)2],所以有Ca(OH)2沉淀析出。
17
题组四 Ksp曲线图像
9.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 A项,温度不变,加入Na2SO4会导致溶解平衡逆向移动,但两离子浓度的乘积仍不变,仍在曲线上,不会由a点变到b点;
C项,d点还没有形成饱和溶液,因此无BaSO4沉淀生成;
D项,a点与c点的Ksp相等。
17
10.(2020·齐齐哈尔期末)常温下,用AgNO3溶液分别滴定浓度均为0.1
mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑
的水解),下列叙述正确的是
A.n点表示AgCl的不饱和溶液
B.Ksp(Ag2C2O4)的数量级为10-11
C.向c(Cl-)=c(
)混合液中滴入AgNO3
溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4(s)+2Cl-
2AgCl(s)+
的平衡常数K=10-9.04
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 A项,n点时c(Ag+)比溶解平衡曲线上的c(Ag+)大,表示AgCl的过饱和溶液,错误;
B项,Ksp(Ag2C2O4)=(10-4)2×10-2.46=1×10-10.46=10-0.46×10-10≈0.347×10-10≈3.47×10-11,故它的数量级为10-11,正确;
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
11.下列有关溶度积常数Ksp的说法正确的是
A.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小
B.溶度积常数Ksp只受温度影响,温度升高Ksp减小
C.难溶电解质的溶度积Ksp越小,则它的溶解度越小
D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
综合强化
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 温度不变,溶度积常数不变,故A项不正确、D项正确;
大多数难溶物的Ksp随温度的升高而增大,但也有少数物质相反,如Ca(OH)2,故B不正确;
只有相同类型的难溶电解质,才满足Ksp越小溶解度越小的规律,C项错误。
17
12.(2020·济南高二检测)一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是
①20
mL
0.01
mol·L-1
KCl溶液 ②30
mL
0.02
mol·L-1
CaCl2溶液 ③40
mL
0.03
mol·L-1
HCl溶液
④10
mL
蒸馏水 ⑤50
mL
0.05
mol·L-1
AgNO3溶液
A.①>②>③>④>⑤
B.④>①>③>②>⑤
C.⑤>④>②>①>③
D.④>③>⑤>②>①
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 AgCl(s)
Ag++Cl-,c(Cl-)或c(Ag+)越大,对AgCl的溶解抑制作用越大,AgCl的溶解度就越小。注意AgCl的溶解度大小只与溶液中Ag+或Cl-的浓度有关,而与溶液体积无关。①c(Cl-)=0.01
mol·L-1,②c(Cl-)=0.04
mol·L-1,③c(Cl-)=0.03
mol·L-1,④c(Cl-)=0
mol·L-1,⑤c(Ag+)=0.05
mol·L-1;Ag+或Cl-浓度由小到大的顺序为④<①<③<②<⑤,故AgCl的溶解度由大到小的顺序为④>①>③>②>⑤。
17
13.(2020·河北廊坊质检)常温下,Ksp(PbI2)=7.1×10-9。取适量黄色PbI2粉末溶于水中,充分搅拌后得到浊液,过滤。在滤液中加入少量KI,测得c(I-)=1.0×10-2
mol·L-1。下列说法正确的是
A.Ksp(PbI2)减小
B.溶液中c(I-)减小
C.产生黄色沉淀
D.溶液中c(Pb2+)=7.1×10-7
mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
14.已知:pAg=-lg
c(Ag+),Ksp(AgCl)=1×10-12。如图是向10
mL
AgNO3溶液中逐滴加入0.1
mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是
A.原AgNO3溶液的物质的量浓度为0.1
mol·L-1
B.图中x点的坐标为(100,6)
C.图中x点表示溶液中Ag+被恰好完全沉淀(浓度为0)
D.若把0.1
mol·L-1
NaCl溶液换成0.1
mol·L-1
NaI溶液,
则图像在终点后变为虚线部分
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
解析 加入NaCl之前,pAg=0,所以c(AgNO3)=1
mol·L-1,A错误;
由于x点c(Ag+)=10-6
mol·L-1,所以Ag+视为沉淀完全(但浓度不为0),则加入的NaCl的物质的量n(NaCl)=n(AgNO3)=0.01
L×1
mol·L-1=0.01
mol,所以V(NaCl)=
=100
mL,B正确、C错误;
若把NaCl换成NaI,由于Ksp(AgI)更小,所以c(Ag+)更小,pAg更大,与图像不符,D错误。
17
15.室温下用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为_____,加碱调节至pH为____时,铁离子刚好沉淀完全(离子浓度小于1×10-5
mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为____时,锌开始沉淀(假定Zn2+浓度为0.1
mol·L-1)。若上述过程不加H2O2后果是___________
_________,原因是__________________________。
已知:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp的近似值
10-17
10-17
10-39
Fe3+
2.7
6
Zn2+和Fe2+
不能分离
Fe(OH)2和Zn(OH)2的Ksp相近
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由于Zn(OH)2和
Fe(OH)2的Ksp相近,若不加双氧水,沉淀Zn2+的同时Fe2+也会沉淀,从而使Zn2+和Fe2+不能分离。
17
16.根据题目提供的溶度积数据进行计算并回答下列问题:
(1)在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(
)=10-3
mol·L-1,则Ca2+是否沉淀完全?_____(填“是”或“否”)。[已知c(Ca2+)≤10-5
mol·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(2)25
℃时,Mg(OH)2饱和溶液_____(填“能”或“不能”)使石蕊溶液变蓝色。(已知Ksp[Mg(OH)2]=4.0×10-12,lg
5=0.7)
能
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(3)大量的碘富集在海藻中,用水浸取后浓缩,该浓缩液中主要含有I-、Cl-等离子。取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始
沉淀时,溶液中
为___________。[已知Ksp(AgCl)=1.8×10-10,
Ksp(AgI)=8.5×10-17]
4.7×10-7
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
17.(1)工业废水中常含有一定量的
,它们会对人类及生态系统产生很大损害,必须进行处理。Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
Cr3++3OH-,常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降低为10-5
mol·L-1,溶液的pH应调至_____。
5
解析 Ksp=c(Cr3+)·c3(OH-)=10-32,
pH=-lg
c(H+)=-lg
10-5=5。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
(2)常温下,在0.10
mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=___________
mol·L-1
(Ksp[Cu(OH)2]=2.2×10-20)。若在0.10
mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中H+的浓度是______
mol·L-1。
2.2×10-8
0.20
解析 pH=8时c(OH-)=10-6
mol·L-1,由氢氧化铜的溶度积常数可知:Ksp=2.2×10-20=10-12×c(Cu2+),得c(Cu2+)=2.2×10-8
mol·L-1。使Cu2+完全沉淀为CuS,已知c(Cu2+)=0.10
mol·L-1,根据反应关系式:Cu2+~2H+得c(H+)=0.20
mol·L-1。
返回
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
本课结束
