高中化学苏教版(2019)选择性必修1 专题3 第四单元 第2课时 沉淀溶解平衡原理的应用(57张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1 专题3 第四单元 第2课时 沉淀溶解平衡原理的应用(57张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-05 18:56:29 | ||
图片预览










文档简介
(共57张PPT)
第2课时
沉淀溶解平衡原理的应用
1.变化观念与平衡思想
能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
2.科学探究与创新意识
学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉淀转化等实验探究。
核心素养发展目标
课时对点练
内容索引
一、沉淀转化原理
二、沉淀转化的应用
一、沉淀转化原理
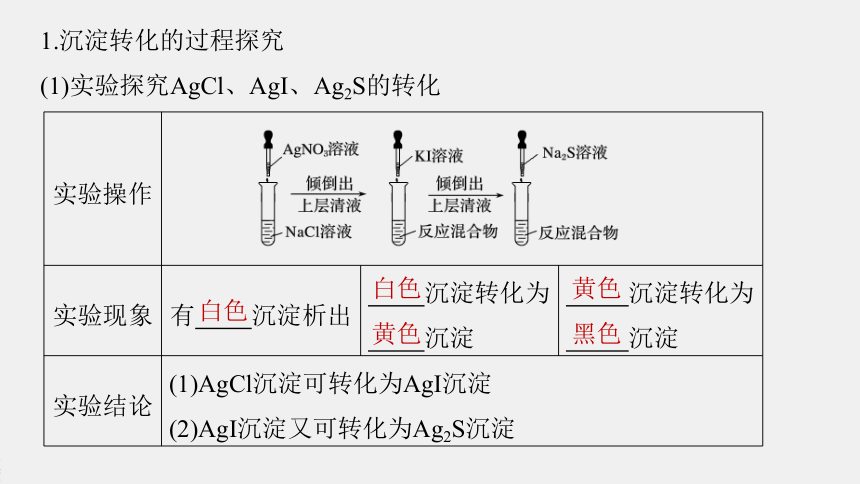
1.沉淀转化的过程探究
(1)实验探究AgCl、AgI、Ag2S的转化
实验操作
?
实验现象
有
沉淀析出
沉淀转化为
沉淀
沉淀转化为
沉淀
实验结论
(1)AgCl沉淀可转化为AgI沉淀
(2)AgI沉淀又可转化为Ag2S沉淀
白色
白色
黄色
黄色
黑色
(2)理论分析
①根据溶解度数据可知三种沉淀溶解能力从大到小的顺序是________
。
②向AgCl沉淀中滴加KI溶液时,溶液中的________________________
,溶液中Ag+浓度
,促使_______________________
,最终AgCl完全转化为AgI。
AgI转化为Ag2S的原理相同。
AgCl>
AgI>Ag2S
Ag+和I-结合生成了更难
溶解的AgI
减小
AgCl的沉淀溶解平衡向其
溶解的方向移动
③沉淀的转化示意图
④沉淀转化的离子方程式:
;
。
2.沉淀转化的实质:
。
AgCl(s)+I-
AgI(s)+Cl-
2AgI(s)+S2-
Ag2S(s)+2I-
沉淀溶解平衡的移动
3.沉淀转化的条件:溶液中的离子浓度幂之积
Ksp
(1)一般是
的沉淀转化成
的沉淀容易实现。两种沉淀的溶解度差别越大,沉淀转化越容易。
(2)在特殊情况下,控制反应条件,也可使
的物质转化为
的物质。
大于
溶解度小
溶解度更小
溶解能力相对较弱
溶解能力相对较强
(1)向AgCl沉淀中加入KI溶液,沉淀颜色转变成黄色沉淀,是由于Ksp(AgI)(2)所谓沉淀完全就是用沉淀剂将溶液中的某一离子除尽( )
(3)沉淀转化可用勒夏特列原理解释( )
(4)沉淀的转化只能由难溶的转化为更难溶的( )
正误判断
√
×
√
×
1.在25
℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。
应用体验
?
AgCl
AgI
Ag2S
Ksp
1.77×10-10
8.51×10-17
6.3×10-50
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25
℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
√
2.根据第1题中的溶度积数据,计算AgCl沉淀转化为AgI沉淀的平衡常数,并从平衡常数的角度解释该转化的可能性。
答案 AgCl沉淀转化为AgI沉淀的离子方程式,
该反应的平衡常数:
由于该反应的平衡常数很大,则AgCl沉淀能完全转化为AgI沉淀。
返回
二、沉淀转化的应用
1.锅炉除垢
水垢中的CaSO4(s)
CaCO3(s)
Ca2+(aq)
(1)沉淀转化
由于CaCO3的溶解能力
CaSO4,用碳酸钠溶液很容易将水垢中的CaSO4转化为疏松、易溶于酸的CaCO3沉淀,离子方程式为__________
___________
__________
。
(2)沉淀溶解
H+与碳酸钙电离的
结合生成
脱离固体,使碳酸钙溶解。离子方程式为
。
小于
CaSO4(s)+
CO2
CaCO3(s)+2H+===Ca2++H2O+CO2↑
2.重晶石转化为可溶性钡盐
重晶石BaSO4(s)
BaCO3(s)
Ba2+(aq)
(1)沉淀转化
虽然BaSO4比BaCO3更难溶于水,由于饱和Na2CO3溶液中的
浓度较大,BaSO4电离出的
。用饱和Na2CO3溶液多次重复处理,可使大部分BaSO4转化为BaCO3。
离子方程式为
。
(2)沉淀溶解
用盐酸溶解碳酸钡,可使Ba2+转入溶液中。
离子方程式为
。
BaCO3(s)+2H+===Ba2++H2O+CO2↑
3.物质的提纯——除去CuSO4溶液中混有的少量Fe3+
由于Fe(OH)3的溶解度比Cu(OH)2
,调节溶液的pH至3~4时,Cu2+
中,Fe3+
,达到除去Fe3+的目的。
小得多
留在溶液
水解生成Fe(OH)3而析出
4.铜蓝矿的形成过程
原生铜的硫化物
CuSO4(溶液)
CuS(铜蓝)
生成铜蓝的有关化学方程式:
,
。
ZnS(s)+CuSO4
CuS(s)+ZnSO4
PbS(s)+CuSO4
CuS(s)+PbSO4
1.牙齿表面的牙釉质起着保护牙齿的作用,其主要成分为Ca5(PO4)3OH
(羟基磷灰石),它是一种难溶电解质,Ksp=2.5×10-59;氟磷灰石[Ca5(PO4)3F]是一种更难溶的电解质。
(1)解释吃糖后不刷牙容易形成蛀牙的原因:______________________
________________________________________________________________________________________________________。
深度思考
存在沉淀溶解平衡:
和OH-,使平衡向溶解方向移动,加速牙齿腐蚀
(2)请解释含氟牙膏使牙齿变坚固的原因并写出此反应的离子方程式:_____________________________________________________________
______________________________________________________________
__________________________________________。
F-与难溶于水的羟基磷灰石[Ca5(PO4)3(OH)]反应生成更难溶且耐酸的氟磷灰石[Ca5(PO4)3F],覆盖在牙齿表面,抵抗H+的侵袭;Ca5(PO4)3(OH)(s)+F-
Ca5(PO4)3F(s)+OH-
2.除去硫酸铜溶液中混有少量铁离子的流程图
计算使0.010
mol·L-1Fe3+开始沉淀及沉淀完全时的pH。(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cu(OH)2]=2.2×10-20)
Fe3+开始沉淀时,c(Fe3+)=0.010
mol·L-1
c(OH-)≈6.4×10-13mol·L-1 pOH≈12.2 pH=1.8
Fe3+完全沉淀时,c(Fe3+)=1.0×10-5mol·L-1
c(OH-)≥6.4×10-12mol·L-1 pH≥2.8
同理:可求出0.010
mol·L-1Cu2+开始沉淀的pH≈5.2
故:0.010
mol·L-1Cu2+和0.010
mol·L-1Fe3+的混合溶液,若要使Fe3+沉淀完全而Cu2+不沉淀,应控制的溶液pH为:2.8≤pH<5.2。
3.用沉淀法除去溶液中的有害离子时,当剩余离子浓度≤10-5mol·L-1时,认为离子已沉淀完全或离子已有效除去。通过计算说明,用5%的Na2SO4溶液给误食Ba2+的患者洗胃,能否有效除去?已知:Ksp(BaSO4)=1.1×10-10。
4.已知Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.5×10-9,解答下列问题:
(1)向等浓度的碳酸钠、硫酸钠的混合溶液中逐滴加入氯化钡溶液,最先出现的沉淀是________。
(2)某同学设想用下列流程得到BaCl2溶液,
则①的离子方程式为________________________________,该反应的平衡常数K=_______。
BaSO4
0.044
(1)一般来说,当溶液中有多种可以沉淀的离子且生成相同类型的沉淀时,Ksp越小的越先沉淀。
(2)当离子浓度小于1×10-5
mol·L-1时,认为已完全沉淀。
特别提醒
返回
课
时
对
点
练
题组一 沉淀溶解平衡原理与实验探究
1.当氢氧化镁固体在水中达到沉淀溶解平衡Mg(OH)2(s)
Mg2++2OH-时,为使Mg(OH)2固体的量减少,需加入少量的
A.NH4NO3
B.NaOH
C.MgSO4
D.Na2SO4
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
解析 要使Mg(OH)2固体的量减小,应使Mg(OH)2的沉淀溶解平衡右移,可减小c(Mg2+)或c(OH-)。NH4NO3电离出的
能结合OH-,使平衡右移。
2.已知:Ksp(ZnS)>Ksp(CuS),在有白色固体ZnS存在的饱和溶液中滴加适量CuSO4溶液,产生的实验现象是
A.固体逐渐溶解,最后消失
B.固体由白色变为黑色
C.固体颜色变化但质量不变
D.固体逐渐增多,但颜色不变
√
解析 ZnS和CuS的阴、阳离子个数比为1∶1,且Ksp(ZnS)>Ksp(CuS),可得ZnS的溶解度大于CuS的溶解度,因此在ZnS饱和溶液中加CuSO4,会使ZnS沉淀转化生成黑色的CuS。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 除杂与沉淀剂的选择
3.某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4。在调节溶液pH时,应选用的试剂是
A.NaOH
B.ZnO
C.ZnSO4
D.Fe2O3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
解析 溶液中含有FeCl3杂质,将溶液调至pH=4,可使Fe3+水解生成Fe(OH)3沉淀而除去,注意不能引入新的杂质,可加入ZnO和酸反应调节溶液pH,使铁离子全部沉淀。
4.要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
化合物
PbSO4
PbSO3
PbS
溶解度/g
1.03×10-4
1.81×10-7
1.84×10-14
由上述数据可知,选用的沉淀剂最好为
A.硫化物
B.硫酸盐
C.碳酸盐
D.以上沉淀剂均可
√
解析 生成物的溶解度越小,沉淀反应越容易发生。要将Pb2+沉淀,就要形成溶解度更小的物质,由表中数据可知,PbS的溶解度最小,沉淀剂最好为硫化物。
5.实验室测定水体中氯离子的含量时,常使用AgNO3溶液滴定法,已知在25
℃时几种银盐的Ksp和颜色如下表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
难溶盐
AgCl
AgBr
AgI
Ag2CrO4
Ag2CO3
Ksp
1.8×10-10
5.4×10-13
8.5×10-17
2.0×10-12
8.1×10-12
颜色
白色
淡黄色
黄色
砖红色
白色
可用作滴定Cl-指示剂的是
A.K2CrO4
B.Na2CO3
C.NaBr
D.NaI
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 测定水体中的Cl-,选用AgNO3溶液滴定,当Cl-消耗完后,Ag+应与指示剂反应,生成一种有色的沉淀。则选择的指示剂的阴离子应在Cl-后面沉淀,显然不能选择NaBr和NaI,另外Ag2CO3为白色沉淀,无法与AgCl沉淀区分开来。故只能选择K2CrO4,当Ag+浓度相同时,Cl-在
之前沉淀,设两者达到沉淀溶解平衡时,溶液中c(Ag+)=x
mol·L-1,AgCl:x2=1.8×10-10,x≈1.34×10-5
mol·L-1;Ag2CrO4:
=2.0×10-12,x≈1.59×10-4
mol·L-1,由此可知
沉淀时需要的Ag+浓度更大。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组三 用沉淀平衡原理解释实际问题
6.可溶性钡盐有毒,医院中常用无毒硫酸钡作为内服“钡餐”造影剂。医院抢救钡离子中毒者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:某温度下,Ksp(BaCO3)=2.6×10-9;Ksp(BaSO4)=1.1×10-10。下列推断正确的是
A.不用碳酸钡作为内服造影剂,是因为碳酸钡比硫酸钡更难溶
B.可以用0.36
mol·L-1的Na2SO4溶液给钡离子中毒者洗胃
C.抢救钡离子中毒者时,若没有硫酸钠也可以用碳酸钠溶液代替
D.误饮c(Ba2+)=1.0×10-5
mol·L-1的溶液时,会引起钡离子中毒
√
解析 碳酸钡能与胃酸反应生成可溶性钡盐,钡离子有毒,所以不能用碳酸钡作为内服造影剂,A错误;
碳酸钡与胃酸反应转化为可溶性钡盐,起不到解毒的作用,C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A.过滤后的溶液中一定没有S2-
B.MnS难溶于水,可溶于MnCl2溶液中
C.常温时,CuS、PbS、CdS比MnS更难溶
D.加入MnS后生成CuS的离子方程式是Cu2++S2-===CuS↓
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 难溶不是不溶,只是溶解度很小,故A错误;
MnS难溶于水也难溶于MnCl2溶液,故B错误;
通过添加过量的难溶电解质MnS,除去Cu2+、Pb2+、Cd2+等离子,是沉淀转化的原理,故C正确;
沉淀转化的离子方程式为Cu2++MnS(s)
CuS(s)+Mn2+,故D错误。
8.(2020·南京联考)工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+,Cu2++MnS(s)
CuS(s)+Mn2+。下列说法错误的是
A.该反应平衡时c(Mn2+)=c(Cu2+)
B.MnS的Ksp大于CuS的Ksp
C.向平衡体系中加入少量CuSO4固体后,c(Mn2+)增大
D.该反应的平衡常数K=
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
9.向紫色Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3灰绿色沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(
),其平衡关系如下:
Cr3++3OH-
Cr(OH)3
+H++H2O
(紫色)
(灰绿色)
(亮绿色)
向50
mL
0.05
mol·L-1Cr2(SO4)3溶液中加入1.0
mol·L-1NaOH溶液50
mL,充分反应后,溶液中可观察到的现象是
A.溶液为紫色
B.溶液中有灰绿色沉淀
C.溶液为亮绿色
D.无法判断
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是
A.T1>T2
B.加入BaCl2固体,可使溶液由a点变到c点
C.c点时,在T1、T2两个温度下均有固体析出
D.a点和b点的Ksp相等
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
解析 因为硫酸钡在水中溶解时吸收热量,则温度升高硫酸钡的Ksp增大,T2时硫酸钡的Ksp大于T1时硫酸钡的Ksp,故T2>T1,A错误;
硫酸钡溶液中存在着沉淀溶解平衡,a点在平衡曲
线上,加入BaCl2,c(Ba2+)增大,平衡左移,c(
)应降低,所以不能使溶液由a点变到c点,B错误;
Ksp是常数,温度不变,Ksp不变,同一温度下,在曲线上的任意一点Ksp都相等,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.常温下,Ag2S与CuS在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是
A.Ksp(Ag2S)=10-29.2
B.向含CuS沉淀的悬浊液中加入Na2S
饱和溶液,Ksp(CuS)减小
C.若Z点为Ag2S的分散系,v(沉淀)>
v(溶解)
D.CuS(s)+2Ag+
Ag2S(s)+Cu2+
平衡常数很大,反应趋于完全
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 A项,图像X(20,9.2),即c(Ag+)=10-20
mol·L-1,c(S2-)=10-9.2
mol·L-1,Ksp(Ag2S)=c2(Ag+)·c(S2-)=10-49.2,错误;
B项,Ksp(CuS)的大小只与温度有关,错误;
C项,若Z点为Ag2S的分散系,是不饱和溶液,v(沉淀)<v(溶解),错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.(2020·郑州高二检测)25
℃时有关物质的颜色和溶度积(Ksp)如下表:
物质
AgCl
AgBr
AgI
Ag2S
颜色
白
淡黄
黄
黑
Ksp
1.8×10-10
5.4×10-13
8.5×10-17
1.8×10-50
下列叙述中不正确的是
A.向AgCl的白色悬浊液中加入0.1
mol·L-1
KI溶液,有黄色沉淀产生
B.25
℃时,AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度相同
C.25
℃,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同
D.在5
mL
1.8×10-6
mol·L-1
NaCl溶液中,加入1滴(20滴约为1
mL)1×
10-3
mol·L-1
AgNO3溶液,不能产生白色沉淀
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 由Ksp(AgCl)>Ksp(AgI)可知A项正确;
由四种物质的溶度积常数计算可知,其饱和水溶液中c(Ag+)的大小关系为AgCl>AgBr>AgI>Ag2S,B项错误;
由于溶度积常数只是温度的函数,温度不变其值不变,C项正确;
加入一滴硝酸银溶液后c(Cl-)可认为保持不变,即c(Cl-)=1.8×10-6
mol·L-1,而AgNO3溶液相当于稀释100倍,故c(Ag+)=1×10-5
mol·L-1,c(Cl-)·c(Ag+)=1.8×10-11<Ksp(AgCl),故没有沉淀生成,D项正确。
13.已知常温下,Ksp(AgBr)=4.9×10-13、Ksp(AgI)=8.3×10-17。
(1)现向含有AgI的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”“变小”或“不变”,下同);
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
变小
解析 加入AgNO3固体,使c(Ag+)增大,AgI溶解平衡向左移动,c(I-)减小。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
②若改加更多的AgI固体,则c(Ag+)______;
不变
解析 改加更多的AgI固体,仍是该温度下的饱和溶液,各离子浓度不变。
③若改加AgBr固体,则c(I-)______,而c(Ag+)______。
变小
变大
解析 因AgBr的溶解度大于AgI的溶解度,所以改加AgBr固体时,使c(Ag+)变大,而使AgI的溶解平衡向生成AgI的方向移动,c(I-)变小。
(2)现向含有NaBr、KI均为0.002
mol·L-1的溶液中加入等体积浓度为4×10-3
mol·L-1的AgNO3溶液,则产生的沉淀是_____________(填化学式);若向其中再加入适量的NaI固体,则最终可发生沉淀转化的总反应式表示为_________________________。
AgI、AgBr
解析 等体积混合后c(Br-)=c(I-)=0.001
mol·L-1,c(Ag+)=2×
10-3
mol·L-1。因Ksp(AgI)mol·L-1,剩余c(Ag+)=2×10-3
mol·L-1-0.001
mol·L-1=0.001
mol·L-1,c(Ag+)·c(Br-)=0.001×0.001=1×10-6
>4.9×10-13,所以有AgBr沉淀生成;若再向其中加入适量NaI固体时,会有AgBr转化为AgI。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.已知25
℃:
难溶电解质
CaCO3
CaSO4
MgCO3
Ksp
2.8×10-9
9.1×10-6
6.8×10-6
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,实验步骤如下:
①向100
mL
0.1
mol·L-1的CaCl2溶液中加入100
mL
0.1
mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入3
g
Na2CO3固体,搅拌,静置沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置后再弃去上层清液。
④____________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)由题中信息知Ksp越大,表示电解质的溶解度越____(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:____________________________
_________。
(3)设计第③步的目的是______________________。
(4)请补充第④步操作及发生的现象:_____________________________
_______________________________。
(5)请写出该原理在实际生活、生产中的一个应用:________________
________________________________。
大
Na2CO3+CaSO4(s)
CaCO3(s)
+Na2SO4
向沉淀中加入足量的盐酸,沉淀
完全溶解,并放出无色无味的气体
将锅炉水垢中的
CaSO4转化为CaCO3,再用盐酸除去
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 Ksp越大,表示电解质的溶解度越大,溶解度大的沉淀会向溶解度小的沉淀转化,要证明CaSO4完全转化为CaCO3,可以加入盐酸,因为CaSO4不和盐酸反应,而CaCO3可完全溶于盐酸。在实际生活、生产中利用此反应可以将锅炉水垢中的CaSO4转化为CaCO3再用盐酸除去。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
15.难溶电解质在水溶液中存在着沉淀溶解平衡。
已知:某温度下,Cu(OH)2(s)
Cu2++2OH-,Ksp[Cu(OH)2]=2×10-20
Fe(OH)3(s)
Fe3++3OH-,Ksp[Fe(OH)3]=8×10-38
某CuSO4溶液中含有Fe3+杂质,溶液中CuSO4的浓度为2.0
mol·L-1,
通常认为残留在溶液中的离子浓度小于1×10-5
mol·L-1时即沉淀完全,则:
(1)该溶液中的Fe3+刚好沉淀完全时溶液的pH约为
____。
3.3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)该溶液中的Cu2+开始形成Cu(OH)2沉淀时的pH约为_____。
4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)若将该溶液的pH调至3.5,_____(填“是”或“否”)可以达到除去Fe3+杂质而不损失Cu2+的目的。
(注:lg
2≈0.3,lg
5≈0.7)
是
解析 Fe3+刚好沉淀完全时溶液的pH为3.3,Cu2+开始形成沉淀时的pH为4,溶液的pH调至3.5时Fe3+已经沉淀完全,Cu2+还未沉淀,可以达到除去Fe3+杂质而不损失Cu2+的目的。
返回
本课结束
第2课时
沉淀溶解平衡原理的应用
1.变化观念与平衡思想
能用平衡移动原理分析理解沉淀的溶解与生成、沉淀转化的实质。
2.科学探究与创新意识
学会用沉淀溶解平衡的移动解决生产、生活中的实际问题,并设计实验探究方案,进行沉淀转化等实验探究。
核心素养发展目标
课时对点练
内容索引
一、沉淀转化原理
二、沉淀转化的应用
一、沉淀转化原理
1.沉淀转化的过程探究
(1)实验探究AgCl、AgI、Ag2S的转化
实验操作
?
实验现象
有
沉淀析出
沉淀转化为
沉淀
沉淀转化为
沉淀
实验结论
(1)AgCl沉淀可转化为AgI沉淀
(2)AgI沉淀又可转化为Ag2S沉淀
白色
白色
黄色
黄色
黑色
(2)理论分析
①根据溶解度数据可知三种沉淀溶解能力从大到小的顺序是________
。
②向AgCl沉淀中滴加KI溶液时,溶液中的________________________
,溶液中Ag+浓度
,促使_______________________
,最终AgCl完全转化为AgI。
AgI转化为Ag2S的原理相同。
AgCl>
AgI>Ag2S
Ag+和I-结合生成了更难
溶解的AgI
减小
AgCl的沉淀溶解平衡向其
溶解的方向移动
③沉淀的转化示意图
④沉淀转化的离子方程式:
;
。
2.沉淀转化的实质:
。
AgCl(s)+I-
AgI(s)+Cl-
2AgI(s)+S2-
Ag2S(s)+2I-
沉淀溶解平衡的移动
3.沉淀转化的条件:溶液中的离子浓度幂之积
Ksp
(1)一般是
的沉淀转化成
的沉淀容易实现。两种沉淀的溶解度差别越大,沉淀转化越容易。
(2)在特殊情况下,控制反应条件,也可使
的物质转化为
的物质。
大于
溶解度小
溶解度更小
溶解能力相对较弱
溶解能力相对较强
(1)向AgCl沉淀中加入KI溶液,沉淀颜色转变成黄色沉淀,是由于Ksp(AgI)
(3)沉淀转化可用勒夏特列原理解释( )
(4)沉淀的转化只能由难溶的转化为更难溶的( )
正误判断
√
×
√
×
1.在25
℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。
应用体验
?
AgCl
AgI
Ag2S
Ksp
1.77×10-10
8.51×10-17
6.3×10-50
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25
℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
√
2.根据第1题中的溶度积数据,计算AgCl沉淀转化为AgI沉淀的平衡常数,并从平衡常数的角度解释该转化的可能性。
答案 AgCl沉淀转化为AgI沉淀的离子方程式,
该反应的平衡常数:
由于该反应的平衡常数很大,则AgCl沉淀能完全转化为AgI沉淀。
返回
二、沉淀转化的应用
1.锅炉除垢
水垢中的CaSO4(s)
CaCO3(s)
Ca2+(aq)
(1)沉淀转化
由于CaCO3的溶解能力
CaSO4,用碳酸钠溶液很容易将水垢中的CaSO4转化为疏松、易溶于酸的CaCO3沉淀,离子方程式为__________
___________
__________
。
(2)沉淀溶解
H+与碳酸钙电离的
结合生成
脱离固体,使碳酸钙溶解。离子方程式为
。
小于
CaSO4(s)+
CO2
CaCO3(s)+2H+===Ca2++H2O+CO2↑
2.重晶石转化为可溶性钡盐
重晶石BaSO4(s)
BaCO3(s)
Ba2+(aq)
(1)沉淀转化
虽然BaSO4比BaCO3更难溶于水,由于饱和Na2CO3溶液中的
浓度较大,BaSO4电离出的
。用饱和Na2CO3溶液多次重复处理,可使大部分BaSO4转化为BaCO3。
离子方程式为
。
(2)沉淀溶解
用盐酸溶解碳酸钡,可使Ba2+转入溶液中。
离子方程式为
。
BaCO3(s)+2H+===Ba2++H2O+CO2↑
3.物质的提纯——除去CuSO4溶液中混有的少量Fe3+
由于Fe(OH)3的溶解度比Cu(OH)2
,调节溶液的pH至3~4时,Cu2+
中,Fe3+
,达到除去Fe3+的目的。
小得多
留在溶液
水解生成Fe(OH)3而析出
4.铜蓝矿的形成过程
原生铜的硫化物
CuSO4(溶液)
CuS(铜蓝)
生成铜蓝的有关化学方程式:
,
。
ZnS(s)+CuSO4
CuS(s)+ZnSO4
PbS(s)+CuSO4
CuS(s)+PbSO4
1.牙齿表面的牙釉质起着保护牙齿的作用,其主要成分为Ca5(PO4)3OH
(羟基磷灰石),它是一种难溶电解质,Ksp=2.5×10-59;氟磷灰石[Ca5(PO4)3F]是一种更难溶的电解质。
(1)解释吃糖后不刷牙容易形成蛀牙的原因:______________________
________________________________________________________________________________________________________。
深度思考
存在沉淀溶解平衡:
和OH-,使平衡向溶解方向移动,加速牙齿腐蚀
(2)请解释含氟牙膏使牙齿变坚固的原因并写出此反应的离子方程式:_____________________________________________________________
______________________________________________________________
__________________________________________。
F-与难溶于水的羟基磷灰石[Ca5(PO4)3(OH)]反应生成更难溶且耐酸的氟磷灰石[Ca5(PO4)3F],覆盖在牙齿表面,抵抗H+的侵袭;Ca5(PO4)3(OH)(s)+F-
Ca5(PO4)3F(s)+OH-
2.除去硫酸铜溶液中混有少量铁离子的流程图
计算使0.010
mol·L-1Fe3+开始沉淀及沉淀完全时的pH。(Ksp[Fe(OH)3]=2.6×10-39,Ksp[Cu(OH)2]=2.2×10-20)
Fe3+开始沉淀时,c(Fe3+)=0.010
mol·L-1
c(OH-)≈6.4×10-13mol·L-1 pOH≈12.2 pH=1.8
Fe3+完全沉淀时,c(Fe3+)=1.0×10-5mol·L-1
c(OH-)≥6.4×10-12mol·L-1 pH≥2.8
同理:可求出0.010
mol·L-1Cu2+开始沉淀的pH≈5.2
故:0.010
mol·L-1Cu2+和0.010
mol·L-1Fe3+的混合溶液,若要使Fe3+沉淀完全而Cu2+不沉淀,应控制的溶液pH为:2.8≤pH<5.2。
3.用沉淀法除去溶液中的有害离子时,当剩余离子浓度≤10-5mol·L-1时,认为离子已沉淀完全或离子已有效除去。通过计算说明,用5%的Na2SO4溶液给误食Ba2+的患者洗胃,能否有效除去?已知:Ksp(BaSO4)=1.1×10-10。
4.已知Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.5×10-9,解答下列问题:
(1)向等浓度的碳酸钠、硫酸钠的混合溶液中逐滴加入氯化钡溶液,最先出现的沉淀是________。
(2)某同学设想用下列流程得到BaCl2溶液,
则①的离子方程式为________________________________,该反应的平衡常数K=_______。
BaSO4
0.044
(1)一般来说,当溶液中有多种可以沉淀的离子且生成相同类型的沉淀时,Ksp越小的越先沉淀。
(2)当离子浓度小于1×10-5
mol·L-1时,认为已完全沉淀。
特别提醒
返回
课
时
对
点
练
题组一 沉淀溶解平衡原理与实验探究
1.当氢氧化镁固体在水中达到沉淀溶解平衡Mg(OH)2(s)
Mg2++2OH-时,为使Mg(OH)2固体的量减少,需加入少量的
A.NH4NO3
B.NaOH
C.MgSO4
D.Na2SO4
对点训练
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
解析 要使Mg(OH)2固体的量减小,应使Mg(OH)2的沉淀溶解平衡右移,可减小c(Mg2+)或c(OH-)。NH4NO3电离出的
能结合OH-,使平衡右移。
2.已知:Ksp(ZnS)>Ksp(CuS),在有白色固体ZnS存在的饱和溶液中滴加适量CuSO4溶液,产生的实验现象是
A.固体逐渐溶解,最后消失
B.固体由白色变为黑色
C.固体颜色变化但质量不变
D.固体逐渐增多,但颜色不变
√
解析 ZnS和CuS的阴、阳离子个数比为1∶1,且Ksp(ZnS)>Ksp(CuS),可得ZnS的溶解度大于CuS的溶解度,因此在ZnS饱和溶液中加CuSO4,会使ZnS沉淀转化生成黑色的CuS。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 除杂与沉淀剂的选择
3.某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,为了除去FeCl3杂质,需将溶液调至pH=4。在调节溶液pH时,应选用的试剂是
A.NaOH
B.ZnO
C.ZnSO4
D.Fe2O3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
解析 溶液中含有FeCl3杂质,将溶液调至pH=4,可使Fe3+水解生成Fe(OH)3沉淀而除去,注意不能引入新的杂质,可加入ZnO和酸反应调节溶液pH,使铁离子全部沉淀。
4.要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
化合物
PbSO4
PbSO3
PbS
溶解度/g
1.03×10-4
1.81×10-7
1.84×10-14
由上述数据可知,选用的沉淀剂最好为
A.硫化物
B.硫酸盐
C.碳酸盐
D.以上沉淀剂均可
√
解析 生成物的溶解度越小,沉淀反应越容易发生。要将Pb2+沉淀,就要形成溶解度更小的物质,由表中数据可知,PbS的溶解度最小,沉淀剂最好为硫化物。
5.实验室测定水体中氯离子的含量时,常使用AgNO3溶液滴定法,已知在25
℃时几种银盐的Ksp和颜色如下表:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
难溶盐
AgCl
AgBr
AgI
Ag2CrO4
Ag2CO3
Ksp
1.8×10-10
5.4×10-13
8.5×10-17
2.0×10-12
8.1×10-12
颜色
白色
淡黄色
黄色
砖红色
白色
可用作滴定Cl-指示剂的是
A.K2CrO4
B.Na2CO3
C.NaBr
D.NaI
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 测定水体中的Cl-,选用AgNO3溶液滴定,当Cl-消耗完后,Ag+应与指示剂反应,生成一种有色的沉淀。则选择的指示剂的阴离子应在Cl-后面沉淀,显然不能选择NaBr和NaI,另外Ag2CO3为白色沉淀,无法与AgCl沉淀区分开来。故只能选择K2CrO4,当Ag+浓度相同时,Cl-在
之前沉淀,设两者达到沉淀溶解平衡时,溶液中c(Ag+)=x
mol·L-1,AgCl:x2=1.8×10-10,x≈1.34×10-5
mol·L-1;Ag2CrO4:
=2.0×10-12,x≈1.59×10-4
mol·L-1,由此可知
沉淀时需要的Ag+浓度更大。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组三 用沉淀平衡原理解释实际问题
6.可溶性钡盐有毒,医院中常用无毒硫酸钡作为内服“钡餐”造影剂。医院抢救钡离子中毒者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。已知:某温度下,Ksp(BaCO3)=2.6×10-9;Ksp(BaSO4)=1.1×10-10。下列推断正确的是
A.不用碳酸钡作为内服造影剂,是因为碳酸钡比硫酸钡更难溶
B.可以用0.36
mol·L-1的Na2SO4溶液给钡离子中毒者洗胃
C.抢救钡离子中毒者时,若没有硫酸钠也可以用碳酸钠溶液代替
D.误饮c(Ba2+)=1.0×10-5
mol·L-1的溶液时,会引起钡离子中毒
√
解析 碳酸钡能与胃酸反应生成可溶性钡盐,钡离子有毒,所以不能用碳酸钡作为内服造影剂,A错误;
碳酸钡与胃酸反应转化为可溶性钡盐,起不到解毒的作用,C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
7.常温下,以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等,通过添加过量的难溶电解质MnS,可使这些金属离子形成硫化物沉淀并过滤除去,下列说法正确的是
A.过滤后的溶液中一定没有S2-
B.MnS难溶于水,可溶于MnCl2溶液中
C.常温时,CuS、PbS、CdS比MnS更难溶
D.加入MnS后生成CuS的离子方程式是Cu2++S2-===CuS↓
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 难溶不是不溶,只是溶解度很小,故A错误;
MnS难溶于水也难溶于MnCl2溶液,故B错误;
通过添加过量的难溶电解质MnS,除去Cu2+、Pb2+、Cd2+等离子,是沉淀转化的原理,故C正确;
沉淀转化的离子方程式为Cu2++MnS(s)
CuS(s)+Mn2+,故D错误。
8.(2020·南京联考)工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+,Cu2++MnS(s)
CuS(s)+Mn2+。下列说法错误的是
A.该反应平衡时c(Mn2+)=c(Cu2+)
B.MnS的Ksp大于CuS的Ksp
C.向平衡体系中加入少量CuSO4固体后,c(Mn2+)增大
D.该反应的平衡常数K=
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
9.向紫色Cr2(SO4)3的水溶液中加入NaOH溶液,当pH=4.6时,开始出现Cr(OH)3灰绿色沉淀,随着pH的升高,沉淀增多;但当pH>13时,沉淀消失,出现亮绿色的亚铬酸根离子(
),其平衡关系如下:
Cr3++3OH-
Cr(OH)3
+H++H2O
(紫色)
(灰绿色)
(亮绿色)
向50
mL
0.05
mol·L-1Cr2(SO4)3溶液中加入1.0
mol·L-1NaOH溶液50
mL,充分反应后,溶液中可观察到的现象是
A.溶液为紫色
B.溶液中有灰绿色沉淀
C.溶液为亮绿色
D.无法判断
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
综合强化
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是
A.T1>T2
B.加入BaCl2固体,可使溶液由a点变到c点
C.c点时,在T1、T2两个温度下均有固体析出
D.a点和b点的Ksp相等
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
解析 因为硫酸钡在水中溶解时吸收热量,则温度升高硫酸钡的Ksp增大,T2时硫酸钡的Ksp大于T1时硫酸钡的Ksp,故T2>T1,A错误;
硫酸钡溶液中存在着沉淀溶解平衡,a点在平衡曲
线上,加入BaCl2,c(Ba2+)增大,平衡左移,c(
)应降低,所以不能使溶液由a点变到c点,B错误;
Ksp是常数,温度不变,Ksp不变,同一温度下,在曲线上的任意一点Ksp都相等,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.常温下,Ag2S与CuS在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是
A.Ksp(Ag2S)=10-29.2
B.向含CuS沉淀的悬浊液中加入Na2S
饱和溶液,Ksp(CuS)减小
C.若Z点为Ag2S的分散系,v(沉淀)>
v(溶解)
D.CuS(s)+2Ag+
Ag2S(s)+Cu2+
平衡常数很大,反应趋于完全
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 A项,图像X(20,9.2),即c(Ag+)=10-20
mol·L-1,c(S2-)=10-9.2
mol·L-1,Ksp(Ag2S)=c2(Ag+)·c(S2-)=10-49.2,错误;
B项,Ksp(CuS)的大小只与温度有关,错误;
C项,若Z点为Ag2S的分散系,是不饱和溶液,v(沉淀)<v(溶解),错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.(2020·郑州高二检测)25
℃时有关物质的颜色和溶度积(Ksp)如下表:
物质
AgCl
AgBr
AgI
Ag2S
颜色
白
淡黄
黄
黑
Ksp
1.8×10-10
5.4×10-13
8.5×10-17
1.8×10-50
下列叙述中不正确的是
A.向AgCl的白色悬浊液中加入0.1
mol·L-1
KI溶液,有黄色沉淀产生
B.25
℃时,AgCl、AgBr、AgI、Ag2S饱和水溶液中Ag+的浓度相同
C.25
℃,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同
D.在5
mL
1.8×10-6
mol·L-1
NaCl溶液中,加入1滴(20滴约为1
mL)1×
10-3
mol·L-1
AgNO3溶液,不能产生白色沉淀
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 由Ksp(AgCl)>Ksp(AgI)可知A项正确;
由四种物质的溶度积常数计算可知,其饱和水溶液中c(Ag+)的大小关系为AgCl>AgBr>AgI>Ag2S,B项错误;
由于溶度积常数只是温度的函数,温度不变其值不变,C项正确;
加入一滴硝酸银溶液后c(Cl-)可认为保持不变,即c(Cl-)=1.8×10-6
mol·L-1,而AgNO3溶液相当于稀释100倍,故c(Ag+)=1×10-5
mol·L-1,c(Cl-)·c(Ag+)=1.8×10-11<Ksp(AgCl),故没有沉淀生成,D项正确。
13.已知常温下,Ksp(AgBr)=4.9×10-13、Ksp(AgI)=8.3×10-17。
(1)现向含有AgI的饱和溶液中:
①加入固体AgNO3,则c(I-)________(填“变大”“变小”或“不变”,下同);
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
变小
解析 加入AgNO3固体,使c(Ag+)增大,AgI溶解平衡向左移动,c(I-)减小。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
②若改加更多的AgI固体,则c(Ag+)______;
不变
解析 改加更多的AgI固体,仍是该温度下的饱和溶液,各离子浓度不变。
③若改加AgBr固体,则c(I-)______,而c(Ag+)______。
变小
变大
解析 因AgBr的溶解度大于AgI的溶解度,所以改加AgBr固体时,使c(Ag+)变大,而使AgI的溶解平衡向生成AgI的方向移动,c(I-)变小。
(2)现向含有NaBr、KI均为0.002
mol·L-1的溶液中加入等体积浓度为4×10-3
mol·L-1的AgNO3溶液,则产生的沉淀是_____________(填化学式);若向其中再加入适量的NaI固体,则最终可发生沉淀转化的总反应式表示为_________________________。
AgI、AgBr
解析 等体积混合后c(Br-)=c(I-)=0.001
mol·L-1,c(Ag+)=2×
10-3
mol·L-1。因Ksp(AgI)
mol·L-1-0.001
mol·L-1=0.001
mol·L-1,c(Ag+)·c(Br-)=0.001×0.001=1×10-6
>4.9×10-13,所以有AgBr沉淀生成;若再向其中加入适量NaI固体时,会有AgBr转化为AgI。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.已知25
℃:
难溶电解质
CaCO3
CaSO4
MgCO3
Ksp
2.8×10-9
9.1×10-6
6.8×10-6
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,实验步骤如下:
①向100
mL
0.1
mol·L-1的CaCl2溶液中加入100
mL
0.1
mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入3
g
Na2CO3固体,搅拌,静置沉淀后弃去上层清液。
③再加入蒸馏水搅拌,静置后再弃去上层清液。
④____________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)由题中信息知Ksp越大,表示电解质的溶解度越____(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式:____________________________
_________。
(3)设计第③步的目的是______________________。
(4)请补充第④步操作及发生的现象:_____________________________
_______________________________。
(5)请写出该原理在实际生活、生产中的一个应用:________________
________________________________。
大
Na2CO3+CaSO4(s)
CaCO3(s)
+Na2SO4
向沉淀中加入足量的盐酸,沉淀
完全溶解,并放出无色无味的气体
将锅炉水垢中的
CaSO4转化为CaCO3,再用盐酸除去
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 Ksp越大,表示电解质的溶解度越大,溶解度大的沉淀会向溶解度小的沉淀转化,要证明CaSO4完全转化为CaCO3,可以加入盐酸,因为CaSO4不和盐酸反应,而CaCO3可完全溶于盐酸。在实际生活、生产中利用此反应可以将锅炉水垢中的CaSO4转化为CaCO3再用盐酸除去。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
15.难溶电解质在水溶液中存在着沉淀溶解平衡。
已知:某温度下,Cu(OH)2(s)
Cu2++2OH-,Ksp[Cu(OH)2]=2×10-20
Fe(OH)3(s)
Fe3++3OH-,Ksp[Fe(OH)3]=8×10-38
某CuSO4溶液中含有Fe3+杂质,溶液中CuSO4的浓度为2.0
mol·L-1,
通常认为残留在溶液中的离子浓度小于1×10-5
mol·L-1时即沉淀完全,则:
(1)该溶液中的Fe3+刚好沉淀完全时溶液的pH约为
____。
3.3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)该溶液中的Cu2+开始形成Cu(OH)2沉淀时的pH约为_____。
4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)若将该溶液的pH调至3.5,_____(填“是”或“否”)可以达到除去Fe3+杂质而不损失Cu2+的目的。
(注:lg
2≈0.3,lg
5≈0.7)
是
解析 Fe3+刚好沉淀完全时溶液的pH为3.3,Cu2+开始形成沉淀时的pH为4,溶液的pH调至3.5时Fe3+已经沉淀完全,Cu2+还未沉淀,可以达到除去Fe3+杂质而不损失Cu2+的目的。
返回
本课结束
