高中化学苏教版(2019)选择性必修1 专题3 水溶液中的离子反应 阶段重点突破练(六)(41张PPT)
文档属性
| 名称 | 高中化学苏教版(2019)选择性必修1 专题3 水溶液中的离子反应 阶段重点突破练(六)(41张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-05 20:35:47 | ||
图片预览








文档简介
(共41张PPT)
阶段重点突破练(六)
一、盐类水解的影响因素及应用
1.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO说法正确的是
A.电离程度:HCN>HClO
B.pH:HClO>HCN
C.与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(CN-)<c(ClO-)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 NaCN和NaClO都为强碱弱酸盐,相同物质的量浓度时NaCN溶液的pH较大,说明CN-水解的程度大,因此HCN比HClO的酸性更弱,电离程度:HCN<HClO,A项错误;
pH:HClO<HCN,B项错误;
由于都是一元酸,与NaOH完全反应时,消耗NaOH的物质的量相同,C项错误;
同浓度的HCN和HClO,酸性HCN<HClO,c(CN-)<c(ClO-),D项正确。
15
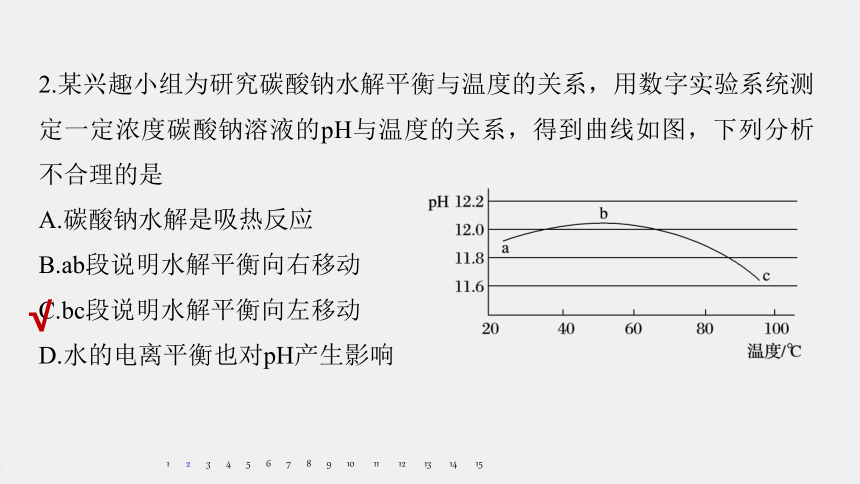
2.某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是
A.碳酸钠水解是吸热反应
B.ab段说明水解平衡向右移动
C.bc段说明水解平衡向左移动
D.水的电离平衡也对pH产生影响
1
2
3
4
5
6
7
8
9
10
11
12
13
√
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
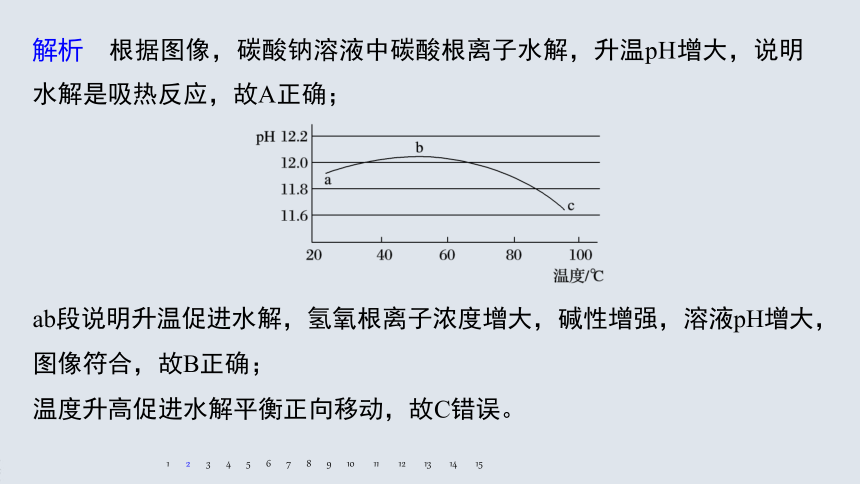
解析 根据图像,碳酸钠溶液中碳酸根离子水解,升温pH增大,说明水解是吸热反应,故A正确;
ab段说明升温促进水解,氢氧根离子浓度增大,碱性增强,溶液pH增大,图像符合,故B正确;
温度升高促进水解平衡正向移动,故C错误。
15
3.下列事实:①Na2HPO4水溶液呈碱性;②NaHSO4水溶液呈酸性;③NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂;④铵态氮肥不能与草木灰一起施用;⑤FeCl3的止血作用;⑥配制SnCl2溶液时加入盐酸;⑦NH4F溶液不能用玻璃瓶盛放;⑧MgCl2溶液中的FeCl3杂质可以加入过量的MgCO3除去。其中与盐类的水解有关的是
A.全部
B.除②⑤以外
C.除②⑦以外
D.除③⑧以外
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
15
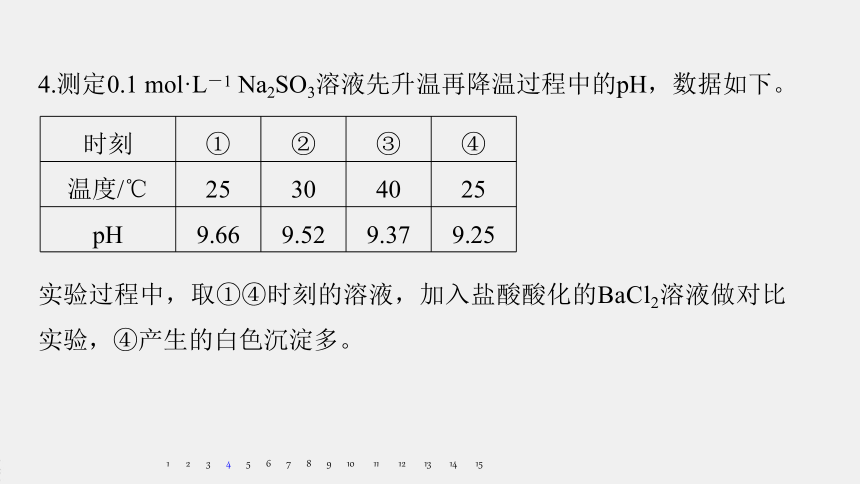
4.测定0.1
mol·L-1
Na2SO3溶液先升温再降温过程中的pH,数据如下。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生的白色沉淀多。
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
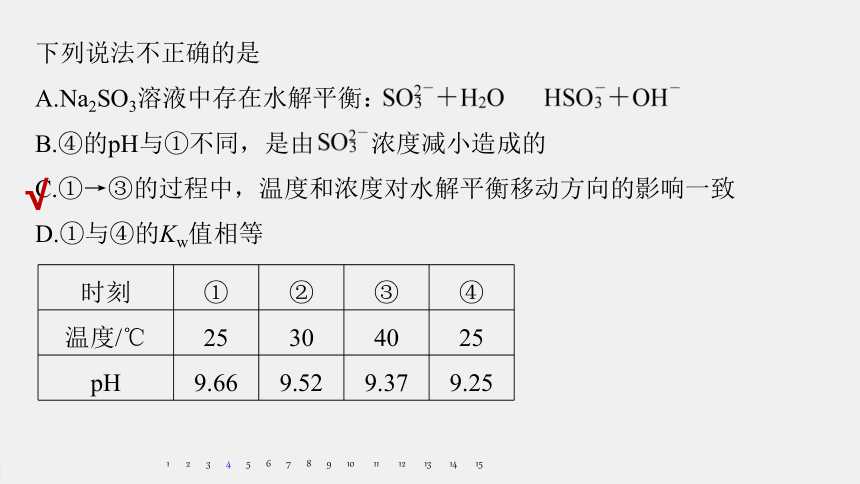
下列说法不正确的是
A.Na2SO3溶液中存在水解平衡:
B.④的pH与①不同,是由
浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的Kw值相等
时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
√
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
Kw只与温度有关,D对。
15
5.(2020·杭州高二质检)已知NH3·H2O为弱碱,下列实验事实能证明HA为弱酸的是
A.浓度为0.1
mol·L-1
HA的导电性比浓度为0.1
mol·L-1硫酸的导电性弱
B.0.1
mol·L-1
NH4A溶液的pH等于7
C.0.1
mol·L-1
HA溶液能使甲基橙变红色
D.等物质的量浓度的NaA和HA混合溶液pH小于7
1
2
3
4
5
6
7
8
9
10
11
12
13
√
14
15
二、离子浓度大小比较
6.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
因两物质是等体积、等物质的量浓度混合,钠与碳应是恒等关系,而发生反应时,钠与碳以1∶1的比例析出,故滤液中的钠与碳仍应恒等,B正确;
15
7.(八省联考·河北,9)醋酸为一元弱酸,25
℃时,其电离常数Ka=1.75×10-5。下列说法错误的是
A.0.1
mol·L-1
CH3COOH溶液的pH在2~3范围内
B.CH3COONa溶液中,c(CH3COOH)+c(H+)=c(OH-)
C.将0.1
mol·L-1
CH3COOH溶液加水稀释,其电离常数和
均不变
D.等体积的0.1
mol·L-1
NaOH溶液和0.1
mol·L-1
CH3COOH溶液混合后,
溶液pH>7,且c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
1
2
3
4
5
6
7
8
9
10
11
12
13
√
14
15
由CH3COONa溶液中质子守恒得:c(CH3COOH)+c(H+)=c(OH-),B项正确;
溶液混合后溶质为CH3COONa,pH>7,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.(2020·浙江7月选考,23)常温下,用0.1
mol·L-1的氨水滴定10
mL浓度均为0.1
mol·L-1的HCl和CH3COOH的混合液,下列说法不正确的是
A.在氨水滴定前,HCl和CH3COOH的混合液中c(Cl-)>c(CH3COO-)
B.当滴入氨水10
mL时,c(
)+c(NH3·H2O)=c(CH3COO-)+
c(CH3COOH)
C.当滴入氨水20
mL时,c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH-)
D.当溶液呈中性时,氨水滴入量大于20
mL,c(
)<c(Cl-)
1
2
3
4
5
6
7
8
9
10
11
12
13
√
14
15
解析 HCl是强酸,CH3COOH是弱酸,浓度均为0.1
mol·L-1时,c(Cl-)>c(CH3COO-),A正确;
滴入10
mL氨水时,NH3·H2O和CH3COOH的物质的量相等,据物料守恒可得c(
)+c(NH3·H2O)=c(CH3COO-)+c(CH3COOH),B正确;
滴入20
mL氨水时,恰好完全反应,所得溶液为等浓度的NH4Cl和CH3COONH4的混合溶液,据电荷守恒可知c(
)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-),据物料守恒可得c(
)+c(NH3·H2O)=c(CH3COOH)+c(CH3COO-)+c(Cl-),联立两式可得c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH-),C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
三、根据图像分析粒子浓度关系
9.(2020·无锡高二月考)常温下,向浓度均为0.1
mol·L-1、体积均为100
mL
的两种一元酸HX、HY的溶液中,分别加入NaOH
固体,lg?
随
加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是
A.HX的酸性弱于HY
B.c点溶液中:c(Y-)C.a点由水电离出的c(H+)=10-12
mol·L-1
D.b点溶液中粒子浓度大小关系为c(Y-)+c(HY)=c(Na+)+0.02
mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
b点lg?
=0,则溶液中c(H+)=c(OH-)=10-7
mol·L-1,此时消耗
的NaOH为0.008
mol,c(Na+)=0.08
mol·L-1,根据物料守恒,c(Y-)+c(HY)=0.1
mol·L-1,因此c(Y-)+c(HY)=c(Na+)+0.02
mol·L-1,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10.(2020·南昌二中高二期末)常温下,向10
mL
0.1
mol·L-1的某一元酸HR溶液中逐滴加入0.1
mol·L-1氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是
A.a→b导电能力增强说明HR为弱酸
B.a、b点所示溶液中水的电离程度不相同
C.b点恰好完全中和,pH=7说明NH4R没有
水解
D.c点溶液存在c(
)>c(R-)、c(OH-)>c(H+)
√
15
解析 a→b导电能力增强,说明反应后溶液中离子浓度增大,也证明HR在溶液中部分电离,为弱酸,故A正确;
a、b点所示溶液中一元酸HR电离的氢离子浓度不同,对水的电离的抑制程度不同,因此水的电离程度不同,故B正确;
NH4R为弱酸弱碱盐,NH4R溶液的pH=7,说明铵根离子和R-的水解程度相等,故C错误;
根据图像可知,c点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(
)>c(R-),故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.常温时,向25
mL
0.1
mol·L-1
NaOH溶液中逐滴加入0.2
mol·L-1醋酸溶液,曲线如图所示。有关粒子浓度大小关系的比较正确的是
A.在A、B间任一点(不包含A、B两点),溶液中
一定有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有:c(Na+)=c(CH3COO-)=
c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 A点附近,加入少量醋酸时,可以出现c(Na+)>c(OH-)>c(CH3COO-)>c(H+);由题可知当醋酸溶液体积为12.5
mL时恰好完全反应生成CH3COONa,溶液显碱性,B点为中性点,所以a>12.5,c(Na+)=c(CH3COO-)>c(OH-)=c(H+),D点可理解为CH3COOH和CH3COONa两种溶质物质的量相同,所以c(CH3COO-)+c(CH3COOH)=2c(Na+)。
15
12.下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3两种溶液
中的c(Na+):②>①
B.0.1
mol·L-1某二元强碱弱酸盐NaHA溶液中:
c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.上图表示用0.1
mol·L-1
CH3COOH溶液滴定20
mL
0.1
mol·L-1
NaOH
溶液的滴定曲线,则pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+)
D.上图a点溶液中各离子浓度的关系:c(OH-)=c(H+)+c(CH3COO-)+
2c(CH3COOH)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 pH相等的钠盐中,弱酸根离子水解程度越大,钠盐浓度越小,则钠离子浓度越小,弱酸根离子水解程度:
>CH3COO-,则c(Na+):②<①,A错误;
根据物料守恒得c(Na+)=c(A2-)+c(HA-)+c(H2A),B错误;
常温下,pH=7时溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(Na+)=c(CH3COO-),C错误;
根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得c(Na+)=2c(CH3COO-)+2c(CH3COOH),所以得c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.(2020·苏州高三质检)常温下,将HCl气体通入1
L
浓度均为0.1
mol·L-1的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是
A.Ka(HB)的数量级为10-9
B.酸性的强弱顺序为HCl>HA>HB
C.当通入0.1
mol
HCl气体时:c(B-)>c(A-)
D.当混合溶液呈中性时:c(Na+)=c(Cl-)+
c(A-)+c(B-)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
即Ka(HB)<Ka(HA),所以酸性:HA>HB,向NaA和NaB的混合溶液中通入HCl后,溶液中存在HA、HB,则说明HCl酸性强于HA和HB,所以酸性强弱顺序为HCl>HA>HB,B正确;
原溶液中NaA和NaB均为0.1
mol,根据强酸制弱酸
原理,通入0.1
mol
HCl,H+先与B-反应,反应后溶液中溶质为0.1
mol
NaA、0.1
mol
NaCl、0.1
mol
HB,NaA完全电离,微弱水解,而HB部分电离,所以溶液中c(B-)<c(A-),C错误;
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
混合溶液的电荷守恒为c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),当溶液呈中性时,c(H+)=c(OH-),所以有c(Na+)=c(Cl-)+c(A-)+c(B-),D正确。
15
四、大题综合练
14.10
℃时,在烧杯中加入0.1
mol·L-1的NaHCO3溶液400
mL,加热,测得该溶液的pH发生如下变化:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
温度/℃
10
20
30
50
70
pH
8.3
8.4
8.5
8.9
9.4
(1)甲同学认为,该溶液的pH升高的原因是
的水解程度增大,故碱性增强,该反应的离子方程式为___________________________。
15
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
温度/℃
10
20
30
50
70
pH
8.3
8.4
8.5
8.9
9.4
大于
解析 乙同学根据NaHCO3受热易分解,认为受热时发生反应:2NaHCO3
Na2CO3+CO2↑+H2O,这样溶质变成Na2CO3,而pH增大,说明Na2CO3的水解程度大于NaHCO3的水解程度。
15
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10
℃后再测定溶液pH,若pH______(填“>”“<”或“=”,下同)8.3,说明甲正确;若pH______8.3,说明乙正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
温度/℃
10
20
30
50
70
pH
8.3
8.4
8.5
8.9
9.4
=
>
解析 若甲同学的观点正确,则当温度再恢复至10
℃时,pH应为8.3,若乙同学的观点正确,则当温度降回至10
℃时,则pH应大于8.3。
15
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断,实验装置如图,加热煮沸NaHCO3溶液,发现试管A中澄清石灰水变浑浊,说明______(填“甲”或“乙”)推测正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
乙
解析 根据A中澄清石灰水变浑浊,说明NaHCO3在加热煮沸时发生了分解反应生成了Na2CO3、CO2和水,证明乙同学观点正确。
15
(5)将一定体积0.1
mol·L-1的NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变);将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1。据此资料可以判断_____(填“甲”或“乙”)推测正确,原因是________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
乙
溶液冷却至室温后pH大于8.4,说明此实验过程中有新物质生成
15
15.已知25
℃时部分弱电解质的电离平衡常数如表所示,回答下列问题:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka=1.8×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka=3.0×10-8
(1)物质的量浓度均为0.1
mol·L-1的四种溶液:pH由小到大排列的顺序是____________(填字母)。
a.CH3COONa
b.Na2CO3
c.NaClO
d.NaHCO3
a<d<c<b
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)常温下,0.1
mol·L-1
CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)。
BD
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________
__________________________。
(4)25
℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=__________________(填准确数值)。
(5)25
℃时,将a
mol·L-1的醋酸与b
mol·L-1氢氧化钠等体积混合,反应
后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为________。
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka=1.8×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka=3.0×10-8
ClO-+
9.9×10-7
mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(6)标准状况下,将1.12
L
CO2通入100
mL
1
mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+________________。
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka=1.8×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka=3.0×10-8
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
本课结束
阶段重点突破练(六)
一、盐类水解的影响因素及应用
1.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO说法正确的是
A.电离程度:HCN>HClO
B.pH:HClO>HCN
C.与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(CN-)<c(ClO-)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 NaCN和NaClO都为强碱弱酸盐,相同物质的量浓度时NaCN溶液的pH较大,说明CN-水解的程度大,因此HCN比HClO的酸性更弱,电离程度:HCN<HClO,A项错误;
pH:HClO<HCN,B项错误;
由于都是一元酸,与NaOH完全反应时,消耗NaOH的物质的量相同,C项错误;
同浓度的HCN和HClO,酸性HCN<HClO,c(CN-)<c(ClO-),D项正确。
15
2.某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析不合理的是
A.碳酸钠水解是吸热反应
B.ab段说明水解平衡向右移动
C.bc段说明水解平衡向左移动
D.水的电离平衡也对pH产生影响
1
2
3
4
5
6
7
8
9
10
11
12
13
√
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 根据图像,碳酸钠溶液中碳酸根离子水解,升温pH增大,说明水解是吸热反应,故A正确;
ab段说明升温促进水解,氢氧根离子浓度增大,碱性增强,溶液pH增大,图像符合,故B正确;
温度升高促进水解平衡正向移动,故C错误。
15
3.下列事实:①Na2HPO4水溶液呈碱性;②NaHSO4水溶液呈酸性;③NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂;④铵态氮肥不能与草木灰一起施用;⑤FeCl3的止血作用;⑥配制SnCl2溶液时加入盐酸;⑦NH4F溶液不能用玻璃瓶盛放;⑧MgCl2溶液中的FeCl3杂质可以加入过量的MgCO3除去。其中与盐类的水解有关的是
A.全部
B.除②⑤以外
C.除②⑦以外
D.除③⑧以外
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
15
4.测定0.1
mol·L-1
Na2SO3溶液先升温再降温过程中的pH,数据如下。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生的白色沉淀多。
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
下列说法不正确的是
A.Na2SO3溶液中存在水解平衡:
B.④的pH与①不同,是由
浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的Kw值相等
时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
√
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
Kw只与温度有关,D对。
15
5.(2020·杭州高二质检)已知NH3·H2O为弱碱,下列实验事实能证明HA为弱酸的是
A.浓度为0.1
mol·L-1
HA的导电性比浓度为0.1
mol·L-1硫酸的导电性弱
B.0.1
mol·L-1
NH4A溶液的pH等于7
C.0.1
mol·L-1
HA溶液能使甲基橙变红色
D.等物质的量浓度的NaA和HA混合溶液pH小于7
1
2
3
4
5
6
7
8
9
10
11
12
13
√
14
15
二、离子浓度大小比较
6.常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
因两物质是等体积、等物质的量浓度混合,钠与碳应是恒等关系,而发生反应时,钠与碳以1∶1的比例析出,故滤液中的钠与碳仍应恒等,B正确;
15
7.(八省联考·河北,9)醋酸为一元弱酸,25
℃时,其电离常数Ka=1.75×10-5。下列说法错误的是
A.0.1
mol·L-1
CH3COOH溶液的pH在2~3范围内
B.CH3COONa溶液中,c(CH3COOH)+c(H+)=c(OH-)
C.将0.1
mol·L-1
CH3COOH溶液加水稀释,其电离常数和
均不变
D.等体积的0.1
mol·L-1
NaOH溶液和0.1
mol·L-1
CH3COOH溶液混合后,
溶液pH>7,且c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
1
2
3
4
5
6
7
8
9
10
11
12
13
√
14
15
由CH3COONa溶液中质子守恒得:c(CH3COOH)+c(H+)=c(OH-),B项正确;
溶液混合后溶质为CH3COONa,pH>7,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),D项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
8.(2020·浙江7月选考,23)常温下,用0.1
mol·L-1的氨水滴定10
mL浓度均为0.1
mol·L-1的HCl和CH3COOH的混合液,下列说法不正确的是
A.在氨水滴定前,HCl和CH3COOH的混合液中c(Cl-)>c(CH3COO-)
B.当滴入氨水10
mL时,c(
)+c(NH3·H2O)=c(CH3COO-)+
c(CH3COOH)
C.当滴入氨水20
mL时,c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH-)
D.当溶液呈中性时,氨水滴入量大于20
mL,c(
)<c(Cl-)
1
2
3
4
5
6
7
8
9
10
11
12
13
√
14
15
解析 HCl是强酸,CH3COOH是弱酸,浓度均为0.1
mol·L-1时,c(Cl-)>c(CH3COO-),A正确;
滴入10
mL氨水时,NH3·H2O和CH3COOH的物质的量相等,据物料守恒可得c(
)+c(NH3·H2O)=c(CH3COO-)+c(CH3COOH),B正确;
滴入20
mL氨水时,恰好完全反应,所得溶液为等浓度的NH4Cl和CH3COONH4的混合溶液,据电荷守恒可知c(
)+c(H+)=c(Cl-)+c(CH3COO-)+c(OH-),据物料守恒可得c(
)+c(NH3·H2O)=c(CH3COOH)+c(CH3COO-)+c(Cl-),联立两式可得c(CH3COOH)+c(H+)=c(NH3·H2O)+c(OH-),C正确;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
三、根据图像分析粒子浓度关系
9.(2020·无锡高二月考)常温下,向浓度均为0.1
mol·L-1、体积均为100
mL
的两种一元酸HX、HY的溶液中,分别加入NaOH
固体,lg?
随
加入NaOH的物质的量的变化如图所示(忽略加入NaOH固体导致溶液温度的变化)。下列叙述正确的是
A.HX的酸性弱于HY
B.c点溶液中:c(Y-)
mol·L-1
D.b点溶液中粒子浓度大小关系为c(Y-)+c(HY)=c(Na+)+0.02
mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
b点lg?
=0,则溶液中c(H+)=c(OH-)=10-7
mol·L-1,此时消耗
的NaOH为0.008
mol,c(Na+)=0.08
mol·L-1,根据物料守恒,c(Y-)+c(HY)=0.1
mol·L-1,因此c(Y-)+c(HY)=c(Na+)+0.02
mol·L-1,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
10.(2020·南昌二中高二期末)常温下,向10
mL
0.1
mol·L-1的某一元酸HR溶液中逐滴加入0.1
mol·L-1氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是
A.a→b导电能力增强说明HR为弱酸
B.a、b点所示溶液中水的电离程度不相同
C.b点恰好完全中和,pH=7说明NH4R没有
水解
D.c点溶液存在c(
)>c(R-)、c(OH-)>c(H+)
√
15
解析 a→b导电能力增强,说明反应后溶液中离子浓度增大,也证明HR在溶液中部分电离,为弱酸,故A正确;
a、b点所示溶液中一元酸HR电离的氢离子浓度不同,对水的电离的抑制程度不同,因此水的电离程度不同,故B正确;
NH4R为弱酸弱碱盐,NH4R溶液的pH=7,说明铵根离子和R-的水解程度相等,故C错误;
根据图像可知,c点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(
)>c(R-),故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.常温时,向25
mL
0.1
mol·L-1
NaOH溶液中逐滴加入0.2
mol·L-1醋酸溶液,曲线如图所示。有关粒子浓度大小关系的比较正确的是
A.在A、B间任一点(不包含A、B两点),溶液中
一定有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有:c(Na+)=c(CH3COO-)=
c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
解析 A点附近,加入少量醋酸时,可以出现c(Na+)>c(OH-)>c(CH3COO-)>c(H+);由题可知当醋酸溶液体积为12.5
mL时恰好完全反应生成CH3COONa,溶液显碱性,B点为中性点,所以a>12.5,c(Na+)=c(CH3COO-)>c(OH-)=c(H+),D点可理解为CH3COOH和CH3COONa两种溶质物质的量相同,所以c(CH3COO-)+c(CH3COOH)=2c(Na+)。
15
12.下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3两种溶液
中的c(Na+):②>①
B.0.1
mol·L-1某二元强碱弱酸盐NaHA溶液中:
c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.上图表示用0.1
mol·L-1
CH3COOH溶液滴定20
mL
0.1
mol·L-1
NaOH
溶液的滴定曲线,则pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+)
D.上图a点溶液中各离子浓度的关系:c(OH-)=c(H+)+c(CH3COO-)+
2c(CH3COOH)
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
解析 pH相等的钠盐中,弱酸根离子水解程度越大,钠盐浓度越小,则钠离子浓度越小,弱酸根离子水解程度:
>CH3COO-,则c(Na+):②<①,A错误;
根据物料守恒得c(Na+)=c(A2-)+c(HA-)+c(H2A),B错误;
常温下,pH=7时溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(Na+)=c(CH3COO-),C错误;
根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得c(Na+)=2c(CH3COO-)+2c(CH3COOH),所以得c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH),D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.(2020·苏州高三质检)常温下,将HCl气体通入1
L
浓度均为0.1
mol·L-1的NaA和NaB的混合溶液中,混合溶液的pH与离子浓度变化的关系如图所示(忽略溶液体积的变化)。下列叙述不正确的是
A.Ka(HB)的数量级为10-9
B.酸性的强弱顺序为HCl>HA>HB
C.当通入0.1
mol
HCl气体时:c(B-)>c(A-)
D.当混合溶液呈中性时:c(Na+)=c(Cl-)+
c(A-)+c(B-)
1
2
3
4
5
6
7
8
9
10
11
12
13
14
√
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
即Ka(HB)<Ka(HA),所以酸性:HA>HB,向NaA和NaB的混合溶液中通入HCl后,溶液中存在HA、HB,则说明HCl酸性强于HA和HB,所以酸性强弱顺序为HCl>HA>HB,B正确;
原溶液中NaA和NaB均为0.1
mol,根据强酸制弱酸
原理,通入0.1
mol
HCl,H+先与B-反应,反应后溶液中溶质为0.1
mol
NaA、0.1
mol
NaCl、0.1
mol
HB,NaA完全电离,微弱水解,而HB部分电离,所以溶液中c(B-)<c(A-),C错误;
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
混合溶液的电荷守恒为c(Na+)+c(H+)=c(Cl-)+c(A-)+c(B-)+c(OH-),当溶液呈中性时,c(H+)=c(OH-),所以有c(Na+)=c(Cl-)+c(A-)+c(B-),D正确。
15
四、大题综合练
14.10
℃时,在烧杯中加入0.1
mol·L-1的NaHCO3溶液400
mL,加热,测得该溶液的pH发生如下变化:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
温度/℃
10
20
30
50
70
pH
8.3
8.4
8.5
8.9
9.4
(1)甲同学认为,该溶液的pH升高的原因是
的水解程度增大,故碱性增强,该反应的离子方程式为___________________________。
15
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3的水解程度。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
温度/℃
10
20
30
50
70
pH
8.3
8.4
8.5
8.9
9.4
大于
解析 乙同学根据NaHCO3受热易分解,认为受热时发生反应:2NaHCO3
Na2CO3+CO2↑+H2O,这样溶质变成Na2CO3,而pH增大,说明Na2CO3的水解程度大于NaHCO3的水解程度。
15
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10
℃后再测定溶液pH,若pH______(填“>”“<”或“=”,下同)8.3,说明甲正确;若pH______8.3,说明乙正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
温度/℃
10
20
30
50
70
pH
8.3
8.4
8.5
8.9
9.4
=
>
解析 若甲同学的观点正确,则当温度再恢复至10
℃时,pH应为8.3,若乙同学的观点正确,则当温度降回至10
℃时,则pH应大于8.3。
15
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断,实验装置如图,加热煮沸NaHCO3溶液,发现试管A中澄清石灰水变浑浊,说明______(填“甲”或“乙”)推测正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
乙
解析 根据A中澄清石灰水变浑浊,说明NaHCO3在加热煮沸时发生了分解反应生成了Na2CO3、CO2和水,证明乙同学观点正确。
15
(5)将一定体积0.1
mol·L-1的NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变);将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1。据此资料可以判断_____(填“甲”或“乙”)推测正确,原因是________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
乙
溶液冷却至室温后pH大于8.4,说明此实验过程中有新物质生成
15
15.已知25
℃时部分弱电解质的电离平衡常数如表所示,回答下列问题:
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka=1.8×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka=3.0×10-8
(1)物质的量浓度均为0.1
mol·L-1的四种溶液:pH由小到大排列的顺序是____________(填字母)。
a.CH3COONa
b.Na2CO3
c.NaClO
d.NaHCO3
a<d<c<b
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)常温下,0.1
mol·L-1
CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)。
BD
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________
__________________________。
(4)25
℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=__________________(填准确数值)。
(5)25
℃时,将a
mol·L-1的醋酸与b
mol·L-1氢氧化钠等体积混合,反应
后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为________。
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka=1.8×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka=3.0×10-8
ClO-+
9.9×10-7
mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(6)标准状况下,将1.12
L
CO2通入100
mL
1
mol·L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:c(OH-)=2c(H2CO3)+________________。
化学式
CH3COOH
H2CO3
HClO
电离平衡常数
Ka=1.8×10-5
Ka1=4.3×10-7
Ka2=5.6×10-11
Ka=3.0×10-8
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
本课结束
