北京市师大附高实验高中2020-2021学年高一下学期期中考试化学试题(A卷) Word版含答案
文档属性
| 名称 | 北京市师大附高实验高中2020-2021学年高一下学期期中考试化学试题(A卷) Word版含答案 |  | |
| 格式 | doc | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-06 10:37:03 | ||
图片预览




文档简介
北师大附属实验中学2020-2021学年度第二学期
高一年级化学期中测试A卷
可能用到的相对原子质量:H-1
C-12
N-14
O-16
Na-23
Cl-35.5
第Ⅰ部分选择题(共50分)
每小题2分。在每小题给出的四个选项中,选出最符合题目要求的一项。
1.
2020年10月,我国大飞机C919亮相飞行大会。下列关于C919飞机所用的材料中,主要成分属于金属材料的是
A.
风挡——玻璃
B.
轮胎——橡胶
C.
尾翼主盒——碳纤维
D.
座椅滑轨——铝锂合金
2.
当光束通过下列分散系时,能观察到丁达尔效应的是
A.
NaCl溶液
B.
蔗糖溶液
C.
CuSO4溶液
D.
Fe(OH)3胶体
3.
常温下,下列溶液可用铁质容器盛装的是
A.
稀硝酸
B.
稀硫酸
C.
浓硝酸
D.
浓盐酸
4.
下列气体中,与酸雨密切相关的是
A.
N2
B.
CO2
C.
SO2
D.
CO
5.
下列物质中,既含有氨分子,又含有铵根离子是
A.
氨气
B.
氨水
C.
硝酸
D.
硝酸钾
6.
下列物质的电子式书写正确的是(
)
A.
B.
C.
D.
7.
某元素的原子结构示意图为
,下列关于该元素的说法中,不正确的是
A.
元素符号是S
B.
属于短周期元素
C.
非金属性比氧的强
D.
最高正化合价是+6价
8.
下列元素中,原子半径最大的是
A.
Li
B.
Na
C.
F
D.
S
9.
下列金属中,通常用电解法冶炼的是
A.
Na
B.
Fe
C.
Hg
D.
Ag
10.
(Ac的中文名“锕”)是一种医用放射性同位素,在治疗癌症方面有重大作用。下列关于的说法中,正确的是
A.
质子数为225
B.
中子数为89
C.
核外电子数为136
D.
质子数与中子数之和为225
11.
下列关于化学反应与能量的说法中,不正确的是
A.
Mg与盐酸的反应属于放热反应
B.
能量变化是化学反应的基本特征之一
C.
Ba(OH)2·8H2O与NH4Cl的反应属于放热反应
D.
反应物的总能量低于生成物的总能量,反应时从环境吸收能量
12.
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是(
)
A.
浓硫酸与水
B.
生石灰与水
C.
熟石灰与水
D.
氯化钠与水
13.
下列离子方程式中,正确的是
A.
向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO=BaSO4↓+H2O
B.
NH4HCO3溶液与过量KOH浓溶液共热:NH+OH-NH3↑+H2O
C.
稀硝酸和过量的铁屑反应:3Fe+8H++2NO=3Fe3++2NO↑+4H2O
D.
小苏打(NaHCO3)治疗胃酸过多:HCO+H+=CO2↑+H2O
14.
汽车尾气催化转化装置的工作原理如图所示。
下列说法中,不正确的是
A.
汽车尾气中含有的CO和NO是大气污染物
B.
使用催化转化装置可减少汽车尾气对大气的污染
C.
该过程中碳元素只被氧化,氮元素只被氧化
D.
该过程中会发生反应:2NO2+4CO4CO2+N2
15.
部分短周期元素的原子半径及主要化合价如下,根据表中信息,判断以下叙述正确的是
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.
143
0.112
0.
104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.
氢化物的稳定性为H2TB.
单质与稀盐酸反应的剧烈程度为LC.
M与T形成的化合物具有两性
D.
L2+与R2-的核外电子数相等
16.
下列事实不能用元素周期律知识解释的是
A.
氧化性:Cl2>Br2
B.
稳定性:HC1>H2S
C.
酸性:H2SO4>H2S03
D.
碱性:NaOH>Mg
(
OH)
2
17.
我国研发一款拥有自主知识产权的超薄铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第五周期第ⅠA族元素,下列关于37Rb的说法正确的是
A.
与同周期元素53I的原子半径比:Rb>I
B.
中子数为50的Rb的核素:Rb
C.
元素的金属性:K>Rb
D.
最高价氧化物对应的水化物的碱性:KOH>RbOH
18.
关于中和热测定的说法错误的是
A.
在测定中和热实验中需要使用的仪器有天平、量筒、烧杯、温度计
B.
盐酸与某强碱中和放出的热量随反应物的用量改变而改变,但中和热不变
C.
NaOH稍过量可以保证盐酸完全被NaOH中和
D.
测定结果准确与否的关键是尽量减小热量损失及准确读取混合溶液的最高温度等
19.
如图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是
A.
拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共放出1368kJ能量
B.
由H、O原子形成2molH2O(g),共吸收1852kJ能量
C.
2molH2(g)和1molO2(g)反应生成2molH2O(l),共放出484kJ能量
D.
2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量
20
已知:(1)Zn(s)
+O2(g)=
ZnO(s),
△H=-348.3
kJ/mol
(2)
2Ag(s)+O2(g)=
Ag2O
(s),△H=
-31.0
kJ/moL
则ZnO(s)+2Ag(s)=
Zn(s)
+Ag2O(s)的△H等于
A.
-317.3
kJ/mol
B.
317.3
kJ/mol
C.
-332.8
kJ/mol
D.
-379.3
kJ/mol
21.
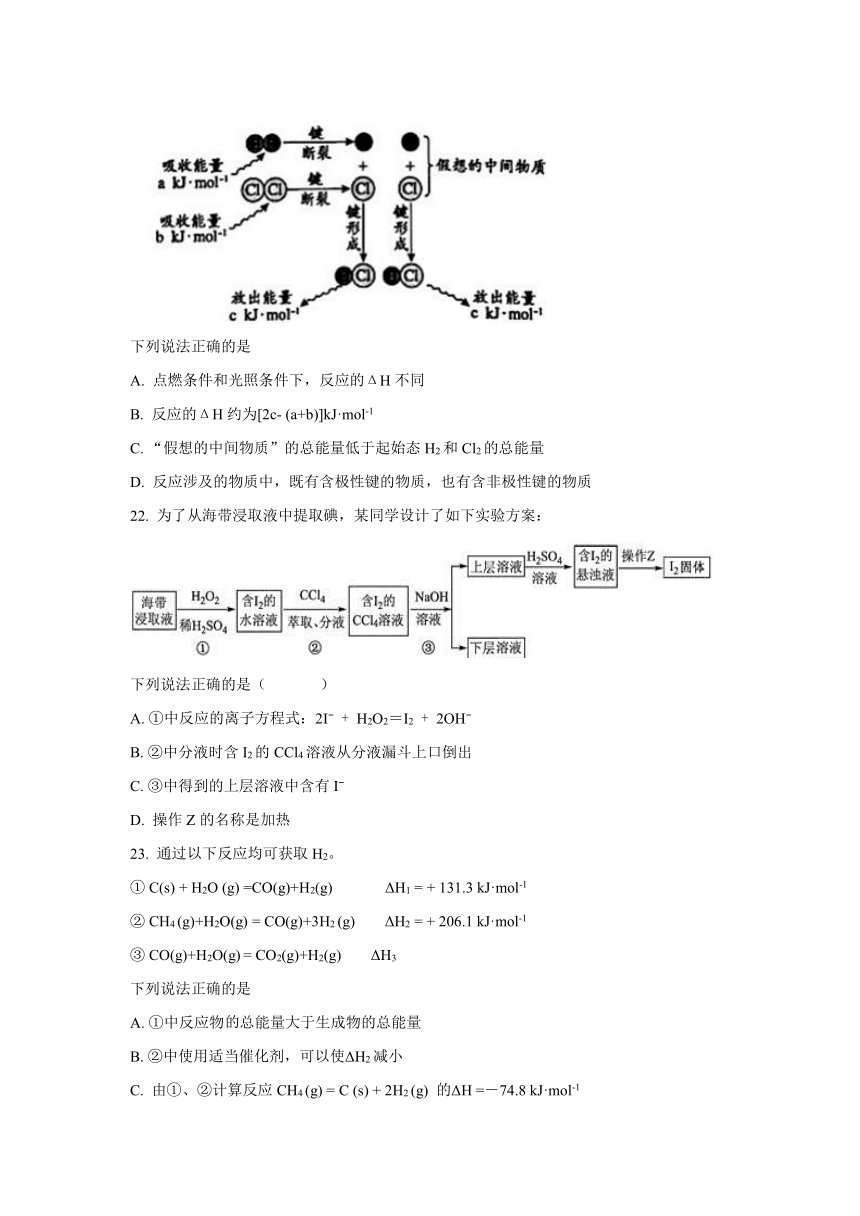
已知:H2(g)+Cl2(g)
2HCl(g)反应的能量变化示意图如下:
下列说法正确的是
A.
点燃条件和光照条件下,反应的ΔH不同
B.
反应的ΔH约为[2c-
(a+b)]kJ·mol-1
C.
“假想的中间物质”的总能量低于起始态H2和Cl2的总能量
D.
反应涉及的物质中,既有含极性键的物质,也有含非极性键的物质
22.
为了从海带浸取液中提取碘,某同学设计了如下实验方案:
下列说法正确的是(???
)
A.
①中反应的离子方程式:2I?
+
H2O2=I2
+
2OH?
B.
②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C.
③中得到的上层溶液中含有I?
D.
操作Z的名称是加热
23.
通过以下反应均可获取H2。
①
C(s)
+
H2O
(g)
=CO(g)+H2(g)
ΔH1
=
+
131.3
kJ·mol-1
②
CH4
(g)+H2O(g)
=
CO(g)+3H2
(g)
ΔH2
=
+
206.1
kJ·mol-1
③
CO(g)+H2O(g)
=
CO2(g)+H2(g)
ΔH3
下列说法正确的是
A.
①中反应物总能量大于生成物的总能量
B.
②中使用适当催化剂,可以使ΔH2减小
C.
由①、②计算反应CH4
(g)
=
C
(s)
+
2H2
(g)
的ΔH
=-74.8
kJ·mol-1
D.
若知反应C
(s)
+
CO2
(g)
=
2CO
(g)
的ΔH,结合ΔH1可计算出ΔH3
24.
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体
A.
可能是N2与NO2的混和气体
B.
可能是O2与NO2的混和气体
C.
可能是NO气体
D.
只可能是NO2一种气体
25.
某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号
Ⅰ
Ⅱ
Ⅲ
实验步骤
充分振荡,加2mL蒸馏水
充分振荡,加2mL蒸馏水
充分振荡,加2mL蒸馏水
实验现象
铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是
A.
实验Ⅰ、Ⅱ、Ⅲ中均涉及到Fe3+被还原
B.
对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.
实验Ⅰ、Ⅲ中加入蒸馏水后c(Cu2+)相同
D.
向实验Ⅲ反应后溶液中加入饱和NaCl溶液可能出现白色沉淀
第Ⅱ部分非选择题(共50分)
26.
溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如图:
(1)Cl2和苦卤中的Br-反应生成Br2的离子方程式是___。
(2)吸收塔中,A吸收了Br2后的溶液中含有Br-和BrO,则A是___(填序号)。
a.NaCl溶液
b.Na2CO3溶液
c.SO2气体
(3)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是___。
27.
元素周期表在学习、研究中有很重要的作用,如表是元素周期表中的短周期元素部分。
(1)e的原子结构示意图是___,该元素单质可应用于___(填序号,下同)。
①光导纤维
②半导体材料
③陶瓷材料
(2)f、g的最高价氧化物对应的水化物中,酸性较强的物质是___(写化学式)。
(3)下列事实能判断a和b的非金属性强弱的是___。
①氢化物的稳定性强弱
②相同温度下,氢化物的溶解度大小
③最高价氧化物对应的水化物的酸性强弱
(4)c、d单质更容易与水反应的为___(写化学式),请从原子结构角度解释其原因:___。
(5)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。50Sn在元素周期表中的位置是___,以下说法中正确的是___。
①Sn元素的最高正化合价为+4
②Sn的原子半径比e大
③SnF2只具有氧化性
28.
某化学实验小组同学利用图1装置制备氨气,并探究氨气的性质(部分仪器已略去)。
(1)实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为____。
(2)干燥NH3应选用的干燥剂是____(填序号)。
①浓H2SO4②碱石灰
③P2O5
(3)收集氨气时,请你选择氨气的进气口____(填“a”或“b”)。
(4)图2装置(盛放的液体均为水)可用于吸收多余氨气的是____(填序号)。
(5)图3为合成氨催化氧化制硝酸的流程示意图:
共价键
N≡N
H—H
N—H
断开1mol共价键所需能量(kJ)
946
436
391
①结合表中数据进行估算,写出工业合成氨反应的热化学方程式:____。
②氧化炉中的化学方程式____。
③吸收塔NO2HNO3氧化剂与还原剂物质的量之比为____。
29.
稀土是一种重要的战略资源,我国稀土出口量世界第一。铈(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为CeCO3F)形式存在。工业上利用氟碳铈矿制取CeO2的一种工艺流程如图:
资料:①铈(Ce)常见的化合价为+3和+4;
②在O2作用下,氟碳铈矿焙烧后的产物中有CeO2和CeF4;
③在硫酸体系中,Ce4+在[(HA)2]中的溶解度大于其在水中的溶解度,Ce3+与之相反。
回答下列问题:
(1)步骤Ⅰ“焙烧”过程中CeCO3F发生反应的化学方程式为____。
(2)步骤Ⅱ充分反应后经过滤,得到的水溶液中阳离子有____。
(3)步骤Ⅲ的操作名称是____。
(4)步骤Ⅳ中加入H2O2的目的是____。
(5)步骤Ⅴ中发生反应的离子方程式是____。
(6)取上述流程中得到的CeO2产品加硫酸溶解,可与50.0mL0.1mol/LFeSO4溶液恰好完全反应(铈元素被还原为Ce3+,其他杂质均不参与反应),该产品中CeO2的质量分数为____。(已知:CeO2的摩尔质量为172g/mol)
30.
研究金属与稀硝酸的反应,实验如下。
序号
实验试剂(20℃)
实验现象
Ⅰ
过量铜粉、2mL0.5mol/LHNO3
无色气体(遇空气变红棕色),溶液变为蓝色
Ⅱ
过量铁粉、2mL0.5mol/LHNO3
6mL无色气体(经检测为H2),溶液几乎无色
(1)Ⅰ中的无色气体是___。
(2)Ⅱ中生成H2离子方程式是___。
(3)研究Ⅱ中的氧化剂。
①甲同学通过理论分析,认为NO也能被还原。其依据是___。
②乙认为该浓度的硝酸中H+的氧化性大于NO,所以NO没有发生反应。根据Ⅰ和Ⅱ,丙同学认为乙的说法不正确。其理由是___。
③丙同学通过实验证实了反应后的溶液中含有NH。生成NH的离子方程式是___。
(4)丙同学进一步研究了Al与NO反应的情况。
序号
实验试剂(20℃)
实验现象
Ⅲ
铝粉、稀硝酸
溶液无色,试管上方呈浅红棕色
Ⅳ
铝粉、NaNO3溶液、几滴NaOH
产生大量气泡,能使湿润红色石蕊试纸变蓝
Ⅴ
铝粉、NaNO3溶液
产生气泡,能使湿润红色石蕊试纸变蓝
根据实验Ⅰ~Ⅴ,金属与NO反应时,影响NO还原产物不同的因素有___。
师大附属实验中学2020-2021学年度第二学期
高一年级化学期中测试A卷
答案版
可能用到的相对原子质量:H-1
C-12
N-14
O-16
Na-23
Cl-35.5
第Ⅰ部分选择题(共50分)
每小题2分。在每小题给出的四个选项中,选出最符合题目要求的一项。
1.
2020年10月,我国大飞机C919亮相飞行大会。下列关于C919飞机所用的材料中,主要成分属于金属材料的是
A.
风挡——玻璃
B.
轮胎——橡胶
C.
尾翼主盒——碳纤维
D.
座椅滑轨——铝锂合金
答案:D
2.
当光束通过下列分散系时,能观察到丁达尔效应的是
A.
NaCl溶液
B.
蔗糖溶液
C.
CuSO4溶液
D.
Fe(OH)3胶体
答案:D
3.
常温下,下列溶液可用铁质容器盛装的是
A.
稀硝酸
B.
稀硫酸
C.
浓硝酸
D.
浓盐酸
答案:C
4.
下列气体中,与酸雨密切相关的是
A.
N2
B.
CO2
C.
SO2
D.
CO
答案:C
5.
下列物质中,既含有氨分子,又含有铵根离子是
A.
氨气
B.
氨水
C.
硝酸
D.
硝酸钾
答案:B
6.
下列物质的电子式书写正确的是(
)
A.
B.
C.
D.
答案:D
7.
某元素的原子结构示意图为
,下列关于该元素的说法中,不正确的是
A.
元素符号是S
B.
属于短周期元素
C.
非金属性比氧的强
D.
最高正化合价是+6价
答案:C
8.
下列元素中,原子半径最大的是
A.
Li
B.
Na
C.
F
D.
S
答案:B
9.
下列金属中,通常用电解法冶炼的是
A.
Na
B.
Fe
C.
Hg
D.
Ag
答案:A
10.
(Ac的中文名“锕”)是一种医用放射性同位素,在治疗癌症方面有重大作用。下列关于的说法中,正确的是
A.
质子数为225
B.
中子数为89
C.
核外电子数为136
D.
质子数与中子数之和为225
答案:D
11.
下列关于化学反应与能量的说法中,不正确的是
A.
Mg与盐酸的反应属于放热反应
B.
能量变化是化学反应的基本特征之一
C.
Ba(OH)2·8H2O与NH4Cl的反应属于放热反应
D.
反应物的总能量低于生成物的总能量,反应时从环境吸收能量
答案:C
12.
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是(
)
A.
浓硫酸与水
B.
生石灰与水
C.
熟石灰与水
D.
氯化钠与水
答案:B
13.
下列离子方程式中,正确的是
A.
向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO=BaSO4↓+H2O
B.
NH4HCO3溶液与过量KOH浓溶液共热:NH+OH-NH3↑+H2O
C.
稀硝酸和过量的铁屑反应:3Fe+8H++2NO=3Fe3++2NO↑+4H2O
D.
小苏打(NaHCO3)治疗胃酸过多:HCO+H+=CO2↑+H2O
答案:D
14.
汽车尾气催化转化装置的工作原理如图所示。
下列说法中,不正确的是
A.
汽车尾气中含有的CO和NO是大气污染物
B.
使用催化转化装置可减少汽车尾气对大气的污染
C.
该过程中碳元素只被氧化,氮元素只被氧化
D.
该过程中会发生反应:2NO2+4CO4CO2+N2
答案:C
15.
部分短周期元素的原子半径及主要化合价如下,根据表中信息,判断以下叙述正确的是
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.
143
0.112
0.
104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.
氢化物的稳定性为H2TB.
单质与稀盐酸反应的剧烈程度为LC.
M与T形成的化合物具有两性
D.
L2+与R2-的核外电子数相等
答案:C
16.
下列事实不能用元素周期律知识解释的是
A.
氧化性:Cl2>Br2
B.
稳定性:HC1>H2S
C.
酸性:H2SO4>H2S03
D.
碱性:NaOH>Mg
(
OH)
2
答案:C
17.
我国研发一款拥有自主知识产权的超薄铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第五周期第ⅠA族元素,下列关于37Rb的说法正确的是
A.
与同周期元素53I的原子半径比:Rb>I
B.
中子数为50的Rb的核素:Rb
C.
元素的金属性:K>Rb
D.
最高价氧化物对应的水化物的碱性:KOH>RbOH
答案:A
18.
关于中和热测定的说法错误的是
A.
在测定中和热实验中需要使用的仪器有天平、量筒、烧杯、温度计
B.
盐酸与某强碱中和放出的热量随反应物的用量改变而改变,但中和热不变
C.
NaOH稍过量可以保证盐酸完全被NaOH中和
D.
测定结果准确与否的关键是尽量减小热量损失及准确读取混合溶液的最高温度等
答案:A
19.
如图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是
A.
拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共放出1368kJ能量
B.
由H、O原子形成2molH2O(g),共吸收1852kJ能量
C.
2molH2(g)和1molO2(g)反应生成2molH2O(l),共放出484kJ能量
D.
2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量
答案:D
20
已知:(1)Zn(s)
+O2(g)=
ZnO(s),
△H=-348.3
kJ/mol
(2)
2Ag(s)+O2(g)=
Ag2O
(s),△H=
-31.0
kJ/moL
则ZnO(s)+2Ag(s)=
Zn(s)
+Ag2O(s)的△H等于
A.
-317.3
kJ/mol
B.
317.3
kJ/mol
C.
-332.8
kJ/mol
D.
-379.3
kJ/mol
答案:B
21.
已知:H2(g)+Cl2(g)
2HCl(g)反应的能量变化示意图如下:
下列说法正确的是
A.
点燃条件和光照条件下,反应的ΔH不同
B.
反应的ΔH约为[2c-
(a+b)]kJ·mol-1
C.
“假想的中间物质”的总能量低于起始态H2和Cl2的总能量
D.
反应涉及的物质中,既有含极性键的物质,也有含非极性键的物质
答案:D
22.
为了从海带浸取液中提取碘,某同学设计了如下实验方案:
下列说法正确的是(???
)
A.
①中反应的离子方程式:2I?
+
H2O2=I2
+
2OH?
B.
②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C.
③中得到的上层溶液中含有I?
D.
操作Z的名称是加热
答案:C
23.
通过以下反应均可获取H2。
①
C(s)
+
H2O
(g)
=CO(g)+H2(g)
ΔH1
=
+
131.3
kJ·mol-1
②
CH4
(g)+H2O(g)
=
CO(g)+3H2
(g)
ΔH2
=
+
206.1
kJ·mol-1
③
CO(g)+H2O(g)
=
CO2(g)+H2(g)
ΔH3
下列说法正确的是
A.
①中反应物总能量大于生成物的总能量
B.
②中使用适当催化剂,可以使ΔH2减小
C.
由①、②计算反应CH4
(g)
=
C
(s)
+
2H2
(g)
的ΔH
=-74.8
kJ·mol-1
D.
若知反应C
(s)
+
CO2
(g)
=
2CO
(g)
的ΔH,结合ΔH1可计算出ΔH3
答案:D
24.
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体
A.
可能是N2与NO2的混和气体
B.
可能是O2与NO2的混和气体
C.
可能是NO气体
D.
只可能是NO2一种气体
答案:B
25.
某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号
Ⅰ
Ⅱ
Ⅲ
实验步骤
充分振荡,加2mL蒸馏水
充分振荡,加2mL蒸馏水
充分振荡,加2mL蒸馏水
实验现象
铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是
A.
实验Ⅰ、Ⅱ、Ⅲ中均涉及到Fe3+被还原
B.
对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.
实验Ⅰ、Ⅲ中加入蒸馏水后c(Cu2+)相同
D.
向实验Ⅲ反应后溶液中加入饱和NaCl溶液可能出现白色沉淀
答案:C
第Ⅱ部分非选择题(共50分)
26.
溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如图:
(1)Cl2和苦卤中的Br-反应生成Br2的离子方程式是___。
(2)吸收塔中,A吸收了Br2后的溶液中含有Br-和BrO,则A是___(填序号)。
a.NaCl溶液
b.Na2CO3溶液
c.SO2气体
(3)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是___。
答案:(1)Cl2+2Br-=
Br2+2Cl-
(2)b
(3)5Br-+BrO+6H+=
3Br2+3H2O
27.
元素周期表在学习、研究中有很重要的作用,如表是元素周期表中的短周期元素部分。
(1)e的原子结构示意图是___,该元素单质可应用于___(填序号,下同)。
①光导纤维
②半导体材料
③陶瓷材料
(2)f、g的最高价氧化物对应的水化物中,酸性较强的物质是___(写化学式)。
(3)下列事实能判断a和b的非金属性强弱的是___。
①氢化物的稳定性强弱
②相同温度下,氢化物的溶解度大小
③最高价氧化物对应的水化物的酸性强弱
(4)c、d单质更容易与水反应的为___(写化学式),请从原子结构角度解释其原因:___。
(5)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。50Sn在元素周期表中的位置是___,以下说法中正确的是___。
①Sn元素的最高正化合价为+4
②Sn的原子半径比e大
③SnF2只具有氧化性
答案:(1)
①.
②.
②
(2)HClO4
(3)①③
(4)
①.
Na
②.
钠最外层只有一个电子,还原性更强
(5)
①.
第五周期第ⅣA族
②.
①②
28.
某化学实验小组同学利用图1装置制备氨气,并探究氨气的性质(部分仪器已略去)。
(1)实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为____。
(2)干燥NH3应选用的干燥剂是____(填序号)。
①浓H2SO4②碱石灰
③P2O5
(3)收集氨气时,请你选择氨气的进气口____(填“a”或“b”)。
(4)图2装置(盛放的液体均为水)可用于吸收多余氨气的是____(填序号)。
(5)图3为合成氨催化氧化制硝酸的流程示意图:
共价键
N≡N
H—H
N—H
断开1mol共价键所需能量(kJ)
946
436
391
①结合表中数据进行估算,写出工业合成氨反应的热化学方程式:____。
②氧化炉中的化学方程式____。
③吸收塔NO2HNO3氧化剂与还原剂物质的量之比为____。
答案:(1)
(2)②
(3)a
(4)②
(5)
①.
②.
③.
1:2
29.
稀土是一种重要的战略资源,我国稀土出口量世界第一。铈(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为CeCO3F)形式存在。工业上利用氟碳铈矿制取CeO2的一种工艺流程如图:
资料:①铈(Ce)常见的化合价为+3和+4;
②在O2作用下,氟碳铈矿焙烧后的产物中有CeO2和CeF4;
③在硫酸体系中,Ce4+在[(HA)2]中的溶解度大于其在水中的溶解度,Ce3+与之相反。
回答下列问题:
(1)步骤Ⅰ“焙烧”过程中CeCO3F发生反应的化学方程式为____。
(2)步骤Ⅱ充分反应后经过滤,得到的水溶液中阳离子有____。
(3)步骤Ⅲ的操作名称是____。
(4)步骤Ⅳ中加入H2O2的目的是____。
(5)步骤Ⅴ中发生反应的离子方程式是____。
(6)取上述流程中得到的CeO2产品加硫酸溶解,可与50.0mL0.1mol/LFeSO4溶液恰好完全反应(铈元素被还原为Ce3+,其他杂质均不参与反应),该产品中CeO2的质量分数为____。(已知:CeO2的摩尔质量为172g/mol)
答案:(1)
(2)Ce4+和Ce3+
(3)分液
(4)作为还原剂
(5)
(6)86%
30.
研究金属与稀硝酸的反应,实验如下。
序号
实验试剂(20℃)
实验现象
Ⅰ
过量铜粉、2mL0.5mol/LHNO3
无色气体(遇空气变红棕色),溶液变为蓝色
Ⅱ
过量铁粉、2mL0.5mol/LHNO3
6mL无色气体(经检测为H2),溶液几乎无色
(1)Ⅰ中的无色气体是___。
(2)Ⅱ中生成H2离子方程式是___。
(3)研究Ⅱ中的氧化剂。
①甲同学通过理论分析,认为NO也能被还原。其依据是___。
②乙认为该浓度的硝酸中H+的氧化性大于NO,所以NO没有发生反应。根据Ⅰ和Ⅱ,丙同学认为乙的说法不正确。其理由是___。
③丙同学通过实验证实了反应后的溶液中含有NH。生成NH的离子方程式是___。
(4)丙同学进一步研究了Al与NO反应的情况。
序号
实验试剂(20℃)
实验现象
Ⅲ
铝粉、稀硝酸
溶液无色,试管上方呈浅红棕色
Ⅳ
铝粉、NaNO3溶液、几滴NaOH
产生大量气泡,能使湿润红色石蕊试纸变蓝
Ⅴ
铝粉、NaNO3溶液
产生气泡,能使湿润红色石蕊试纸变蓝
根据实验Ⅰ~Ⅴ,金属与NO反应时,影响NO还原产物不同的因素有___。
答案:(1)NO或一氧化氮
(2)Fe+2H+=Fe2++H2↑
(3)
①.
铜的还原性弱于铁,但有NO气体放出,说明NO也能被还原。
②.
硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出
③.
(4)金属的还原性、溶液的酸碱性等因素有关。
高一年级化学期中测试A卷
可能用到的相对原子质量:H-1
C-12
N-14
O-16
Na-23
Cl-35.5
第Ⅰ部分选择题(共50分)
每小题2分。在每小题给出的四个选项中,选出最符合题目要求的一项。
1.
2020年10月,我国大飞机C919亮相飞行大会。下列关于C919飞机所用的材料中,主要成分属于金属材料的是
A.
风挡——玻璃
B.
轮胎——橡胶
C.
尾翼主盒——碳纤维
D.
座椅滑轨——铝锂合金
2.
当光束通过下列分散系时,能观察到丁达尔效应的是
A.
NaCl溶液
B.
蔗糖溶液
C.
CuSO4溶液
D.
Fe(OH)3胶体
3.
常温下,下列溶液可用铁质容器盛装的是
A.
稀硝酸
B.
稀硫酸
C.
浓硝酸
D.
浓盐酸
4.
下列气体中,与酸雨密切相关的是
A.
N2
B.
CO2
C.
SO2
D.
CO
5.
下列物质中,既含有氨分子,又含有铵根离子是
A.
氨气
B.
氨水
C.
硝酸
D.
硝酸钾
6.
下列物质的电子式书写正确的是(
)
A.
B.
C.
D.
7.
某元素的原子结构示意图为
,下列关于该元素的说法中,不正确的是
A.
元素符号是S
B.
属于短周期元素
C.
非金属性比氧的强
D.
最高正化合价是+6价
8.
下列元素中,原子半径最大的是
A.
Li
B.
Na
C.
F
D.
S
9.
下列金属中,通常用电解法冶炼的是
A.
Na
B.
Fe
C.
Hg
D.
Ag
10.
(Ac的中文名“锕”)是一种医用放射性同位素,在治疗癌症方面有重大作用。下列关于的说法中,正确的是
A.
质子数为225
B.
中子数为89
C.
核外电子数为136
D.
质子数与中子数之和为225
11.
下列关于化学反应与能量的说法中,不正确的是
A.
Mg与盐酸的反应属于放热反应
B.
能量变化是化学反应的基本特征之一
C.
Ba(OH)2·8H2O与NH4Cl的反应属于放热反应
D.
反应物的总能量低于生成物的总能量,反应时从环境吸收能量
12.
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是(
)
A.
浓硫酸与水
B.
生石灰与水
C.
熟石灰与水
D.
氯化钠与水
13.
下列离子方程式中,正确的是
A.
向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO=BaSO4↓+H2O
B.
NH4HCO3溶液与过量KOH浓溶液共热:NH+OH-NH3↑+H2O
C.
稀硝酸和过量的铁屑反应:3Fe+8H++2NO=3Fe3++2NO↑+4H2O
D.
小苏打(NaHCO3)治疗胃酸过多:HCO+H+=CO2↑+H2O
14.
汽车尾气催化转化装置的工作原理如图所示。
下列说法中,不正确的是
A.
汽车尾气中含有的CO和NO是大气污染物
B.
使用催化转化装置可减少汽车尾气对大气的污染
C.
该过程中碳元素只被氧化,氮元素只被氧化
D.
该过程中会发生反应:2NO2+4CO4CO2+N2
15.
部分短周期元素的原子半径及主要化合价如下,根据表中信息,判断以下叙述正确的是
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.
143
0.112
0.
104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.
氢化物的稳定性为H2T
单质与稀盐酸反应的剧烈程度为L
M与T形成的化合物具有两性
D.
L2+与R2-的核外电子数相等
16.
下列事实不能用元素周期律知识解释的是
A.
氧化性:Cl2>Br2
B.
稳定性:HC1>H2S
C.
酸性:H2SO4>H2S03
D.
碱性:NaOH>Mg
(
OH)
2
17.
我国研发一款拥有自主知识产权的超薄铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第五周期第ⅠA族元素,下列关于37Rb的说法正确的是
A.
与同周期元素53I的原子半径比:Rb>I
B.
中子数为50的Rb的核素:Rb
C.
元素的金属性:K>Rb
D.
最高价氧化物对应的水化物的碱性:KOH>RbOH
18.
关于中和热测定的说法错误的是
A.
在测定中和热实验中需要使用的仪器有天平、量筒、烧杯、温度计
B.
盐酸与某强碱中和放出的热量随反应物的用量改变而改变,但中和热不变
C.
NaOH稍过量可以保证盐酸完全被NaOH中和
D.
测定结果准确与否的关键是尽量减小热量损失及准确读取混合溶液的最高温度等
19.
如图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是
A.
拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共放出1368kJ能量
B.
由H、O原子形成2molH2O(g),共吸收1852kJ能量
C.
2molH2(g)和1molO2(g)反应生成2molH2O(l),共放出484kJ能量
D.
2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量
20
已知:(1)Zn(s)
+O2(g)=
ZnO(s),
△H=-348.3
kJ/mol
(2)
2Ag(s)+O2(g)=
Ag2O
(s),△H=
-31.0
kJ/moL
则ZnO(s)+2Ag(s)=
Zn(s)
+Ag2O(s)的△H等于
A.
-317.3
kJ/mol
B.
317.3
kJ/mol
C.
-332.8
kJ/mol
D.
-379.3
kJ/mol
21.
已知:H2(g)+Cl2(g)
2HCl(g)反应的能量变化示意图如下:
下列说法正确的是
A.
点燃条件和光照条件下,反应的ΔH不同
B.
反应的ΔH约为[2c-
(a+b)]kJ·mol-1
C.
“假想的中间物质”的总能量低于起始态H2和Cl2的总能量
D.
反应涉及的物质中,既有含极性键的物质,也有含非极性键的物质
22.
为了从海带浸取液中提取碘,某同学设计了如下实验方案:
下列说法正确的是(???
)
A.
①中反应的离子方程式:2I?
+
H2O2=I2
+
2OH?
B.
②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C.
③中得到的上层溶液中含有I?
D.
操作Z的名称是加热
23.
通过以下反应均可获取H2。
①
C(s)
+
H2O
(g)
=CO(g)+H2(g)
ΔH1
=
+
131.3
kJ·mol-1
②
CH4
(g)+H2O(g)
=
CO(g)+3H2
(g)
ΔH2
=
+
206.1
kJ·mol-1
③
CO(g)+H2O(g)
=
CO2(g)+H2(g)
ΔH3
下列说法正确的是
A.
①中反应物总能量大于生成物的总能量
B.
②中使用适当催化剂,可以使ΔH2减小
C.
由①、②计算反应CH4
(g)
=
C
(s)
+
2H2
(g)
的ΔH
=-74.8
kJ·mol-1
D.
若知反应C
(s)
+
CO2
(g)
=
2CO
(g)
的ΔH,结合ΔH1可计算出ΔH3
24.
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体
A.
可能是N2与NO2的混和气体
B.
可能是O2与NO2的混和气体
C.
可能是NO气体
D.
只可能是NO2一种气体
25.
某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号
Ⅰ
Ⅱ
Ⅲ
实验步骤
充分振荡,加2mL蒸馏水
充分振荡,加2mL蒸馏水
充分振荡,加2mL蒸馏水
实验现象
铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是
A.
实验Ⅰ、Ⅱ、Ⅲ中均涉及到Fe3+被还原
B.
对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.
实验Ⅰ、Ⅲ中加入蒸馏水后c(Cu2+)相同
D.
向实验Ⅲ反应后溶液中加入饱和NaCl溶液可能出现白色沉淀
第Ⅱ部分非选择题(共50分)
26.
溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如图:
(1)Cl2和苦卤中的Br-反应生成Br2的离子方程式是___。
(2)吸收塔中,A吸收了Br2后的溶液中含有Br-和BrO,则A是___(填序号)。
a.NaCl溶液
b.Na2CO3溶液
c.SO2气体
(3)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是___。
27.
元素周期表在学习、研究中有很重要的作用,如表是元素周期表中的短周期元素部分。
(1)e的原子结构示意图是___,该元素单质可应用于___(填序号,下同)。
①光导纤维
②半导体材料
③陶瓷材料
(2)f、g的最高价氧化物对应的水化物中,酸性较强的物质是___(写化学式)。
(3)下列事实能判断a和b的非金属性强弱的是___。
①氢化物的稳定性强弱
②相同温度下,氢化物的溶解度大小
③最高价氧化物对应的水化物的酸性强弱
(4)c、d单质更容易与水反应的为___(写化学式),请从原子结构角度解释其原因:___。
(5)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。50Sn在元素周期表中的位置是___,以下说法中正确的是___。
①Sn元素的最高正化合价为+4
②Sn的原子半径比e大
③SnF2只具有氧化性
28.
某化学实验小组同学利用图1装置制备氨气,并探究氨气的性质(部分仪器已略去)。
(1)实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为____。
(2)干燥NH3应选用的干燥剂是____(填序号)。
①浓H2SO4②碱石灰
③P2O5
(3)收集氨气时,请你选择氨气的进气口____(填“a”或“b”)。
(4)图2装置(盛放的液体均为水)可用于吸收多余氨气的是____(填序号)。
(5)图3为合成氨催化氧化制硝酸的流程示意图:
共价键
N≡N
H—H
N—H
断开1mol共价键所需能量(kJ)
946
436
391
①结合表中数据进行估算,写出工业合成氨反应的热化学方程式:____。
②氧化炉中的化学方程式____。
③吸收塔NO2HNO3氧化剂与还原剂物质的量之比为____。
29.
稀土是一种重要的战略资源,我国稀土出口量世界第一。铈(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为CeCO3F)形式存在。工业上利用氟碳铈矿制取CeO2的一种工艺流程如图:
资料:①铈(Ce)常见的化合价为+3和+4;
②在O2作用下,氟碳铈矿焙烧后的产物中有CeO2和CeF4;
③在硫酸体系中,Ce4+在[(HA)2]中的溶解度大于其在水中的溶解度,Ce3+与之相反。
回答下列问题:
(1)步骤Ⅰ“焙烧”过程中CeCO3F发生反应的化学方程式为____。
(2)步骤Ⅱ充分反应后经过滤,得到的水溶液中阳离子有____。
(3)步骤Ⅲ的操作名称是____。
(4)步骤Ⅳ中加入H2O2的目的是____。
(5)步骤Ⅴ中发生反应的离子方程式是____。
(6)取上述流程中得到的CeO2产品加硫酸溶解,可与50.0mL0.1mol/LFeSO4溶液恰好完全反应(铈元素被还原为Ce3+,其他杂质均不参与反应),该产品中CeO2的质量分数为____。(已知:CeO2的摩尔质量为172g/mol)
30.
研究金属与稀硝酸的反应,实验如下。
序号
实验试剂(20℃)
实验现象
Ⅰ
过量铜粉、2mL0.5mol/LHNO3
无色气体(遇空气变红棕色),溶液变为蓝色
Ⅱ
过量铁粉、2mL0.5mol/LHNO3
6mL无色气体(经检测为H2),溶液几乎无色
(1)Ⅰ中的无色气体是___。
(2)Ⅱ中生成H2离子方程式是___。
(3)研究Ⅱ中的氧化剂。
①甲同学通过理论分析,认为NO也能被还原。其依据是___。
②乙认为该浓度的硝酸中H+的氧化性大于NO,所以NO没有发生反应。根据Ⅰ和Ⅱ,丙同学认为乙的说法不正确。其理由是___。
③丙同学通过实验证实了反应后的溶液中含有NH。生成NH的离子方程式是___。
(4)丙同学进一步研究了Al与NO反应的情况。
序号
实验试剂(20℃)
实验现象
Ⅲ
铝粉、稀硝酸
溶液无色,试管上方呈浅红棕色
Ⅳ
铝粉、NaNO3溶液、几滴NaOH
产生大量气泡,能使湿润红色石蕊试纸变蓝
Ⅴ
铝粉、NaNO3溶液
产生气泡,能使湿润红色石蕊试纸变蓝
根据实验Ⅰ~Ⅴ,金属与NO反应时,影响NO还原产物不同的因素有___。
师大附属实验中学2020-2021学年度第二学期
高一年级化学期中测试A卷
答案版
可能用到的相对原子质量:H-1
C-12
N-14
O-16
Na-23
Cl-35.5
第Ⅰ部分选择题(共50分)
每小题2分。在每小题给出的四个选项中,选出最符合题目要求的一项。
1.
2020年10月,我国大飞机C919亮相飞行大会。下列关于C919飞机所用的材料中,主要成分属于金属材料的是
A.
风挡——玻璃
B.
轮胎——橡胶
C.
尾翼主盒——碳纤维
D.
座椅滑轨——铝锂合金
答案:D
2.
当光束通过下列分散系时,能观察到丁达尔效应的是
A.
NaCl溶液
B.
蔗糖溶液
C.
CuSO4溶液
D.
Fe(OH)3胶体
答案:D
3.
常温下,下列溶液可用铁质容器盛装的是
A.
稀硝酸
B.
稀硫酸
C.
浓硝酸
D.
浓盐酸
答案:C
4.
下列气体中,与酸雨密切相关的是
A.
N2
B.
CO2
C.
SO2
D.
CO
答案:C
5.
下列物质中,既含有氨分子,又含有铵根离子是
A.
氨气
B.
氨水
C.
硝酸
D.
硝酸钾
答案:B
6.
下列物质的电子式书写正确的是(
)
A.
B.
C.
D.
答案:D
7.
某元素的原子结构示意图为
,下列关于该元素的说法中,不正确的是
A.
元素符号是S
B.
属于短周期元素
C.
非金属性比氧的强
D.
最高正化合价是+6价
答案:C
8.
下列元素中,原子半径最大的是
A.
Li
B.
Na
C.
F
D.
S
答案:B
9.
下列金属中,通常用电解法冶炼的是
A.
Na
B.
Fe
C.
Hg
D.
Ag
答案:A
10.
(Ac的中文名“锕”)是一种医用放射性同位素,在治疗癌症方面有重大作用。下列关于的说法中,正确的是
A.
质子数为225
B.
中子数为89
C.
核外电子数为136
D.
质子数与中子数之和为225
答案:D
11.
下列关于化学反应与能量的说法中,不正确的是
A.
Mg与盐酸的反应属于放热反应
B.
能量变化是化学反应的基本特征之一
C.
Ba(OH)2·8H2O与NH4Cl的反应属于放热反应
D.
反应物的总能量低于生成物的总能量,反应时从环境吸收能量
答案:C
12.
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是(
)
A.
浓硫酸与水
B.
生石灰与水
C.
熟石灰与水
D.
氯化钠与水
答案:B
13.
下列离子方程式中,正确的是
A.
向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO=BaSO4↓+H2O
B.
NH4HCO3溶液与过量KOH浓溶液共热:NH+OH-NH3↑+H2O
C.
稀硝酸和过量的铁屑反应:3Fe+8H++2NO=3Fe3++2NO↑+4H2O
D.
小苏打(NaHCO3)治疗胃酸过多:HCO+H+=CO2↑+H2O
答案:D
14.
汽车尾气催化转化装置的工作原理如图所示。
下列说法中,不正确的是
A.
汽车尾气中含有的CO和NO是大气污染物
B.
使用催化转化装置可减少汽车尾气对大气的污染
C.
该过程中碳元素只被氧化,氮元素只被氧化
D.
该过程中会发生反应:2NO2+4CO4CO2+N2
答案:C
15.
部分短周期元素的原子半径及主要化合价如下,根据表中信息,判断以下叙述正确的是
元素代号
L
M
Q
R
T
原子半径/nm
0.160
0.
143
0.112
0.
104
0.066
主要化合价
+2
+3
+2
+6、-2
-2
A.
氢化物的稳定性为H2T
单质与稀盐酸反应的剧烈程度为L
M与T形成的化合物具有两性
D.
L2+与R2-的核外电子数相等
答案:C
16.
下列事实不能用元素周期律知识解释的是
A.
氧化性:Cl2>Br2
B.
稳定性:HC1>H2S
C.
酸性:H2SO4>H2S03
D.
碱性:NaOH>Mg
(
OH)
2
答案:C
17.
我国研发一款拥有自主知识产权的超薄铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第五周期第ⅠA族元素,下列关于37Rb的说法正确的是
A.
与同周期元素53I的原子半径比:Rb>I
B.
中子数为50的Rb的核素:Rb
C.
元素的金属性:K>Rb
D.
最高价氧化物对应的水化物的碱性:KOH>RbOH
答案:A
18.
关于中和热测定的说法错误的是
A.
在测定中和热实验中需要使用的仪器有天平、量筒、烧杯、温度计
B.
盐酸与某强碱中和放出的热量随反应物的用量改变而改变,但中和热不变
C.
NaOH稍过量可以保证盐酸完全被NaOH中和
D.
测定结果准确与否的关键是尽量减小热量损失及准确读取混合溶液的最高温度等
答案:A
19.
如图为反应2H2(g)+O2(g)=2H2O(g)的能量变化示意图。下列说法正确的是
A.
拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共放出1368kJ能量
B.
由H、O原子形成2molH2O(g),共吸收1852kJ能量
C.
2molH2(g)和1molO2(g)反应生成2molH2O(l),共放出484kJ能量
D.
2molH2(g)和1molO2(g)反应生成2molH2O(g),共放出484kJ能量
答案:D
20
已知:(1)Zn(s)
+O2(g)=
ZnO(s),
△H=-348.3
kJ/mol
(2)
2Ag(s)+O2(g)=
Ag2O
(s),△H=
-31.0
kJ/moL
则ZnO(s)+2Ag(s)=
Zn(s)
+Ag2O(s)的△H等于
A.
-317.3
kJ/mol
B.
317.3
kJ/mol
C.
-332.8
kJ/mol
D.
-379.3
kJ/mol
答案:B
21.
已知:H2(g)+Cl2(g)
2HCl(g)反应的能量变化示意图如下:
下列说法正确的是
A.
点燃条件和光照条件下,反应的ΔH不同
B.
反应的ΔH约为[2c-
(a+b)]kJ·mol-1
C.
“假想的中间物质”的总能量低于起始态H2和Cl2的总能量
D.
反应涉及的物质中,既有含极性键的物质,也有含非极性键的物质
答案:D
22.
为了从海带浸取液中提取碘,某同学设计了如下实验方案:
下列说法正确的是(???
)
A.
①中反应的离子方程式:2I?
+
H2O2=I2
+
2OH?
B.
②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C.
③中得到的上层溶液中含有I?
D.
操作Z的名称是加热
答案:C
23.
通过以下反应均可获取H2。
①
C(s)
+
H2O
(g)
=CO(g)+H2(g)
ΔH1
=
+
131.3
kJ·mol-1
②
CH4
(g)+H2O(g)
=
CO(g)+3H2
(g)
ΔH2
=
+
206.1
kJ·mol-1
③
CO(g)+H2O(g)
=
CO2(g)+H2(g)
ΔH3
下列说法正确的是
A.
①中反应物总能量大于生成物的总能量
B.
②中使用适当催化剂,可以使ΔH2减小
C.
由①、②计算反应CH4
(g)
=
C
(s)
+
2H2
(g)
的ΔH
=-74.8
kJ·mol-1
D.
若知反应C
(s)
+
CO2
(g)
=
2CO
(g)
的ΔH,结合ΔH1可计算出ΔH3
答案:D
24.
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时试管内水面上升,但不能充满试管,当向试管内鼓入氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的可能是什么气体
A.
可能是N2与NO2的混和气体
B.
可能是O2与NO2的混和气体
C.
可能是NO气体
D.
只可能是NO2一种气体
答案:B
25.
某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号
Ⅰ
Ⅱ
Ⅲ
实验步骤
充分振荡,加2mL蒸馏水
充分振荡,加2mL蒸馏水
充分振荡,加2mL蒸馏水
实验现象
铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是
A.
实验Ⅰ、Ⅱ、Ⅲ中均涉及到Fe3+被还原
B.
对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液的阴离子种类有关
C.
实验Ⅰ、Ⅲ中加入蒸馏水后c(Cu2+)相同
D.
向实验Ⅲ反应后溶液中加入饱和NaCl溶液可能出现白色沉淀
答案:C
第Ⅱ部分非选择题(共50分)
26.
溴及其化合物广泛用于医药、塑料阻燃剂等,苦卤提溴的工业流程如图:
(1)Cl2和苦卤中的Br-反应生成Br2的离子方程式是___。
(2)吸收塔中,A吸收了Br2后的溶液中含有Br-和BrO,则A是___(填序号)。
a.NaCl溶液
b.Na2CO3溶液
c.SO2气体
(3)从吸收塔出来的溶液中加入稀H2SO4得到Br2的离子方程式是___。
答案:(1)Cl2+2Br-=
Br2+2Cl-
(2)b
(3)5Br-+BrO+6H+=
3Br2+3H2O
27.
元素周期表在学习、研究中有很重要的作用,如表是元素周期表中的短周期元素部分。
(1)e的原子结构示意图是___,该元素单质可应用于___(填序号,下同)。
①光导纤维
②半导体材料
③陶瓷材料
(2)f、g的最高价氧化物对应的水化物中,酸性较强的物质是___(写化学式)。
(3)下列事实能判断a和b的非金属性强弱的是___。
①氢化物的稳定性强弱
②相同温度下,氢化物的溶解度大小
③最高价氧化物对应的水化物的酸性强弱
(4)c、d单质更容易与水反应的为___(写化学式),请从原子结构角度解释其原因:___。
(5)为满足不同需求,牙膏中还会添加一些特殊物质,如含氟牙膏中添加氟化亚锡(SnF2)。50Sn在元素周期表中的位置是___,以下说法中正确的是___。
①Sn元素的最高正化合价为+4
②Sn的原子半径比e大
③SnF2只具有氧化性
答案:(1)
①.
②.
②
(2)HClO4
(3)①③
(4)
①.
Na
②.
钠最外层只有一个电子,还原性更强
(5)
①.
第五周期第ⅣA族
②.
①②
28.
某化学实验小组同学利用图1装置制备氨气,并探究氨气的性质(部分仪器已略去)。
(1)实验室用NH4Cl和Ca(OH)2制取NH3的化学方程式为____。
(2)干燥NH3应选用的干燥剂是____(填序号)。
①浓H2SO4②碱石灰
③P2O5
(3)收集氨气时,请你选择氨气的进气口____(填“a”或“b”)。
(4)图2装置(盛放的液体均为水)可用于吸收多余氨气的是____(填序号)。
(5)图3为合成氨催化氧化制硝酸的流程示意图:
共价键
N≡N
H—H
N—H
断开1mol共价键所需能量(kJ)
946
436
391
①结合表中数据进行估算,写出工业合成氨反应的热化学方程式:____。
②氧化炉中的化学方程式____。
③吸收塔NO2HNO3氧化剂与还原剂物质的量之比为____。
答案:(1)
(2)②
(3)a
(4)②
(5)
①.
②.
③.
1:2
29.
稀土是一种重要的战略资源,我国稀土出口量世界第一。铈(Ce)是一种典型的稀土元素,其在自然界中主要以氟碳铈矿(主要成分为CeCO3F)形式存在。工业上利用氟碳铈矿制取CeO2的一种工艺流程如图:
资料:①铈(Ce)常见的化合价为+3和+4;
②在O2作用下,氟碳铈矿焙烧后的产物中有CeO2和CeF4;
③在硫酸体系中,Ce4+在[(HA)2]中的溶解度大于其在水中的溶解度,Ce3+与之相反。
回答下列问题:
(1)步骤Ⅰ“焙烧”过程中CeCO3F发生反应的化学方程式为____。
(2)步骤Ⅱ充分反应后经过滤,得到的水溶液中阳离子有____。
(3)步骤Ⅲ的操作名称是____。
(4)步骤Ⅳ中加入H2O2的目的是____。
(5)步骤Ⅴ中发生反应的离子方程式是____。
(6)取上述流程中得到的CeO2产品加硫酸溶解,可与50.0mL0.1mol/LFeSO4溶液恰好完全反应(铈元素被还原为Ce3+,其他杂质均不参与反应),该产品中CeO2的质量分数为____。(已知:CeO2的摩尔质量为172g/mol)
答案:(1)
(2)Ce4+和Ce3+
(3)分液
(4)作为还原剂
(5)
(6)86%
30.
研究金属与稀硝酸的反应,实验如下。
序号
实验试剂(20℃)
实验现象
Ⅰ
过量铜粉、2mL0.5mol/LHNO3
无色气体(遇空气变红棕色),溶液变为蓝色
Ⅱ
过量铁粉、2mL0.5mol/LHNO3
6mL无色气体(经检测为H2),溶液几乎无色
(1)Ⅰ中的无色气体是___。
(2)Ⅱ中生成H2离子方程式是___。
(3)研究Ⅱ中的氧化剂。
①甲同学通过理论分析,认为NO也能被还原。其依据是___。
②乙认为该浓度的硝酸中H+的氧化性大于NO,所以NO没有发生反应。根据Ⅰ和Ⅱ,丙同学认为乙的说法不正确。其理由是___。
③丙同学通过实验证实了反应后的溶液中含有NH。生成NH的离子方程式是___。
(4)丙同学进一步研究了Al与NO反应的情况。
序号
实验试剂(20℃)
实验现象
Ⅲ
铝粉、稀硝酸
溶液无色,试管上方呈浅红棕色
Ⅳ
铝粉、NaNO3溶液、几滴NaOH
产生大量气泡,能使湿润红色石蕊试纸变蓝
Ⅴ
铝粉、NaNO3溶液
产生气泡,能使湿润红色石蕊试纸变蓝
根据实验Ⅰ~Ⅴ,金属与NO反应时,影响NO还原产物不同的因素有___。
答案:(1)NO或一氧化氮
(2)Fe+2H+=Fe2++H2↑
(3)
①.
铜的还原性弱于铁,但有NO气体放出,说明NO也能被还原。
②.
硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出
③.
(4)金属的还原性、溶液的酸碱性等因素有关。
同课章节目录
