2021-2022学年九年级化学鲁教版上册2.3 原子的构成课件(共22张PPT)
文档属性
| 名称 | 2021-2022学年九年级化学鲁教版上册2.3 原子的构成课件(共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-07 09:52:17 | ||
图片预览








文档简介
(共22张PPT)
第三节
原子的构成
第二单元
探秘水的世界
第1课时
1.分子和原子的本质区别是:在化学变化中分子可以
,而原子
,故原子是化学变化中
。
知识回顾:
2.分子的特征:
再分
不能再分
最小粒子
分子的质量和体积都很小
分子间存在间隔
分子在不断运动
1.
认识原子的构成,知道原子是由质子、中子和电子构成的。
2.
知道质子、中子、原子核、核外电子的带电情况。
3.知道核电荷数、质子数和核外电子数的关系。
新知学习:
一、原子的结构
(一)发挥想象,说说你对原子的最初认识,原子的外形可能是什么样的?
……
新知学习:
一、原子的结构
1、原子结构发展史
(1)公元前5世纪,希腊哲学家德谟克利特等人认为
:万物是由大量的不可分割的微粒构成的,即由原子构成的。
(2)19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
(3)1897年,英国科学家汤姆森发现了电子。
他提出原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子。
汤姆森原子模型
英国物理学家汤姆森
英国科学家卢瑟福
(1871~1937)
(4)α粒子散射实验(1909年)
卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福的原子结构模型
卢瑟福α粒子散射实验
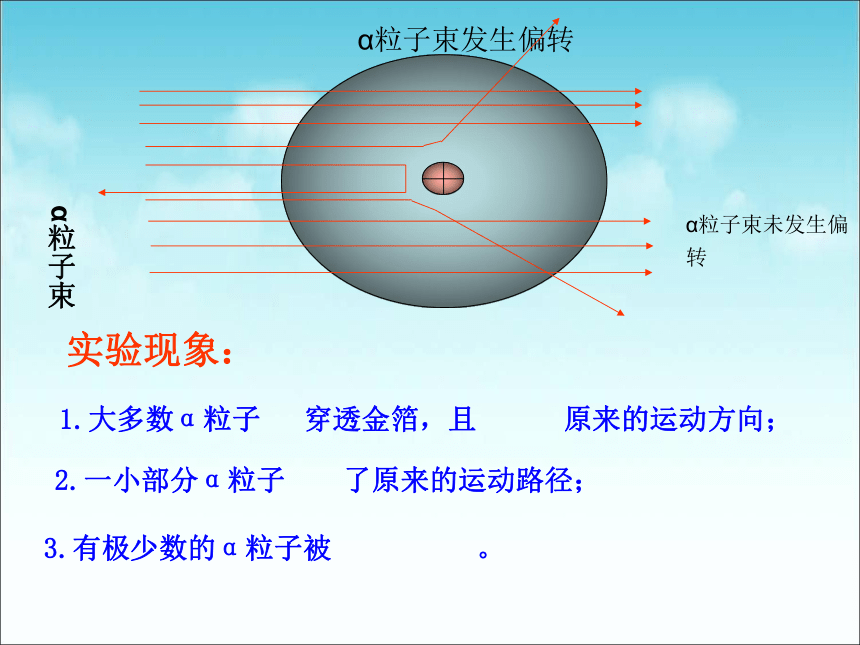
1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔。
α粒子束未发生偏转
α粒子束发生偏转
α粒子束
1.大多数α粒子
穿透金箔,且
原来的运动方向;
实验现象:
2.一小部分α粒子
了原来的运动路径;
3.有极少数的α粒子被
。
α粒子束未发生偏转
α粒子束发生偏转
α粒子束
(1)“绝大多数的α粒子能够顺利穿过金箔且不改变方向”,说明原子内部
空间很大
(2)“有极少数α粒子被反弹回来”,说明金原子核的质量比α粒子
,而且体积
。
大
小
(3)“有一部分α粒子改变了原来前进方向”,说明金原子核带
电。
正
原子弹的爆炸是由原子核的
裂变释放出巨大的能量引起的.
多识一点
原子的构成:
质子
中子
原子
原子核
核外电子
(1个质子带一个单位正电荷)
(1个电子带一个单位负电荷)
(中子不带电)
小组讨论:
(1)构成原子的三种粒子的电性、质量如何?整个原子的质量主要集中在哪部分?
(2)原子中有带电的粒子,那么整个原子是否带电?分子呢?为什么?
观察表格,你能获得哪些信息
名称
符号
质子数
中子数
核外电子数
氢
H
1
0
1
氧
O
8
8
8
钠
Na
11
12
11
氯
Cl
17
18
17
碳-11
C-11
6
6
6
碳-12
C-12
6
7
6
碳-13
C-13
6
8
6
二、探寻原子构成的规律:
1.在原子里,质子数等于核外电子数;
2.并不是所有的原子都有中子;
3.质子数和中子数不一定相等;
4.质子数不同,原子的种类不同;
5.同一类原子,质子数相同。
1.原子是构成物质的一种基本粒子,金、金刚石等都是由
构成的。
原子
原子的性质:
2.原子的性质
①铅笔留下的黑色笔迹是碳原子的堆积,一滴墨水里约含1018个碳原子,说明:
②铅球和铁球受热时融合在一起,说明:
③体温计里的水银柱随体温变化而升降,说明:
原子的质量和体积很小
原子间存在间隔
原子在不断运动,且温度越高运动越快
说说这节课你收获了什么?
原子
原子核
核外电子(带负电)
质子(带正电)
中子(不带电)
不显电性
1、在原子中
核电荷数=核内质子数=核外电子数
一、原子的构成
2、不同的原子,质子数(核电荷数)不同
3、原子的质量主要集中在原子核上
二、原子的性质
1.原子的质量和体积很小
2.原子间存在间隔
3.原子在不断运动
三、当堂达标检测
中考链接:
A
1.
C
2.
中考链接:
Goodbye!
第三节
原子的构成
第二单元
探秘水的世界
第1课时
1.分子和原子的本质区别是:在化学变化中分子可以
,而原子
,故原子是化学变化中
。
知识回顾:
2.分子的特征:
再分
不能再分
最小粒子
分子的质量和体积都很小
分子间存在间隔
分子在不断运动
1.
认识原子的构成,知道原子是由质子、中子和电子构成的。
2.
知道质子、中子、原子核、核外电子的带电情况。
3.知道核电荷数、质子数和核外电子数的关系。
新知学习:
一、原子的结构
(一)发挥想象,说说你对原子的最初认识,原子的外形可能是什么样的?
……
新知学习:
一、原子的结构
1、原子结构发展史
(1)公元前5世纪,希腊哲学家德谟克利特等人认为
:万物是由大量的不可分割的微粒构成的,即由原子构成的。
(2)19世纪初,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。
(3)1897年,英国科学家汤姆森发现了电子。
他提出原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子。
汤姆森原子模型
英国物理学家汤姆森
英国科学家卢瑟福
(1871~1937)
(4)α粒子散射实验(1909年)
卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福的原子结构模型
卢瑟福α粒子散射实验
1911年,英国科学家卢瑟福用一束平行高速运动的α粒子(α粒子是带两个单位正电荷的氦原子)轰击金箔。
α粒子束未发生偏转
α粒子束发生偏转
α粒子束
1.大多数α粒子
穿透金箔,且
原来的运动方向;
实验现象:
2.一小部分α粒子
了原来的运动路径;
3.有极少数的α粒子被
。
α粒子束未发生偏转
α粒子束发生偏转
α粒子束
(1)“绝大多数的α粒子能够顺利穿过金箔且不改变方向”,说明原子内部
空间很大
(2)“有极少数α粒子被反弹回来”,说明金原子核的质量比α粒子
,而且体积
。
大
小
(3)“有一部分α粒子改变了原来前进方向”,说明金原子核带
电。
正
原子弹的爆炸是由原子核的
裂变释放出巨大的能量引起的.
多识一点
原子的构成:
质子
中子
原子
原子核
核外电子
(1个质子带一个单位正电荷)
(1个电子带一个单位负电荷)
(中子不带电)
小组讨论:
(1)构成原子的三种粒子的电性、质量如何?整个原子的质量主要集中在哪部分?
(2)原子中有带电的粒子,那么整个原子是否带电?分子呢?为什么?
观察表格,你能获得哪些信息
名称
符号
质子数
中子数
核外电子数
氢
H
1
0
1
氧
O
8
8
8
钠
Na
11
12
11
氯
Cl
17
18
17
碳-11
C-11
6
6
6
碳-12
C-12
6
7
6
碳-13
C-13
6
8
6
二、探寻原子构成的规律:
1.在原子里,质子数等于核外电子数;
2.并不是所有的原子都有中子;
3.质子数和中子数不一定相等;
4.质子数不同,原子的种类不同;
5.同一类原子,质子数相同。
1.原子是构成物质的一种基本粒子,金、金刚石等都是由
构成的。
原子
原子的性质:
2.原子的性质
①铅笔留下的黑色笔迹是碳原子的堆积,一滴墨水里约含1018个碳原子,说明:
②铅球和铁球受热时融合在一起,说明:
③体温计里的水银柱随体温变化而升降,说明:
原子的质量和体积很小
原子间存在间隔
原子在不断运动,且温度越高运动越快
说说这节课你收获了什么?
原子
原子核
核外电子(带负电)
质子(带正电)
中子(不带电)
不显电性
1、在原子中
核电荷数=核内质子数=核外电子数
一、原子的构成
2、不同的原子,质子数(核电荷数)不同
3、原子的质量主要集中在原子核上
二、原子的性质
1.原子的质量和体积很小
2.原子间存在间隔
3.原子在不断运动
三、当堂达标检测
中考链接:
A
1.
C
2.
中考链接:
Goodbye!
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
