2.3 构成物质的微粒(‖)——原子和离子 导学案-2021-2022学年科粤版九年级化学上册(学生版+教师版)
文档属性
| 名称 | 2.3 构成物质的微粒(‖)——原子和离子 导学案-2021-2022学年科粤版九年级化学上册(学生版+教师版) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-09-07 00:00:00 | ||
图片预览




文档简介
2.2构成物质的微粒(I)——原子和离子
【课前复习】
下列事例不能用分子运动相关知识解释的是
A.
品红扩散
B.
漫天飞沙
C.
酒精挥发
D.
篮球充气
从分子的角度分析并解释下列事实,说法不正确的是
A
湿衣服晒干
温度升高,水分子体积增大
B
品红在水中扩散
分子在不断地运动
C
空气是混合物
由不同分子构成
D
干冰受热升华
二氧化碳分子间的间隔增大
A.
A
B.
B
C.
C
D.
D
A~E分别叙述分子的某种特性,请选择合理的解释,
将序号填入下列横线上。
A.分子间有间隔;B.受热分子运动速度加快,间隙变大;C.分子有质量,但很小;D.分子不断地运动;E.同种分子性质相同。
(1)20mL水和20mL酒精混合后总体积小于40mL??????????;(2)在很远的地方可闻到酒的香味??????????;
(3)水变成水蒸气体积变大??????????;(4)碘的蒸气、碘的固体颗粒都能使淀粉变蓝??????????;
(5)一滴水里约有1.67个水分子??????????。
学习化学可以从微观角度认识世界,请用分子、原子的观点回答下列问题。
空气中的氧气无处不在,是由于______的结果。
用水银温度计测体温时,汞柱会上升______。
碳与氧气发生化学反应时,没有改变的两种粒子是______填写粒子名称。
图Ⅰ是小红按课本进行的一个化学实验,在实验时同学们闻到了一股难闻的刺激性气味。于是小明对原实验装置进行了改进,改进后的装置如图Ⅱ所示。
【实验操作】
向B、C、E三支试管中分别加入5mL蒸馏水,各滴入滴无色酚酞试液,振荡,观察溶液颜色
在A、D试管中分别加入2mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察几分钟。
【分析讨论】
试管放滴有酚酞的蒸馏水的目的是?
?
?
?
?
?
?
?
?
?。
进行操作b时观察到的现象是?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
??。
由此可以得到的实验结论是:?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
??
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
。
对比改进前的实验,改进后实验的优点是???????????
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
??写两条。
【学习目标】
1.知道原子也是构成物质的微粒,理解分子、原子的区别和联系;
2.了解原子的内部构成,知道原子中各粒子间的关系,理解原子不显电性的原因;
3.初步了解相对原子质量的概念,并会查相对原子质量表;
4.了解离子的形成过程,认识离子是构成物质的一种粒子。
【新授课程
】
(一)原子
1.
什么是原子:原子是________________中的最小微粒。在化学变化中,分子本身________________变化,而原子________________变化。
2.
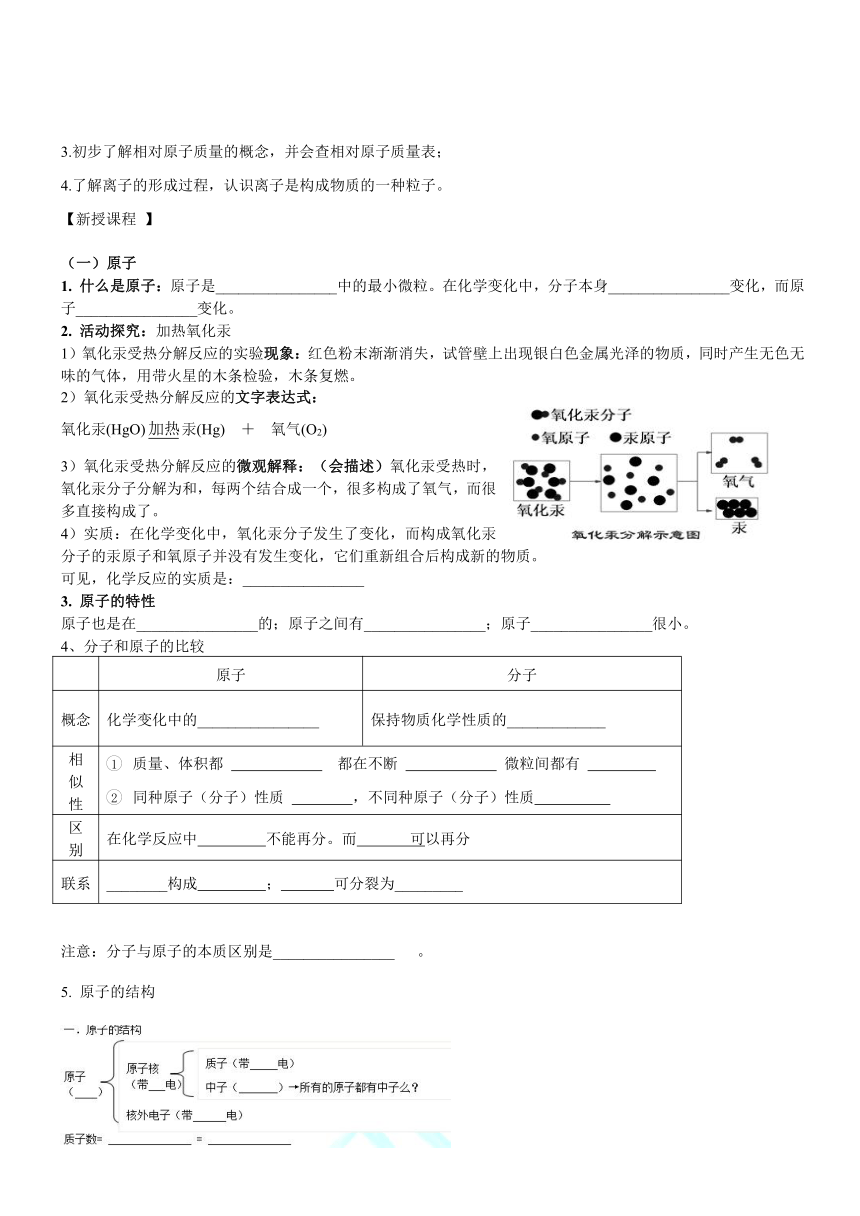
活动探究:加热氧化汞
1)氧化汞受热分解反应的实验现象:红色粉末渐渐消失,试管壁上出现银白色金属光泽的物质,同时产生无色无味的气体,用带火星的木条检验,木条复燃。
2)氧化汞受热分解反应的文字表达式:
氧化汞(HgO)汞(Hg) + 氧气(O2)
3)氧化汞受热分解反应的微观解释:(会描述)氧化汞受热时,氧化汞分子分解为和,每两个结合成一个,很多构成了氧气,而很多直接构成了。
4)实质:在化学变化中,氧化汞分子发生了变化,而构成氧化汞分子的汞原子和氧原子并没有发生变化,它们重新组合后构成新的物质。
可见,化学反应的实质是:________________
3.
原子的特性
原子也是在________________的;原子之间有________________;原子________________很小。
4、分子和原子的比较
原子
分子
概念
化学变化中的________________
保持物质化学性质的_____________
相似性
质量、体积都
都在不断
微粒间都有
同种原子(分子)性质
,不同种原子(分子)性质
区别
在化学反应中
不能再分。而
可以再分
联系
________构成
;
可分裂为_________
注意:分子与原子的本质区别是________________
。
原子的结构
小结:(1)在原子的结构中,构成原子的基本微粒是
、
、
。但并不是所有的原子都含有中子。(氢原子核中就没有种子)。
(2)原子的质量主要集中在
上,所以原子的相对原子质量约等于
+
。
(3)
决定着原子的种类。
3.原子结构示意图
原子核外电子的运动—分层排布
1)原子核外电子是分层排布的
电子层:用于描述运动着的电子离核远近的区域不同。
电子层数:一二三四五六七
离核距离:近远
能量高低:低高
2).观察下列原子结构示意图,回答如下问题:
1.原子核外的第一层电子数不超过
,第二层电子数不超过
,最外层电子数不超过
。
2.金属元素最外层电子数一般
,容易
电子(填“得到”或“失去”)。非金属元素最外层电子数一般
,容易
电子(填“得到”或“失去”)。稀有气体元素最外层电子数为
(氦为
)。把最外层电子数为
(只有一个电子层为
)的结构称为稳定结构。说明元素的化学性质主要是由
决定。
总结:所以说,元素的化学性质主要是由原子的最外层电子数决定的。
元素分类
最外层电子数
结构的稳定性
化学性质
金属元素
一般<4(较少)
不稳定
易失去最外层电子
非金属元素
一般≥4(较多)
不稳定
易得到电子
稀有气体元素
8(He为2个)
稳定
难得失电子,惰性
(二)原子的质量有多大
1.
相对原子质量
相对原子质量的定义:__________________________________________,叫做这种原子的相对原子质量。
相对原子质量的定义式:
相对原子质量==
相对原子质量不是原子的实际质量,是相对标准的一个比值,其单位是“一”,用符号“1”表示,通常省略,绝不能将它跟原子实际质量的单位“g”混淆。
计算原子的相对质量
几种常见的原子
原子质量/
kg
相对原子质量(写出计算过程,保留整数)
氢原子
1.674
×
10-27
碳原子
1.993
×
10-26
氧原子
2.657
×
10-26
铁原子
9.288
×
10-26
(三)离子怎样形成
1.
离子定义:离子:_________________________________;离子也是构成物质的一种微粒。如Na+、Cl-、OH-、SO42-等;
2离子的形成
在化学变化中,原子得到或失去电子后形成离子。金属原子易电子形成离子,非金属原子易到电子形成离子。
阳离子:
的离子。如:Na+
②
离子的分类
阴离子:
的离子。如;
Cl-
阳离子中:核电荷数=核内质子数
核外电子数
阴离子中:核电荷数=核内质子数
核外电子数
③
离子符号:元素符号右上角,数字在
,符号在
,“1”必须省略不写。如:阳离子:Na+、Mg2+、Al3+
等
阴离子:Cl-、O2-
等
离子也是构成物质的一种微粒。由阴、阳离子构成的物质一定是化合物,物质中不存在分子或原子。
(五)分子、原子和离子的关系
1.
分子
原子
离子
定义
区别
相同点
联系
2.
原子
阳离子
阴离子
区别
核电荷数__核外电子数(—带电)
核电荷数__核外电子数(带____电)
核电荷数__核外电子数(带____电)
联系
1.同种元素原子、阳离子、阴离子都具有相同核电荷数,它们同属一种元素
(
)
(
)2.相互转化:阳离子
原子
阴离子
(
)
(
)
举例
(六)从微粒的角度认识化学
1.
用微粒的观点认识化学概念
①
物理变化和化学变化
物理变化:分子、原子种类都没有发生变化。由分子构成的物质在发生物理变化时,物质的分子本身没有变化,没有变成其他物质的分子,只是分子间的间隔发生了变化。
化学变化:分子发生了变化,变成了新的分子;原子没有变化,只是重新组合。
②
混合物和纯净物
混合物:由不同种分子构成(对由分子构成的物质来说)。
纯净物:由同种分子构成(对由分子构成的物质来说)。
用联系实际法理解分子、原子的性质
生活中一些常见的现象,如物质的扩散、溶解、热胀冷缩等都与分子、原子在不断地运动或之间存在间隔有关。当物质受热温度升高时,分子、原子的能量增加,运动速率加快,间隔变大。
【课后检测】
下列是四位同学在课堂上有关构成物质的微粒的交流,其中正确的是( )。
A.物质都是由分子构成的
B.分子是化学变化中的最小微粒
C.原子是微小的实心球体,可以再分
D.分子不一定是由不同种原子构成的
2.与原子化学性质的关系最密切的是(
)
A.
原子的相对原子质量
B.
原子核内的中子数
C.
原子核内的质子数
D.
原子核外的最外层电子数
3.根据右图提供的信息,下列说法正确的是(
)
A.钠原子最外层有11个电子
B.钠的相对原子质量是22.99g
C.钠属于非金属元素
D.钠的原子序数为11
E.在化学反应中,钠原子容易得到电子
4.如图中ABCDE是四种粒子的结构示意图,请回答下列问题.
⑴以上四种粒子的结构示意图中,质子数相同的粒子是______(填字母代号).达到相对稳定结构的粒子是______(填字母代号)
⑵以上四种粒子中,能得到电子的是______(填字母代号).A粒子与______(填字母代号)粒子的化学性质相似。
⑶
D粒子中x=______.
5.
根据给出的原子结构示意图,回答下列问题:
He
Mg
Ca
⑴Mg和Ca的化学性质都比较
(填“活泼”或“不活泼”),它们的化学性质
(填“相似”或“不相似”);
⑵He的化学性质
(填“活泼”或“不活泼”);由此可知,最外层电子数相同时,化学性质
(填“一定”或“不一定”)相似。
2.2构成物质的微粒(I)——原子和离子答案
【课前复习】
下列事例不能用分子运动相关知识解释的是B
A.
品红扩散
B.
漫天飞沙
C.
酒精挥发
D.
篮球充气
从分子的角度分析并解释下列事实,说法不正确的是A
A
湿衣服晒干
温度升高,水分子体积增大
B
品红在水中扩散
分子在不断地运动
C
空气是混合物
由不同分子构成
D
干冰受热升华
二氧化碳分子间的间隔增大
A.
A
B.
B
C.
C
D.
D
A~E分别叙述分子的某种特性,请选择合理的解释,
将序号填入下列横线上。
A.分子间有间隔;B.受热分子运动速度加快,间隙变大;C.分子有质量,但很小;D.分子不断地运动;E.同种分子性质相同。
(1)20mL水和20mL酒精混合后总体积小于40mL?????A?????;(2)在很远的地方可闻到酒的香味????D??????;
(3)水变成水蒸气体积变大???B???????;(4)碘的蒸气、碘的固体颗粒都能使淀粉变蓝????E??????;
(5)一滴水里约有1.67个水分子?????C?????。
学习化学可以从微观角度认识世界,请用分子、原子的观点回答下列问题。
空气中的氧气无处不在,是由于__分子在不断运动____的结果。
用水银温度计测体温时,汞柱会上升_温度升高,汞原子运动加快,原子间隔增大,体积变大_____。
碳与氧气发生化学反应时,没有改变的两种粒子是_碳原子、氧原子_____填写粒子名称。
图Ⅰ是小红按课本进行的一个化学实验,在实验时同学们闻到了一股难闻的刺激性气味。于是小明对原实验装置进行了改进,改进后的装置如图Ⅱ所示。
【实验操作】
向B、C、E三支试管中分别加入5mL蒸馏水,各滴入滴无色酚酞试液,振荡,观察溶液颜色
在A、D试管中分别加入2mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察几分钟。
【分析讨论】
试管放滴有酚酞的蒸馏水的目的是?
?做对比实验
?
?
?
?
?
?
?
?。
进行操作b时观察到的现象是?
?BC试管溶液均变红,且C比B变红的快
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
。
由此可以得到的实验结论是:?分子在不断运动
???温度越高分子运动速率越快
?
?
?
。
对比改进前的实验,改进后实验的优点是?1、尽量减少氨气对环境污染2、同时证明分子运动速率与温度的关??系???写两条。
【学习目标】
1.知道原子也是构成物质的微粒,理解分子、原子的区别和联系;
2.了解原子的内部构成,知道原子中各粒子间的关系,理解原子不显电性的原因;
3.初步了解相对原子质量的概念,并会查相对原子质量表;
4.了解离子的形成过程,认识离子是构成物质的一种粒子。
【新授课程
】
(一)原子
1.
什么是原子:原子是_化学变化中__中的最小微粒。在化学变化中,分子本身_发生___变化,而原子_没有发生__变化。
2.
活动探究:加热氧化汞
1)氧化汞受热分解反应的实验现象:红色粉末渐渐消失,试管壁上出现银白色金属光泽的物质,同时产生无色无味的气体,用带火星的木条检验,木条复燃。
2)氧化汞受热分解反应的文字表达式:
氧化汞(HgO)汞(Hg) + 氧气(O2)
3)氧化汞受热分解反应的微观解释:(会描述)氧化汞受热时,氧化汞分子分解为和,每两个结合成一个,很多构成了氧气,而很多直接构成了。
4)实质:在化学变化中,氧化汞分子发生了变化,而构成氧化汞分子的汞原子和氧原子并没有发生变化,它们重新组合后构成新的物质。
可见,化学反应的实质是:_化学变化中,分子分裂成原子,原子重新组成新的分子___。
3.
原子的特性
原子也是在_不断运动__的;原子之间有_间隔___;原子_质量体积___很小。
4、分子和原子的比较
原子
分子
概念
化学变化中的_最小粒子_
保持物质化学性质的_一种微粒_____
相似性
质量、体积都
很小
都在不断
运动
微粒间都有
间隔
同种原子(分子)性质
相同
,不同种原子(分子)性质
不同
区别
在化学反应中
原子
不能再分。而
分子
可以再分
联系
__原子______构成
分子
;
分子
可分裂为__原子_______
注意:分子与原子的本质区别是__化学变化中,分子可分,原子不可分______________
。
原子的结构
小结:(1)在原子的结构中,构成原子的基本微粒是
质子
、中子
、电子
。但并不是所有的原子都含有中子。(氢原子核中就没有种子)。
(2)原子的质量主要集中在
原子核
上,所以原子的相对原子质量约等于
质子数
+
中子数
。
(3)
决定着原子的种类。
3.原子结构示意图
原子核外电子的运动—分层排布
1)原子核外电子是分层排布的
电子层:用于描述运动着的电子离核远近的区域不同。
电子层数:一二三四五六七
离核距离:近远
能量高低:低高
2).观察下列原子结构示意图,回答如下问题:
1.原子核外的第一层电子数不超过
2
,第二层电子数不超过
8
,最外层电子数不超过
8
。
2.金属元素最外层电子数一般
少于4个电子,容易
失去
电子(填“得到”或“失去”)。非金属元素最外层电子数一般
多余4个电子
,容易
得到
电子(填“得到”或“失去”)。稀有气体元素最外层电子数为
8
(氦为
2
)。把最外层电子数为
8
(只有一个电子层为
2
)的结构称为稳定结构。说明元素的化学性质主要是由
核外最外层电子数
决定。
总结:所以说,元素的化学性质主要是由原子的最外层电子数决定的。
元素分类
最外层电子数
结构的稳定性
化学性质
金属元素
一般<4(较少)
不稳定
易失去最外层电子
非金属元素
一般≥4(较多)
不稳定
易得到电子
稀有气体元素
8(He为2个)
稳定
难得失电子,惰性
(二)原子的质量有多大
1.
相对原子质量
相对原子质量的定义:_以一种碳原子质量1/12为标准,该原子质量与其的比值___,叫做这种原子的相对原子质量。
相对原子质量的定义式:
相对原子质量==
相对原子质量不是原子的实际质量,是相对标准的一个比值,其单位是“一”,用符号“1”表示,通常省略,绝不能将它跟原子实际质量的单位“g”混淆。
计算原子的相对质量
几种常见的原子
原子质量/
kg
相对原子质量(写出计算过程,保留整数)
氢原子
1.674
×
10-27
1
碳原子
1.993
×
10-26
12
氧原子
2.657
×
10-26
16
铁原子
9.288
×
10-26
56
(三)离子怎样形成
1.
离子定义:离子:__带电的原子或原子团_______;离子也是构成物质的一种微粒。如Na+、Cl-、OH-、SO42-等;
2离子的形成
在化学变化中,原子得到或失去电子后形成离子。金属原子易电子形成离子,非金属原子易到电子形成离子。
阳离子:
带正电荷
的离子。如:Na+
②
离子的分类
阴离子:
带负电荷
的离子。如;
Cl-
阳离子中:核电荷数=核内质子数
大于
核外电子数
阴离子中:核电荷数=核内质子数
小于
核外电子数
③
离子符号:元素符号右上角,数字在
前
,符号在
后
,“1”必须省略不写。如:阳离子:Na+、Mg2+、Al3+
等
阴离子:Cl-、O2-
等
离子也是构成物质的一种微粒。由阴、阳离子构成的物质一定是化合物,物质中不存在分子或原子。
(五)分子、原子和离子的关系
1.
分子
原子
离子
定义
保持物质化学性质一种粒子
化学变化中最小粒子
带电原子或原子团
区别
不带电
不带电
带电
相同点
都是构成物质基本微粒
联系
分子由原子构成,原子得失电子变成离子
2.
原子
阳离子
阴离子
区别
核电荷数_等于_核外电子数(不带电)
核电荷数_大于_核外电子数(带__正__电)
核电荷数_小于_核外电子数(带_负___电)
联系
1.同种元素原子、阳离子、阴离子都具有相同核电荷数,它们同属一种元素
(
得到
)
(
得到
)2.相互转化:阳离子
原子
阴离子
(
失去
)
(
失去
)
举例
Cu、C、He等
Na+、Mg2+、Al3+
等
Cl-、O2-
等
(六)从微粒的角度认识化学
1.
用微粒的观点认识化学概念
①
物理变化和化学变化
物理变化:分子、原子种类都没有发生变化。由分子构成的物质在发生物理变化时,物质的分子本身没有变化,没有变成其他物质的分子,只是分子间的间隔发生了变化。
化学变化:分子发生了变化,变成了新的分子;原子没有变化,只是重新组合。
②
混合物和纯净物
混合物:由不同种分子构成(对由分子构成的物质来说)。
纯净物:由同种分子构成(对由分子构成的物质来说)。
用联系实际法理解分子、原子的性质
生活中一些常见的现象,如物质的扩散、溶解、热胀冷缩等都与分子、原子在不断地运动或之间存在间隔有关。当物质受热温度升高时,分子、原子的能量增加,运动速率加快,间隔变大。
【课后检测】
1下列是四位同学在课堂上有关构成物质的微粒的交流,其中正确的是( D )。
A.物质都是由分子构成的
B.分子是化学变化中的最小微粒
C.原子是微小的实心球体,可以再分
D.分子不一定是由不同种原子构成的
2.与原子化学性质的关系最密切的是(
D
)
A.
元素的相对原子质量
B.
原子核内的中子数
C.
原子核内的质子数
D.
原子核外的最外层电子数
3.根据右图提供的信息,下列说法正确的是(
D
)
A.钠原子最外层有11个电子
B.钠的相对原子质量是22.99g
C.钠属于非金属元素D.钠的原子序数为11
E.在化学反应中,钠原子容易得到电子
4.如图中ABCDE是四种粒子的结构示意图,请回答下列问题.
⑴以上四种粒子的结构示意图中,质子数相同的粒子是__AB____(填字母代号).达到相对稳定结构的粒子是_BDE_____(填字母代号)
⑵以上四种粒子中,能得到电子的是__AC____(填字母代号).A粒子与__C____(填字母代号)粒子的化学性质相似。
⑶
D粒子中x=___8___.
5.
根据给出的原子结构示意图,回答下列问题:
He
Mg
Ca
⑴Mg和Ca的化学性质都比较
活泼
(填“活泼”或“不活泼”),它们的化学性质
相似
(填“相似”或“不相似”);
⑵He的化学性质
不活泼
(填“活泼”或“不活泼”);由此可知,最外层电子数相同时,化学性质不一定
(填“一定”或“不一定”)相似。
【课前复习】
下列事例不能用分子运动相关知识解释的是
A.
品红扩散
B.
漫天飞沙
C.
酒精挥发
D.
篮球充气
从分子的角度分析并解释下列事实,说法不正确的是
A
湿衣服晒干
温度升高,水分子体积增大
B
品红在水中扩散
分子在不断地运动
C
空气是混合物
由不同分子构成
D
干冰受热升华
二氧化碳分子间的间隔增大
A.
A
B.
B
C.
C
D.
D
A~E分别叙述分子的某种特性,请选择合理的解释,
将序号填入下列横线上。
A.分子间有间隔;B.受热分子运动速度加快,间隙变大;C.分子有质量,但很小;D.分子不断地运动;E.同种分子性质相同。
(1)20mL水和20mL酒精混合后总体积小于40mL??????????;(2)在很远的地方可闻到酒的香味??????????;
(3)水变成水蒸气体积变大??????????;(4)碘的蒸气、碘的固体颗粒都能使淀粉变蓝??????????;
(5)一滴水里约有1.67个水分子??????????。
学习化学可以从微观角度认识世界,请用分子、原子的观点回答下列问题。
空气中的氧气无处不在,是由于______的结果。
用水银温度计测体温时,汞柱会上升______。
碳与氧气发生化学反应时,没有改变的两种粒子是______填写粒子名称。
图Ⅰ是小红按课本进行的一个化学实验,在实验时同学们闻到了一股难闻的刺激性气味。于是小明对原实验装置进行了改进,改进后的装置如图Ⅱ所示。
【实验操作】
向B、C、E三支试管中分别加入5mL蒸馏水,各滴入滴无色酚酞试液,振荡,观察溶液颜色
在A、D试管中分别加入2mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察几分钟。
【分析讨论】
试管放滴有酚酞的蒸馏水的目的是?
?
?
?
?
?
?
?
?
?。
进行操作b时观察到的现象是?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
??。
由此可以得到的实验结论是:?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
??
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
。
对比改进前的实验,改进后实验的优点是???????????
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
??写两条。
【学习目标】
1.知道原子也是构成物质的微粒,理解分子、原子的区别和联系;
2.了解原子的内部构成,知道原子中各粒子间的关系,理解原子不显电性的原因;
3.初步了解相对原子质量的概念,并会查相对原子质量表;
4.了解离子的形成过程,认识离子是构成物质的一种粒子。
【新授课程
】
(一)原子
1.
什么是原子:原子是________________中的最小微粒。在化学变化中,分子本身________________变化,而原子________________变化。
2.
活动探究:加热氧化汞
1)氧化汞受热分解反应的实验现象:红色粉末渐渐消失,试管壁上出现银白色金属光泽的物质,同时产生无色无味的气体,用带火星的木条检验,木条复燃。
2)氧化汞受热分解反应的文字表达式:
氧化汞(HgO)汞(Hg) + 氧气(O2)
3)氧化汞受热分解反应的微观解释:(会描述)氧化汞受热时,氧化汞分子分解为和,每两个结合成一个,很多构成了氧气,而很多直接构成了。
4)实质:在化学变化中,氧化汞分子发生了变化,而构成氧化汞分子的汞原子和氧原子并没有发生变化,它们重新组合后构成新的物质。
可见,化学反应的实质是:________________
3.
原子的特性
原子也是在________________的;原子之间有________________;原子________________很小。
4、分子和原子的比较
原子
分子
概念
化学变化中的________________
保持物质化学性质的_____________
相似性
质量、体积都
都在不断
微粒间都有
同种原子(分子)性质
,不同种原子(分子)性质
区别
在化学反应中
不能再分。而
可以再分
联系
________构成
;
可分裂为_________
注意:分子与原子的本质区别是________________
。
原子的结构
小结:(1)在原子的结构中,构成原子的基本微粒是
、
、
。但并不是所有的原子都含有中子。(氢原子核中就没有种子)。
(2)原子的质量主要集中在
上,所以原子的相对原子质量约等于
+
。
(3)
决定着原子的种类。
3.原子结构示意图
原子核外电子的运动—分层排布
1)原子核外电子是分层排布的
电子层:用于描述运动着的电子离核远近的区域不同。
电子层数:一二三四五六七
离核距离:近远
能量高低:低高
2).观察下列原子结构示意图,回答如下问题:
1.原子核外的第一层电子数不超过
,第二层电子数不超过
,最外层电子数不超过
。
2.金属元素最外层电子数一般
,容易
电子(填“得到”或“失去”)。非金属元素最外层电子数一般
,容易
电子(填“得到”或“失去”)。稀有气体元素最外层电子数为
(氦为
)。把最外层电子数为
(只有一个电子层为
)的结构称为稳定结构。说明元素的化学性质主要是由
决定。
总结:所以说,元素的化学性质主要是由原子的最外层电子数决定的。
元素分类
最外层电子数
结构的稳定性
化学性质
金属元素
一般<4(较少)
不稳定
易失去最外层电子
非金属元素
一般≥4(较多)
不稳定
易得到电子
稀有气体元素
8(He为2个)
稳定
难得失电子,惰性
(二)原子的质量有多大
1.
相对原子质量
相对原子质量的定义:__________________________________________,叫做这种原子的相对原子质量。
相对原子质量的定义式:
相对原子质量==
相对原子质量不是原子的实际质量,是相对标准的一个比值,其单位是“一”,用符号“1”表示,通常省略,绝不能将它跟原子实际质量的单位“g”混淆。
计算原子的相对质量
几种常见的原子
原子质量/
kg
相对原子质量(写出计算过程,保留整数)
氢原子
1.674
×
10-27
碳原子
1.993
×
10-26
氧原子
2.657
×
10-26
铁原子
9.288
×
10-26
(三)离子怎样形成
1.
离子定义:离子:_________________________________;离子也是构成物质的一种微粒。如Na+、Cl-、OH-、SO42-等;
2离子的形成
在化学变化中,原子得到或失去电子后形成离子。金属原子易电子形成离子,非金属原子易到电子形成离子。
阳离子:
的离子。如:Na+
②
离子的分类
阴离子:
的离子。如;
Cl-
阳离子中:核电荷数=核内质子数
核外电子数
阴离子中:核电荷数=核内质子数
核外电子数
③
离子符号:元素符号右上角,数字在
,符号在
,“1”必须省略不写。如:阳离子:Na+、Mg2+、Al3+
等
阴离子:Cl-、O2-
等
离子也是构成物质的一种微粒。由阴、阳离子构成的物质一定是化合物,物质中不存在分子或原子。
(五)分子、原子和离子的关系
1.
分子
原子
离子
定义
区别
相同点
联系
2.
原子
阳离子
阴离子
区别
核电荷数__核外电子数(—带电)
核电荷数__核外电子数(带____电)
核电荷数__核外电子数(带____电)
联系
1.同种元素原子、阳离子、阴离子都具有相同核电荷数,它们同属一种元素
(
)
(
)2.相互转化:阳离子
原子
阴离子
(
)
(
)
举例
(六)从微粒的角度认识化学
1.
用微粒的观点认识化学概念
①
物理变化和化学变化
物理变化:分子、原子种类都没有发生变化。由分子构成的物质在发生物理变化时,物质的分子本身没有变化,没有变成其他物质的分子,只是分子间的间隔发生了变化。
化学变化:分子发生了变化,变成了新的分子;原子没有变化,只是重新组合。
②
混合物和纯净物
混合物:由不同种分子构成(对由分子构成的物质来说)。
纯净物:由同种分子构成(对由分子构成的物质来说)。
用联系实际法理解分子、原子的性质
生活中一些常见的现象,如物质的扩散、溶解、热胀冷缩等都与分子、原子在不断地运动或之间存在间隔有关。当物质受热温度升高时,分子、原子的能量增加,运动速率加快,间隔变大。
【课后检测】
下列是四位同学在课堂上有关构成物质的微粒的交流,其中正确的是( )。
A.物质都是由分子构成的
B.分子是化学变化中的最小微粒
C.原子是微小的实心球体,可以再分
D.分子不一定是由不同种原子构成的
2.与原子化学性质的关系最密切的是(
)
A.
原子的相对原子质量
B.
原子核内的中子数
C.
原子核内的质子数
D.
原子核外的最外层电子数
3.根据右图提供的信息,下列说法正确的是(
)
A.钠原子最外层有11个电子
B.钠的相对原子质量是22.99g
C.钠属于非金属元素
D.钠的原子序数为11
E.在化学反应中,钠原子容易得到电子
4.如图中ABCDE是四种粒子的结构示意图,请回答下列问题.
⑴以上四种粒子的结构示意图中,质子数相同的粒子是______(填字母代号).达到相对稳定结构的粒子是______(填字母代号)
⑵以上四种粒子中,能得到电子的是______(填字母代号).A粒子与______(填字母代号)粒子的化学性质相似。
⑶
D粒子中x=______.
5.
根据给出的原子结构示意图,回答下列问题:
He
Mg
Ca
⑴Mg和Ca的化学性质都比较
(填“活泼”或“不活泼”),它们的化学性质
(填“相似”或“不相似”);
⑵He的化学性质
(填“活泼”或“不活泼”);由此可知,最外层电子数相同时,化学性质
(填“一定”或“不一定”)相似。
2.2构成物质的微粒(I)——原子和离子答案
【课前复习】
下列事例不能用分子运动相关知识解释的是B
A.
品红扩散
B.
漫天飞沙
C.
酒精挥发
D.
篮球充气
从分子的角度分析并解释下列事实,说法不正确的是A
A
湿衣服晒干
温度升高,水分子体积增大
B
品红在水中扩散
分子在不断地运动
C
空气是混合物
由不同分子构成
D
干冰受热升华
二氧化碳分子间的间隔增大
A.
A
B.
B
C.
C
D.
D
A~E分别叙述分子的某种特性,请选择合理的解释,
将序号填入下列横线上。
A.分子间有间隔;B.受热分子运动速度加快,间隙变大;C.分子有质量,但很小;D.分子不断地运动;E.同种分子性质相同。
(1)20mL水和20mL酒精混合后总体积小于40mL?????A?????;(2)在很远的地方可闻到酒的香味????D??????;
(3)水变成水蒸气体积变大???B???????;(4)碘的蒸气、碘的固体颗粒都能使淀粉变蓝????E??????;
(5)一滴水里约有1.67个水分子?????C?????。
学习化学可以从微观角度认识世界,请用分子、原子的观点回答下列问题。
空气中的氧气无处不在,是由于__分子在不断运动____的结果。
用水银温度计测体温时,汞柱会上升_温度升高,汞原子运动加快,原子间隔增大,体积变大_____。
碳与氧气发生化学反应时,没有改变的两种粒子是_碳原子、氧原子_____填写粒子名称。
图Ⅰ是小红按课本进行的一个化学实验,在实验时同学们闻到了一股难闻的刺激性气味。于是小明对原实验装置进行了改进,改进后的装置如图Ⅱ所示。
【实验操作】
向B、C、E三支试管中分别加入5mL蒸馏水,各滴入滴无色酚酞试液,振荡,观察溶液颜色
在A、D试管中分别加入2mL浓氨水,立即用带橡皮塞的导管按实验图Ⅱ连接好,并将D试管放置在盛有热水的烧杯中,观察几分钟。
【分析讨论】
试管放滴有酚酞的蒸馏水的目的是?
?做对比实验
?
?
?
?
?
?
?
?。
进行操作b时观察到的现象是?
?BC试管溶液均变红,且C比B变红的快
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
。
由此可以得到的实验结论是:?分子在不断运动
???温度越高分子运动速率越快
?
?
?
。
对比改进前的实验,改进后实验的优点是?1、尽量减少氨气对环境污染2、同时证明分子运动速率与温度的关??系???写两条。
【学习目标】
1.知道原子也是构成物质的微粒,理解分子、原子的区别和联系;
2.了解原子的内部构成,知道原子中各粒子间的关系,理解原子不显电性的原因;
3.初步了解相对原子质量的概念,并会查相对原子质量表;
4.了解离子的形成过程,认识离子是构成物质的一种粒子。
【新授课程
】
(一)原子
1.
什么是原子:原子是_化学变化中__中的最小微粒。在化学变化中,分子本身_发生___变化,而原子_没有发生__变化。
2.
活动探究:加热氧化汞
1)氧化汞受热分解反应的实验现象:红色粉末渐渐消失,试管壁上出现银白色金属光泽的物质,同时产生无色无味的气体,用带火星的木条检验,木条复燃。
2)氧化汞受热分解反应的文字表达式:
氧化汞(HgO)汞(Hg) + 氧气(O2)
3)氧化汞受热分解反应的微观解释:(会描述)氧化汞受热时,氧化汞分子分解为和,每两个结合成一个,很多构成了氧气,而很多直接构成了。
4)实质:在化学变化中,氧化汞分子发生了变化,而构成氧化汞分子的汞原子和氧原子并没有发生变化,它们重新组合后构成新的物质。
可见,化学反应的实质是:_化学变化中,分子分裂成原子,原子重新组成新的分子___。
3.
原子的特性
原子也是在_不断运动__的;原子之间有_间隔___;原子_质量体积___很小。
4、分子和原子的比较
原子
分子
概念
化学变化中的_最小粒子_
保持物质化学性质的_一种微粒_____
相似性
质量、体积都
很小
都在不断
运动
微粒间都有
间隔
同种原子(分子)性质
相同
,不同种原子(分子)性质
不同
区别
在化学反应中
原子
不能再分。而
分子
可以再分
联系
__原子______构成
分子
;
分子
可分裂为__原子_______
注意:分子与原子的本质区别是__化学变化中,分子可分,原子不可分______________
。
原子的结构
小结:(1)在原子的结构中,构成原子的基本微粒是
质子
、中子
、电子
。但并不是所有的原子都含有中子。(氢原子核中就没有种子)。
(2)原子的质量主要集中在
原子核
上,所以原子的相对原子质量约等于
质子数
+
中子数
。
(3)
决定着原子的种类。
3.原子结构示意图
原子核外电子的运动—分层排布
1)原子核外电子是分层排布的
电子层:用于描述运动着的电子离核远近的区域不同。
电子层数:一二三四五六七
离核距离:近远
能量高低:低高
2).观察下列原子结构示意图,回答如下问题:
1.原子核外的第一层电子数不超过
2
,第二层电子数不超过
8
,最外层电子数不超过
8
。
2.金属元素最外层电子数一般
少于4个电子,容易
失去
电子(填“得到”或“失去”)。非金属元素最外层电子数一般
多余4个电子
,容易
得到
电子(填“得到”或“失去”)。稀有气体元素最外层电子数为
8
(氦为
2
)。把最外层电子数为
8
(只有一个电子层为
2
)的结构称为稳定结构。说明元素的化学性质主要是由
核外最外层电子数
决定。
总结:所以说,元素的化学性质主要是由原子的最外层电子数决定的。
元素分类
最外层电子数
结构的稳定性
化学性质
金属元素
一般<4(较少)
不稳定
易失去最外层电子
非金属元素
一般≥4(较多)
不稳定
易得到电子
稀有气体元素
8(He为2个)
稳定
难得失电子,惰性
(二)原子的质量有多大
1.
相对原子质量
相对原子质量的定义:_以一种碳原子质量1/12为标准,该原子质量与其的比值___,叫做这种原子的相对原子质量。
相对原子质量的定义式:
相对原子质量==
相对原子质量不是原子的实际质量,是相对标准的一个比值,其单位是“一”,用符号“1”表示,通常省略,绝不能将它跟原子实际质量的单位“g”混淆。
计算原子的相对质量
几种常见的原子
原子质量/
kg
相对原子质量(写出计算过程,保留整数)
氢原子
1.674
×
10-27
1
碳原子
1.993
×
10-26
12
氧原子
2.657
×
10-26
16
铁原子
9.288
×
10-26
56
(三)离子怎样形成
1.
离子定义:离子:__带电的原子或原子团_______;离子也是构成物质的一种微粒。如Na+、Cl-、OH-、SO42-等;
2离子的形成
在化学变化中,原子得到或失去电子后形成离子。金属原子易电子形成离子,非金属原子易到电子形成离子。
阳离子:
带正电荷
的离子。如:Na+
②
离子的分类
阴离子:
带负电荷
的离子。如;
Cl-
阳离子中:核电荷数=核内质子数
大于
核外电子数
阴离子中:核电荷数=核内质子数
小于
核外电子数
③
离子符号:元素符号右上角,数字在
前
,符号在
后
,“1”必须省略不写。如:阳离子:Na+、Mg2+、Al3+
等
阴离子:Cl-、O2-
等
离子也是构成物质的一种微粒。由阴、阳离子构成的物质一定是化合物,物质中不存在分子或原子。
(五)分子、原子和离子的关系
1.
分子
原子
离子
定义
保持物质化学性质一种粒子
化学变化中最小粒子
带电原子或原子团
区别
不带电
不带电
带电
相同点
都是构成物质基本微粒
联系
分子由原子构成,原子得失电子变成离子
2.
原子
阳离子
阴离子
区别
核电荷数_等于_核外电子数(不带电)
核电荷数_大于_核外电子数(带__正__电)
核电荷数_小于_核外电子数(带_负___电)
联系
1.同种元素原子、阳离子、阴离子都具有相同核电荷数,它们同属一种元素
(
得到
)
(
得到
)2.相互转化:阳离子
原子
阴离子
(
失去
)
(
失去
)
举例
Cu、C、He等
Na+、Mg2+、Al3+
等
Cl-、O2-
等
(六)从微粒的角度认识化学
1.
用微粒的观点认识化学概念
①
物理变化和化学变化
物理变化:分子、原子种类都没有发生变化。由分子构成的物质在发生物理变化时,物质的分子本身没有变化,没有变成其他物质的分子,只是分子间的间隔发生了变化。
化学变化:分子发生了变化,变成了新的分子;原子没有变化,只是重新组合。
②
混合物和纯净物
混合物:由不同种分子构成(对由分子构成的物质来说)。
纯净物:由同种分子构成(对由分子构成的物质来说)。
用联系实际法理解分子、原子的性质
生活中一些常见的现象,如物质的扩散、溶解、热胀冷缩等都与分子、原子在不断地运动或之间存在间隔有关。当物质受热温度升高时,分子、原子的能量增加,运动速率加快,间隔变大。
【课后检测】
1下列是四位同学在课堂上有关构成物质的微粒的交流,其中正确的是( D )。
A.物质都是由分子构成的
B.分子是化学变化中的最小微粒
C.原子是微小的实心球体,可以再分
D.分子不一定是由不同种原子构成的
2.与原子化学性质的关系最密切的是(
D
)
A.
元素的相对原子质量
B.
原子核内的中子数
C.
原子核内的质子数
D.
原子核外的最外层电子数
3.根据右图提供的信息,下列说法正确的是(
D
)
A.钠原子最外层有11个电子
B.钠的相对原子质量是22.99g
C.钠属于非金属元素D.钠的原子序数为11
E.在化学反应中,钠原子容易得到电子
4.如图中ABCDE是四种粒子的结构示意图,请回答下列问题.
⑴以上四种粒子的结构示意图中,质子数相同的粒子是__AB____(填字母代号).达到相对稳定结构的粒子是_BDE_____(填字母代号)
⑵以上四种粒子中,能得到电子的是__AC____(填字母代号).A粒子与__C____(填字母代号)粒子的化学性质相似。
⑶
D粒子中x=___8___.
5.
根据给出的原子结构示意图,回答下列问题:
He
Mg
Ca
⑴Mg和Ca的化学性质都比较
活泼
(填“活泼”或“不活泼”),它们的化学性质
相似
(填“相似”或“不相似”);
⑵He的化学性质
不活泼
(填“活泼”或“不活泼”);由此可知,最外层电子数相同时,化学性质不一定
(填“一定”或“不一定”)相似。
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
